2. 复旦大学附属中山医院青浦分院外科ICU
2. Department of Surgery Intensive Care Unit, Qingpu Branch of Shanghai Zhongshan Hospital, affiliated to Fudan University, Shanghai, China
急性呼吸窘迫综合征(Acute respiratory distress syndrome,ARDS)是一种继发于严重疾病,以肺毛细血管通透性增强和弥漫性损伤为基础的呼吸衰竭综合征,主要病理变化为炎症导致的肺微血管通透性增高,肺泡渗出增加,肺水肿和透明膜形成,肺容积减少,肺顺应性下降和严重通气/血流比例失调。常见临床表现为严重的低氧血症和呼吸窘迫,病程发展迅速,ARDS合并休克患者预后极差并且死亡率极高。本文采用前列地尔注射液对2017年1月~2018年12月期间收治的158例ARDS合并休克患者进行治疗,获得了满意的疗效,现报道如下。
资料和方法 一、研究对象及选择标准本研究为前瞻性、双盲对照研究,收集2017年1月至2018年12月ICU收治的ARDS合并休克患者。本研究符合医学伦理学标准,已经过医院伦理委员会批准,并签署知情同意书。
纳入标准:参照2012年“ARDS柏林定义”的诊断标准[1]:(1)一周内出现的急性或进展性呼吸困难;(2)X线或CT显示双肺浸润影,不能完全由胸腔积液、肺塌陷或结节来解释;(3)不能完全由心力衰竭或容量过负荷解释的呼吸衰竭,没有发现ARDS危险因素时可行超声心动图等检查排除静水压性肺水肿;(4)低氧血症:轻度:200 mmHg<PaO2/FiO2≤300 mmHg,PEEP≥5 cm H2O;中度:100 mmHg<PaO2/FiO2≤200 mmHg,PEEP≥5cmH2O;重度:PaO2/FiO2≤100 mmHg,PEEP≥5cm H2O。休克的诊断标准:收缩压≤90mmHg,或需要持续泵入多巴胺≥10 μg/(kg·min)或去甲肾上腺素≥1.0μg/(kg·min)。
排除标准:①年龄<18岁;②孕妇;③严重心功能不全;④活动性出血者;⑤对前列地尔过敏者。
二、分组及治疗将符合纳入排除标准的ARDS合并休克患者按随机数法分为对照组和实验组,对照组患者针对病因对原发病进行积极治疗,给予机械呼吸、抗休克、抗感染、化痰、抑酸、营养支持等,并积极预防多器官功能障碍综合征(MODS)的发生。实验组的患者在此基础上加用前列地尔(国药准字H10980024;北京泰德制药股份有限公司)治疗:将20ug前列地尔注射液加入100mL生理盐水中静脉滴注,2次/d,疗程1周。
对比观察两组患者治疗前后的血气分析结果(氧合指数、乳酸)、C反应蛋白(CRP)、降钙素原(PCT)、白细胞介素IL-6、白细胞计数(WBC)、T细胞亚群CD4/CD8比例等指标以及机械通气持续时间、ICU住院时间和病死率。
三、统计学方法对本次研究所得数据用SPSS 22.0统计学软件进行分析处理,计量资料比较采用t检验,P < 0.05为差异有统计学意义。
结果 一、患者一般情况共纳入ARDS患者158例,实验组患者共82例,其中男46例,女36例,年龄35~84岁,平均(46.8±11.8)岁,原发病:重症肺炎58例、感染性休克15例、急重型颅脑损伤6例、心脏病手术3例,平均APACHEⅡ为19.2分:对照组患者共76例,其中男39例,女37例,年龄32~81岁,平均(43.5±9.6)岁,原发病:重症肺炎55例、感染性休克12例、急重型颅脑损伤10例、心脏病手术5例,平均APACHEⅡ为20.5分。两组患者性别、年龄、原发疾病、APACHEⅡ评分等一般情况比较,差异无统计学意义(P> 0.05)。
二、两组患者治疗前后氧合指数和乳酸的比较与治疗前相比,治疗后两组患者的氧合指数均有明显改善,乳酸值均明显降低,差异具有统计学意义(P < 0.05)。与对照组比较,实验组(前列地尔组)治疗后氧合指数和乳酸的改善更明显,差异具有统计学意义(P < 0.05),见图 1。
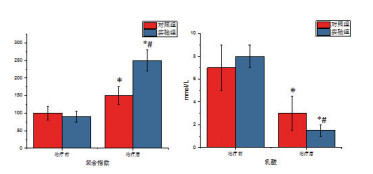
|
图 1 两组患者治疗前后氧合指数和乳酸变化情况比较(与治疗前后比较,*P < 0.05;与对照组比较,#P < 0.05) |
两组患者治疗前后的各项炎性指标均有所下降,免疫指标CD4/CD8比例有所增加,但前列地尔组患者各项指标均显著低于对照组,免疫指标CD4/CD8比例也高于对照组,差异均有统计学意义(P < 0.05),见表 1。
| 表 1 两组患者治疗前后各项炎性指标和免疫指标比较(x±s) |
与对照组相比,前列地尔组患者机械通气时间、ICU住院时间均显著降低,差异具有统计学意义(P < 0.05)。住院期间两组共有10例患者死亡,前列地尔组3例(3.6%),对照组7例(9.2%),前列地尔组患者死亡率显著低于对照组(P < 0.05),见表 2。前列地尔组治疗期间未出现明显不良反应。
| 表 2 两组患者治疗前后机械通气时间、ICU住院时间以及死亡率比较 |
ARDS是一种存在于严重创伤、休克或感染等疾病中的严重综合征,在正常生理状态下,机体的免疫系统能够在炎症作用和抗炎作用间维持平衡,但是在严重创伤、休克等情况下,免疫系统维持的平衡被打破无法有效地对炎症反应进行控制,并且可能处于免疫抑制状态,因此,促进ARDS的进一步发生发展,最终可导致发生多器官功能障碍综合征。有研究表示在血浆及肺泡的灌洗液中,炎症因子的浓度与ARDS的病死率为正线性相关[1],因此,对于AHDS的治疗,抑制炎症反应是一个最重要的环节。
在各种致病因子的作用下,炎性细胞导致肺部出现炎症反应,从而使肺泡毛细血管的内皮受到损伤,导致通透性增加,因此出现肺泡塌陷和肺水肿,使肺的容积减小,顺应性下降,通气/血流比值异常[2]。其中CRP、PCT、IL-6、白细胞计数、能够直接显示患者的炎症程度。IL-6代表炎症介质的水平,T细胞亚群CD4+、CD8+代表了机体抗炎的能力,CD4 /CD8的比值作为免疫调节的一项指标,正常值约1.4~2.0,若其比值>2.0或<1.4,表明细胞免疫功能紊乱,CD4/CD8>2.0则提示存在自身免疫性疾病[3, 4]。
ARDS合并休克患者除了伴有严重的缺氧外,还存在严重的组织灌注不足。动态监测血气分析,计算氧合指数可以反映机械通气的治疗效果,氧合指数升高说明患者呼吸功能有所好转,动态监测乳酸水平则可以反映机体的组织灌注状态,乳酸水平持续降低说明组织灌注得到了改善,反而则说明组织灌注不良且呈进行性加重趋势。本研究结果显示,与对照组相比,ADRS合并休克患者加用前列地尔注射液后氧合指数明显改善,且乳酸水平明显降低,说明患者呼吸功能和组织灌注都有显著改善。同时血浆炎性介质如WBC、CRP等显著降低,免疫功能指标如CD4/CD8的比例显著增加,说明ARDS合并休克患者早期应用前列地尔可以有效抑制炎症反应,改善ARDS患者的预后,患者28d死亡率显著降低。
前列地尔的有效成分为PGE1,PGE1是广泛存在于体内的生物活性物质,具有多种功效:①改善血流动力学,通过增加血管平滑肌细胞内的CAMP含量,发挥其扩血管作用,降低外周阻力;②改善血液流变学,PGE1可抑制血小板凝集,降低血小板的高反应和血栓素A2(TXA2)水平,可抑制血小板活化,促进血栓周围已活化的血小板逆转,改善红细胞的变形能力;③激活脂蛋白酶及促进甘油三酯水解,降低血脂和血黏度;④刺激血管内皮细胞产生组织型纤溶性物质(t-PA),具有一定的直接溶栓作用。⑤通过抑制血管平滑肌细胞的游离钙,抑制血管交感神经末梢释放去甲肾上腺素,使血管平滑肌舒张,改善微循环[5]。有文献报道,前列地尔能够抑制早期的炎症因子释放,降低炎症细胞水平,降低炎症作用对机体产生的损伤,保护血管内皮及机体内重要组织器官,并且能够改善微循环,促进机体对炎症的吸收和对受损组织器官的修复[6~8]。此外,前列地尔注射液可以保护微血管的内皮细胞,因而进一步改善肺毛细血管的损伤情况,改善毛细血管的通透性,缓解肺水肿,促进肺泡张力恢复,从而达到改善肺功能的目的,从而有效改善ARDS患者的肺损伤程度并提高氧合[9~11],而且经气道雾化吸入前列地尔也可以有效改善ARDS患者缺氧的症状,提高氧合[12~15]。
综上所述,前列地尔注射液能够改善ARDS合并休克患者氧合指数和组织灌注,降低炎症介质水平,减轻炎性反应及其对机体的损伤,促进患者恢复呼吸功能,减少机械通气和入住ICU时间,降低患者死亡率。
| [1] |
Camamo JM, McCoy RH, Erstad BL. Retrospective evaluation of inhaled prostaglandins in patients with acute respiratory distress syndrome[J]. Pharmacotherapy, 2005, 25(2): 84-90. |
| [2] |
Attaway AH, Myers C, Velani S, et al. Inhaled Prostacyclin as Salvage Therapy for ARDS:Can We Find the Right Patient?[J]. Respir Care, 2017, 62(8): 1113-1115. DOI:10.4187/respcare.05708 |
| [3] |
Adhikari N, Burns KE, Meade MO. Pharmacologic therapies for adults with acute lung injury and acute respiratory distress syndrome[J]. Cochrane Database Syst Rev, 2004, 8(4). |
| [4] |
刘丽平, 胡生文, 帅佃奎, 等. 前列地尔对感染性休克合并急性呼吸窘迫综合征患者的临床疗效观察[J]. 解放军医学杂志, 2017(9): 805-809. |
| [5] |
劳永光, 黄庆, 宋小娟. 前列地尔对重度肺挫伤并发急性呼吸窘迫综合征患者肺动脉压和右心功能的影响[J]. 广东医学, 2012, 33(4): 532-534. DOI:10.3969/j.issn.1001-9448.2012.04.042 |
| [6] |
刘德昭, 黄品婕, 罗晨芳. 脂微球化前列地尔对原位肝移植术患者肺损伤的影响[J]. 中华麻醉学杂志, 2013, 33(3): 338-341. DOI:10.3760/cma.j.issn.0254-1416.2013.03.021 |
| [7] |
吴进福, 葛胜辉, 姜丽华, 等. 前列地尔对脓毒症大鼠急性肺损伤的影响[J]. 中华麻醉学杂志, 2015, 35(12): 1501-1503. DOI:10.3760/cma.j.issn.0254-1416.2015.12.026 |
| [8] |
吕黄伟, 吴滨阳, 刘钢, 等. 前列腺素E 1对急性呼吸窘迫综合征病人氧供和氧耗的影响[J]. 中华麻醉学杂志, 1999, 19(2): 81-82. DOI:10.3760/j.issn:0254-1416.1999.02.006 |
| [9] |
王勇强. 前列腺素E1对ARDS肺动脉高压影响的临床观察[J]. 天津医药, 2001, 29(8): 475-476. DOI:10.3969/j.issn.0253-9896.2001.08.010 |
| [10] |
Vincent JL, Brase R, Santman F, et al. A multi-centre, double-blind, placebo-controlled study of liposomal prostaglandin E1(TLC C-53) in patients with acute respiratory distress syndrome[J]. Intensive Care Med, 2001, 27(10): 1578-1583. DOI:10.1007/s001340101077 |
| [11] |
Abraham E, Baughman R, Fletcher E, et al. Liposomal prostaglandin E1(TLC C-53) in acute respiratory distress syndrome:a controlled, randomized, double-blind, multicenter clinical trial[J]. Crit Care Med, 1999, 27(8): 1478-1485. DOI:10.1097/00003246-199908000-00013 |
| [12] |
岳子勇, 宋春雨, 李文志, 等. 雾化吸入前列腺素E1对急性肺损伤猪氧合及肺内分流的影响[J]. 中华麻醉学杂志, 2006, 26(5): 435-438. DOI:10.3760/j.issn:0254-1416.2006.05.020 |
| [13] |
Searcy RJ, Morales JR, Ferreira JA, et al. The role of inhaled prostacyclin in treating acute respiratory distress syndrome[J]. Ther Adv Respir Dis, 2015, 9(6): 302-312. DOI:10.1177/1753465815599345 |
| [14] |
Fuller BM, Mohr NM, Skrupky L, et al. The use of inhaled prostaglandins in patients with ARDS:a systematic review and meta-analysis[J]. Chest, 2015, 147(6): 1510-1522. DOI:10.1378/chest.14-3161 |
| [15] |
Siddiqui S, Zubair S, Khan FH. Case of inhaled prostaglandin E1 used to improve hypoxia in ARDS[J]. J Pak Med Assoc, 2004, 54(12): 635-636. |
 2018, Vol. 2
2018, Vol. 2

