2. 河南省人民医院
2. Department of Emergence, He Nan Provincial People's Hospital, Zhengzhou, China
心脏骤停(cardiac arrest, CA)的高致死率及预后不良是急危重症医学研究的重点。经过多年的动物实验与临床实践,心肺复苏术(cardiopulmonary resuscitation, CPR)不断完善,相关治疗措施持续改进,CA患者自主循环恢复(return of spontaneous circulation, ROSC)率已有较大幅度提高,但其生存出院率及良好的神经功能预后仍亟待提高[1, 2]。据统计,美国每年院内心脏骤停(in-hospital cardiac arrest, IHCA)的发生人数超过200 000,其死亡率高达75%[3]。CA后极高的死亡率及不良预后是由其复杂的病理生理过程导致的[4],Laver等研究学者发现[5],脑损伤是心脏骤停后ROSC死亡的主要因素,占OHCA的63%,占IHCA的23%。
正常情况下,在一定平均动脉压(mean arterial pressure, MAP)的范围内,脑血流通过自身调节维持稳定[6, 7],而有研究发现[8, 9],CA所导致的脑缺血、缺氧,破坏了脑血流的自动调节功能。Sundgreen等人报道[10],心脏骤停ROCS后的首个24h内,脑血流自动调节是无功能的或范围是向右平移的,提示MAP需要维持在一个更高的水平才能满足脑血流灌注。
在2015年更新的美国心脏病协会心肺复苏与心血管急救指南中推荐[11],应避免和立即矫正低血压(收缩压低于90mmHg,MAP低于65mmHg)。但是更多研究发现更高的MAP(>65mmHg)有利于CA后患者的预后恢复[12, 13]。不过关于CA后患者的血压改善多是使用升压药物进行维持,而指南中未涉及血管活性药物干预下血压的改善对预后的影响。本文主要关注IHCA患者ROSC后的血压管理及其使用升压药物维持的血压对预后的影响。
资料和方法 (一) 研究对象回顾性收集2013年01月至2017年12月,河南省人民医院IHCA并转入重症监护病房(Intensive Care Unit, ICU)的患者的临床资料,包括急诊ICU、综合ICU、冠心病ICU,根据纳入、排除标准,筛选满足条件的病例信息133例。
纳入标准:①年龄≥18周岁的患者;②满足心脏骤停标准[14],经电除颤或胸外按压≥2min;③ROSC后ICU生存时间≥24h。排除标准:①慢性疾病终末期发生CA;②严重创伤导致的CA;③严重脑部疾病导致的CA;④孕妇;⑤外院CA转入我院及OHCA;⑥临床资料不全的CA。根据患者转出ICU时的CPC评分分为:CPC1~2分的神经功能预后良好组和CPC3~5分的神经功能预后不良组。
(二) 研究方法参照国际通用的Utstein模式[15],设计建立数据登记表,收集CA后ROSC患者的性别、年龄、既往史、初始心律、CA时间、CPR时间、血压、心率、血管活性药物的使用情况、格拉斯哥昏迷评分(Glasgow Coma Scale, GCS)、脑功能评分(Cerebral Performance Categories, CPC)等资料,建立数据库,由两人进行数据录入并核查。
MAP:根据我院ICU的护理记录模式,收集24h中每小时的MAP,MAP=1/3收缩压+2/3舒张压[16]。
平均MAP:24h内每小时MAP的总和除以24h。
升压药物使用情况[17]:换算(μg/kg·min)=去甲肾上腺素(μg/kg·min)+多巴胺(μg/kg·0.5min)+肾上腺素(μg/kg·min)+去氧肾上腺素(μg/kg·0.1min)。
升压药物的使用剂量:根据我院ICU的管理模式,血管活性药物统一使用微量泵进行静脉泵入,从电子护理记录单中收集泵入时间、剂量,计算最大剂量、平均剂量及总剂量。
最大剂量:指CA患者ROSC后24h内使用微量泵泵入升压药物过程中护理记录单所记录的最大剂量μg/kg·min;
平均剂量:指CA患者ROSC后24h内使用微量泵泵入升压药物过程中的总剂量除以总时间;
总剂量:指CA患者ROSC后24h内每位患者使用的总剂量。
以患者转出各ICU时的CPC评分为主要结局指标,CPC评分[18],共分为五级,CPC1~2分为神经功能预后良好,CPC3~5分为神经功能预后不良。
(三) 统计学分析所有数据均采用SPSS20.0软件进行处理。计量资料满足正态性用平均值±标准差(x±s)表示,不满足正态性用中位数(P25-P75)表示,满足正态性和方差齐性用两独立样本t检验比较组间差异,满足正态性,不满足方差齐性用校正的t检验,均不满足的采用Wilcoxon秩和检验。计数资料用百分数表示,用检验(或Fisher概率法)计算。建立多因素logistic回归模型,分析影响患者神经功能预后的因素,以“进入法”筛选自变量。自变量为连续变量时,若连续变量与因变量呈线性关系,则直接纳入logistic回归模型,若呈非线性关系,则进行变量转换纳入logistic回归模型,以P < 0.05为差异具有统计学意义。
结果 (一) 纳入患者的一般情况本研究经过纳入、排除标准共纳入患者133例,其中预后良好患者28例,占21. 05%,预后不良患者105例,占88. 95%。其中预后良好组患者平均年龄较预后不良组低(59. 3 vs.70.0;P=0.002)。
CA发作时的临床表现对预后有较大影响,初始心律分为可除颤心律和不可除颤心律,分别包括(1)心室颤动(ventricular fibrillation, VF)和无脉性室速(pulseless ventricular tachycardia, pVT);(2)心脏停搏和无脉性电活动(pulseless electrical activity, PEA)。其中预后良好组有较多的可除颤心律(19 vs. 26;P=0.001),且以心源性疾病引起的CA居多(22 vs. 60;P=0.038),CPR耗时较短(10.0min vs.15. 0min;P=0.004)。两组患者在CA至CPR时间及CA发生的地点上无统计学差异(具体情况见表 1)。
| 表 1 预后良好组与预后不良组患者一般情况的比较 |
预后良好组较预后不良组患者CA后24h的平均MAP(84. 94±9. 64)mmHg vs.(91. 22±12. 57)mmHg,P=0.03,提示预后不良患者在CA后24h内较预后良好患者平均MAP更高,其中预后良好组有10人使用升压药物占35. 71%,预后不良组有67人使用升压药物占63. 81%,两者有统计学意义(P=0.007),提示预后不良组有更多的患者使用升压药物。但是预后不良组比预后良好组的平均MAP更高而神经功能预后不佳,是否是因为升压药物的使用。预后不良组患者CA后24h内的平均MAP波动幅度更小,走势更加平缓(见图 1)。
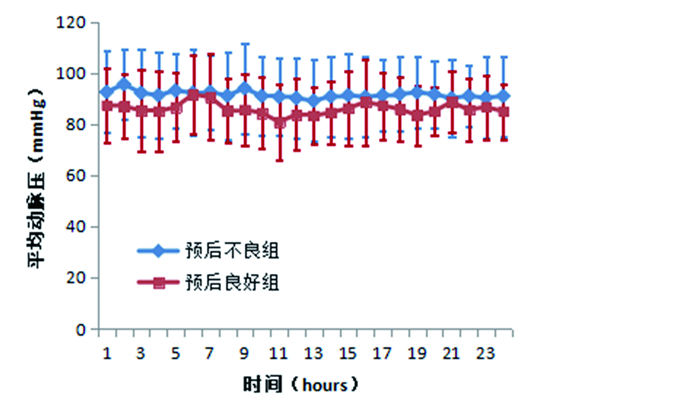
|
图 1 两组患者24h内的平均MAP变化 |
两组患者在使用升压药物的最大剂量、总剂量方面,有统计学差异(P < 0.05),说明预后不良患者在升压药物使用的最大剂量及总剂量上多于预后良好的患者,但两组在平均剂量上无统计学差异(P > 0.05)。(见表 2)
| 表 2 升压药物的使用情况 |
将两组中有统计学意义的变量纳入多因素logistic回归分析,心源性(OR 6. 678, 95%CI 1. 650~27. 030)和可除颤心律(OR 5. 548, 95%CI 1. 12~-27. 302)是预后良好患者的保护因素;年龄的增长(OR 0.947, 95%CI 0.899~0.997),CPR时间的增加(OR 0.839, 95%CI 0.746~0.944),平均MAP的增加(OR 0.922, 95%CI 0.872~0.974),使用升压药物(儿茶酚胺类)的总剂量增加(OR 0.997, 95%CI 0.995~1. 000)是预后良好患者的危险因素,而使用升压药物的最大剂量和平均剂量与预后无关(P > 0.05)(具体情况见表 3)。
| 表 3 平均MAP以连续变量纳入的多因素logistic回归分析 |
在我国有将近2亿9千万的心血管疾病患者,而仅这一类患者每年发生CA的人数就高达55万,相对于我国庞大的人口基数,老龄化进程的发展,完善的CA预防及治疗仍是急危重症医学所不容忽视的问题[19, 20]。国际上对于CPR指南版本的更替及快速的更新也说明了人们对这一临床问题的重视。CA后稳定的血流动力学管理是维持机体器官灌注,维持机体功能的重要指标,但是关于CA后血压的管理这一具体问题未有明确的建议,同样的,在升压药物维持下的较高的MAP对患者预后影响的讨论也未达成统一[21, 22]。本研究主要关注IHCA患者24h的平均MAP与神经功能预后的关系,根据转出ICU时患者的CPC评分,分为预后良好组(1~2分)与预后不良组(3~5分)对比,CA后24h内的血压情况,及CA后24h内使用升压药物,在升压药物的干预下MAP对神经功能预后的影响。比较预后良好组与不良组患者CA后24h内的平均MAP,提示预后不良组患者的平均MAP更高(91. 22±12. 57)mmHg vs. (84. 94±9. 64)mmHg,P=0.03。Beylin等学者[22]曾经指出各时间段内增加的血管活性药物的需求与不良预后相关。但不同的是他们的结果发现CA后24h内生存者较未生存者在1h,6h和24h三个时间点的MAP更高。香港屯门医院的Yu Koon Chiu及其同事研究的OHCA发现生存组患者较未生存组的加权MAP更高(102.1 mmHg vs. 72. 3 mmHg,P < 0.001),同时生存患者对正性肌力药物的需求较未生存组低[23]。不同的是上述的两项研究均是包含OHCA的,而本研究主要关注IHCA。
CA后24h内共有77人使用升压药物维持血压,通过比较两组,发现预后不良组使用升压药物的人数更多(67 vs. 10,P < 0.05),预后不良组较预后良好组在升压药物的使用剂量方面,最大剂量更大(8. 70 vs. 5. 04)μg/kg/min,(P < 0.05),总剂量更多(588 vs. 220)mg,(P < 0.05)。我们考虑可能是预后不良患者CPR时间较长,缺血再灌注导致的机体代谢性酸中毒对儿茶酚胺类升压药物的敏感性不高,使用升压药物的剂量更大;而CA后24h内多数患者存在心肌顿抑,较大剂量升压药物所致的正性肌力作用,增加心肌氧耗、缺血,影响心功能恢复,不利于患者的预后[24~27];另外,本例中使用升压药物的总人数较少,且预后良好组与不良组患者比例的不均衡所导致。将影响患者预后恢复的变量纳入多因素logistic回归分析,发现过高的平均MAP,使用升压药物(儿茶酚胺类)的总剂量增加是预后良好患者的危险因素。与本结果相似的是,有研究者通过集束化治疗OHCA的患者将其MAP维持在目标值75 mmHg以上但并未发现明显的功能性恢复[28]。但王群等研究发现,CA后更高的MAP可能更有助于患者神经功能的恢复,他们在CA后ROSC的30min内进行血压管理,维持MAP于90 mmHg~100 mmHg,进而使用升压药物逐渐升高血压,将MAP维持在140mmHg~150mmHg,48h内每小时重复一次,有助于患者神经功能恢复[29]。
CA后ROSC的血压管理的最佳目标应该是在满足机体灌注的同时维持在最低范围,以减少升压药物的使用,减轻心脏负荷。而人们对于使用升压药物维持CA后的MAP的解释也各不相同,最近的一项动物实验指出,使用中等剂量多巴胺(30μg/kg·min)维持家兔早期CPR,可保持较高的MAP和心输出量,增加脑组织灌注,减轻ROSC早期脑细胞损伤[30]。而不同的是Bro-Jeppesen等人的研究表示在亚低温治疗下的OHCA中大剂量的血管收缩药物的使用与由神经原因导致的死亡风险增加有关[21]。另一个多中心的CA后的亚低温治疗研究也显示PCAS患者血管收缩药物的使用与死亡和不良神经预后相关[22]。最近的一项前瞻性的多中心研究报道大剂量升压药与长期神经不良预后无关,并且CA时的最初节律、亚低温治疗及高血压病史都不影响患者最终的预后[31]。
综上所述,通过研究发现CA后24h内过高的平均MAP,使用升压药物(儿茶酚胺类)的总剂量增加是预后良好患者的危险因素。但是本研究是单中心的回顾性观察研究,所纳入的数据中预后良好患者较少,进行亚组分析的人数则更少,统计结果不够全面,对研究结果的肯定程度还需较大样本验证。
| [1] |
Segal N, Youngquist S, Lurie K. Ideal (i) CPR:Looking beyond shadows in a cave[J]. Resuscitation, 2017, 121: 81-83. |
| [2] |
Caltekin I, Savrun A, Gokcen E, et al. Comparison of the factors affecting neurological outcome in out-of vs in-hospital cardiac arrest cases[J]. J Pak Med Assoc, 2016, 66(11): 1412-1417. |
| [3] |
Merchant RM, Yang L, Becker LB, et al. Incidence of treated cardiac arrest in hospitalized patients in the United States[J]. Crit Care Med, 2011, 39(11): 2401-2406. DOI:10.1097/CCM.0b013e3182257459 |
| [4] |
Bisschops LLA, Hoedemaekers CWE, Hoeven JGVD. Cerebral Blood Flow after Cardiac Arrest[M] Annual Update in Intensive Care and Emergency Medicine 2012. Springer Berlin Heidelberg, 2012: 106-112.
|
| [5] |
Laver S, Farrow C, Turner D, et al. Mode of death after admission to an intensive care unit following cardiac arrest[J]. Intensive Care Med, 2004, 30(11): 2126-2128. |
| [6] |
Chacon M, Jara J.L, Panerai RB. A new model-free index of dynamic cerebral blood flow autoregulation[J]. PLoS One, 2014, 9(10): e108281. DOI:10.1371/journal.pone.0108281 |
| [7] |
Panerai RB. Cerebral autoregulation:from models to clinical applications[J]. Cardiovasc Eng, 2008, 8(1): 42-59. |
| [8] |
Ameloot K, Genbrugge C, Meex I, et al. An observational near-infrared spectroscopy study on cerebral autoregulation in post-cardiac arrest patients:time to drop 'one-size-fits-all' hemodynamic targets?[J]. Resuscitation, 2015, 90: 121-126. DOI:10.1016/j.resuscitation.2015.03.001 |
| [9] |
Nishizawa H, Kudoh I. Cerebral autoregulation is impaired in patients resuscitated after cardiac arrest[J]. Acta Anaesthesiol Scand, 1996, 40(9): 1149-1153. DOI:10.1111/aas.1996.40.issue-9 |
| [10] |
Sundgreen C, Larsen FS, Herzog TM, et al. Autoregulation of cerebral blood flow in patients resuscitated from cardiac arrest[J]. Stroke, 2001, 32(1): 128-132. |
| [11] |
Callaway CW, Donnino MW, Fink EL, et al. Part 8:Post-Cardiac Arrest Care:2015 American Heart Association Guidelines Update for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care[J]. Circulation, 2015, 132(18): S465-482. |
| [12] |
Russo JJ, James TE, Hibbert B, et al. Impact of mean arterial pressure on clinical outcomes in comatose survivors of out-of-hospital cardiac arrest:Insights from the University of Ottawa Heart Institute Regional Cardiac Arrest Registry (CAPITAL-CARe)[J]. Resuscitation, 2017, 113: 27-32. |
| [13] |
Bray JE, Bernard S, Cantwell K, et al. The association between systolic blood pressure on arrival at hospital and outcome in adults surviving from out-of-hospital cardiac arrests of presumed cardiac aetiology[J]. Resuscitation, 2014, 85(4): 509-515. DOI:10.1016/j.resuscitation.2013.12.005 |
| [14] |
李培杰, 曹雯, 张正义. 重视围心脏骤停期患者的抢救[J]. 中国急救医学, 2010, 30(7): 657-658. DOI:10.3969/j.issn.1002-1949.2010.07.025 |
| [15] |
Cummins RO, Chamberlain DA, Abramson NS, et al. Recommended guidelines for uniform reporting of data from out-of-hospital cardiac arrest:the Utstein Style. A statement for health professionals from a task force of the American Heart Association, the European Resuscitation Council, the Heart and Stroke Foundation of Canada, and the Australian Resuscitation Council[J]. Circulation, 1991, 84(2): 960-975. DOI:10.1161/01.CIR.84.2.960 |
| [16] |
Smulyan H, Safar ME. Blood pressure measurement:retrospective and prospective views[J]. Am J Hypertens, 2011, 24(6): 628-634. |
| [17] |
Russell JA, Walley KR, Singer J, et al. Vasopressin versus norepinephrine infusion in patients with septic shock[J]. N Engl J Med, 2008, 358(9): 877-887. |
| [18] |
Becker LB, Aufderheide TP, Geocadin RG, et al. Primary outcomes for resuscitation science studies:a consensus statement from the American Heart Association[J]. Circulation, 2011, 124(19): 2158-2177. |
| [19] |
陈伟伟, 高润霖, 刘力生, 等. 中国心血管病报告2017概要[J]. 中国循环杂志, 2018, 33: 1-8. |
| [20] |
Xu F, Zhang Y, Chen Y. Cardiopulmonary Resuscitation Training in China:Current Situation and Future Development[J]. JAMA Cardiol, 2017, 2(5): 469-470. DOI:10.1001/jamacardio.2017.0035 |
| [21] |
Bro-Jeppesen J, Kjaergaard J, Soholm H, et al. Hemodynamics and vasopressor support in therapeutic hypothermia after cardiac arrest:prognostic implications[J]. Resuscitation, 2014, 85(5): 664-670. DOI:10.1016/j.resuscitation.2013.12.031 |
| [22] |
Beylin ME, Perman SM, Abella BS, et al. Higher mean arterial pressure with or without vasoactive agents is associated with increased survival and better neurological outcomes in comatose survivors of cardiac arrest[J]. Intensive Care Med, 2013, 39(11): 1981-1988. |
| [23] |
Chiu YK, Lui CT, Tsui KL. Impact of hypotension after return of spontaneous circulation on survival in patients of out-of-hospital cardiac arrest[J]. Am J Emerg Med, 2018, 36(1): 79-83. DOI:10.1016/j.ajem.2017.07.019 |
| [24] |
李欣, 郑玉云, 杨玉梅. 心肌顿抑的发生机制及其防治措施研究近况[J]. 陕西医学杂志, 2016, 4(45): 504-505. |
| [25] |
颜春悦, 叶晓东, 蒋龙元. 去甲肾上腺素的应用剂量对感染性休克患者血流动力学及预后的影响[J]. 中国医药科学, 2017, 7(9): 72-74. DOI:10.3969/j.issn.2095-0616.2017.09.021 |
| [26] |
Gilinskii MA, Lunte CE. Norepinephrine of the rat myocardium during repeated ischemia[J]. Ross Fiziol Zh Im I M Sechenova, 2007, 93(8): 860-869. |
| [27] |
Tarvasmaki T, Lassus J, Varpula M, et al. Current real-life use of vasopressors and inotropes in cardiogenic shock-adrenaline use is associated with excess organ injury and mortality[J]. Crit Care, 2016, 20(1): 208. |
| [28] |
Laurent I, Monchi M, Chiche JD, et al. Reversible myocardial dysfunction in survivors of out-of-hospital cardiac arrest[J]. J Am Coll Cardiol, 2002, 40(12): 2110-2116. |
| [29] |
王群, 刘斌, 李奇林, 等. 精细调控血压联合乌司他丁对心肺复苏后脑复苏的疗效观察[J]. 中国急救医学, 2016, 34(6): 502-505. DOI:10.3969/j.issn.1002-1949.2016.06.006 |
| [30] |
兰超, 王超, 吕震宇, 等. 多巴胺对兔心肺复苏早期血流动力学及脑氧代谢的影响[J]. 中华急诊医学杂志, 2018, 27(1): 51-56. DOI:10.3760/cma.j.issn.1671-0282.2018.01.010 |
| [31] |
Laurikkala J, Wilkman E, Pettila V, et al. Mean arterial pressure and vasopressor load after out-of-hospital cardiac arrest:Associations with one-year neurologic outcome[J]. Resuscitation, 2016, 105: 116-122. DOI:10.1016/j.resuscitation.2016.05.026 |
 2018, Vol. 2
2018, Vol. 2

