脓毒症是由感染所引起的机体生理生化反应失衡,从而导致危及生命的器官功能障碍,是重症监护病房常见的死亡原因之一[1]。脓毒症发病机制复杂且尚未完全明确,临床医务工作者在脓毒症预后判断上存在严重困难,也是其病死率居高不下的主要原因[2]。同时,临床上缺乏能早期有效预测脓毒症预后的手段。目前脓毒症的预后研究主要集中在蛋白质和基因领域[3],而代谢紊乱作为脓毒症发展过程中重要的病理生理变化之一,其是否能够提示脓毒症的疾病预后尚不清楚[4]。本研究拟采用基于气相色谱-质谱联用仪(GC-MS)的代谢组学技术比较不同预后脓毒症大鼠间的差异,为脓毒症大鼠预后的判断提供能新策略。
资料和方法 (一) 实验动物和脓毒症大鼠模型制备8周龄雄性SD大鼠,体重250~300g,购自湖南斯莱克景达实验动物有限公司。采用盲肠结扎穿孔术(CLP)复制脓毒症大鼠模型[5]。腹腔注射5%水合氯醛麻醉大鼠,取仰卧位沿腹正中线作3~4cm切口,游离肠系膜和盲肠,在回盲瓣与盲肠末端中线处结扎,18G针头对合穿孔2次,并挤出少许肠内容物,随后将盲肠放回腹腔,逐层关闭腹腔,术毕给予5mL生理盐水皮下注射补充体液丢失。标本采集:CLP术后6h腹腔注射5%水合氯醛麻醉大鼠,尾静脉采血1mL,静置20min后离心10min后收集血清,保存于-80℃待检。
(二) 实验分组按照脓毒症模型大鼠7d存活情况,剔除CLP术后24内死亡的大鼠,分为存活组(n=10)和死亡组(n=10)。
(三) GC-MS分析将血清自然解冻,取50ul大鼠血浆加入内标(L-2-氯-苯丙氨酸,0. 3mg/mL,甲醇配置)、蛋白沉淀剂甲醇-乙腈(2:1, v/v)、冰水浴超声提取、低温离心10min(15000rpm,4℃),取上清液装入玻璃衍生瓶中,挥干、加入甲氧胺盐酸吡啶溶液(15mg/mL),涡旋震荡、肟化,加入BSTFA(含1%TMCS)衍生试剂和正乙烷,涡旋震荡,在70℃反应60min。将样本取出,在室温放置30min,最后在气相色谱-质谱联用仪7890A-5975C(Agilent, USA)进行GC-MS代谢组学分析。
(四) 数据分析GC-MS的原始数据都经过ChromaTOF (v4. 34, LECO, St Joseph, MI)软件进行预处理,经分析得到712个特征峰,去除内标和假阳性峰后进行去冗余、峰合并,得到259个代谢物。用峰面积归一化法得到数据矩阵,将数据矩阵导入SIMCA-P+14. 0软件包(Umetrics, Umeå, Sweden),先采用主成分分析(PCA)观察各个样本之间的总体分布以及整个分析过程的稳定性,再用偏最小二乘法(PLS-DA)来分析并区分各组间代谢轮廓的总体差异,找出组间的差异代谢物。
(五) 代谢物鉴定将每个化合物的特征离子片段谱的碎片质荷比以及丰度与Feihn代谢组学数据库、NIST数据库的标准离子片段谱库进行比对,当匹配度超过70%的检测物都可以被认为是标准物质。
结果 (一) 大鼠血清总离子流图列出大鼠血清总离子流图,并对质控样本(QC)的总离子流图进行重叠,QC样本质谱峰的保留时间和相应强度重现性都很好,分析方法稳定可靠的;同时分别展示存活组和死亡组每组一个样本的总离子流图,通过质荷比和保留时间分析,共得到712个特征峰(见图 1)。
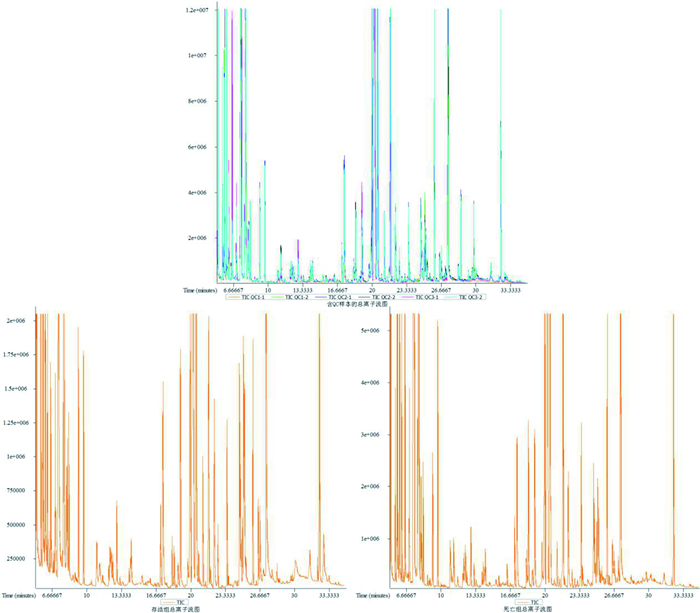
|
图 1 大鼠血清总离子流图 |
对存活组与死亡组数据进行PCA分析发现,两组样本的总体分布稳定性较高,PCA图中存活组样本主要位于左侧象限,死亡组样本主要位于右侧象限,表明存活组与死亡组代谢组学确实存在差别。对比存活组与死亡组数据进行PLS-DA分析发现,存活组与死亡组分布物无交叉,提示两组代谢谱表达变化差别明显,其分析结果明显优于PCA模式分析(见图 2)。
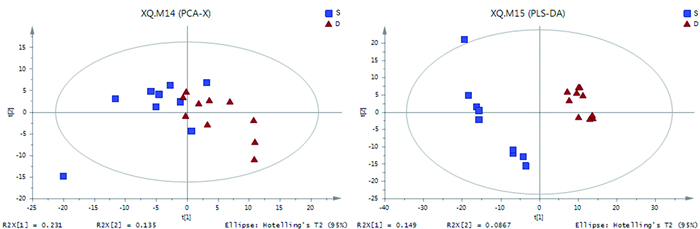
|
图 2 存活组与死亡组的PCA和PLS-DA |
对存活组与死亡组数据进行发现存活组与死亡组之间有30个差异代谢产物(见表 1)。
| 表 1 GC-MS检测脓毒症存活组与死亡组大鼠血清差异代谢产物 |
脓毒症是由感染引起的机体生理、病理生理及生化反应失衡,导致器官功能障碍,严重危及患者生命。全世界每年约有1800万例脓毒症患者,病死率高达30%~50%[6]。我国每年约有300万脓毒症患者,死亡人数约100万人[7]。近年来,不少学者研究并发现了一些有助于脓毒症预后判断的指标,如血清中炎症介质、急性期反应蛋白及各种评分系统等,在一定程度上有助于临床脓毒症的诊疗,但由于脓毒症发病机制尚不明确,病情复杂多病,这些指标并不能达到很好的预后判断效果[8, 9]。
脓毒症初期表现为糖和脂肪的利用障碍,蛋白分解,导致骨骼肌消耗[10]。脓毒症发生后机体的代谢紊乱状态可持续数月或更久,可使机体迅速陷入负氮平衡状态、体重下降、机体免疫功能受损、重要脏器和组织机能受损,感染率病死率增加[11]。通过研究脓毒症早期代谢物的改变,可能作为预后判断的新策略。代谢组学的出现为研究整体代谢谱的变化、判断疾病的预后等方面提供新的契机[12]。
本研究采用CLP复制大鼠脓毒症模型,并运用GC-MS代谢组学技术筛选出存活组和死亡组之间的差异代谢产物,为脓毒症大鼠预后的判断提供能新策略。存活组和死亡组两组结果的模式识别方法比较结果提示两组间的代谢谱表达变化差别明显。我们在存活组和死亡组两组间共筛选出30个差异代谢产物,提示两组间代谢产物存在的差异。
综上所述,本研究通过GC-MS代谢组学技术初步研究了脓毒症存活组和死亡组大鼠的代谢改变,检测血清代谢组学的改变可以提示脓毒症大鼠的预后。本实验仅对脓毒症大鼠血清代谢组学进行了初步研究,仍需进一步深入研究,并探讨其作为临床脓毒症预后评估的有效工具的可能性。
| [1] |
Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] |
Martin GS. Sepsis, severe sepsis and septic shock:changes in incidence, pathogens and outcomes[J]. Expert Rev Anti Infect Ther, 2012, 10(6): 701-706. DOI:10.1586/eri.12.50 |
| [3] |
Sandquist M, Wong HR. Biomarkers of sepsis and their potential value in diagnosis, prognosis and treatment[J]. Expert Rev Clin Immunol, 2014, 10(10): 1349-1356. DOI:10.1586/1744666X.2014.949675 |
| [4] |
Khardori R, Castillo D. Endocrine and metabolic changes during sepsis:an update[J]. Med Clin North Am, 2012, 96(6): 1095-1105. DOI:10.1016/j.mcna.2012.09.005 |
| [5] |
Rittirsch D, Huberlang MS, Flierl M A, et al. Immunodesign of experimental sepsis by cecal ligation and puncture[J]. Nat Protoc, 2009, 4(1): 31-36. DOI:10.1038/nprot.2008.214 |
| [6] |
Mayr FB, Yende S, Angus DC. Epidemiology of severe sepsis[J]. Virulence, 2014, 5(1): 4-11. DOI:10.4161/viru.27372 |
| [7] |
商娜. 脓毒症流行病学研究[J]. 中国急救医学, 2013, 33(1): 8-12. DOI:10.3969/j.issn.1002-1949.2013.1.003 |
| [8] |
Bessière F, Khenifer S, Dubourg J, et al. Prognostic value of troponins in sepsis:a meta-analysis[J]. Intensive Care Med, 2013, 39(7): 1181-1189. DOI:10.1007/s00134-013-2902-3 |
| [9] |
Katia D, Sabino S, Cecilia C, et al. SuPAR as a prognostic biomarker in sepsis[J]. BMC medicine, 2012, 10(1): 2. DOI:10.1186/1741-7015-10-2 |
| [10] |
Elke G, Kott M, Weiler N. When and how should sepsis patients be fed?[J]. Curr Opin Clin Nutr Metab Care, 2015, 18(2): 169-178. DOI:10.1097/MCO.0000000000000151 |
| [11] |
Wu C, Wang X, Yu W, et al. Hypermetabolism in the Initial Phase of Intensive Care Is Related to a Poor Outcome in Severe Sepsis Patients[J]. Ann Nutr Metab, 2015, 66(4): 188-195. DOI:10.1159/000430848 |
| [12] |
Skibsted S, Bhasin MK, Aird WC, et al. Bench-to-bedside review:Future novel diagnostics for sepsis-a systems biology approach[J]. Critical Care, 2013, 17(5): 1-15. |
 2018, Vol. 2
2018, Vol. 2

