2. 华中科技大学同济医学院附属同济医院麻醉科
2. Department of Anesthesiology, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan, China
急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)合并休克是目前重症监护病房患者死亡的主要原因之一[1]。这一类患者同时存在高通透性肺水肿和全身有效循环血量不足的矛盾,而且机械通气使得患者血流动力学更加复杂,合理评估和液体治疗成为临床上一大挑战[2]。常规的静态容量评价指标如中心静脉压(central venous pressure, CVP)并不能准确反映患者的容量反应性[3]。研究表明,动态容量指标如每搏量变异度(stroke volume variation, SVV)和脉压变异度(pulse pressure variation, PPV)等可以用于评估危重患者的容量反应性[4],但对于ARDS患者,由于机械通气以及右心功能不全等因素的存在,SVV和PPV等动态容量指标用于评估容量反应性仍然存在较大的争议[5, 6]。被动抬腿试验(passive leg raising test, PLR)模拟了内源性快速补液,由于受心律失常和自主呼吸影响小、相对安全、效应可逆等特点,已经广泛应用于危重患者的容量反应性评估[7]。本研究将PLR和脉搏指示连续心排血量监测(pulse index continuous cardiac output, PiCCO)技术结合,评价PLR对于ARDS合并休克患者的预后价值,从而为临床液体管理策略提供可靠的理论依据。
资料和方法 一 研究对象纳入2017年7月至2018年6月收入武汉同济医院重症医学科接受机械通气的ARDS合并休克的患者,ARDS诊断符合2012年柏林定义标准[8],入科时平均动脉压低于70 mmHg,或者需要缩血管药物才能维持平均动脉压至70 mmHg以上。排除标准为:①年龄 < 18岁、孕妇、患者和家属拒绝PiCCO置管等治疗;②心力衰竭、急性冠脉综合征、心源性休克或明显容量过负荷状态;③存在股动脉置管禁忌症,抬腿禁忌症者;④未进行有创机械通气;⑤疾病终末期预计入院后24h内死亡的患者。所有患者或家属充分了解病情,同意接受相关处理措施并签署知情同意书。此研究获得华中科技大学同济医院伦理委员会批准。
二 监测指标和方法患者纳入研究后,立即进行重症监护治疗,收集患者的年龄、性别、生命体征、原发疾病、常规血液和血气分析指标、呼吸机参数、血管活性药物种类和剂量、平均动脉压(MAP)、中心静脉压(CVP)、急性生理与慢性健康状况评分(APACHE Ⅱ)和序贯器官衰竭评分(SOFA)等指标。患者给予适当镇静镇痛,采用肺保护性通气策略:容量控制通气,小潮气量(6 ml/kg);PEEP以静态压力-容积曲线低位转折点法和最大氧输送法确定;控制气道平台压(Pplat≤25 cmH2O)。
颈内静脉或者锁骨下静脉穿刺置入中心静脉导管(7F,美国Arrow公司),并通过胸片确定了导管尖端位于上腔静脉右心房开口附近。股动脉穿刺置入PiCCO热稀释导管(4F,德国Pulsion Medical Systems公司),将中心静脉导管和股动脉导管连接温度探头后分别与PICCO2机器连接,利用热稀释原理测量心排血指数(CI)、全心舒张末期容积指数(GEDVI)、血管外肺水指数(EVLWI)、肺血管通透指数(PVPI)、每搏量指数(SVI)、每搏量变异度(SVV)等指标。
三 PLR及容量反应性的测定患者取平卧位稳定后,将床头抬高45度取半卧位,稳定1分钟;改为仰卧位且将下肢抬高45度持续1分钟;PiCCO测量完毕后恢复原有体位,洗脱PLR效应。过程中患者的机械通气、镇静镇痛药物、血管活性药物等治疗均保持不变。记录PLR前后SVI的变化,SVI的增加≥15%定义为PLR阳性,即为容量有反应性[7]。SVI的增加 < 15%定义为PLR阴性,即为容量无反应性。
四 主要观察指标将纳入的患者分为PLR阳性组和PLR阴性组,比较两组患者PLR之前基础资料(一般情况、原发疾病、呼吸机参数、血流动力学参数等)和临床效果指标(机械通气时间、ICU住院时间以及28天生存率等)的差异。
五 统计学方法应用IBM SPSS 23.0统计软件包进行统计学分析,符合正态或近似正态分布的计量资料以均数±标准差表示,两独立样本比较采用独立样本t检验或配对t检验;计数资料以百分比表示,组间比较采用四格表资料的卡方检验。采用Kaplan-Meier生存分析法分析患者累积生存情况;以P < 0.05为差异具有统计学意义。
结果 一 两组患者的临床特征两组患者在基线时的性别、年龄、原发疾病、APACHE Ⅱ评分、SOFA评分、机械通气参数、氧合指数、去甲肾上腺素剂量、MAP和CVP等指标的差异无统计学意义。PiCCO监测显示两组患者PLR之前的CI、SVI、SVV、GEDVI以及PVPI无统计学差异。PLR阴性组患者的EVLWI较PLR阳性组患者明显升高(P < 0.001)。与PLR阴性组相比较,PLR阳性组患者机械通气时间明显缩短(9.1±3.1天vs 14.9±2.5天, P=0.024)、ICU住院时间明显减少(12.2±3.4天vs 16.8±4.2天, P=0.038),28天生存率明显升高(75% vs 43%, P=0.029)。见表 1。
| 表 1 两组患者的临床资料比较 |
PLR阳性组患者,PLR前后MAP、CVP、CI、SVI显著增高(P < 0.05),SVV显著降低(P=0.004),而GEDVI、EVLWI和PVPI无显著差异。PLR阴性组患者,PLR前后CVP显著升高(P=0.022),余指标均无统计学差异。见表 2。
| 表 2 PLR前后两组患者血流动力学指标比较 |
Kaplan-Meier生存分析显示,PLR阳性组的累计生存率明显高于PLR阴性组(χ2=5.129,P=0.024)。见图 1。
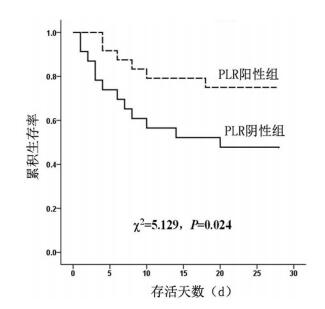
|
图 1 两组患者Kaplan-Meier生存分析 |
ARDS是由于肺内或肺外严重疾病导致的以进行性呼吸窘迫和顽固性低氧血症为特征的危重症。大量研究表明,ARDS的发病机制是过度的炎症反应引起肺血管内皮和肺泡上皮细胞通透性显著增加,大量液体渗出到肺间质和肺泡腔,从而引起肺水肿。肺水肿的严重程度与ARDS的病情发展和预后密切相关,ARDS合并休克患者病情进一步加重,死亡率明显增加[9]。液体管理是ARDS合并休克患者治疗的重要环节,补液过多会造成肺水肿及呼吸衰竭进一步加重,补液不足会使有效循环血量更加不足从而加重休克。因此,ARDS合并休克患者的液体管理必须考虑到两者的平衡,在改善循环状态、保证器官灌注前提下进行限制性液体管理。精确评估ARDS患者的前负荷和容量反应性,可以有效避免不合适的液体治疗风险。CVP等传统评价指标由于受机械正压通气等因素的影响,并不能准确反映患者的容量负荷[3]。
近年来,已经有较多研究将PiCCO技术用于ARDS患者的液体管理和严重程度判断。EVLWI和PVPI的升高与ARDS患者肺水肿的严重程度密切相关,可以有效判断ARDS患者的临床预后[10][11]。SVV≥15%或PPV≥12%能够有效评估ARDS的容量反应性,从而指导液体治疗决策[12][13]。然而也有研究显示对于特定人群,SVV和PPV并不能准确评估ARDS的容量反应性[5][6],原因可能为ARDS患者机械正压通气可能会造成的胸腔内压变化,从而显著影响SVV和PPV的准确性。另外,有约22%中重度ARDS患者合并急性右心功能不全,右心室-肺动脉功能不全会明显影响SVV和PPV的准确性,干扰液体管理策略[14, 15]。因而,目前临床上对ARDS患者的液体管理依然困难。PLR模拟了内源性快速补液,如果患者前负荷不足,对补液有反应性,则实施PLR后心输出量和SVI就会明显增加。然而每个患者PLR后回心血量并不恒定,受到患者基础容量状态的影响较大。但对同一患者而言,PLR后回心血量增加250~450ml不等,可以有效判断患者的容量反应性,而且这种前负荷增加的效应可逆,相对安全[7]。
本研究发现PLR阳性组和阴性组患者的PiCCO参数指标(CI、SVI、SVV、GEDVI和PVPI)均无明显差异,提示SVV并不能准确反映ARDS合并休克患者的容量反应性。而只有在PLR阳性组,实施PLR后才显著改善患者的血流动力学状态。而本组发现,PLR阳性组患者EVLWI较低,提示肺水肿的程度较PLR阴性组低。与PLR阴性组相比,PLR阳性组患者机械通气时间和ICU住院时间较短,28天生存率明显提高。容量有反应性的患者预后较好,原因可能为患者心肺代偿能力较强,另一方面PLR准确评估了患者的容量状态,为ARDS合并休克患者液体管理提供了可靠的临床依据。
综上所述,PLR结合PiCCO技术可以有效评估ARDS合并休克患者的容量反应性,并且可以作为ARDS合并休克患者的预后指标。由于本研究总样本量仍然偏小,PLR对于ARDS患者的评估价值尚需要大样本临床研究支持。
| [1] |
Fan E, Brodie D, Slutsky AS. Acute Respiratory Distress Syndrome:Advances in Diagnosis and Treatment[J]. JAMA, 2018, 319(7): 698-710. DOI:10.1001/jama.2017.21907 |
| [2] |
National Heart L, Blood Institute Acute Respiratory Distress Syndrome Clinical Trials N, Wiedemann HP, et al. Comparison of two fluid-management strategies in acute lung injury[J]. N Engl J Med, 2006, 354(24): 2564-2575. DOI:10.1056/NEJMoa062200 |
| [3] |
National Heart L, Blood Institute Acute Respiratory Distress Syndrome Clinical Trials N, Wheeler AP, et al. Pulmonary-artery versus central venous catheter to guide treatment of acute lung injury[J]. N Engl J Med, 2006, 354(21): 2213-2224. DOI:10.1056/NEJMoa061895 |
| [4] |
Khwannimit B, Bhurayanontachai R. Prediction of fluid responsiveness in septic shock patients:comparing stroke volume variation by FloTrac/Vigileo and automated pulse pressure variation[J]. Eur J Anaesthesiol, 2012, 29(2): 64-69. DOI:10.1097/EJA.0b013e32834b7d82 |
| [5] |
Lakhal K, Ehrmann S, Benzekri-Lefevre D, et al. Respiratory pulse pressure variation fails to predict fluid responsiveness in acute respiratory distress syndrome[J]. Crit Care, 2011, 15(2): R85. DOI:10.1186/cc10083 |
| [6] |
Zhang Z, Ni H, Qian Z. Effectiveness of treatment based on PiCCO parameters in critically ill patients with septic shock and/or acute respiratory distress syndrome:a randomized controlled trial[J]. Intensive Care Med, 2015, 41(3): 444-451. DOI:10.1007/s00134-014-3638-4 |
| [7] |
Jabot J, Teboul JL, Richard C, Monnet X. Passive leg raising for predicting fluid responsiveness:importance of the postural change[J]. Intensive Care Med, 2009, 35(1): 85-90. DOI:10.1007/s00134-008-1293-3 |
| [8] |
Force ADT, Ranieri VM, Rubenfeld GD, et al. Acute respiratory distress syndrome:the Berlin Definition[J]. JAMA, 2012, 307(23): 2526-2533. |
| [9] |
Kushimoto S, Endo T, Yamanouchi S, et al. Relationship between extravascular lung water and severity categories of acute respiratory distress syndrome by the Berlin definition[J]. Crit Care, 2013, 17(4): R132. DOI:10.1186/cc12811 |
| [10] |
Chew MS, Ihrman L, During J, et al. Extravascular lung water index improves the diagnostic accuracy of lung injury in patients with shock[J]. Crit Care, 2012, 16(1): R1. DOI:10.1186/cc10599 |
| [11] |
Kushimoto S, Taira Y, Kitazawa Y, et al. The clinical usefulness of extravascular lung water and pulmonary vascular permeability index to diagnose and characterize pulmonary edema:a prospective multicenter study on the quantitative differential diagnostic definition for acute lung injury/acute respiratory distress syndrome[J]. Crit Care, 2012, 16(6): R232. DOI:10.1186/cc11898 |
| [12] |
Biais M, Nouette-Gaulain K, Quinart A, Roullet S, Revel P, Sztark F. Uncalibrated stroke volume variations are able to predict the hemodynamic effects of positive end-expiratory pressure in patients with acute lung injury or acute respiratory distress syndrome after liver transplantation[J]. Anesthesiology, 2009, 111(4): 855-862. DOI:10.1097/ALN.0b013e3181b27fb2 |
| [13] |
Huang CC, Fu JY, Hu HC, et al. Prediction of fluid responsiveness in acute respiratory distress syndrome patients ventilated with low tidal volume and high positive end-expiratory pressure[J]. Crit Care Med, 2008, 36(10): 2810-2816. DOI:10.1097/CCM.0b013e318186b74e |
| [14] |
Mekontso Dessap A, Boissier F, Charron C, et al. Acute cor pulmonale during protective ventilation for acute respiratory distress syndrome:prevalence, predictors, and clinical impact[J]. Intensive Care Med, 2016, 42(5): 862-870. DOI:10.1007/s00134-015-4141-2 |
| [15] |
Mahjoub Y, Pila C, Friggeri A, et al. Assessing fluid responsiveness in critically ill patients:False-positive pulse pressure variation is detected by Doppler echocardiographic evaluation of the right ventricle[J]. Crit Care Med, 2009, 37(9): 2570-2575. DOI:10.1097/CCM.0b013e3181a380a3 |
 2018, Vol. 2
2018, Vol. 2

