脓毒症是宿主对感染的反应失控而导致的危及生命的器官功能障碍,脓毒性休克是脓毒症发展的严重阶段[1]。脓毒症具有发病率高、病死率高、住院费用高的“三高”特点,是儿童重症监护病房(pediatric intensive care unit,PICU)危重患者的主要死因之一。脓毒症、脓毒性休克患者常伴随器官功能障碍的发生,心功能障碍为脓毒症患者常见器官功能障碍之一。数十年前首次报道脓毒症左室收缩功能障碍,直到床旁心脏超声在ICU的广泛应用才有了很好的认识,但目前脓毒症心功能障碍的发生机制尚不明确,可能是线粒体功能障碍、内皮细胞激活、细胞因子释放、心肌抑制物质、高浓度一氧化氮、冠脉血流的异常分布等多种因素共同作用的结果[2]。研究发现脓毒症左室收缩功能障碍发生率约20%~60%[3-7]。1951年Waisbren第一次描述了脓毒症患者心血管功能变化[8]。1984年Parker等首次应用放射性核素血管造影技术证实了脓毒症心肌抑制的存在[9]。同年,Ozier等首次应用心脏超声技术证实了脓毒症心肌抑制[10]。脓毒症心肌抑制三个主要特征包括:左心室扩张、射血分数降低、心室功能在7~10天恢复正常[11]。目前国内外尚无明确的脓毒血症心肌抑制诊断标准,现关于脓毒症心肌抑制的诊断主要依据临床表现、心脏超声及心肌损伤标志物的检测。国内外关于成人脓毒症心功能障碍的研究较多,尤其左室收缩功能障碍,但对儿童脓毒症心功能障碍的研究相对较少,儿童脓毒症左室收缩心功能障碍时是否与成人具有相同的表现尚未证实。
目前床旁心脏超声是评估脓毒症患者心功能障碍的重要工具[12]。随着床旁心脏超声在ICU的应用,脓毒症心功能障碍的研究更加普遍。心脏超声通过观察心肌运动、测定心功能指标等判断脓毒症患儿心功能障碍状况,多种心脏超声参数可用于脓毒症心功能障碍的评估,目前左室射血分数(left ventricular ejection fraction,LVEF)为公认的评估脓毒症左心收缩功能障碍的指标,一般以LVEF<50%作为诊断标准[4, 13, 14]。B型钠尿肽(B-type natriuretic peptide,BNP)是1988年Sudoh等[15]首次在猪脑组织内发现的一种利钠多肽,广泛分布于脑、脊髓、心、肺等,以在心脏中含量最高,主要由心室肌细胞分泌,为临床常用评估心功能指标之一,心室压力负荷和(或)容量负荷过重是引起BNP释放的主要机制。脓毒症患者发生心功能障碍时心室壁张力和压力升高,BNP水平随之升高。有研究发现,BNP高低与脓毒症严重程度及病死率成正比,BNP升高与LVEF降低相关,随LVEF值的改善而降低[16]。BNP的半衰期约20分钟,NT-proBNP半衰期约70~120分钟,便于临床检测,故NT-proBNP常作为心脏损伤标志物。
本研究中采用床旁心脏超声技术、心肌损伤标志物NT-proBNP等评估脓毒症患儿的心功能变化状况。了解我本院儿科重症监护病房(pediatric intensive care unit,PICU)脓毒症左室收缩功能障碍发生率,探讨左室收缩功能障碍及心肌损伤标志物NT-proBNP的预后价值。
对象与方法 (一) 研究对象研究对象为2015年12月至2016年12月入住上海儿童医学中心PICU并被诊断严重脓毒症的患儿43例。本研究方案获得医院伦理委员会批准(批件号SCMCIRB-K2016017)。研究对象纳入标准:①收入我本院PICU符合2012严重脓毒症和脓毒性休克国际管理指南[17]中脓毒症诊断标准的。脓毒症是指由感染(可疑或证实)引起的全身炎症反应综合征,严重脓毒症是指脓毒症导致的组织低灌注或器官功能障碍,脓毒性休克是指脓毒症导致的组织低灌注和心血管功能障碍。②年龄大于28天、纠正胎龄大于41周的早产儿、小于18岁;③排除先天性心脏病、先天性心脏病术后、心肌病、心肌炎、慢性心功能不全、心力衰竭、冠状动脉疾病、慢性肾功能不全及入选前7天发生胸部创伤、胸外按压、电除颤、电复律的患儿。
(二) 研究方法 一. 心脏功能指标本研究为前瞻性队列研究,符合入选标准的患儿分别于入PICU后第1天(d1)、第2天(d2)、第3天(d3)、第7天(d7)、第10天(d10)行超声心动图检查,采用Simpson’s方法测量患者LVEF,采用5-1MHz心脏超声探头,将探头置于胸骨旁,取得胸骨旁长轴切面清晰图像,测出左室舒张末期内径(left ventricular end-diastolic dimension,LVEDD)和左室收缩末期内径(left ventricular end-systolic dimension,LVESD),重复测量三次数据,取其平均值。记录相关参数:LVEF、左室短轴缩短率(left ventricular fractional shortening,LVFS)、左室舒张末期容积(left ventricular end-diastolic volume, LVEDV)、左室收缩末期容积(left ventricular end-systolic volume,LVESV)、每博量(stroke volume,SV)、心率(heart rate,HR),心输出量[(cardiac output,CO)(CO=SV×HR)],左室舒张末期容积指数(left ventricular end-diastolic volume index, LVEDVI)、左室收缩末期容积指数(left ventricular end-systolic volume index,LVESVI)、每博量指数(stroke volume index,SVI)、心脏指数(cardiac index,CI)均由LVEDV、LVESV、SV、CO体表面积标准化。同时采集血标本,检测心肌损伤标志物NT-pro BNP。
二. 记录指标患者一般情况,包括年龄,性别,入PICU后6小时内是否机械通气,机械通气的天数,住PICU的天数,住院天数,28天预后。
三. 研究分组:根据LVEF,将严重脓毒症患儿分为:心肌抑制(sepsis induced myocardial depression,SIMD)组和非心肌抑制(non-sepsis induced myocardial depression,N-SIMD)组,心肌抑制定义为:LVEF<50%或LVEF较基线水平下降≥10%;非心肌抑制组:LVEF ≥50%[13, 18]。根据28天预后,分为存活组和死亡组。
(三) 统计学方法采用IBM SPSS 19.0统计软件包进行统计学分析。符合正态分布或近似正态分布的计量资料以(x±s)表示,两独立样本比较使用独立样本t检验,多个独立样本比较使用单因素方差分析。非正态分布的计量资料以中位数及四分位间距[M(QL, QU)]表示,两独立样本比较使用Mann-Whitney U检验,多个独立样本比较使用Kruskal-Wallis检验。计数资料以百分比表示,组间比较采用四格表资料的χ2检验。绘制Kaplan-Meier生存曲线,log-rank检验比较生存率的差异。P<0.05为差异有统计学意义。ROC曲线下面积(area under roc curve,AUC)法评价LVEF、NT-proBNP预测28天病死率的敏感度和特异度。
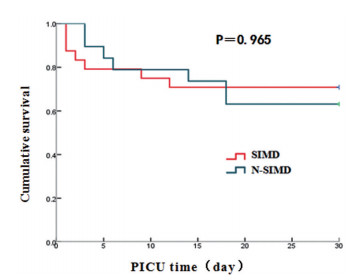
结果 (一) 严重脓毒症心肌抑制组与非心肌抑制组一般及预后资料比较本研究共纳入严重脓毒症患儿43例(56.58%),其中心肌抑制组24例(55.81%);脓毒症心肌抑制组与非心肌抑制组28天病死率分别为37.5%、36.8%;两组间年龄、性别、入PICU后6h内机械通气、机械通气时间、PICU时间、住院时间、28 d预后等比较差异均无统计学意义(P>0.05)(见表 1,图 1)。
| 表 1 心肌抑制组与非心肌抑制组一般及预后资料比较 |
|
图 1 严重脓毒症心肌抑制组、非心肌抑制组入PICU后28d生存曲线 |
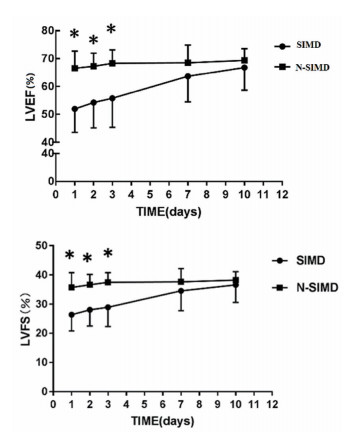
入PICU后d1~d3,脓毒症心肌抑制组LVEF、LVFS均低于非心肌抑制组,心肌抑制组LVESVI均高于非心肌抑制组,两组间比较差异有统计学意义(P<0.05);d7、d10两时间点LVEF、LVFS、LVESVI和各时间点其余血流动力学指标两组间比较差异无统计学意义(P>0.05);入PICU后d1~d3、d7心肌抑制组NT-proBNP均高于非心肌抑制组,两组间比较差异有统计学意义(P<0.05)(见表 2,图 2)。
| 表 2 心肌抑制组与非心肌抑制组心脏功能指标比较 |
|
图 2 心肌抑制组、非心肌抑制组d1~d3、d7、d10LVEF、LVFS比较,*P<0.05 |
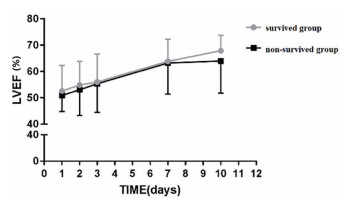
心脏超声指标、NT-proBNP两组间各时间点比较差异无统计学意义(P>0.05);各时间点PICU时间两组间比较差异无统计学意义(P>0.05);机械通气时间、住院时间组间比较差异有统计学意义(P<0.05)(见表 3-4,图 3)。
| 表 3 心肌抑制者存活组与死亡组心脏超声比较 |
| 表 4 心肌抑制者存活组与死亡组预后指标比较 |
|
图 3 心肌抑制者存活组与死亡组d1~d3、d7、d10LVEF比较,P>0.05 Figure 3 Comparison of LVEF between survived group and non-survived group in SIMD in d1~d3, d7, d10, P > 0.05 |
LVEF、NT-proBNP预测左室收缩功能障碍患者28天病死率的AUC均<0.7(见表 5-6)。
| 表 5 LVEF、NT-proBNP预测心肌抑制者28天病死率的ROC曲线结果 |
脓毒症或脓毒性休克,是世界范围内儿童死亡的最常见原因之一[17]。脓毒症左室收缩功能障碍是一种发生于严重脓毒症和脓毒性休克早期的的可逆性的器官功能障碍[19]。Charpentier等关于成人严重脓毒症和脓毒性休克患者的研究发现中病程第2天左室收缩功能障碍发生率为44%,病程第8天心功能恢复正常范围[21]。Williams等关于液体和儿茶酚胺抵抗型儿童脓毒性休克的研究发现,左室收缩功能障碍发生率为44%,且与初期疾病严重程度和血管活性药物的应用成正相关[6]。本研究中,严重脓毒症和脓毒性休克患儿左室收缩功能障碍发生率为55.81%,前3天心肌抑制组LVEF较非心肌抑制组明显降低,第7天、第10天心肌抑制组LVEF较前明显升高,恢复至正常范围。与先前脓毒症左室功能障碍发生率的研究报道相一致。
脓毒症左室收缩功能障碍对预后的影响尚存在争议,尽管许多研究发现脓毒症患者LVEF越低,预后越好,但其与关于LVEF降低与脓毒症患者病死率间关系的研究结果互相矛盾并不一致[3, 9, 22]。近期Sevilla Berrios等一项Meta分析显示,成人脓毒症左室收缩功能障碍, 即LVEF的降低,与严重脓毒症或脓毒性休克预后无明显相关性,纳入的所有研究中左室收缩功能障碍的界值LVEF均小于50%,预后指标为ICU病死率、住院病死率、30天病死率及1年病死率等[13]。Raj和Williams等关于儿童脓毒性休克的研究有相似的发现。但也有成人研究发现,左室收缩功能障碍与脓毒症患者不良预后相关[7]。Prabhu等关于66例脓毒性休克患者的研究发现,脓毒症左心室收缩功能障碍即LVEF小于50%,与脓毒性休克患者病死率相关[5]。二尖瓣环收缩期峰值流速与LVEF均为左室收缩功能障碍的指标,在Weng等的研究中,二尖瓣环收缩期峰值流速预测脓毒性休克患者病死率的ROC曲线下面积为0.83,脓毒性休克患者左室收缩功能障碍与其病死率相关。研究发现,严重脓毒症患者病死率为28%~52%23,脓毒症左室收缩功能障碍者病死率可高达47%21。本研究中严重脓毒症患儿总的28天病死率为37.21%,脓毒症患儿左室收缩功能障碍者28天病死率为37.5%,与无左室收缩功能障碍与脓毒症患者28天病死率预后无关无明显差异,与文献报道相一致。
另外,本研究中左室收缩功能障碍与无左室收缩功能障碍两组间入PICU后6小时内机械通气例数、机械通气时间、PICU时间及住院时间均无统计学差异;脓毒症左室收缩功能障碍者存活组与死亡组机械通气时间、住院时间组间有统计学差异, PICU时间组间比较无统计学差异,与Raj和Williams等关于脓毒性休克患儿的研究结果相类似[6, 7]。可能原因是儿童一般对药物的作用更加敏感,对疾病造成的损伤的恢复能力较强,早期积极的血流动力学监测和超声指导下的治疗,这些均有可能使得脓毒症患儿预后不受心功能障碍的影响。
随着心脏超声在ICU的广泛应用,人们对脓毒症心功能障碍有了更好的认识。LVEF为目前公认的评估脓毒症左室收缩功能障碍的指标[4]。多项研究发现,可逆性脓毒症左室收缩功能障碍即LVEF降低,在严重脓毒症患者中普遍存在[24]。本研究通过床旁心脏超声评价脓毒症患儿左室收缩功能变化,入PICU前3天脓毒症心肌抑制组LVEF和LVFS明显低于非心肌抑制组,d7、d10心肌抑制组LVEF和LVFS恢复至正常范围,从脓毒症左室收缩功能障碍的发生、发展至恢复的过程符合文献报道的脓毒症心功能障碍变化的演变规律。SVI、CI组间比较无统计学差异,SVI始终处于正常范围,CI均较正常范围升高,与Parker等[9]研究报道相一致。所有患者LVEDVI始终处于正常范围, 与Jardin等[25, 26]研究结果一致。本研究中,严重脓毒症患儿左室收缩功能障碍者存活组与死亡组心脏超声指标组间比较无统计学差异。Prabhu等[5]关于成人脓毒性休克的研究中LVEF预测病死率的ROC曲线下面积为0.656,同样,本研究中LVEF预测脓毒症左室收缩功能障碍患儿28天病死率的AUC<0.7,提示LVEF不能预测儿童脓毒症左室收缩功能障碍者28天预后。
NT-proBNP是由心肌细胞合成的具有生物学活性的神经多肽,为临床常用心脏生物标志物,心室壁张力、舒张末压力和容积的升高为引起BNP水平升高的主要原因[27]。NT-BNP目前常作为心力衰竭的生物标志物[28]。多项成人研究发现,NT-proBNP水平的升高与脓毒症左室收缩功能障碍相关[16, 20, 27]。一项儿童脓毒性休克的研究发现,与健康患者或不伴有感染和心功能障碍的危重患者相比,脓毒性休克患者NT-proBNP水平的升高与左室收缩功能障碍、疾病严重程度相关[29]。本研究中,脓毒症早期NT-proBNP明显升高,尤其d2升高更明显,各时间点NT-proBNP左室收缩功能障碍者明显高于非左室收缩功能障碍者,d7随着心脏功能的恢复已较前明显下降,与Charpentier等[21]的研究结果相类似,与脓毒症心肌抑制患者病情演变相符合,提示NT-proBNP与脓毒症患儿左室收缩功能障碍的相关。NT-proBNP与脓毒症左室收缩功能障碍者预后间关系的研究结果不一致。多项关于脓毒症左室收缩功能障碍的研究发现,NT-proBNP水平的升高可用于病死率的预测[16, 20, 27]。Weng和Williams等[6, 30]关于脓毒性休克左室收缩功能障碍的研究发现NT-proBNP与病死率间无明显相关性。本研究结果显示,严重脓毒症患儿左室收缩功能障碍者存活组与死亡组相比,NT-proBNP组间比较无统计学差异,另外NT-proBNP预测严重脓毒症患儿左室收缩功能障碍者28天病死率的AUC<0.7,提示NT-proBNP预测儿童脓毒症左室收缩功能障碍者28天预后的价值较低,与上述部分研究结果相一致。本研究存在一定的局限性。首先,本研究未进行脓毒症左室舒张功能及右心室功能的研究。其次,由于病情危重,大部分患儿进行心脏超声评估时已有血管活性药物的应用,可能会导致左室收缩功能障碍发生率的低估。最后,本研究为单中心研究,样本量小,需要进一步扩大样本量研究。
综上所述,脓毒症左室收缩功能障碍在严重脓毒症患儿中比较高发,常发生于疾病早期,于7~10天内恢复至正常,是一种可逆性器官功能障碍。本研究没有发现脓毒症左室收缩功能障碍及心肌损伤标志物NT-proBNP与严重脓毒症患儿28天预后相关。
| [1] |
姚咏明, 任超, 吴瑶. 深化对脓毒性休克发病本质的认识[J]. 实用休克杂志, 2017, 1(1): 1-4. |
| [2] |
Merx MW, Weber C. Sepsis and the heart[J]. Circulation, 2007, 116(7): 793-802. DOI:10.1161/CIRCULATIONAHA.106.678359 |
| [3] |
Vieillard-Baron A, Caille V, Charron C, al. e. Vieillard-Baron Actual incidence of global left ventricular hypokinesia in adult septic shock. Crit Care Med, 2008, 36(6): 1701-6.
|
| [4] |
Pulido JN, Afessa B, Masaki M, et al. Clinical spectrum, frequency, and significance of myocardial dysfunction in severe sepsis and septic shock[J]. Mayo Clinic proceedings, 2012, 87(7): 620-8. DOI:10.1016/j.mayocp.2012.01.018 |
| [5] |
Prabhu MM, Yalakala SK, Shetty R, et al. Prognosis of left ventricular systolic dysfunction in septic shock patients[J]. Journal of clinical and diagnostic research:JCDR, 2015, 9(3): OC05-8. |
| [6] |
Williams FZ, Sachdeva R, Travers CD, et al. Characterization of Myocardial Dysfunction in Fluid-and Catecholamine-Refractory Pediatric Septic Shock and Its Clinical Significance[J]. Journal of intensive care medicine, 2016, 88(5): 661-668. |
| [7] |
Raj S, Killinger JS, Gonzalez JA, et al. Myocardial dysfunction in pediatric septic shock[J]. The Journal of pediatrics, 2014, 164(1): 72. DOI:10.1016/j.jpeds.2013.09.027 |
| [8] |
Waisbren BA. Bacteremia due to gram-negative bacilli other than the Salmonella; a clinical and therapeutic study[J]. AMA archives of internal medicine, 1951, 88(4): 467-488. DOI:10.1001/archinte.1951.03810100051005 |
| [9] |
Parker MM, Shelhamer JH, Bacharach SL, et al. Profound but Reversible Myocardial Depression in Patients with Septic Shock[J]. Ann Intern Med, 1984, 100(4): 483-490. DOI:10.7326/0003-4819-100-4-483 |
| [10] |
Ozier Y, Guéret P, Jardin F, et al. Two-dimensional echocardiographic demonstration of acute myocardial depression in septic shock[J]. Critical care medicine, 1984, 12(7): 596-599. DOI:10.1097/00003246-198407000-00011 |
| [11] |
Sato R, Nasu M. A review of sepsis-induced cardiomyopathy[J]. Journal of intensive care, 2015, 3: 48. DOI:10.1186/s40560-015-0112-5 |
| [12] |
Vieillard-Baron A. Septic cardiomyopathy[J]. Annals of intensive care, 2011, 1(1): 6. DOI:10.1186/2110-5820-1-6 |
| [13] |
Sevilla Berrios RA, O'Horo JC, Velagapudi V, et al. Correlation of left ventricular systolic dysfunction determined by low ejection fraction and 30-day mortality in patients with severe sepsis and septic shock:a systematic review and meta-analysis[J]. Journal of critical care, 2014, 29(4): 495-499. DOI:10.1016/j.jcrc.2014.03.007 |
| [14] |
Dittoe N, Stultz D, Schwartz BP, et al. Quantitative left ventricular systolic function:from chamber to myocardium[J]. Critical care medicine, 2007, 35(8): S330-9. |
| [15] |
Sudoh T, Kangawa K, Minamino N, et al. A new natriuretic peptide in porcine brain[J]. Nature, 1988, 332(6159): 78-81. DOI:10.1038/332078a0 |
| [16] |
Turner KL, Moore LJ, Todd SR, et al. Identification of cardiac dysfunction in sepsis with B-type natriuretic peptide[J]. Journal of the American College of Surgeons, 2011, 213(1): 139-46. DOI:10.1016/j.jamcollsurg.2011.03.027 |
| [17] |
Dellinger RP, Levy MM, Rhodes A, et al. Surviving sepsis campaign:international guidelines for management of severe sepsis and septic shock:2012[J]. Crit Care Med, 2013, 41(2): 580-637. DOI:10.1097/CCM.0b013e31827e83af |
| [18] |
Sato R, Kuriyama A, Takada T, et al. Prevalence and risk factors of sepsis-induced cardiomyopathy:A retrospective cohort study[J]. Medicine, 2016, 95(39): e5031. DOI:10.1097/MD.0000000000005031 |
| [19] |
Sato R, Nasu M. A review of sepsis-induced cardiomyopathy[J]. Journal of intensive care, 2015, 3(1). |
| [20] |
Post F, Weilemann LS, Messow CM. B-type natriuretic peptide as a marker for sepsis-induced myocardial depression in intensive care patients[J]. Critical care medicine, 2008, 36(11): 3030-3037. DOI:10.1097/CCM.0b013e31818b9153 |
| [21] |
Charpentier J, Luyt C-E, Fulla Y, et al. Brain natriuretic peptide:A marker of myocardial dysfunction and prognosis during severe sepsis[J]. Critical care medicine, 2004, 32(3): 660-665. DOI:10.1097/01.CCM.0000114827.93410.D8 |
| [22] |
Furian T, Aguiar C, Prado K, et al. Ventricular dysfunction and dilation in severe sepsis and septic shock:relation to endothelial function and mortality[J]. Journal of critical care, 2012, 27(3): 9-15. |
| [23] |
Jawad I, Luksic I, Rafnsson SB. Assessing available information on the burden of sepsis:global estimates of incidence, prevalence and mortality[J]. Journal of global health, 2012, 2(1): 1-4. |
| [24] |
Huang SJ, Nalos M, McLean AS. Is early ventricular dysfunction or dilatation associated with lower mortality rate in adult severe sepsis and septic shock? A meta-analysis[J]. Crit Care, 2013, 17(3): R96. DOI:10.1186/cc12741 |
| [25] |
Jardin F, Brun-Ney D, Auvert B, et al. Sepsis-related cardiogenic shock[J]. Crit Care Med, 1990, 18(10): 1055-1060. DOI:10.1097/00003246-199010000-00001 |
| [26] |
Jardin F, Fourme T, Page B, et al. Persistent preload defect in severe sepsis despite fluid loading:A longitudinal echocardiographic study in patients with septic shock[J]. Chest, 1999, 116(5): 1354-1359. DOI:10.1378/chest.116.5.1354 |
| [27] |
Klouche K, Pommet S, Amigues L, et al. Plasma brain natriuretic peptide and troponin levels in severe sepsis and septic shock:relationships with systolic myocardial dysfunction and intensive care unit mortality[J]. Journal of intensive care medicine, 2014, 29(4): 229-237. DOI:10.1177/0885066612471621 |
| [28] |
Sugimoto M, Kuwata S, Kurishima C, et al. Cardiac biomarkers in children with congenital heart disease[J]. World journal of pediatrics:WJP, 2015, 11(4): 309-315. DOI:10.1007/s12519-015-0039-x |
| [29] |
Domico M, Liao P, Anas N, et al. Elevation of brain natriuretic peptide levels in children with septic shock[J]. Pediatric critical care medicine:a journal of the Society of Critical Care Medicine and the World Federation of Pediatric Intensive and Critical Care Societies, 2008, 9(5): 478-483. DOI:10.1097/PCC.0b013e3181849b99 |
| [30] |
Weng L, Liu YT, Du B, et al. The Prognostic value of left ventricular systolic function as measured by tissue Doppler imaging in septic shock[J]. Crit Care, 2012, 16(3): R71. DOI:10.1186/cc11328 |
 2018, Vol. 2
2018, Vol. 2

