2. 河南省人民医院儿童重症监护室
2. PICU, Henan province people's hospital, Zhengzhou, China
脓毒症严重威胁人类生命健康,儿童脓毒症发生于多种类型感染之后,可引起免疫系统异常、微循环障碍以及血液成分异常,死亡率达15~50%[1, 2]。脓毒症的主要症状包括:呼吸急促、白细胞聚集、心动过速以及白细胞减少或发热。尽管目前对于脓毒症已经有诸多的治疗手段,但是其疗效并不理想[3]。因此,寻求一种可有效改善脓毒症预后的手段和方法十分必要。MiRNA分子作为一种小分子调节RNA,被证实在炎症、细胞增殖、凋亡、自噬的发展中均发挥了重要作用[4]。miR-34a在细胞内具有多种生物学功能,参与炎症反应和细胞凋亡的调节[5],但miR-34a在脓毒症中的作用有待进一步研究。脓毒症可激活多条分子信号通路并释放多种炎性细胞因子诱导炎症反应的发生,控制炎症反应是治疗脓毒症的重要手段。JAK/STAT信号通路是调节免疫反应的重要信号途径,磷酸化的STAT3(p-STAT3)分子入核后可以促进多种促炎因子(如诱导性一氧化氮合酶(inducible nitric oxide synthase, iNOS))的转录[6]。iNOS是M1型巨噬细胞极化的特征性基因,极化的M1型巨噬细胞可释放炎性细胞[7]。本研究中,在肺泡巨噬细胞和U973细胞过表达和敲低miRNA-34a,LPS处理后观察巨噬细胞中JAK/STAT3信号通路相关蛋白质的变化。在大鼠中转染miR-34a抑制剂,才用CLP制作大鼠脓毒症模型,观测巨噬细胞形态以及JAK/STAT3信号通路蛋白的表达水平。结果显示,miR-34a通过激活JAK/STAT3信号通路,促进脓毒症大鼠体内肺组织巨噬细胞内iNOS的表达。
材料与方法 (一) 试验动物SPF级SD大鼠(年龄:生活1周以内),全部动物实验遵循国际实验动物评价和坚定委员会的指南,符合动物伦理的要求。
(二) 肺巨噬细胞的分离和培养根据既往报道的方法由切除的肺组织对巨噬细胞进行分离和培养[8],使用选择RPMI-1640培养基(GIBCO,Rockville,MD)+10%胎牛血清(FBS,GIBCO,Rockville,MD)+0.25 μg/mL两性霉素B+100 U/mL青霉素+100 μg/mL链霉素(HyClone,Salt Lake City,UT),细胞培养置于37℃、含5%CO2的培养箱内, 3~4天后分离备用。
(三) miR-34a抑制剂转染的CLP诱导脓毒症动物模型制备盲肠结扎脓毒症动物模型制备依照Rittirsch等人建立的方法[9]。36只动物被随机分为4组,分别为:对照组,健康大鼠;模型组,盲肠穿孔模型大鼠;阴性对照组,盲肠传控模型动物+对照抑制剂注射模型;以及实验组:盲肠穿孔模型动物+miR-34a抑制剂注射组。
(四) U937细胞系培养U937细胞系购自与美国ATCC(American Type Culture Collection,ATCC,Rockville, MD, USA)。细胞培养基采用RPMI1640培养基+10%胎牛血清+100 U/mL青霉素+100 mg/mL链霉素,培养环境为37℃、含5%CO2的培养箱。U937细胞使用0.5 μg/mL的LPS刺激12hr,随后洗涤细胞并做进一步分析。
(五) 细胞转染细胞转染分别使用50 nM的对照类似物、miR-34a类似物、抑制剂对照物、miR-34a抑制剂(GenePharma Co.上海),转染载体使用脂质体TM 2000 (Invitrogen, Carlsbad, CA, USA)。
(六) qRT-PCR试验根据标准制备流程收集细胞以及组织当中的总RNAs,使用M-MLV(Promega,美国)制备合成cDNA。定量PCR采用Applied Biosystems StepOnePlusTM系统,引物设计序列如下:5’- UGGCAGUGUCUUAGCUGGUUGU-3’(Dharmacon, Chicago, IL, USA),使用GAPDS作为内参,使用2-ΔΔCt分析系统对表达水平进行分析。
(七) WBRIPA裂解液裂解细胞或肺组织,检测蛋白质浓度,SDS-PAGE分离蛋白质,转膜并进行5%BSA室温封闭1 h,4℃孵育STAT3以及其磷酸化抗体(p-STAT3)(Abcam,Cambridge,UK)过夜。二抗(Abcam,Cambridge,UK)室温孵育1小时,使用辣根过氧化物酶化学显色法分析WB条带。
(八) 流式细胞分析U973细胞样品以及肺组织提取的单细胞依据Jhingran等人建立的方法进行制备[10];稀释至1×106细胞/mL,采集100 μL的U973细胞和肺组织细胞使用抗iNOS/FITC(Caltag Laboratories, Calif., USA)标记,F480/FITC抗体(Novocastra Laboratories, Ltd., UK)进行二抗孵育。使用其他预处理试剂(Caltag Laboratories)协助抗体进入细胞核。
(九) HE和IHC肺组织使用10%甲醛固定,进行石蜡包埋后并进行切片(切片厚度5 μm)。脱蜡并水化后进行HE染色和免疫组织化学染色[11]。
(十) 统计分析使用单因素分析的方法进行统计分析,所有数据使用均值±SD的方法进行表示,P<0.05表示有统计学差异。
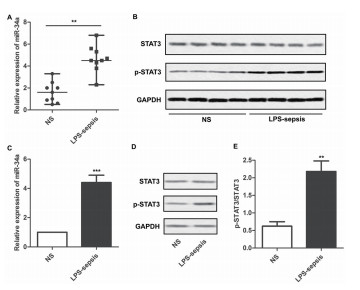
结果 (一) LPS诱导的脓毒症大鼠以及人巨噬细胞中miR-34a和磷酸化STAT3的表达上调qRT-PCR方法检测肺巨噬细胞、U973细胞中miR-34a及p-STAT3/STAT3的表达量进行检测。如图 1A、B显示,与正常肺巨噬细胞相比,LPS-诱导的肺巨噬细胞内的miR-34a及p-STAT3/STAT3表达量显著上调。U973细胞内能够检测到相似的结果(图 1C、D、E)。
|
图 1 LPS诱导的脓毒症大鼠以及人巨噬细胞内miR-34a、p-STAT3表达上调。A.正常大鼠以及脓毒症大鼠体内分离的肺巨噬细胞内miR-34a的表达水平。B.脓毒症大鼠模型中STAT3及p-STAT3的表达水平。C.qRT-PCR方法检测U973细胞当中的miR-34a表达水平。D.U973细胞中STAT3和p-STAT3的表达水平。E.p-STAT3/STAT3的半定量分析。 |
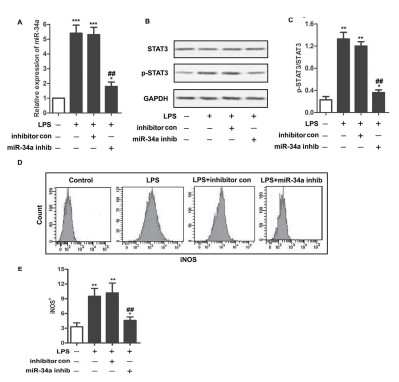
与对照组相比,转染miR-34ainhibitor的巨噬细胞,在受到LPS刺激后,p-STAT3表达水平显著下降(图 2B, C);iNOS+的表达量显著下降(图 2D, E)。
|
图 2 LPS诱导的巨噬细胞中miR-34a的表达与iNOS+细胞一致。A.qRT-PCR检测验证U973细胞中miR-34ainhibitor的转染效率。B-C.WB结果显示不同组别细胞内p-STAT3表达水平的变化。D-E.iNOS+细胞数在不同组别之间的对比。 |
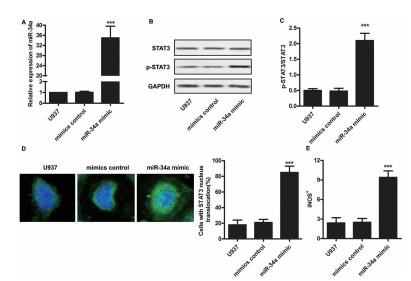
与对照相比,转染miR-34amimic的细胞表达miR-34a的水平显著增高(图 3A)。p-STAT3/STAT3水平在过表达miR-34a的巨噬细胞U937细胞内表达水平较对照细胞内明显增高(图 3B C),免疫荧光检测提示:过表达miR-34a的细胞中STAT3的入核水平较对照组显著增高(图 3D)。流式细胞检测结果显示,过表达miR-34a的细胞内iNOS+细胞量显著高于对照组(图 3E)。
|
图 3 miR-34a通过STAT3入核介导iNOS+产生。A.qRT-PCR验证miR-34a转染效果。B-C.p-STAT3和STAT3的表达水平。D.STAT3入核效果的检测。E iNOS+的表达水平(***与对照组比较,P<0.001)。 |
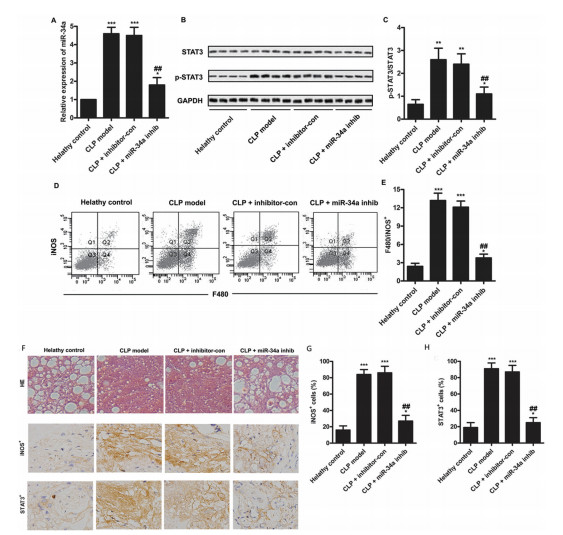
通过静脉注射miR-34ainhibitor的方法沉默大鼠miR-34a的表达,动物水平验证miR-34ainhibitor对CLP诱导脓毒症大鼠模型的保护作用。通过收集模型大鼠的肺组织并进行脓毒症相关因子的检测,来验证miR-34a抑制剂的保护作用。WB的结果显示:p-STAT3/STAT3的水平在注射miR-34a抑制剂后显著下降(图 4A-C),采用流式细胞技术检测肺内F480+巨噬细胞及其iNOS表达发现,抑制miR-34a后,F480+巨噬细胞内iNOS表达量显著下调。HE染色结果提示,沉默miR-34a可以减少肺组织内巨噬细胞形态学改变、纤维蛋白沉积、改善内膜增厚和纤维小结的形成。同时,miR-34a的沉默可减轻肺内炎症反应以及对肺泡组织的破坏(图 4F)。如图 4F、G显示,沉默miR-34a后肺内组织的iNOS+和STAT3表达量明显减少。
|
图 4 沉默miR-34a可以减轻CLP诱导脓毒症大鼠的肺损伤 A-B. CLP模型当中的转染效率以及STAT3/p-STAT3的表达量变化。C.大鼠肺组织当中的STAT3的表达量。D-E.肺组织内iNOS阳性细胞数目检测结果。F-H.HE以及免疫组化染色结果提示肺组织内iNOS+以及STAT3表达量的改变。(与对照组比较,**P<0.01, ***P<0.001;与阴性对照组比较,##P<0.01)。 |
脓毒症是由于宿主对感染的反应失调造成危及生命的器官功能障碍[12],每年约有3000万脓毒症患儿,其中死亡约800万例[1]。虽然越来越多的实验证据使我们对于脓毒症的理解越来越深入,但是尚无有效的药物能够治愈脓毒症[13]。既往的众多研究揭示了miRNAs参与了机体当中的病理和生理反应,例如血管生成、增值、分化、凋亡以及炎症[14]。这些研究对于miRNAs在脓毒症当中的救治作用均起到了提示作用。脓毒症的病理进程十分复杂,在脓毒症早期,通常机体表现为一种高炎症反应状态[15],这种状态是机体对于感染或者损伤产生的一种自我保护机制,然而,一旦这样的炎症反应过程失控,那么随之而来的将是严重的后果[16]。
众多的实验证据表明,miRNAs在脓毒症的发病过程中发挥了重要作用。例如,miR-148在硬骨鱼体内可以负性调节TLR受体的反应从而调节炎症反应[17];大鼠过敏性鼻炎模型中,miR-133b能够通过调节Nlrp3的功能减轻过敏反应以及过敏症状[18];糖尿病肾病模型中,miR-29c则通过调节tristetraprolin蛋白的功能调节炎症因子的表达、释放[19]。此外,miR-34a作为miR-34家族中的一员,同样参与了炎症反应的进程。Kurowska等人的体外研究实验证实,通过沉默miR-34a,可以降低促炎因子的产生和释放[20],此外,有报道证实miR-34a参与了内皮细胞流量依赖的炎症反应[21]。脓毒症诱导的肺内皮细胞损伤以及肺组织纤维化进程涉及到p53基因与miR-34a的负反馈调节[22]。与我们的研究结果相似的是,miR-34a可以显著促进LPS诱导的脓毒症模型中肺组织巨噬细胞的活化以及了LPS诱导的U973细胞系炎症反应水平。这些结果提示miR-34a对炎症反应具有促进作用。
研究表明,包括脓毒症在内的炎症反应相关性疾病的进展与JAK/STAT信号通路的过度活化强烈相关[23],而miRNAs在这条信号通路的激活过程中扮演了重要作用。Zhang J等人的研究结果显示,树突状细胞的炎症反应和心肌细胞的凋亡受到miR-181a和miR-150通过JAK-STAT/c-Fos信号通路的调节[24]。miR-149可以通过STAT3信号通路降低肝细胞内的炎症反应[25]。本研究结果证实,沉默miR-34a能够降低p-STAT3/STAT3信号通路的活化及其入核,结合前述,miR-34a可能通过STAT3信号通路调节炎症反应进程。
iNOS是一种促炎因子,脓毒症当中通常能够检测到iNOS的过量表达[26]。因此,抑制促炎因子产生的药物可能是未来开发抗炎药物的重要靶点[27]。miRNAs在炎症性疾病当中对于iNOS表达的促进作用已经得到证实:miR-27b在糖尿病等疾病中可以抑制iNOS的表达[28];miR-146a则可以通过TRAF6抑制iNOS表达保护大鼠免于分支杆菌的感染[29];过表达mmu-miR-125b则可以通过eEF2K和CCNA2抑制巨噬细胞激活[30]。本研究表明,沉默miR-34a可以减少肺内巨噬细胞释放iNOS,这一结果提示沉默miR-34a可能降低炎症反应。
综上所述,本研究证实miR-34a通过激活JAK/STAT3通路促进肺巨噬细胞iNOS的分泌,进而诱导LPS介导的脓毒症乳鼠的肺损伤,这些结果对于未来miR-34a的临床应用可能提供部分试验证据。
| [1] |
Dugani S, Kissoon N. Global advocacy needed for sepsis in children[J]. J Infect, 2017, 74 Suppl 1: S61-s65. |
| [2] |
Agyei JO, Lipinski LJ, Leonardo J. Case Report of a Primary Pituitary Abscess and Systematic Literature Review of Pituitary Abscess with a Focus on Patient Outcomes[J]. World Neurosurg, 2017, 101: 76-92. DOI:10.1016/j.wneu.2017.01.077 |
| [3] |
Opal SM, Dellinger RP, Vincent JL, et al. The next generation of sepsis clinical trial designs:what is next after the demise of recombinant human activated protein[J]. Crit Care Med, 2014, 42(7): 1714-1721. DOI:10.1097/CCM.0000000000000325 |
| [4] |
Saravanan S, Thirugnanasambantham K, Hanieh H, et al. miRNA-24 and miRNA-466i-5p controls inflammation in rat hepatocytes[J]. Cell Mol Immunol, 2015, 12(1): 113-115. DOI:10.1038/cmi.2014.67 |
| [5] |
Tilyek A, Chai C, Hou X, et al. The protective effects of Ribes diacanthum Pall on cisplatin-induced nephrotoxicity in mice[J]. J Ethnopharmacol, 2016, 178: 297-306. DOI:10.1016/j.jep.2015.10.003 |
| [6] |
Ganster RW, Taylor BS, Shao L, et al. Complex regulation of human inducible nitric oxide synthase gene transcription by Stat 1 and NF-kappa B[J]. Proc Natl Acad Sci U S A, 2001, 98(15): 8638-8643. DOI:10.1073/pnas.151239498 |
| [7] |
Essandoh K, Li Y, Huo J, et al. MiRNA-Mediated Macrophage Polarization and its Potential Role in the Regulation of Inflammatory Response[J]. Shock, 2016, 46(2): 122-131. DOI:10.1097/SHK.0000000000000604 |
| [8] |
Finney-Hayward TK, Popa MO, Bahra P, et al. Expression of transient receptor potential C6 channels in human lung macrophages[J]. Am J Respir Cell Mol Biol, 2010, 43(3): 296-304. DOI:10.1165/rcmb.2008-0373OC |
| [9] |
Rittirsch D, Huber-Lang MS, Flierl MA, et al. Immunodesign of experimental sepsis by cecal ligation and puncture[J]. Nat Protoc, 2009, 4(1): 31-36. DOI:10.1038/nprot.2008.214 |
| [10] |
Jhingran A, Kasahara S, Hohl TM. Flow Cytometry of Lung and Bronchoalveolar Lavage Fluid Cells from Mice Challenged with Fluorescent Aspergillus Reporter (FLARE) Conidia[J]. Bio Protoc, 2016, 6(18). |
| [11] |
Iseki Y, Shibutani M, Maeda K, et al. Significance of E-cadherin and CD44 expression in patients with unresectable metastatic colorectal cancer[J]. Oncol Lett, 2017, 14(1): 1025-1034. DOI:10.3892/ol.2017.6269 |
| [12] |
Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. Jama, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [13] |
Fink MP, Warren HS. Strategies to improve drug development for sepsis[J]. Nat Rev Drug Discov, 2014, 13(10): 741-758. DOI:10.1038/nrd4368 |
| [14] |
O'Connell RM, Rao DS, Chaudhuri AA, et al. Physiological and pathological roles for microRNAs in the immune system[J]. Nat Rev Immunol, 2010, 10(2): 111-122. DOI:10.1038/nri2708 |
| [15] |
Weber GF, Swirski FK. Immunopathogenesis of abdominal sepsis[J]. Langenbecks Arch Surg, 2014, 399(1): 1-9. DOI:10.1007/s00423-013-1129-7 |
| [16] |
Brochner AC, Toft P. Pathophysiology of the systemic inflammatory response after major accidental trauma[J]. Scand J Trauma Resusc Emerg Med, 2009, 17: 43. DOI:10.1186/1757-7241-17-43 |
| [17] |
Chu Q, Gao Y, Bi D, et al. MicroRNA-148 as a negative regulator of the common TLR adaptor mediates inflammatory response in teleost fish[J]. Sci Rep, 2017, 7(1): 4124. DOI:10.1038/s41598-017-04354-9 |
| [18] |
Xiao L, Jiang L, Hu Q, et al. MicroRNA-133b Ameliorates Allergic Inflammation and Symptom in Murine Model of Allergic Rhinitis by Targeting Nlrp3[J]. Cell Physiol Biochem, 2017, 42(3): 901-912. DOI:10.1159/000478645 |
| [19] |
Guo J, Li J, Zhao J, et al. MiRNA-29c regulates the expression of inflammatory cytokines in diabetic nephropathy by targeting tristetraprolin[J]. Sci Rep, 2017, 7(1): 2314. DOI:10.1038/s41598-017-01027-5 |
| [20] |
Kurowska-Stolarska M, Alivernini S, Melchor EG, et al. MicroRNA-34a dependent regulation of AXL controls the activation of dendritic cells in inflammatory arthritis[J]. Nat Commun, 2017, 8: 15877. DOI:10.1038/ncomms15877 |
| [21] |
Fan W, Fang R, Wu X, et al. Shear-sensitive microRNA-34a modulates flow-dependent regulation of endothelial inflammation[J]. J Cell Sci, 2015, 128(1): 70-80. DOI:10.1242/jcs.154252 |
| [22] |
Shetty SK, Tiwari N, Marudamuthu AS, et al. p53 and miR-34a Feedback Promotes Lung Epithelial Injury and Pulmonary Fibrosis[J]. Am J Pathol, 2017, 187(5): 1016-1034. DOI:10.1016/j.ajpath.2016.12.020 |
| [23] |
Chen YK, Xu YK, Zhang H, et al. Emodin alleviates jejunum injury in rats with sepsis by inhibiting inflammation response[J]. Biomed Pharmacother, 2016, 84: 1001-1007. DOI:10.1016/j.biopha.2016.10.031 |
| [24] |
Zhu J, Yao K, Guo J, et al. miR-181a and miR-150 regulate dendritic cell immune inflammatory responses and cardiomyocyte apoptosis via targeting JAK1-STAT1/c-Fos pathway[J]. J Cell Mol Med, 2017, 21(11): 2884-2895. DOI:10.1111/jcmm.2017.21.issue-11 |
| [25] |
Zhang Q, Su J, Wang Z, et al. MicroRNA-149* suppresses hepatic inflammatory response through antagonizing STAT3 signaling pathway[J]. Oncotarget, 2017, 8(39): 65397-65406. |
| [26] |
Li CY, Suzuki K, Hung YL, et al. Aloe Metabolites Prevent LPS-Induced Sepsis and Inflammatory Response by Inhibiting Mitogen-Activated Protein Kinase Activation[J]. Am J Chin Med, 2017, 45(4): 847-861. DOI:10.1142/S0192415X17500458 |
| [27] |
Hseu YC, Wu FY, Wu JJ, et al. Anti-inflammatory potential of Antrodia Camphorata through inhibition of iNOS, COX-2 and cytokines via the NF-kappaB pathway[J]. Int Immunopharmacol, 2005, 5(13-14): 1914-1925. DOI:10.1016/j.intimp.2005.06.013 |
| [28] |
Cunha JP, Lizarte FSN, Novais PC, et al. Expression profiles of eNOS, iNOS and microRNA-27b in the corpus cavernosum of rats submitted to chronic alcoholism and Diabetes mellitus[J]. Acta Cir Bras, 2017, 32(1): 38-45. DOI:10.1590/s0102-865020170105 |
| [29] |
Li M, Wang J, Fang Y, et al. microRNA-146a promotes mycobacterial survival in macrophages through suppressing nitric oxide production[J]. Sci Rep, 2016, 6: 23351. DOI:10.1038/srep23351 |
| [30] |
Xu Z, Zhao L, Yang X, et al. Mmu-miR-125b overexpression suppresses NO production in activated macrophages by targeting eEF2K and CCNA2[J]. BMC Cancer, 2016, 16: 252. DOI:10.1186/s12885-016-2288-z |
 2018, Vol. 2
2018, Vol. 2

