心源性休克(Cardiogenic shock,CS)是由于心输出量下降导致的组织器官灌注不足,表现为低血压、终端器官持续低灌注和对液体复苏无反应,常伴有重要脏器功能障碍,是心力衰竭最严重的阶段。心源性休克具有起病急骤、表现多样、进展迅速、病死率高的特点,是儿科临床危重症之一[1, 2]。据统计,美国在院患儿中5~10%死于心源性休克[3, 4],病死率高达60~85%[5, 6]。目前,儿童心源性休克仍无国际公认诊断标准或治疗指南,易导致漏诊误诊;肌钙蛋白(troponin,TnT), 肌酸磷酸激酶同工酶(CK-MB)和乳酸(Lactate,LA)有助于判断心源性休克的发生,但缺乏特异性和早期预警作用[7]。儿童心源性休克与成人心源性休克在病因、临床特点、治疗及预后评估方面存在显著差异。我国小儿心源性休克的流行病学资料尚无循证依据。本文回顾性总结2015年4月至2018年3月上海交通大学附属儿童医院PICU收治59例心源性休克患儿的临床特点,分析与儿童心源性休克预后相关的危险因素,报道如下。
对象与方法 (一) 对象回顾性收集2015年4月至2018年3月上海交通大学附属儿童医院PICU收治的1月龄至14岁的心源性休克患儿59例。心源性休克诊断标准为①有急性发作或加重的心脏疾患;②收缩压降至同年龄正常血压低限以下;③有外周微循环不足的表现:如苍白、发绀、心率快、少尿或无尿、足底毛细血管再充盈时间延长;④有心功能不全体征:如心音低钝、奔马律、肝脏增大、双肺湿罗音或血性分泌物、中心静脉压(central venous pressure, CVP)>6 cmH2O(0.8 kPa);⑤床边心脏超声:左室射血分数(left ventricular ejection fraction, LVEF)<0.55,左室短轴缩短率(fractional shortening, FS)<0.30;⑥排除其他类型休克。上述指标中,1、2、5、6为必备指标,加3、4任意2个症状和体征即可诊断[8]。排除入院24h内死亡或自动出院患儿。收集患儿人口学资料、原发病、合并器官功能障碍、临床生化指标、体外生命支持技术种类和28d生存情况。按照28 d生存情况,分为存活组(32例)及死亡组(27例)。临床资料收集与整理经医院伦理委员会批准(批准文号:2016011)。
(二) 主要监测方式与治疗措施所有患儿均行持续有创动脉血压、心率、呼吸、血氧饱和度、CVP监测,行血气分析、心肌酶谱、电解质、血糖和LA等检查,监测尿量、心超、心电图、胸片等。主要抢救措施包括:①血管活性药物:使用多巴酚丁胺、多巴胺、肾上腺素、米力农、胺碘酮等;②液体治疗方案:限制液体管理,根据心超、USCOM等评估,存在前负荷不足时给予生理盐水5~10 ml/kg,于30~60 min缓慢静滴,同时监测CVP、肝脏大小、肺部啰音等,应用利尿剂或连续性肾替代(CRRT)协助液体管理;③其他治疗:包括镇静,纠正酸碱平衡、血糖及电解质紊乱。根据患儿脏器功能状态给予呼吸机、起搏器或ECMO治疗。其中ECMO支持指征为:大剂量血管活性药物(肾上腺素+/去甲肾上腺素>0.5 ug/kg·min)血流动力学仍难以维持,出现心指数(CI)<2 L/min·m2持续3 h以上,LA>5 mmol/L,尿量<0.5 ml/kg·h持续5 h以上。
(三) 观察指标收集患儿的一般资料,包括年龄、性别、基础疾病、合并器官功能障碍、PICU住院时间、28 d生存情况等;采集患儿入PICU 24 h内心肌酶谱及超声心动图参数(H-FABP、CK、CK-MB、TnT、CI、EF、PAP、LVEDV)、机械通气及肺功能参数(PIP、PEEP和P/F指数)、肝肾功能指标(TBIL、ALT、BUN、Cr)和神经系统功能评分(Glasgow评分)。
(四) 统计学处理采用SPSS 17.0软件进行统计学分析。计数资料采用例数和百分率(%)表示,应用卡方检验进行两组间差异比较;正态分布计量资料以均数±标准差(x±s),两组间差异分析采用t检验;偏态分布计量资料以中位数(25百分位数,75百分位数)表示,两组间差异分析Mann-Whitney检验。采用受试者工作特征(receiver operating characteristic, ROC)曲线及Kaplan-meier生存曲线分析评估各观察指标与28 d死亡率之间的关系。P<0.05为差异有统计学意义。
结果 (一) 一般资料比较合计心源性休克患儿59例,占同期PICU收治危重症患儿1.23%;其中,死亡27例,病死率为45.76%。入PICU24h内存活组与死亡组儿童危重评分(PCIS)[(88.93±7.65) vs. (64.00±5.48)]、PRISM Ⅲ[(16.00±4.39) vs. (22.80±2.18)]、收缩压[(84.79±16.57) mmHg vs. (54.40±11.27) mmHg]、LA [(2.90±1.98) mmol/L vs. (9.34±3.34) mmol/L]、累及器官障碍个数[2.00 (0.75, 3.00) vs. 3.00 (2.00, 3.00)]差异有统计学意义(均P<0.05),而年龄、性别、体重和原发病的构成比较差异无统计学意义,见表 1。12例入PICU后进行体外膜氧合(ECMO)支持治疗,8例(66.7%)存活出院,死亡4例(33.3%),其中1撤离ECMO后死于噬血细胞综合征,另1例为体外心肺复苏(external cardiopulmonary resuscitation, ECPR)死亡。
| 表 1 59例心源性休克患儿基本资料 |
死亡患儿和存活患儿入PICU 24h内心型脂肪酸结合蛋白(H-FABP)、肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)、CI、肌酐(Cr)、谷丙转氨酶(ALT)分别为[(111.65±86.81) ng/mL vs. (11.66±8.67) ng/mL, 558.00 (185.00, 1385.00) μ/L vs. 134.00 (49.75, 338.75) μ/L, 81.00 (32.00, 269.00) μ/L vs. 26.50 (16.75, 48.75) μ/L, (2.65±0.73) L/min·m2 vs.(4.01±2.02) L/min·m2,66.00 (53.00, 87.00) μmol/L vs. 30.00(23.50, 58.50) μmol/L, 136.00 (59.00, 234.00) U/L vs.26.50 (11.75, 81.50) U/L],两组间差异有统计学意义(均P<0.05);而心超参数射血分数(EF)、肺动脉压力(PAP)、左室舒张末期容积(LVEDV)在两组之间差异无统计学意义(均P>0.05);TNT、EF、PAP、LVEDV、TBIL、BUN,机械通气参数PIP、PEEP及PaO2/FiO2在两组间比较差异均无统计学意义(均P>0.05), 见表 2。
| 表 2 存活组与死亡组器官功能障碍 |
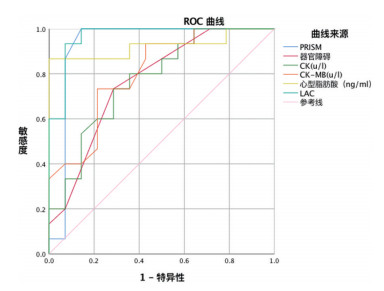
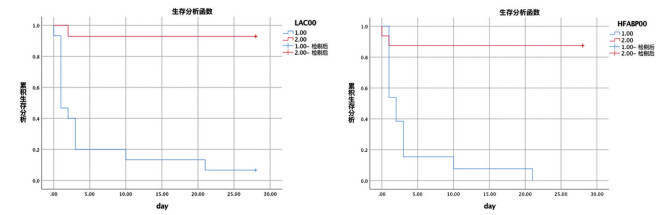
采用ROC曲线分析器官障碍个数、心血管功能生化指标(存活组与死亡组单因素组间比较有统计学差异的指标)H-FABP、CK、CK-MB、和LA预测心源性休克28d生存状态,发现LA (AUC:0.967,95% CI:0.905-1.000,P<0.001)及H-FABP(AUC:0.924,95% CI:0.813-1.000,P<0.001)明显优于CK(AUC:0.774,95% CI:0.603-0.945,P=0.012)、CK-MB(AUC:0.805,95% CI:0.646-0.964,P=0.805)、器官障碍个数(AUC:0.769,95% CI:0.594-0944,P=0.014), 见图 1。预测心源性休克患儿28 d生存情况LA的截断值为5.4 mmol/L(敏感度93.3%,特异度92.9%)、H-FABP的截断值为34.10 ng/mL(敏感度86.7%,特异度100%)。以LA≥5.4 mmol/L、LA<5.4 mmol/L及H-FABP≥34.10 ng/mL、H-FABP<34.10 ng/mL进行分组,经Log-Rank对比分析Kaplan-Meier生存曲线提示LA≥5.4 mmol/L组的28 d死亡率显著高于LA<5.4 mmol/L组,H-FABP≥34.10 ng/mL组的28 d死亡率显著高于H-FABP<34.10 ng/mL组,差异有统计学意义,见图 2。
|
图 1 采用ROC曲线分析器官障碍个数、心血管功能生化指标(H-FABP、CK、CK-MB)和乳酸(LA)预测心源性休克28d生存状态的价值。 |
|
图 2 Kaplan-Meier生存曲线对比LA≥5.4 mmol/L vs. LA<5.4 mmol/L(A)及H-FABP≥34.10 ng/mLvs. H-FABP<34.10 ng/mL(B)心源性休克患儿的28 d生存情况。 |
本组心源性休克占PICU危重症构成比1.23%,病死率为45.76%;主要病因包括心肌病、暴发性心肌炎、先天性心脏病(未手术)和心脏术后低心排等。H-FABP、CK、CK-MB、CI指标在存活组与死亡组差异具有统计学意义(均P<0.05),但TNT、EF、PAP、LVEDV指标在两组间无显著性差异(均P>0.05);高LA和H-FABP是患儿死亡的有效预测指标。
小儿心源性休克病死率高达60~85%[5, 6],病因以原发或继发性心肌病、急性或暴发性心肌炎、心律失常、先天性心脏病、心脏手术后低心排综合征,及心内膜炎、风湿热、重症川崎病、瓣膜病变、药物或毒物中毒等为主[9, 10]。本组PICU患儿中心肌病、暴发性心肌炎、先天性心脏病及心脏术后低心排为前四位主要原因,与文献报告类似。
传统上心源性休克病情评估主要包括心脏超声和血流动力学指标,同时参考生物学指标包括TnT、CK-MB和NT-BNP等指标。新近报道H-FABP作为心脏特异表达的新型小胞质蛋白在心肌受损早期即可升高,被认为是心血管疾病的早期生物标志物和不良心脏事件的有效预后指标[11, 12]。H-FABP也是儿童严重脓毒症和脓毒症休克患者28天病死率的有效预测指标[13]。本组发现LA、H-FABP、CK、CK-MB等死亡组中显著升高。ROC曲线发现H-FABP的AUC为0.924,95% CI:0.813-1.000,P<0.001,截断值为34.10 ng/mL(敏感度86.7%,特异度100%),LA的AUC为0.967,95% CI:0.905-1.000,P<0.001,截断值为5.4 mmol/L(敏感度93.3%,特异度92.9%),明显优于传统心肌损伤标志物CK、CK-MB。心源性休克患儿28 d生存率在H-FABP≥34.10 ng/mL或LA≥5.4 mmol/L时显著下降。因此,H-FABP及LA可作为预测心源性休克患儿预后的重要标志物。
ECMO是心源性休克患儿循环支持的有效手段,来自体外生命支持组织(Extracorporeal Life Support Organization, ELSO)资料显示1992~2013年以来因心脏疾病行ECMO治疗的例数逐年增加,行ECMO治疗的心源性休克患者平均生存率大于40%[14, 15]。本组12例严重心源性休克入PICU后进行ECMO治疗,8例(66.7%)存活出院,说明ECMO是严重心源性休克的重要挽救性治疗措施,可提高抢救成功率。
| [1] |
Reynolds HR, Hochman JS. Cardiogenic shock:current concepts and improving outcomes[J]. Circulation, 2008, 117(5): 686-697. DOI:10.1161/CIRCULATIONAHA.106.613596 |
| [2] |
Fisher JD, Nelson DG, et al. Clinical spectrum of shock in the pediatric emergency department[J]. Pediatr Emerg Care, 2010, 26(9): 622-625. DOI:10.1097/PEC.0b013e3181ef04b9 |
| [3] |
Rossano JW, Kim JJ, et al. Prevalence, morbidity, and mortality of heart failure-related hospitalizations in children in the United Stated:a population-based study[J]. J card Fail, 2012, 18(6): 459-470. DOI:10.1016/j.cardfail.2012.03.001 |
| [4] |
Webster G, Zhang J, et al. Comparison of the epidemiology and co-morbidities of heart failure in the pediatric and adult populations:a retrospective, cross-sectional study[J]. BMC Cardiovasc Disord, 2006, 6: 23. DOI:10.1186/1471-2261-6-23 |
| [5] |
Chang P, Hsu HY, et al. Shock in the pediatric emergency service:five years' experience[J]. Acta Paediatr Taiwan, 1999, 40(1): 9-12. |
| [6] |
Hollenberg SM, Kavinsky CJ, et al. Cardiogenic shock[J]. Ann Intern Med, 1999, 131(1): 47-59. DOI:10.7326/0003-4819-131-1-199907060-00010 |
| [7] |
Maria Christiane, Valeria Braga Brailepsteri. Main Considerations of Cardiogenic Shock and Its Predictors:Systematic Review[J]. Cardiol Res, 2018, 9(2): 75-82. DOI:10.14740/cr715w |
| [8] |
杨思源, 陈树宝. 小儿心脏病学[M]. 北京: 人民卫生出版社, 2012: 656.
|
| [9] |
Andrews RE, Fenton MJ, et al. New-onset heart failure due to heart muscle disease in childhood:a prospective study in the United kingdom and Ireland[J]. Circulation, 2008, 117(1): 79-84. DOI:10.1161/CIRCULATIONAHA.106.671735 |
| [10] |
Saji T, Matsuura H, et al. Comparison of the clinical presentation, treatment, and outcome of fulminant and acute myocarditis in children[J]. Circ J, 2012, 76(5): 1222-1228. DOI:10.1253/circj.CJ-11-1032 |
| [11] |
Jayaprakash N, Gajie O, et al. Elevated modified shock index in early sepsis is associated with myocardial dysfunction and mortality[J]. J Crit Care, 2018, 2(43): 30-35. |
| [12] |
Zhou FJ, Zhou CY, et al. Diagnostic value of analysis of H-FABP, NT-proBNP, and cTnl in heart function in children with congenital heart disease and pneumonia[J]. Eur Rev Med Phamacol Sci, 2014, 18(10): 1513-1516. |
| [13] |
周益平, 熊熙, 王春霞, 等. 心型脂肪酸结合蛋白在儿童严重脓毒症及脓毒性休克中的意义[J]. 中华急诊医学杂志, 2018, 27(6): 363-368. |
| [14] |
Brown KL, Ichord R, et al. Outcomes following extracorporeal membrane oxygenation in children with cardiac disease[J]. Pediatr Crit Care Med, 2013, 14(5): 73-83. |
| [15] |
Thiagarajan RR, Laussen PC, et al. Extracorporeal membrane oxygenation to aid cardiopulmonary resuscitation in infants and children[J]. Circulation, 2007, 116(15): 1693-1700. DOI:10.1161/CIRCULATIONAHA.106.680678 |
 2018, Vol. 2
2018, Vol. 2

