2. 天津市第一中心医院重症医学科;
3. 天津市急救医学研究所
2. Department of intensive care medicine of Tianjin First Central Hospital, Tianjin, China;
3. Tianjin Institute of emergency medicine Tian Jin, China
脓毒症(sepsis)是由感染引起的、能够危及生命的、以器官功能障碍为表现的临床综合征,是ICU患者最主要的死因[1]。过度炎症反应、免疫及凝血功能紊乱是脓毒症的核心病理机制,导致脓毒症多种并发症的发生。血小板是脓毒症时机体炎症、免疫及凝血反应的重要效应细胞,能够参与识别病原体及病原相关分子模式(PAMPs)、黏附并活化白细胞、释放炎症因子、促进凝血反应等过程,加重脓毒症宿主反应紊乱,引起多器官功能障碍[2]。白细胞介素18(IL-18)是一种在体内广泛分布的促炎因子,进而能够诱导干扰素(IFN)-γ的产生,在感染及炎症的起始免疫反应中具有重要的调控作用[3]。脓毒症时,患者外周血IL-18表达量显著升高,且与疾病严重程度及预后密切相关[4]。有研究表明,人类免疫缺陷病毒(HIV)感染时,血小板能够释放IL-18,进而加重疾病病情[5]。但脓毒症时血小板与IL-18的释放是否相关,目前还不清楚。本研究拟制备脓毒症大鼠模型,初步探究脓毒症大鼠体内血小板与IL-18释放的相关性。
材料与方法 (一) 实验动物本研究已获天津市第一中心医院实验动物管理委员会批准。雄性SD大鼠78只,质量为190~210 g,购于北京维通利华实验动物技术有限公司,动物合格证号:SCXK(京)2014-0001。先将大鼠置于标准条件下(室温18-22℃,相对湿度60%~80%,自然光照明,标准大鼠动物饲料喂养,自由进食、饮水)饲养1周以适应环境。根据体重由轻到重编号,采用随机数法将78只雄性SD大鼠随机分为12小时假手术组、12小时模型组、24小时假手术组、24小时模型组、48小时假手术组和48小时模型组,每组12只;另有6只健康大鼠取血后作体外观察用。
(二) 主要仪器及试剂Synergy 2全功能酶标仪(Biotek公司);FACSAria Ⅱ流式细胞仪(BD公司);大鼠白细胞介素18(IL-18)酶联免疫吸附实验(ELISA)试剂盒购自武汉博士徳生物科技有限公司;大鼠别藻青蛋白(APC)-抗白细胞分化抗原61(CD61)及藻红蛋白(PE)-抗CD62P流式抗体购自Biolegend公司;枸橼酸钠抗凝管(美国BD医疗器械有限公司);称量2 g柠檬酸钠、1.5 g柠檬酸、2.5 g葡萄糖溶于100 ml双蒸水(ddH2O)充分混匀,0.22 um孔径滤器过滤除菌,制成枸橼酸钠葡萄糖(ACD)抗凝液,4℃保存备用。
(三) 造模依据参考文献[6],采用盲肠结扎穿孔法(CLP)制备大鼠脓毒症模型,具体步骤:按0.6 ml/100 g体重予5%水合氯醛腹腔注射以麻醉;待夹趾无反应后,将大鼠腹部朝上固定于手术台上;腹部备皮并碘伏消毒后,用手术剪沿前正中线在上腹部皮层和肌层分别剪一长约2.5 cm切口,用手术镊小心夹出盲肠,置于37℃生理盐水淋湿的纱布上,分离肠系膜,4号缝合线结扎盲肠远端1/2,避开肠系膜血管;用棱长3 mm的三棱针在结扎远端刺穿盲肠,轻轻挤压使少量肠内容物从穿孔漏出,用棉签擦去漏出的肠内容物并将盲肠纳回腹腔;用缝合线分别缝合腹壁肌层和皮层,去固定,从大鼠颈后皮下注入10 ml 37℃生理盐水。假手术组大鼠不结扎盲肠及穿孔,其他操作同模型组。
(四) 血浆IL-18检测在各时间点麻醉相应大鼠,腹主动脉取血,ACD按1:6抗凝。取1 ml ACD抗凝血,1000 g 10 min离心,取上清300 ul分装冻存于-80℃。参照大鼠IL-18 ELISA检测试剂盒说明书,检测大鼠血浆IL-18的浓度。
(五) 血小板活化率检测将剩余的ACD抗凝血200 g 20 min离心;取20 ul PRP与65 ul生理盐水、15 ulACD混匀;分别加入5 ul APC-抗CD61和PE-抗CD62P流式抗体,避光孵育15 min;加入100 ul 4%多聚甲醛,避光固定10 min;加入1 ml生理盐水稀释,1000 g 10 min离心,轻轻弃去上清;500 ul 1%多聚甲醛重悬血小板沉淀。用流式细胞仪检测CD61+细胞中CD61+CD62P+细胞的百分比。
(六) LPS体外诱导血小板释放IL-18的观察将6只健康雄性SD大鼠麻醉后经腹主动脉取血,枸橼酸钠真空采血管抗凝,200 g 20 min离心,轻轻吸上1/2的PRP,分成两份,其中一份1000 g 10 min离心,-80℃保存上清;另一份加入LPS使终浓度为100 ng/ml,静置6h后1000 g 10 min离心,-80℃保存上清。按前述方法检测上清中IL-18的表达水平。
(七) 统计方法用IBM SPSS Statistics 22对结果进行统计,两组间独立样本的计量资料在正态分布时采用两独立样本t检验比较均值,结果用均数±标准差表示;两组间配对样本的计量资料在正态分布时采用配对t检验比较均值,结果用均数±标准差表示,在非正态分布时采用秩和检验。用Flowjo X10.0.7分析流式细胞术结果。用Graphpad Prism 7制作统计图。
结果 (一) 大鼠造模后表现在盲肠远端1/2被结扎后,大鼠逐渐出现状态萎靡、活动减少、体温减低、大便不成形;18小时后CLP模型大鼠开始出现死亡;解剖大鼠腹部后见腹腔内有大量腹水、肠腔胀气、肠壁水肿。假手术组大鼠状态较好,活动量正常,观察时间段内未出现死亡,腹腔内部明显腹水,无肠腔胀气及肠壁水肿。以上现象表明大鼠CLP模型制备成功。
(二) CLP大鼠血浆IL-18表达水平按结扎制备CLP大鼠模型后,在相应时间点采集大鼠血浆样品,检测IL-18表达水平。各观察时间点CLP组大鼠血浆IL-18表达水平均显著高于sham组大鼠(12 h: t=4.049, P < 0.01; 24 h: t=5.976, P < 0.0001; 48 h:t=4.242, P < 0.001)。
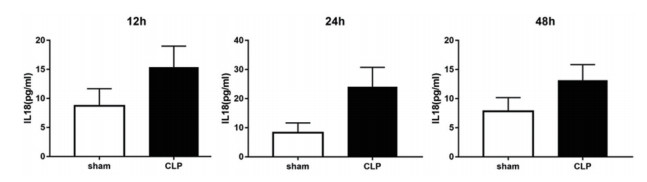
|
图 1 CLP大鼠血浆IL-18表达水平(n=8) |
采集大鼠富血小板血浆,检测血小板活化程度。各观察时间点CLP组大鼠的血小板活化率均高于sham组大鼠(12 h: t=4.055, P < 0.01; 24 h: t=4.497, P < 0.01;48 h:t=3.226, P < 0.01)。
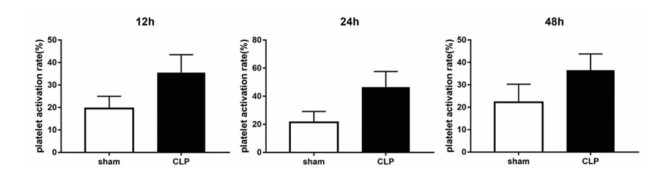
|
图 2 模型组大鼠血小板活化率显著升高(n=6) |
为观察血小板是否能释放IL-18,取大鼠PRP后予LPS刺激,观察上清中IL-18表达水平。LPS刺激后,PRP中IL-18表达水平较未刺激前显著增加,差异有统计学意义(n=6,t=4.837,P < 0.01)。
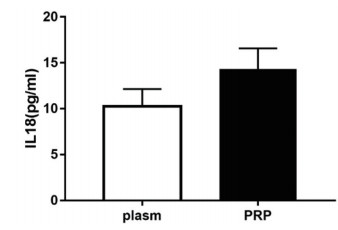
|
图 3 LPS刺激6h后PRP中IL-18表达水平显著升高(n=6) |
脓毒症是ICU住院患者的主要死因之一,给社会带来了沉重的疾病和经济负担[7]。过度炎症反应及免疫紊乱是脓毒症发病的中间环节和重要病机,导致了脓毒症的严重病情和不良预后。在PAMPs及损伤相关分子模式(DAMPs)的诱导下,包括巨噬细胞在内的多种细胞分泌IL-18,进而发挥促炎因子的作用,激活核转录因子(NF)-κB、细胞外调节蛋白激酶(ERK)和丝裂原活化蛋白激酶(MAPK)等转录因子,调控IFN-γ等炎症因子的转录、翻译及释放,进一步发挥促炎、调节免疫的作用[3]。Oberholzer A等研究表明,脓毒症患者的血浆IL-18表达水平较烧伤患者及健康人更高,而脓毒症休克及预后不佳的脓毒症患者伴随更高水平的血浆IL-18[4]。Yamada T等也发现,ICU住院患者中不能存活患者的血浆IL-18表达水平显著高于存活者,且血浆IL-18表达水平与患者APACHE Ⅱ评分密切相关[8]。本研究中,脓毒症模型大鼠血浆IL-18表达水平较假手术组显著升高,尤以24h升高最为明显,与Yamashita H等观察到的结果较为一致。但本实验中IL-18表达水平较文献报道偏低,可能与实验用动物的种属不同及检测试剂生产厂商不一致有关[9]。
血小板活化是脓毒症的特征之一。脓毒症时,多种因素激活凝血反应,促使大量凝血酶的合成;PAMPs及多种炎症因子活化血管内皮,暴露内皮下胶原,促使内皮合成大量假性血管性血友病因子(vWF)和组织因子(TF)。凝血酶、PAMPs、内皮下胶原、vWF、TF及细菌均能诱导血小板活化[2]。本研究中,脓毒症模型大鼠血小板表面的活化标志物P选择素的表达水平较假手术组大鼠显著增加,与既往文献报道一致[10]。活化的血小板与中性粒细胞发生黏附,进而促进其组织浸润及中性粒细胞细胞外陷阱(NET)的形成,辅助机体对入侵病原体的清除与限制。与此同时,活化的血小板还能够通过促进微循环血栓的形成、加剧机体炎症反应等途径促使器官功能障碍的发生,引起脓毒症器官功能不全。
血小板虽然是无核细胞,不携带基因组,但其拥有信号依赖的剪接及翻译功能,能够将来自巨核细胞的前体信使核糖核酸(pre-mRNA)剪接成成熟的mRNA,并由粗面内质网及核糖体将其翻译成相应的蛋白质[11-13]。此外,血小板还含有炎症小体等蛋白修饰机制,能够将pre-IL1β、pre-IL-18等前体蛋白修饰成活性蛋白后释放出胞外,参与宿主反应[5, 14]。Allam O等发现,在凝血酶等血小板激活剂的刺激下,人血小板能够合成并释放IL-18[5]。本实验结果表明,大鼠血小板在LPS刺激下也能够释放IL-18。这进一步提示,在脓毒症模型大鼠体内,多种因素促使血小板活化率增加,可能伴随血小板合成和释放IL-18增加,进而参与引起血浆IL-18表达水平升高及后续炎症反应的进一步加剧。
综上所述,脓毒症模型大鼠体内血小板活化显著增加,并可能与血浆IL-18的表达增加相关。
| [1] |
MervynSinger, MD, FRCP; CliffordS. Deutschman, MD, MS; ChristopherWarrenSeymour, MD, MSc; et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. The Journal of the American Medical Association, 2016, 315(8): 801-810.
|
| [2] |
de Stoppelaar SF, van't Veer C, van der Poll T, et al. The Role of Platelets In sepsis[J]. Thromb Haemost, 2014, 112(4): 666-677. |
| [3] |
Sedimbi SK, H ggl f T, Karlsson MC, et al. IL 18 in inflammatory and autoimmune disease[J]. Cell. Mol. Life Sci, 2013, 70(24): 4795-4808. DOI:10.1007/s00018-013-1425-y |
| [4] |
Oberholzer A1, Steckholzer U, Kurimoto M, et al. Interleukin-18 plasma levels are increased in patients with sepsis compared to severely injured patients[J]. Shock, 2001, 16(6): 411-414. DOI:10.1097/00024382-200116060-00001 |
| [5] |
Allam O, Samarani S, Jenabian MA, et al. Differential synthesis and release of IL-18 and IL-18 Binding Protein from human platelets and their implications for HIV infection[J]. Cytokine, Elsevier Ltd, 2017, 90: 144-154. |
| [6] |
Rittirsch D, Huber-Lang MS, Flierl MA, et al. Immunodesign of experimental sepsis by cecal ligation and puncture[J]. Nature Protocols, 2009, 4(1): 31-36. DOI:10.1038/nprot.2008.214 |
| [7] |
姚咏明, 任超, 吴瑶. 深化对脓毒性休克发病本质的认识[J]. 实用休克杂志, 2017, 1(1): 1-4. |
| [8] |
Yamada T, Aoyama-Ishikawa M, Yamashita H, et al. IL-18 production and IL-18 promoter polymorphisms correlate with mortality in ICU patients[J]. In Vivo, 2014, 28(3): 391-396. |
| [9] |
Yamashita H, Ishikawa M, Inoue T, Usami M, et al. Interleukin-18 reduces blood Gglucose and molecules plasma corticosterone in a septic mouse model[J]. shock, 2017, 47(4): 455-462. DOI:10.1097/SHK.0000000000000747 |
| [10] |
郑贵军, 武子霞, 李银平, 等. 脓毒症大鼠血小板膜糖蛋白的表达变化及血必净的干预作用[J]. 中国危重病急救医学, 2008, 20(12): 758-760. DOI:10.3321/j.issn:1003-0603.2008.12.020 |
| [11] |
Warshaw AL, Laster L, Shulman NR. Protein Synthesis by Human Platelets[J]. the Journal of Biological Chemistry, 1967, 242(9): 2094-2097. |
| [12] |
Denis MM, Tolley ND, Bunting M, et al. Escaping the nuclear confines:Signal-dependent pre-mRNA splicing in anucleate platelets[J]. Cell, 2005, 122(3): 379-391. DOI:10.1016/j.cell.2005.06.015 |
| [13] |
TS'AO C-H. Rough Endoplasmic Reticulum and Ribosomes in Blood Platelets[J]. Scandinavian journal of Haematology, 1971, 8: 134-140. |
| [14] |
Hottz ED, Lopes JF, Freitas C, et al. Platelets mediate increased endothelium permeability in dengue through NLRP3-inflammasome activation[J]. Blood, 2013, 122(20): 3405-3414. DOI:10.1182/blood-2013-05-504449 |
 2018, Vol. 2
2018, Vol. 2

