继2015年法国发布成人心源性休克(cardiogenic shock, CS)的管理专家建议后,近期美国心脏病学会在《循环》(Circulation)杂志在线发表了《心源性休克的当代管理科学声明》(以下简称声明)。该声明总结心源性休克的流行病学、病理生理学、病因和结局,回顾当代最佳药物、外科、机械循环支持和管理实践,提倡区域化分层管理,并提出了未来研究的重点。
一、诊断CS是指因心输出量明显减少而致组织器官灌注不足的临床综合征,主要表现为组织灌注明显减低所致的临床和生化指标异常。包括:1.持续性低血压(收缩压<90 mmHg,持续时间>30分钟);2.器官灌注受损体征(至少一项):精神状态改变、皮肤湿冷、少尿、血清乳酸水平升高。尽管shock研究中有血流动力学参数心脏指数(CI)≤2.2 L·min-1·m-2和肺毛细血管楔压(PCWP)≥15 mmHg标准,声明指出,休克的诊断主要依据临床表现,血流动力学参数并非必须,但有助于明确诊断并对不同临床研究进行比较。
二、病理生理机制CS始于心脏,波及全身。心肌收缩功能受损导致潜在的螺旋式的心输出量减少、血压下降,后者导致冠状动脉缺血、心肌损伤,继而导致心功能进一步下降,发生恶性循环。心输出量降低可以导致急性和亚急性血流动力学紊乱,包括外周血管、肢体及重要器官灌注不足,而外周循环失代偿进一步促进休克发展。外周血管收缩尽管增加冠状动脉和其他重要脏器灌注,但也导致心脏后负荷增加。此外,急性心肌损伤诱发系统性炎症,炎症介质如诱导性一氧化氮合酶、白介素、肿瘤坏死因子等释放增加,可引起病理性血管扩张,促进心源性休克的进程。新证据也表明组织微循环障碍和心源性休克短期死亡率相关。
三、血流动力学表型早期研究描述CS患者临床特征为心力衰竭和中心静脉压(CVP)升高。有创血流动力学测量开展后,CS患者进一步被定义为在于低CI、高外周血管阻力和高PCWP。SHOCK研究中,“冷湿”型为CS最常见的临床表型,占心肌梗死相关CS患者的三分之二。心源性休克的血流动力学表型特点见图 1。

|
图 1 心源性休克的血流动力学表型特点; CI:心脏指数;SVRI:外周血管阻力指数;PCVW:肺毛细血管楔压 |
病因分为:①心肌病变,包括急性心肌梗死、急性心力衰竭、心脏手术后低排综合征、流出道梗阻、心肌顿抑、全身系统炎症反应或脓毒症并发心肌损伤、心肌挫伤等;②瓣膜病变,包括自身瓣膜病和人工瓣膜病变如人工瓣膜阻塞、关闭不全或受限、瓣叶裂等;③电生理性,如房性和室性快速性心律失常和缓慢性心律失常;④心脏梗阻病变,如心包填塞、心包缩窄和肺栓塞;⑤其他,如中毒、低温等。
有研究报告多达81%CS患者伴有急性冠状动脉综合征(ACS),5%~12%ACS患者并发CS,ACS患者机械并发症(包括乳头肌破裂、室间隔缺损或游离壁破裂)过去被认为是晚期并发症,但实际上最常见于住院24小时内。
五、实验室评价、无创检测和血流动力学监测建议:所有患者CS进行心电图、胸部X线、超声心动图检查,以明确急性血流动力学紊乱的主要机制。怀疑急性主动脉综合征或肺栓塞时,如无禁忌证,可行CT扫描或经食管超声心动图。建议的实验室检测包括血常规、电解质、肌酐、肝功能检查、动脉血气、乳酸和连续的心肌肌钙蛋白水平监测。
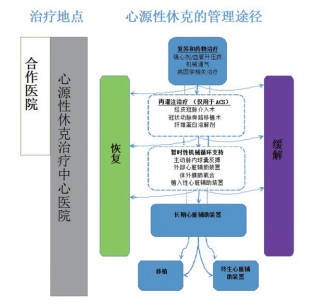
六、CS的管理声明推荐CS管理流程如下(图 2)。
|
图 2 心源性休克管理路径 |
冠状动脉再灌注是急性心肌梗死并发CS患者有循证医学证据基础的主要干预措施。①溶栓治疗:建议:对合并STEMI的CS患者,当早期介入不能及时完成,可在权衡再灌注获益、出血风险和预期的造影时间延迟的基础上,可考虑静脉溶栓治疗。②早期介入策略:建议:对所有可疑ACS的CS患者,无论心肌梗死发生时间,推荐早期介入治疗策略,包括不能排除神经系统疾病或已接受溶栓治疗的患者。
(7.1) PCI策略建议:证据继续支持ACS并发CS的患者早期血管重建,可选择使用PCI或CABG。对罪犯血管和血流动力学相关的非罪犯血管同时行血运重建是合理的。推荐造影或PCI术中优先使用桡动脉入路。
(7.2) 抗血栓药物建议:所有CS患者PCI术后无严重出血并发症者需继续双联抗血小板治疗。当不能口服或有吸收障碍者,可予以静脉使用糖蛋白Ⅱb/Ⅲa抑制剂或静脉P2Y 12抑制剂坎格雷洛。
特别指出,CS患者PCI术后最佳的抗凝管理仍不清楚,鉴于CS患者中急性肾损伤和急性肝损伤的高发病率较高,建议CS患者PCI术后优先使用静脉注射普通肝素。
(7.3) 冠状动脉旁路移植术建议:在心肌梗死相关CS患者,尤其是存在多支或左主干病变的患者,需根据患者的临床情况,冠状动脉解剖,手术风险,潜在的治疗延迟和患者意愿等,心脏内外科医生共同协商决定血运重建方式(PCI或CABG)。
(7.4) 药物治疗① 血流动力学监测 仅有很少的研究数据指导CS患者的血流动力学监测。建议:对CS诊断不确定的患者,或者对初始治疗无效的中到重度CS患者,建议置入肺动脉导管监测肺动脉压力,血流动力学监测可作为其他终末脏器灌注功能指标的补充,可以权衡平均动脉压过高或过低的风险、评估终末器官和组织灌注是否充足,并能够连续监测全身组织灌注指标。
② 非血管活性药物处理 建议:STEMI患者合并心力衰竭或低心排出量时避免使用β受体阻滞剂,低血压时避免使用RAAS拮抗剂。患者低血容量纠正、停止使用正性肌力药物或血管活性药物24小时以上血流动力学稳定的患者,可启动β受体阻滞剂。
患者升压药物停用24小时以上,血流动力学稳定,同时患者肾功能恢复到近基线水平,RAAS拮抗剂相关的高血钾和低血钠风险较低时,可启用RAAS拮抗剂。对合并肺水肿患者可联用RAAS拮抗剂和正性肌力扩血管药物。
(7.5) 血管升压药和正性肌力药物和其他升压药比较,去甲肾上腺素心律失常副作用更少,可以作为CS患者升压的重要选择。但声明同时表示,由于证据的局限性,目前最佳的一线血管活性药物仍不明确。
(7.6) 集束化管理和危重并发症的预防① 机械通气:目前没有涉及CS患者通气模式选择的大规模临床试验。尽管在非休克的心衰患者中,无创通气可以显著改善呼吸困难和低氧血症,以及与之相关的代谢紊乱,但对死亡率的影响尚不清楚。而真实的临床工作中,CS的患者大多数需要有创机械通气,但目前没有充足的证据推荐特定的通气模式、策略(包括肺保护性通气)。建议:调整优化机械通气模式和参数,防止低氧或高氧血症,减少病人不适和呼吸机不同步,从而达到对患者最佳的血流动力学。②连续性肾脏替代治疗:在CS患者中,有13%~28%的人发生急性肾损伤,20%的患者需要肾脏替代治疗。建议:患者达到KDIGO指南中所述2期急性肾损伤时,即血清肌酐增加到2倍基线以上和尿量<0.5ml·kg-1·h-1≥12小时或当“威胁生命的水、电解质和/或酸碱失衡”的存在,可以考虑连续性肾脏替代治疗。
(7.7) 机械辅助装置(mechanical circulatory support,MCS)与心脏移植临时的MCS:①主动脉内球囊反搏建议:在CS患者合并重度二尖瓣反流或急性室间隔缺损可考虑IABP术,在无法获得其他器械支持的CS患者也可以应用IABP术。②体外膜肺氧合建议:在无法应用其他器械解决的缺氧患者中首选使用VA模式的ECMO;ECMO也可以考虑心肺复苏术期间使用。③右室辅助装置:Impella RP (Abiomed Europe)和TandemHeart装置已在临床上尝试用于右心功能的支持,但仍待前瞻性随机对照研究探讨它们对CS患者临床预后的作用。④长期的MCS建议:长期的MCS可以作为恢复期辅助治疗、移植前辅助支持或永久性替代治疗策略。对无长期的MCS支持,有恢复的能力,并且没有不可逆的终末器官功能障碍、全身感染、或相对禁忌证,长期的MCS可以被认为是CS患者的主要措施。⑤心脏移植建议:MCS植入同时应评估所有患者心脏移植的可能性。如果临时或持久的MCS装置植入不能改善心功能的患者可考虑行心脏移植。
八、总结CS是一种病因多样、血流动力学迥异的急危重综合征,常与多系统器官衰竭有关。CS的严重性和复杂性需要快速诊断,及早治疗,优化管理流程,建立区域化协作体系。然而,目前仍存在很多悬而未决的难题:如CS的病理生理学仍不清楚;许多常规的CS治疗方法没有经过严格的研究;迫切需要新的治疗方案来减少患者发病率和高死亡率。为解决理论和实践的鸿沟,声明强调应共同规划CS研究步骤,开展临床试验,并建立临床登记制度,为今后科学研究、临床诊治提供理论基础,以期最终改善CS患者预后。
 2018, Vol. 2
2018, Vol. 2

