2. 中国科学院水生生物研究所 淡水生态和生物技术国家重点实验室,武汉 430072;
3. 中国地质大学环境学院,武汉 430074
2. Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072;
3. School of Environment, China University of Geosciences, Wuhan 430074
全球能源供需情况、能源供应安全和能源利用产生的温室效应等气候污染现象日趋严峻,开展清洁能源的开发与利用变得更为迫切。微生物作为环境中广泛存在的一种微小生物,其数量十分庞大。微生物在清洁能源的生产和利用方面有独特的优势,将其用于产电和废水治理已不仅仅是一个设想。微生物燃料电池(Microbial fuel cell,MFC)的出现将设想变为实现,通过阳极微生物代谢的催化氧化和阴极的化学还原作用可以将该系统环境中的有机物进行分解氧化,将其化学能转变为电能,是一项兼具污染治理与产能的新兴技术[1]。
在MFC这个系统中,产电微生物(Electrici-gens)[2]直接或间接的通过介质将氧化有机物获得的电子传递到阳极上产生电流,在微生物燃料电池的运行过程中起到生物催化剂的作用,是燃料电池成功启动必不可少的一部分。不同种类的产电微生物,其电子转移机制与能力有所差异,直接影响着MFC的产电性能,从而决定着MFC在工程实践中的性能与应用。因此对当前已获得的不同种类的产电微生物进行归纳总结,并探讨可能存在的各种电子传递机制,对于加速MFC的进一步发展与应用具有十分重要的实践意义。本文主要从生物学的角度对产电微生物及MFC的最新进展进行总结和分析,通过归纳总结目前已筛选的产电微生物种类、相关的研究方法以及目前研究较多的几种电子传递机制,期望为产电微生物的筛选与应用工作奠定一定的理论基础,并提供思路。
1 微生物燃料电池的发展最早开展微生物产电研究是英国的植物学家Potter,其在对大肠杆菌进行厌氧培养时意外发现菌液能产生一定量的电流,由此对微生物的利用翻开了新的篇章[3]。鉴于微生物利用的各种优势,越来越多的科学家们对其开展相关研究,随着研究的深入,微生物燃料电池发生了一次次质的飞跃。
在20世纪80年代后期,研究发现外加氧化还原电子介体后会加快电子的转移的速率[4]。但是电子中介体也存在着不容忽视的缺点,由于制备工艺较为复杂,其价格十分昂贵,目前已知的大多数中间介体是有机有毒类物质,可能导致微生物发生中毒等现象,从而降低其生物催化活性,因此微生物燃料电池取得进一步发展首当其冲的是决定中间介体在应用中可能存在的一些风险。为此,MFC的发展一直未取得较大的进展,直到1987年,Lovley等[5]从河底的沉积物中分离纯化出无需电子中介也能产生较高电能的产电微生物Geobacter metallireducens,该菌株的发现使得MFC的发展有了更大的提升空间。自此,科学家们对于MFC的研究翻开了新的篇章,使微生物燃料电池的应用价值更为凸显。可见,在MFC的发展历程中,产电微生物的不断发现推动着微生物燃料电池的蓬勃发展,通过相应途径筛选出更加有效的产电微生物是微生物燃料电池发生质的飞跃的前提条件之一。
微生物燃料电池已初步成型,在此基础上研究者还开发出一系列更具针对性的装置,如微生物电解电池(Microbial electrolysis cells,MECs)[6]、微生物脱盐电池(Microbial desalination cells,MDCs)[7]和微生物燃料电池生物传感器(MFC Biosensor)[8]等。此外,将微生物燃料电池与其他工艺耦合也是使之发挥更大效益的方法之一,为提高废水的处理效率及能源回收的效果,目前常见的耦合方式有MFC耦合厌氧流化床(AFB-MFC)[9]、MFC耦合膜生物反应器(MBR-MFC)[10]、MFC耦合序批式反应器(MFC-SBR)[11]及与人工湿地系统耦合(CW-MFC)[12]等。本课题组为使人工湿地发挥更大作用,将拥有巨大潜力的微生物燃料电池与之耦合来强化脱氮效率[13],并公开了一种以钢渣为阳极的同步产电和污水净化装置,通过以钢渣作为电池阳极填料,同时作为填料嵌入复合垂直流人工湿地系统中,形成了微生物燃料电池和人工湿地相耦合的新型结构方法[14]。
目前,绝大部分的产电微生物都是通过厌氧分离技术获得[15]。但有研究采用传统的好氧分离技术从微氧富集过的阳极生物膜中分离获得3株具有相似的电子转移机制的产电微生物[16],且研究发现有氧与厌氧环境下的阳极其微生物群落结构也存在较大的差异[17]。由此可见,微氧环境下的微生物燃料电池可能定向富集到具有相似功能的高效微生物,尝试在微氧的环境中筛选产电微生物,并对比研究不同条件下筛选获得的产电微生物的性能差异,有望促进MFC的进一步完善,从而加速其在环境中的应用。
2 产电微生物的种类产电微生物作为MFC的生物催化剂,在燃料电池中的作用无可取代。目前,已分离获得的产电微生物主要集中在变形菌门(Proteobacteria)及厚壁菌门(Firmieutes)[18]。越来越多的研究表明,MFC中产电微生物的菌属已呈现出多元化的趋势,环境中存在的产电微生物可能远远不止上百种,仍有许多具有产电特性的微生物等待被发掘[19]。为了更深入了解各类产电微生物的种类差异及相似性,对现有的主要产电微生物进行系统性的归纳总结显得十分必要。
2.1 细菌类的产电微生物 2.1.1 希瓦氏菌(Shewanella)希瓦氏菌属是研究较多的一类产电微生物,它们都属于变形菌门,革兰氏阴性菌,具有铁还原性,在有氧条件下,可以进行呼吸代谢产生CO2,在厌氧条件下,进行发酵作用获得自身生存所需能力(表 1)。
Geobacter菌属的微生物均为严格厌氧菌,仅能在厌氧条件下生存,该类细菌在MFC的阳极上可以高度富集,所以在无外加电子受体的条件下也可以以电极为受体而氧化还原体系中的电子供体(表 2)。目前,已获得菌株Geobacter sulfurreducens的全基因组[26],随后有研究者对Geobacter metallireducens进行了基因组测序[27],有助于今后通过分子手段研究获得具有较高产电特性的微生物。
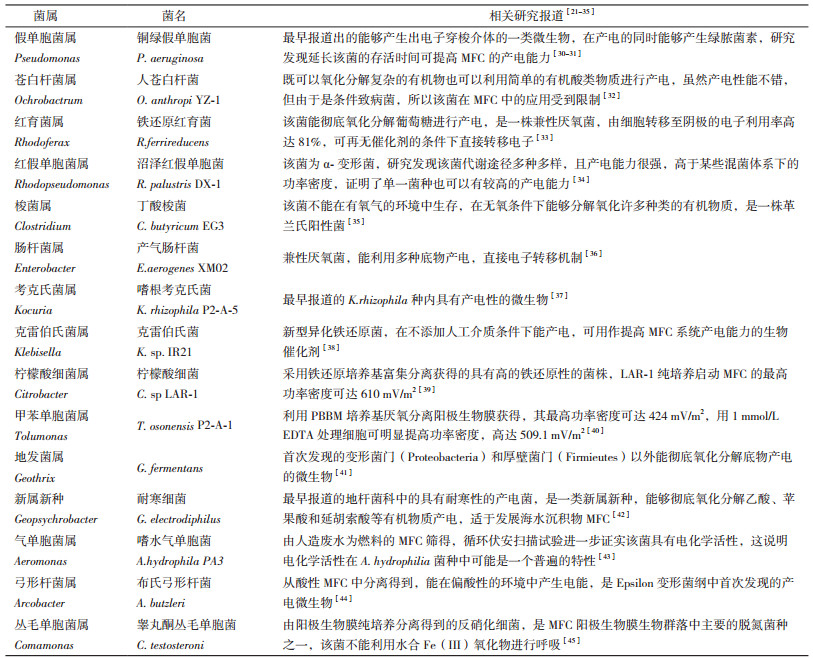
除Shewanella和Geobacter两大菌属外,研究发现假单胞菌属、苍白杆菌属、红育菌属、红假单胞菌属、梭菌属、肠杆菌属、考克氏菌属属、克雷伯氏菌属、柠檬酸细菌属及甲苯单胞菌属等也有产电微生物的存在(表 3)。
21世纪,有学者开始研究MFC系统中具有产电特性的真核生物,如酵母真菌[46]等。因为真核细胞结构更加复杂,所以目前从MFC中分离发现的真菌类产电微生物远没有原核生物多[47]。但是酵母菌对于MFC的发展有以下几个优势[46, 48]:(1) 酵母细胞容易控制,而且能分解较复杂的有机物,如淀粉、纤维素等;(2) MFC阳极室多为厌氧或兼性厌氧环境,酵母菌能在厌氧条件下存活,所以分离纯化获得具有电化学活性的酵母真菌对于MFC的发展具有深远意义。表 4汇总了相关真菌类产电微生物的研究报道。
产电微生物是MFC系统的生物催化剂,在MFC运行中起着至关重要的作用。任何含有大量微生物的废水、污泥、沉积物都可以作为产电微生物的筛选来源,随着相关学者们的的不断研究,越来越多具有产电特性的菌种已被发现,但是相对具有庞大家族的整个微生物体系而言,还有许多产电微生物等待发掘。
目前,获得产电微生物的途径主要有两种。一种是直接验证法,即将获得的纯菌接种至相应的电化学系统中监测其是否能产生电流,该法直接果断,能明确表征接种的菌株是否具有产电特性,但是微生物的种群是十分庞大的,不可能一一鉴定所有菌种,所以该法具有一定的盲目性;另一种途径是对混合菌体系进行电化学富集后,MFC阳极生物膜中产电微生物比例增大,再利用特定培养基对阳极生物膜或阳极液进行分离纯化,从而可以更高效的筛选产电微生物。近几年,为提高产电微生物筛选的有效性,研究发现,对MFC的阳极进行修饰改变其理化特性可以促进阳极生物膜的形成及电子转移速率,从而可以更有针对性地获得具有优良特性的产电微生物。Liu等[54]首次用甲酸修饰AC-MFC阳极,不仅最高功率密度提高了38.1%,而且由于阳极表面更清洁,阳极表面氧气和氮气量下降,促进了阳极表面细菌的生长,获得最优微生物群落。对菌源进行预处理也可以更有效的获得产电微生物,Vamshi等[55]通过碘丙烷和加热预处理生物催化剂来抑制非产电微生物的生长从而选择富集产电微生物,筛选出了少数属于Xanthomonas、Pseudomonas、Prevotella属的胞外产电微生物,MFC的功率输出也得到提高。此外,产电微生物的分离培养条件对其筛选结果也有很大影响。自然环境中微生物的数量高达106之多,但是人类依靠传统的纯培养方法仅能分离出环境中不足1.0%的微生物[56],还有许多未培养微生物[57]等待被发现。对于微生物燃料电池中的产电微生物而言,亦是如此,有必要结合分子生物学技术发展更高效的微生物培养技术,筛选出优良的产电微生物。通过对不同运行状态下MFC系统进行产电微生物的筛选工作,有助于对比不同条件下最优产电微生物的种类差异,从而更有针对性开展相应产电微生物的应用,使发展中的微生物燃料电池技术更有效的应用到实际产能和污染物治理。
MFC作为一种复合体系,其兼具厌氧处理和好氧处理的特点,在MFC的整个运行过程中,因为有电子的产生与传输,微生物燃料电池才得以产生电能。产电微生物作为微生物反应体系的生物催化剂,对该过程起着决定性的影响,所以研究产电微生物在MFC中的作用对于深入开展相关应用研究十分必要。李晶等[58]研究微生物发酵与产电之间的关系发现,MFC的产电过程可能是由发酵菌与产电菌共同作用的结果,不同种类的微生物依次降解基质,分步利用自身生长所需有机物,协同代谢作用将有机物的化学能转变为电能。研究在MFC中纯菌株与混菌株的产电性能差异发现,不同菌种的组合对MFC污水治理能力及产电情况均有影响[59-60]。可见,对产电微生物及产电微生物与非产电微生物之间进行合理组合有望提高MFC的产电性能。
3 产电微生物的电子产生与传递机制MFC的产能离不开微生物的催化氧化过程。产电微生物氧化分解阳极室内的有机物产生电子和质子,其中电子由微生物细胞转移至阳极表面的速率与MFC的产电能力息息相关,从理论水平开展产电微生物产生电子与电子转移机制的研究对于在实践水平提高MFC的电能输出能力具有十分重要的意义,下文对当前MFC中主要研究的几种机制进行归纳总结,有助于理解MFC的运行原理,为开展相关研究奠定一定的理论基础。
3.1 电子产生机制在微生物燃料电池中,产电微生物的代谢活动与电子的产生与转移密切相关。在MFC体系中,产电微生物在阳极氧化分解有机物会产生电子,该生物氧化过程主要包括NADH和FADH两种氧化途径。产电微生物的生物氧化过程主要3个阶段组成,首先有机底物在微生物脱氢酶的作用下分解产生电子,电子借助多个电子载体的作用通过电子传递链传递至阴极,与最终电子受体作用,形成一个完整的路线产生电能,同时产电微生物获得相应能量来维持自身生长[18]。
3.2 电子传递机制对于产电微生物电子传递机制的研究主要借助电化学的技术与手段,如循环伏安曲线法、计时电流法等。此外,为更深入的研究电子传递机制,还要借助分子学的方法。鉴于Shewanella和Geobacter菌属的产电微生物已获得全基因组,主要对该菌属的产电微生物进行电子传递机制的研究[61]。生物膜机制和电子穿梭机制是目前研究较多的电子传递机制,随着各类细菌全基因组的获得,人们对微生物电子传递机制将会有更多的发现与更深入的探索。
3.2.1 生物膜机制生物膜机制,主要是指微生物能够集中在微生物燃料电池的阳极表面,形成一层薄薄的生物膜,在无电子中间介体的条件下通过纳米导线或细胞表面直接接触电极进行电子传递的方式。传递方式主要有两种:(1) 直接接触传递,是指微生物是直接与阳极表面进行接触。菌株S. putrefactions IR-1是首次报道的能够直接进行电子转移的产电微生物,通过在阳极表面形成电化学活性生物膜来促进直接电子转移[20],有研究发现电活性生物膜在不同的生长阶段其内阻也存在较大的差异,可以考虑在生物膜的不同阶段采取合适的手段降低其内阻从而提高MFC的产电性能[62-63];(2)“纳米导线”传递,是指代微生物可以自身合成具有一定导电性能的菌毛或鞭毛,能通过该种“纳米导线”间接的与阳极接触,从而实现较远距离的电子传递,但是该方式也存在一定的缺陷,微生物合成“纳米导线”需要较多的能量,因此投加过多的底物可能影响MFC的性能。Reguera等[64]首次发现了菌株G. Sulfurreducens在还原3价铁的过程中生成了类似于菌毛的纳米导线,测定其电导率发现具有很好的导电性能。继G. sulfurreducens之后研究最多的产电菌是S. oneidensis,该菌在缺氧条件下能分泌大量的有机和无机化合物,最初认为该菌的“纳米导线”是基于菌毛的结构,但是进一步的研究证明S. oneidensis并不产生菌毛结构,其“纳米导线”是该菌的细胞外膜和周质的扩展部分[65-66]。
3.2.2 电子穿梭机制电子穿梭机制指微生物能够利用一些具有催化作用的电子中介体,可能是外源中介体,也可能是一些小分子类似的物质或者成其他形式的物质进行电子转移。与生物膜机制相比,不仅不受距离上的限制,也无需投入更多的能量来合成“纳米导线”[67]。该种传递机制主要有3种形式:(1) 外源介体的有介体电子传递。MFC中常用外源电子穿梭体有醌类物质和腐殖质,腐殖质是一种天然的有机混合物,广泛分布于环境土壤中,由于其富含醌基,具有电化学活性物质,是近几年研究的热门,虽然相较与其他外源电子穿梭体,腐殖质具有很大的优势,但研究发现腐殖质的自身结构以及外界的环境因素均会影响其电子传递的能力,其工业化应用还有待进一步的研究[67-69]。此外,还有一些其他的外源介体也可促进MFC中的电子转移,Hubenova等[70]研究发现在酵母细胞的悬浮液中加入合成染料DANSQI能在启动MFC后很快提高电压输出,分析结果表明这与染料在阳极的电化学氧化有关,染料产生的阳离子自由基可以穿透酵母细胞,刺激胞内发生一系列变化,DANSQI可能作为亚细胞电子穿梭体,增加基质的有氧氧化反应。可见根据需要选择合适的外源介体,开展高效无毒的外源电子介体研究对于MFC的发展同样具有重要意义;(2) 微生物次级代谢物为介体的电子传递。一些产电微生物在产电过程中可以分泌绿脓菌素、细菌吩嗪类物质和核黄素等次级代谢产物,这些物质具有一定的氧化还原特性,可以促进MFC的产电过程[71]。研究发现有些微生物能分泌多种次级代谢产物,不同的产物间发挥协同作用,增强电子的传递效率,从而提高MFC的产电性能[72-73];(3) 还原态初级代谢产物原位氧化传递。有一类微生物能够以氧化代谢过程中释放的H2、H2S等气体作为氧化还原介体进行电极间的电子传递过程[74-75],Schröder等[76]利用E.coli K12产生H2,然后将H2在涂有铂的催化电极上重新氧化,获得了最大150 mA的电流,初步推测H2在后续的产电过程中起到电子穿梭体的作用。
在实际环境条件下,由于各种有机物与微生物等存在很大的差异,因此不能直接用上述机制直接进行解释,但该机制有助于理解电子传递的方式。目前MFC扩大化应用最主要的限制是其产生的功率密度过低,研究者们发现可以通过修饰电极表面使之更有助于微生物细胞的黏附并促进厚的导电生物膜的形成来解决这一障碍[70]。此外,合成生物学的出现也有望打破产电效率低下这一瓶颈,在电子传递机制研究中引入合成生物学技术是通过设计重构和功能强化等手段以获得具有优良性能的电化学活性的微生物[77-78]。该技术的优势主要体现在两个方面,一是可以通过敲除或导入特定基因等手段改造非产电微生物[79-80],使其胞外电子传递能力增强来获得兼具多种优良性能的产电微生物;二是对现有产电微生物进行改造以提高其电子转移能力与效率,从而大大提高产电微生物的性能,使其在MFC的应用上发挥更高效的作用[81-82]。可见,考察产电微生物在电极上附着及电子传递过程中的各种影响因素,并对其进行深入研究,不仅有助于在较深层面解析不同条件下的电子传递机理,同样可以获取新的思路。开展电极材料改性及开发新型电极材料的研究,深入合成生物学等技术在微生物中的应用研究有望解决MFC扩大化应用中存在的问题与挑战,加速MFC在实际工程中的应用。
4 展望高效产电微生物的不断被发现,使得MFC发生一次又一次质的飞跃,由最初需要添加外源电子介体的时代逐渐迈入无介体时代,MFC的研究不断展现出其作为一种新兴的清洁能源技术的优势,将具有更加广阔的应用前景。产电微生物作为其中必不可少的一个组成部分,对其作用机理的研究还将不断完善。虽然目前MFC的制作成本较高、输出功率水平较低,但其在处理各类难降解污染物废水[83],用于有毒有害物质的生物传感器[8]等方面显示出极大的开发应用前景。此外,将MFC与人工湿地等厌氧-好氧污水处理技术进行耦合也具有十分深远的意义,类似于污水处理厂的工艺流程一样,将不同的技术进行合理的组合将有助于获得更好的处理效果,有望发挥更大的潜力[9-12, 84-85]。
未来,MFC中产电微生物的研究将主要集中在以下几个方面:开展MFC阳极生物膜形成机理上的研究;寻找更为快速高效的产电微生物驯化富集方法;结合分子生物学技术筛选兼具多种功能的优良产电微生物;通过合成生物学等技术获得高效多样的产电菌株;开展不同种类菌种的混合研究;深入研究不同电子传递机制间的作用方式等。随着研究的逐渐完善,微生物燃料电池将在各个领域显示极大的优势,有望解决能源短缺及废水污染等问题。
| [1] | Fan DL, Wang LY, Chen YW. Wait microbial fuel cells the latest research progress[J]. Modern Chemical Industry, 2011, 31 (6): 14–18. |
| [2] | Lovley DR. Microbial fuel cells:novel microbial physiologies and engineering approaches[J]. Current Opinion in Biotechnology, 2006, 17 (3): 327–332. DOI:10.1016/j.copbio.2006.04.006 |
| [3] | Kim BH, Park HS. Electrochemical activity of an Fe(Ⅲ)-reducing bacterium, Shewanella putrefaciens IR-1, in the presence of alternative electron acceptors[J]. Biotechnology Techniques, 1999, 13 (7): 475–8. DOI:10.1023/A:1008993029309 |
| [4] | Roller SD, Bennetto HP, Delaney GM, et al. Electron-transfer coupling in microbial fuel cells:1. comparison of redox-mediator reduction rates and respiratory rates of bacteria[J]. Journal of Chemical Technology & Biotechnology Biotechnology, 1984, 34 (1): 3–12. |
| [5] | Lovley DR, Stolz JF, Nord GL, et al. Anaerobic production of magnetite by a dissimilatory iron-reducing microorganism[J]. Nature, 1987, 330 (6145): 252–254. DOI:10.1038/330252a0 |
| [6] | Rivera I, Buitrón G, Bakonyi P, et al. Hydrogen production in a microbial electrolysis cell fed with a dark fermentation effluent[J]. Journal of Applied Electrochemistry, 2015, 45 (11): 1223–1229. DOI:10.1007/s10800-015-0864-6 |
| [7] | Saba B, Christy AD, Yu ZT, et al. Simultaneous power generation and desalination of microbial desalination cells using Nannochloropsis salina(Marine Algae)versus potassium ferricyanide as catholytes[J]. Environmental Engineering Science, 2017. doi:10.10891ees.2016.0291. |
| [8] | Chen Z, Niu Y, Zhao S, et al. A novel biosensor for ρ-nitrophenol based on an aerobic anode microbial fuel cell[J]. Biosensors & Bioelectronics, 2016, 85 : 860–868. |
| [9] | Huang JS, Yang P, Li CM, et al. Effect of nitrite and nitrate concentrations on the performance of AFB-MFC enriched with high-strength synthetic wastewater[J]. Biotechnology Research International, 2015 : 798397. |
| [10] | Wang J, Bi F, Ngo HH, et al. Evaluation of energy-distribution of a hybrid microbial fuel cell-membrane bioreactor(MFC-MBR)for cost-effective wastewater treatment[J]. Bioresource Technology, 2016, 200 : 420–425. DOI:10.1016/j.biortech.2015.10.042 |
| [11] | Wang YP, Zhang HL, Li WW, et al. Improving electricity generation and substrate removal of a MFC-SBR system through optimization of COD loading distribution[J]. Biochemical Engineering Journal, 2014, 85 (15): 15–20. |
| [12] | Doherty L, Zhao YQ, Zhao XH, et al. A review of a recently emerged technology:constructed wetland-microbial fuel cells[J]. Water Research, 2015, 85 : 38–45. DOI:10.1016/j.watres.2015.08.016 |
| [13] | 中国科学院水生生物研究所. 一种复合垂直流人工湿地耦合微生物电解池强化脱氮的方法及装置: 中国, CN105217797A[P], 2016-01-06. |
| [14] | 中国科学院水生生物研究所. 一种以钢渣为阳极的同步产电和污水净化的装置: 中国, CN105502673A[P], 2016-04-20. |
| [15] | 冯玉杰, 李贺, 王鑫, 等. 电化学产电菌的分离及性能评价[J]. 环境科学, 2010, 31(11): 2804–2810. |
| [16] | 吴松, 肖勇, 郑志勇, 等. 微氧环境中电化学活性微生物的分离与鉴定[J]. 环境科学, 2014(10): 3933–3939. |
| [17] | Quan XC, Quan YP, Tao K, et al. Comparative investigation on microbial community and electricity generation in aerobic and anaerobic enriched MFCs[J]. Bioresource Technology, 2013, 128 (128C): 259–265. |
| [18] | 李颖, 孙永明, 孔晓英, 等. 微生物燃料电池中产电微生物的研究进展[J]. 微生物学通报, 2009, 36(9): 1404–1409. |
| [19] | Koch C, Harnisch F. Is there a Specific ecological niche for electroactive microorganisms?[J]. Chemelectrochem, 2016, 3 (9): 1282–1295. DOI:10.1002/celc.201600079 |
| [20] | Kim HJ, Park HS, Hyun MS, et al. A mediator-less microbial fuel cell using a metal reducing bacterium, Shewanella putrefaciens[J]. Enzyme & Microbial Technology, 2002, 30 (2): 145–152. |
| [21] | Ringeisen BR, Henderson E, Wu PK, et al. High power density from a miniature microbial fuel cell using Shewanella oneidensis DSP10[J]. Environmental Science & Technology, 2006, 40 (8): 2629–2634. |
| [22] | Sekar R, Shin HD, Dichristina TJ. Activation of an otherwise silent xylose metabolic pathway in Shewanella oneidensis[J]. Appl Environ Microbiol, 2016, 82 (13): 3996–4005. DOI:10.1128/AEM.00881-16 |
| [23] | Marsili E, Baron DB, Shikhare ID, et al. Shewanella secretes flavins that mediate extracellular electron transfer[J]. Proc Natl Academy of Sciences, 2008, 105 (10): 3968–3973. DOI:10.1073/pnas.0710525105 |
| [24] | Biffinger JC, Fitzgerald LA, Ray R, et al. The utility of Shewanella japonica, for microbial fuel cells[J]. Bioresource Technology, 2011, 102 (1): 290–297. DOI:10.1016/j.biortech.2010.06.078 |
| [25] | Xu M, Guo J, Cen Y, et al. Shewanella decolorationis sp. nov. a dye-decolorizing bacterium isolated from activated sludge of a waste-water treatment plant[J]. International Journal of Systematic & Evolutionary Microbiology, 2005, 55 (1): 363–368. |
| [26] | Coppi MV, Leang C, Sandler SJ, et al. Development of a Genetic System for Geobacter sulfurreducens[J]. Applied & Environ Microbiol, 2001, 67 (7): 3180–3187. |
| [27] | Aklujkar M, Krushkal J, DiBartolo G, et al. The genome sequence of Geobacter metallireducens:features of metabolism, physiology and regulation common and dissimilar to Geobacter sulfurreducens[J]. BMC Microbiology, 2009, 9 : 109. DOI:10.1186/1471-2180-9-109 |
| [28] | Yi H, Nevin KP, Kim BC, et al. Selection of a variant of Geobacter sulfurreducens with enhanced capacity for current production in microbial fuel cells[J]. Biosensors & Bioelectronics, 2009, 24 (12): 3498–3503. |
| [29] | Call DF, Logan BE. A method for high throughput bioelectrochemical research based on small scale microbial electrolysis cells[J]. Biosensors & Bioelectronics, 2011, 26 (11): 4526–4531. |
| [30] | Rabaey K, Boon N, Siciliano SD, et al. Biofuel cells select for microbial consortia that self-mediate electron transfer[J]. Applied & Environ Microbiol, 2004, 70 (9): 5373–5382. |
| [31] | 游婷. 铜绿假单胞菌存活时间延长可提高生物燃料电池的产电量[J]. 生物工程学报, 2017, 33(4): 601–608. |
| [32] | Zuo Y, Xing D, Regan JM, et al. Isolation of the exoelectrogenic bacterium Ochrobactrum anthropi YZ-1 by using a U-tube microbial fuel cell[J]. Applied & Environ Microbiol, 2008, 74 (10): 3130–3137. |
| [33] | Chaudhuri SK, Lovley DR. Electricity generation by direct oxidation of glucose in mediatorless microbial fuel cells[J]. Nature Biotechnology, 2003, 21 (10): 1229–1232. DOI:10.1038/nbt867 |
| [34] | Xing D, Zuo Y, Cheng S, et al. Electricity generation by Rhodopseudomonas palustris DX-1[J]. Environmental Science & Technology, 2008, 42 (11): 4146–4151. |
| [35] | Pham CA, Jung SJ, Phung NT, et al. A novel electrochemically active and Fe(Ⅲ)-reducing bacterium phylogenetically related to Aeromonas hydrophila, isolated form a microbial fuel cell[J]. FEMS Microbiology Letters, 2003, 223 (1): 129–134. DOI:10.1016/S0378-1097(03)00354-9 |
| [36] | 张锦涛, 周顺桂. 产气肠杆菌燃料电池产电机制研究[J]. 环境科学, 2009, 30(4): 1215–1220. |
| [37] | 李明, 梁湘, 骆健美, 等. 一株产电菌嗜根考克氏菌(Kocuria rhizophila)的分离及其产电性能优化[J]. 环境科学学报, 2015, 35(10): 3078–3087. |
| [38] | Lee YY, Kim TG, Cho KS. Enhancement of electricity production in a mediatorless air-cathode microbial fuel cell using Klebsiella sp. IR21[J]. Bioprocess & Biosystems Engineering, 2016, 39 (6): 1005–1014. |
| [39] | Liu L, Lee DJ, Wang A, et al. Isolation of Fe(Ⅲ)-reducing bacterium, Citrobacter sp. LAR-1, for startup of microbial fuel cell[J]. International Journal of Hydrogen Energy, 2015, 41 (7): 4498–4503. |
| [40] | Luo J, Jia Y, He H, et al. A new electrochemically active bacterium phylogenetically related to Tolumonas osonensis, and power performance in MFCs[J]. Bioresource Technology, 2013, 139C (7): 141–148. |
| [41] | Bond DR, Lovley DR. Evidence for involvement of an electron shuttle in electricity generation by Geothrix fermentans[J]. App-lied & Environ Microbiol, 2005, 71 (4): 2186–2189. |
| [42] | Holmes DE, Nicoll JS, Bond DR, et al. Potential role of a novel psychrotolerant member of the family Geobacteraceae, Geopsychrobacter electrodiphilus gen. nov., sp. nov., in electricity production by a marine sediment fuel cell[J]. Applied & Environ Microbiol, 2004, 70 (10): 6023–6030. |
| [43] | Pham CA, Jung SJ, Phung NT, et al. A novel electrochemically active and Fe(Ⅲ)-reducing bacterium phylogenetically related to Aeromonas hydrophila, isolated from a microbial fuel cell[J]. FEMS Microbiology Letters, 2003, 223 (1): 129–134. DOI:10.1016/S0378-1097(03)00354-9 |
| [44] | Fedorovich V, Knighton MC, Pagaling E, et al. Novel electrochemically active bacterium phylogenetically related to Arcobacter butzleri, isolated from a microbial fuel cell[J]. Applied & Environ Microbiol, 2009, 75 (23): 7326–7334. |
| [45] | Xing D, Cheng S, Logan BE, et al. Isolation of the exoelectrogenic denitrifying bacterium Comamonas denitrificans based on dilution to extinction[J]. Applied Microbiology & Biotechnology, 2010, 85 (5): 1575–1587. |
| [46] | Mao L, Verwoerd WS. Selection of Organisms for systems biology study of microbial electricity generation:a review[J]. Internat-ional Journal of Energy & Environmental Engineering, 2013, 4 (1): 1–18. |
| [47] | Hubenova Y, Mitov M. Potential application of Candida melibiosica in biofuel cells[J]. Bioelectrochemistry, 2010, 78 (1): 57–61. DOI:10.1016/j.bioelechem.2009.07.005 |
| [48] | Schaetzle O, Barrière F, Baronian K. Bacteria and yeasts as catalysts in microbial fuel cells:electron transfer from microorganisms to electrodes for green electricity[J]. Energy & Environmental Science, 2008, 1 (6): 607–620. |
| [49] | Prasad D, Arun S, Murugesan M, et al. Direct electron transfer with yeast cells and construction of a mediatorless microbial fuel cell[J]. Biosensors & Bioelectronics, 2007, 22 (11): 2604–2610. |
| [50] | Lee YY, Kim TG, Cho KS. Isolation and characterization of a novel electricity-producing yeast, Candida, sp. IR11[J]. Bioresource Technology, 2015, 192 : 556–563. DOI:10.1016/j.biortech.2015.06.038 |
| [51] | Raghavulu SV, Goud RK, Sarma PN, et al. Saccharomyces cerevisiae, as anodic biocatalyst for power generation in biofuel cell:Influence of redox condition and substrate load[J]. Bioresource Technology, 2011, 102 (3): 2751–2757. DOI:10.1016/j.biortech.2010.11.048 |
| [52] | Haslett ND, Rawson FJ, Barriëre F, et al. Characterisation of yeast microbial fuel cell with the yeast Arxula adeninivorans as the biocatalyst[J]. Biosensors and Bioelectronics, 2011, 26 (9): 3742–3747. DOI:10.1016/j.bios.2011.02.011 |
| [53] | Williams J, Trautwein-Schult A, Jankowska D, et al. Identification of uric acid as the redox molecule secreted by the yeast Arxula adeninivorans[J]. Applied Microbiology & Biotechnology, 2014, 98 (5): 2223–2229. |
| [54] | Liu W, Cheng S, Guo J. Anode modification with formic acid:A simple and effective method to improve the power generation of microbial fuel cells[J]. Applied Surface Science, 2014, 320 (320): 281–286. |
| [55] | Vamshi KK, Venkata MS. Selective enrichment of electrogenic bacteria for fuel cell application:Enumerating microbial dynamics using MiSeq platform[J]. Bioresource Technology, 2016, 213 : 146–154. DOI:10.1016/j.biortech.2016.03.117 |
| [56] | Alain K, Querellou J. Cultivating the uncultured:limits, advances and future challenges[J]. Extremophiles Life Under Extreme Conditions, 2009, 13 (4): 583–594. DOI:10.1007/s00792-009-0261-3 |
| [57] | 范念斯, 齐嵘, 杨敏. 未培养微生物的培养方法进展[J]. 应用与环境生物学报, 2016, 22(3): 524–530. |
| [58] | 李晶, 袁林江, 刘正川, 等. 微生物发酵对MFC产电的影响[J]. 环境工程学报, 2016, 10(8): 4049–4054. DOI:10.12030/j.cjee.201503180 |
| [59] | 陈姗姗, 张翠萍, 刘广立, 等. 纯菌株与混合菌株在MFC中降解喹啉及产电性能的研究[J]. 环境科学, 2010, 31(9): 2148–2154. |
| [60] | 赵磊, 宋加妹, 于俊伟, 等. 混合菌群与单菌株微生物燃料电池产电性能初步研究[J]. 化学与生物工程, 2013, 30(1): 64–67. |
| [61] | Logan BE. Exoelectrogenic bacteria that power microbial fuel cells[J]. Nature Reviews Microbiology, 2009, 7 (5): 375–381. DOI:10.1038/nrmicro2113 |
| [62] | 侯俊先, 刘中良, 李艳霞, 等. 电活性生物膜生长过程中电荷与传质阻抗的变化规律[J]. 科学通报, 2016(33): 3616–3622. |
| [63] | Peng L, Zhang XT, Yin J, et al. Geobacter sulfurreducens, adapts to low electrode potential for extracellular electron transfer[J]. Electrochimica Acta, 2016, 191 : 743–749. DOI:10.1016/j.electacta.2016.01.033 |
| [64] | Reguera G, Mccarthy KD, Mehta T, et al. Extracellular electron transfer via microbial nanowires[J]. Nature, 2005, 435 (7045): 1098–1101. DOI:10.1038/nature03661 |
| [65] | Kumar R, Singh L, Zularisam AW. Exoelectrogens:Recent advances in molecular drivers involved in extracellular electron transfer and strategies used to improve it for microbial fuel cell applications[J]. Renewable & Sustainable Energy Reviews, 2016, 56 : 1322–1336. |
| [66] | Pirbadian S, Barchinger SE, Leung K M, et al. Shewanella oneidensis MR-1 nanowires are outer membrane and periplasmic extensions of the extracellular electron transport components[J]. Proc Natl Acad Sci USA, 2014, 111 (35): 12883–12888. DOI:10.1073/pnas.1410551111 |
| [67] | 马金莲, 马晨, 汤佳, 等. 电子穿梭体介导的微生物胞外电子传递:机制及应用[J]. 化学进展, 2015(12): 1833–1840. DOI:10.7536/PC150533 |
| [68] | 蔡茜茜, 袁勇, 胡佩, 等. 腐殖质电化学特性及其介导的胞外电子传递研究进展[J]. 应用与环境生物学报, 2015, 21(6): 996–1002. |
| [69] | 李丽, 檀文炳, 王国安, 等. 腐殖质电子传递机制及其环境效应研究进展[J]. 环境化学, 2016, 35(2): 254–266. DOI:10.7524/j.issn.0254-6108.2016.02.2015071002 |
| [70] | Hubenova Y, Bakalska R, Hubenova E, et al. Mechanisms of electron transfer between a styrylquinolinium dye and yeast in biofuel cell[J]. Bioelectrochemistry, 2016, 112 : 158–165. DOI:10.1016/j.bioelechem.2016.02.005 |
| [71] | Xia X, Cao XX, Liang P, et al. Electricity generation from glucose by a Klebsiella sp. in microbial fuel cells[J]. Applied Microbio-logy & Biotechnology, 2010, 87 (1): 383–390. |
| [72] | Okamoto A, Hashimoto K, Nealson KH, et al. Rate enhancement of bacterial extracellular electron transport involves bound flavin semiquinones[J]. Proc Natl Acad Sci USA, 2013, 110 (19): 7856–7861. DOI:10.1073/pnas.1220823110 |
| [73] | Sydow A, Krieg T, Mayer F, et al. Electroactive bacteria--molecular mechanisms and genetic tools[J]. Applied Microbiology and Biotechnology, 2014, 98 (20): 8481–8495. DOI:10.1007/s00253-014-6005-z |
| [74] | Rabaey K, Rozendal RA. Microbial electrosynthesis-revisiting the electrical route for microbial production[J]. Nature Reviews Microbiology, 2010, 8 (10): 706–716. DOI:10.1038/nrmicro2422 |
| [75] | Sydow A, Krieg T, Mayer F, et al. Electroactive bacteria-molecular mechanisms and genetic tools[J]. Applied Microbiology and Biotechnology, 2014, 98 (20): 8481–8495. DOI:10.1007/s00253-014-6005-z |
| [76] | Schröder U, Niessen J, Scholz F. A generation of microbial fuel cells with current outputs boosted by more than one order of magnitude[J]. Angewandte Chemie International Edition, 2003, 115 (25): 2986–2989. |
| [77] | 吕永坤, 堵国成, 陈坚, 等. 合成生物学技术研究进展[J]. 生物技术通报, 2015, 31(4): 134–148. |
| [78] | 李锋, 宋浩. 微生物胞外电子传递效率的合成生物学强化[J]. 生物工程学报, 2017, 33(3): 516–534. |
| [79] | Yong YC, Yu YY, Yang Y, et al. Increasing intracellular releasable electrons dramatically enhances bioelectricity output in microbial fuel cells[J]. Electrochemistry Communications, 2012, 19 : 13–16. DOI:10.1016/j.elecom.2012.03.002 |
| [80] | Simone S, Salome N, Nick W, et al. Engineering mediator-based electroactivity in the obligate aerobic bacterium Pseudomonas putida KT2440[J]. Frontiers in Microbiology, 2015, 6 : 284. |
| [81] | Lin T, Bai X, Hu Y, et al. Synthetic Saccharomyces cerevisiae-Shewanella oneidensis consortium enables glucose-fed high-performance microbial fuel cell[J]. Aiche Journal, 2016, 63 (6): 1830–1838. |
| [82] | Liu T, Yu Y, Deng X, et al. Enhanced Shewanella biofilm promotes bioelectricity generation[J]. Biotechnology & Bioengineering, 2015, 112 (10): 2051. |
| [83] | Huang L, Cheng S, Chen G. Bioelectrochemical systems for efficient recalcitrant wastes treatment[J]. Journal of Chemical Technology & Biotechnology, 2011, 86 (4): 481–491. |
| [84] | 许丹, 肖恩荣, 徐栋, 等. 微生物燃料电池与人工湿地耦合系统研究进展[J]. 化工学报, 2015(7): 2370–2376. |
| [85] | 许鹏, 许丹, 张义, 等. 植物型微生物燃料电池研究进展[J]. 工业安全与环保, 2014(9): 33–35. |