2. 养分循环与资源环境安徽省重点实验室, 安徽 合肥 230031
2. Anhui Provincial Key Laboratory of Nutrient Recycling, Resources & Environment, Hefei 230031, China
我国土壤污染面积不断加大, 其中重金属镉(Cd)是首要的无机污染物, 受污染耕地面积达1.33万hm2, 镉点超标率达7.0%, 且因镉污染引起的健康危害事件逐年上升, 科学有效地修复镉污染土壤[1-3], 已成为当前迫切需要解决的现实问题。
针铁矿作为土壤中重要的矿物组分, 其表面羟基位点密度高, 可变正电荷多, 比表面积大, 对镉离子具有强烈的吸附作用[4], 镉离子主要以水合离子形态与针铁矿结合形成双齿络合物吸附在针铁矿表面, 吸附后Cd2+活性降低, 结构稳定性加强[5-6]。同时镉在针铁矿表面的吸附受体系pH、背景电解质种类和强度以及反应时间等因素的影响[7-10]。
在土壤中矿物颗粒和腐殖质很少单独存在, 有机质常常通过离子交换、配位交换等方式吸附固定在黏土矿物、铁氧化物等表面, 形成土壤腐殖质-矿质复合体[11]。胡敏酸(HA)作为腐殖物质的主要组分, 广泛存在于土壤和水体沉积物中, 含有丰富的羧基、羟基、酚羟基等多种活性官能团, 可以与重金属离子进行配位交换形成络合物[12]。当带负电荷的腐殖酸以配位交换形式吸附包被在针铁矿表面时, 可改变矿物表面的电荷状态、比表面积、表面孔径以及表面粗糙度等理化性质[13-14]。研究认为腐殖酸在矿物表面吸附过程中产生了一层比较牢固且具有离子活性的有机包膜, 形成矿物-腐殖质复合微粒, 这种包膜增强了针铁矿的吸附性, 促进镉离子在针铁矿表面的吸附行为; 同时金属离子与HA在矿物表面形成HA-重金属离子(M)-矿物三相复合物, 根据吸附自由能变化推测镉在复合体中的吸附为物理吸附过程, 其吸附机制可能有氢键、偶极作用力和范德华力等作用[15-18]。
磷是植物生长必需元素之一, 也是造成水体富营养化的重要因素, 磷酸根作为磷素的主要存在方式, 是重要的含氧阴离子, 在固液体系中它的存在会影响反应体系电势、位点密度以及复合体表面性质, 进而影响重金属离子在固相表面的行为特征[19-20]。目前大量研究集中于无机阴离子和有机酸分子等对重金属镉在矿物表面的吸附影响, 但关于磷酸盐对更接近土壤环境的有机无机复合体的镉离子吸附效应研究较少。笔者将HA吸附包被在针铁矿表面合成的有机无机复合体作为吸附质, 并对复合体表面性质进行表征, 采用传统批次平衡吸附试验方法, 研究磷酸根共存下镉离子在针铁矿和复合体表面的等温吸附和动力学吸附特征, 分析磷酸根离子存在下电解质强度和pH对镉离子吸附的影响, 为深入了解镉的环境行为和利用磷素来修复镉污染土壤提供科学依据。
1 材料与方法 1.1 针铁矿和复合体的制备针铁矿(G)和复合体(GH)的制备均参考WANG等[21]的方法。合成样品经X-射线衍射分析(英国马尔文仪器有限公司D8 ADVNCE)鉴定证实为针铁矿。根据国际腐殖质协会(IHSS)推荐的方法分离提纯获得胡敏酸, 提取胡敏酸所用土壤为西藏当雄高山草甸土[22]。复合体的制备方法如下:反应体系设置针铁矿悬浮液质量浓度为1.0 g·L-1, 背景电解质为0.001 mol·L-1 NaNO3, pH 4.5, 胡敏酸质量浓度为40 mg·L-1。在25 ℃恒温摇床上振荡(220 r·min-1)24 h后取出并在9 000 r·min-1条件下离心(离心半径为6.16 cm,相对离心力为5 580)。离心后倒去上清液, 继续加入过量胡敏酸, 使矿物充分吸附胡敏酸直至饱和, 重复2~3次。收集固体沉淀物, 用超纯水洗去残余的胡敏酸。将固体残留物冻干, 研磨备用, 采用元素分析仪(意大利欧维特EA3000)测定其含碳量w为5.55%。
1.2 试验方法 1.2.1 针铁矿和复合体的电位滴定试验采用自动电位滴定仪(836 Titrando, 瑞士万通)测定, 整个滴定过程通过Tiamo软件进行程序控制。加入40 mL 5.0 g·L-1矿物悬液到样品池中, 通入高纯度N2, 先用0.1 mol·L-1 HNO3滴定至pH 2.5, 保持30 min后, 再用0.01 mol·L-1 NaOH滴定至pH为10, 在滴定过程中控制漂移值为0.1 mV·s-1。每个样品重复滴定3次, 获得滴定曲线。
1.2.2 等温吸附试验在50 mL离心管中加入10 mL质量浓度为2.0 g·L-1矿物悬浮液, 背景电解质为0.001 mol·L-1 NaNO3。加入一定量的Cd(NO3)2溶液, 使镉离子最终浓度为0~20 μmol·L-1, 磷酸根(NaH2PO4)浓度为100 μmol·L-1, 总反应体积为20 mL, 不足部分用背景电解质溶液补充。用0.01 mol·L-1 NaOH或0.01 mol·L-1 HNO3调节体系pH值。该体系在25 ℃恒温摇床上振荡(220 r·min-1)24 h后取出, 在9 000 r·min-1条件下离心10 min, 将上清液过0.45 μm微孔滤膜, 用原子吸收分光光谱法测定上清液中镉离子浓度。同时以不加磷处理作为对照。Cd吸附量通过初始加入量与上清液中残留量之差计算获得。用Visual Minteq 3.0软件对反应体系进行理论计算, 结果显示在该体系条件下不会产生沉淀, 下同。
1.2.3 吸附动力学试验配制质量浓度为2.0 g·L-1、背景电解质为0.001 mol·L-1 NaNO3的矿物悬浮液, 先将悬浮液用超声波分散60 min, 然后用磁力搅拌器搅拌24 h, 使矿物悬浮液充分分散。反应体系pH为4.5时, Cd(NO3)2溶液浓度设置为10 μmol·L-1(单一针铁矿选用浓度为5 μmol·L-1); 反应体系pH为6.5时, Cd(NO3)2溶液浓度设置为20 μmol·L-1(单一针铁矿选用浓度为10 μmol·L-1)。整个反应体系背景电解质为0.001 mol·L-1 NaNO3, 磷酸根溶液(NaH2PO4)浓度为100 μmol·L-1。最终反应体积为400 mL。以镉离子和磷酸盐溶液加入到矿物悬浮液的时间作为反应起始时间。按照一定时间(10~1 800 min)吸取混合液10 mL, 立即在9 000 r·min-1条件下离心, 过0.45 μm微孔滤膜, 收集上清液。用0.01 mol·L-1 NaOH或0.01 mol·L-1 HNO3调节体系pH值。同时以不加磷处理作为对照。整个反应过程在磁力搅拌器下不停搅拌进行。吸附量按上述方法测定和计算。
1.2.4 电解质影响试验配制电解质NaNO3浓度为0.001、0.01和0.1 mol·L-1的矿物悬浮液, 其质量浓度为2.0 g·L-1。超声波分散60 min后在磁力搅拌器下搅拌24 h, 使矿物充分分散。制备浓度为20 μmol·L-1的Cd(NO3)2溶液和浓度为200 μmol·L-1的磷酸根溶液。离心管中分别加入10 mL矿物悬浮液、5 mL镉溶液和5 mL磷酸根溶液, 使体系的矿物质量浓度为1.0 g·L-1, 反应总体积为20 mL。设置pH分别为4.5和6.5两个处理。用0.01 mol·L-1 NaOH或0.01 mol·L-1 HNO3调节pH值, 同时设置不加磷处理作为对照。其他过程如上所述。
1.3 数据处理酸碱滴定数据按照FEIN等[23]的方法处理, 用格氏(Gran)图确定滴定体系中的等当点(Ve)来校正滴定零点(zero point of titration)并估算表面活性位点浓度(Hs)[24]。格氏函数计算公式为
酸性一侧:
| ${{G}_{\text{a}}}=({{V}_{0}}+{{V}_{\text{a}}}+3{{V}_{\text{b}}})\times {{10}^{-\beta }}\times 100, $ | (1) |
碱性一侧:
| ${{G}_{\text{b}}}=({{V}_{0}}+{{V}_{\text{a}}}+{{V}_{\text{b}}})\times {{10}^{-(13.8-\beta )}}\times 100。$ | (2) |
式(1)~(2)中, Ga和Gb为格氏函数; V0为体系的初始体积, mL; Va为加入酸的总体积, mL; Vb为滴定点上滴定剂(NaOH)滴加体积, mL; β为滴定过程中体系的pH。利用格氏图中两个等当点Veb1和Veb2的对应值可以估算Hs:
| ${{H}_{\text{s}}}=\frac{({{V}_{\text{eb2, 样品}}}-{{V}_{\text{eb1,样品}}}){{C}_{\text{b}}}-({{V}_{\text{eb2, 空白}}}-{{V}_{\text{eb1, 空白}}}){{C}_{\text{b}}}}{m}。$ | (3) |
式(3)中, Cb为滴定剂(NaOH)浓度, mol·L-1; m为吸附剂质量, g。
Langmuir方程:
| ${{q}_{\text{e}}}=\frac{{{X}_{\text{m}}}{{K}_{\text{L}}}{{C}_{\text{e}}}}{1+{{K}_{\text{L}}}{{C}_{\text{e}}}}。$ | (4) |
式(4)中, qe为磷酸盐在矿物表面的吸附量, μmol·g-1; Ce为吸附平衡时上清液磷酸盐浓度, μmol·L-1; Xm为磷酸盐在矿物表面的理论最大吸附量, μmol·g-1; KL为矿物对磷酸盐的吸附亲和力常数, L·μmol-1。
二级动力学方程:
| $\frac{\text{d}q}{\text{d}t}=k{{({{q}_{\text{e}}}-{{q}_{t}})}^{2}}。$ | (5) |
式(5)中, qe和qt分别为平衡时和t时刻镉的吸附量, μmol·g-1; k为二级动力学吸附速率常数, g·μmol-1·min-1。定义t=0时, qt=0, 方程可变为直线形式:
采用Microsoft Excel 2010软件进行数据处理, 并用Origin 8.0软件对试验数据进行方程拟合和作图。
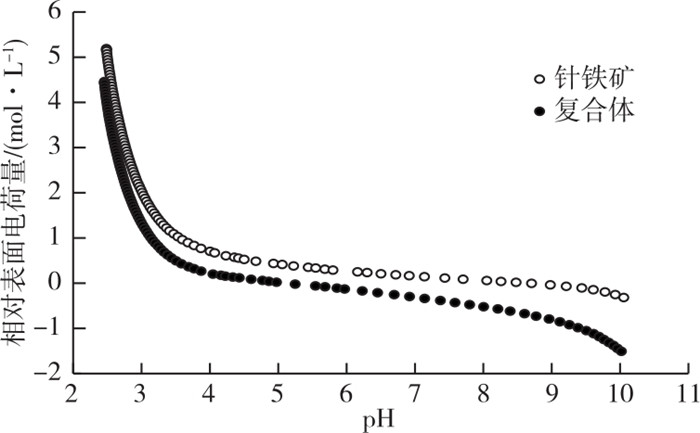
2 结果与分析 2.1 针铁矿和针铁矿-胡敏酸复合体的性质表征针铁矿和复合体的酸碱滴定曲线见图 1。图 1中纵坐标标目相对表面电荷量的物理意义为固体表面消耗的净质子数, 可以直观地反映被滴定物表面的pH缓冲能力, 即曲线斜率绝对值越大, 官能团就越多。由图 1可知, 针铁矿-胡敏酸复合体曲线斜率绝对值高于单一针铁矿; 且从pH 2.5滴定到pH 10的过程中, 复合体消耗的总碱量(1.192 mmol·g-1)也高于单一针铁矿(1.030 mmol·g-1)(表 1), 这表明针铁矿被胡敏酸吸附包被后可增加其表面官能团数量。
|
图 1 背景电解质为0.001 mol·L-1 NaNO3条件下针铁矿和复合体的电位滴定曲线 Fig. 1 Potentiometric titrations for goethite (G) andcomplexes (GH) in 0.001 mol·L-1 NaNO3 |
|
|
表 1 针铁矿和复合体的表面位点浓度、比表面积及等电点 Table 1 The site density, specific surface area (SSA), and the isoelectric points (IEP) of goethite (G) and complexes (GH) |
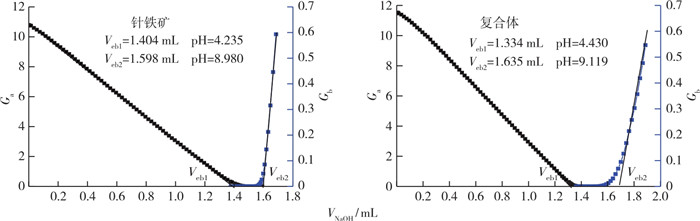
选用格氏函数对电位滴定数据进行处理, 计算得到针铁矿和针铁矿-胡敏酸复合体表面的总位点浓度, 从而可研究针铁矿吸附胡敏酸后表面位点的变化[24]。针铁矿和针铁矿-胡敏酸复合体的格氏图见图 2, 利用格氏图得到样品的2个等当点Veb1和Veb2, 从而计算得到它们的表面位点浓度Hs(表 1)。由表 1可知, 在针铁矿的电位滴定过程中, 用于与其表面各种受体发生键合所消耗的NaOH只有0.19 mL, 计算获得针铁矿表面位点浓度为0.11 mmol·g-1; 而复合体消耗的NaOH为0.30 mL, 形成针铁矿-胡敏酸复合体的表面位点浓度为0.18 mmol·g-1, 复合体表面位点浓度比针铁矿增加0.07 mmol·g-1。这表明胡敏酸与针铁矿形成复合体的过程中产生了一些新的表面位点。另外, 胡敏酸的包被降低了针铁矿比表面积(SSA), 比表面积下降37.45%;同时, 胡敏酸包被形成的复合体的等电点值明显低于针铁矿, 表明胡敏酸在矿物表面的吸附包被显著降低了自身的等电点。
|
Ga和Gb为格氏函数。 图 2 针铁矿和复合体的格氏图 Fig. 2 The Gran plot of the back-titration data of goethite (G) and complexes (GH) tested |
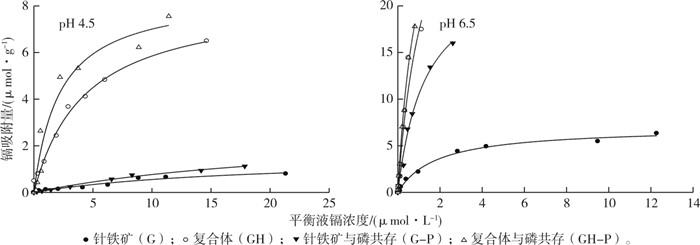
从镉离子在针铁矿和复合体表面的等温吸附曲线(图 3)可以看出, 镉离子在复合体表面的吸附随着其初始浓度的增加而先快速增加后缓慢上升, 最后基本达到平衡; 在单一针铁矿表面镉离子吸附量随着初始浓度的增加一直缓慢增加; 镉离子在复合体表面的吸附量明显高于单一针铁矿。在磷酸根离子共存下, 镉离子在针铁矿和复合体表面的吸附量均显著高于无磷体系。镉离子在针铁矿和复合体表面的吸附曲线均为L型, 用Langmuir方程对其进行拟合, 均获得较好的拟合结果(表 2)。
|
图 3 pH 4.5和6.5条件下镉离子在针铁矿和复合体表面的等温吸附 Fig. 3 Cd adsorption isotherm on goethite (G) and complexes (GH) at pH 4.5 and 6.5 |
|
|
表 2 镉离子在针铁矿和复合体表面等温吸附的Langmuir参数 Table 2 The parameters of Langmuir equation for Cd adsorption on goethite (G) and complexes (GH) |
由表 2可知, 在pH为4.5条件下, 当没有磷酸根离子时, 镉离子在针铁矿和复合体表面的最大吸附量(Xm)分别为1.536和8.375 μmol·g-1; 当磷酸根共存时, 两者对镉离子的最大吸附量分别增加为2.686和8.626 μmol·g-1, 分别比不添加磷处理提高74.87%和3.00%。同时复合体对镉离子的最大吸附量显著高于针铁矿:当没有磷酸根存在时, 镉离子在复合体表面的最大吸附量比针铁矿高6.839 μmol·g-1, 增加4.45倍; 当磷酸根共存时, 复合体对镉的最大吸附量比针铁矿高5.940 μmol·g-1, 增加2.21倍。当pH为6.5时, 磷酸根离子共存条件下针铁矿和复合体对镉离子最大吸附量均高于没有磷酸根条件下。在针铁矿体系镉的最大吸附量增加17.422 μmol·g-1, 增加2.50倍; 在复合体表面, 镉最大吸附量增加0.541 μmol·g-1, 提高1.37%。在pH为6.5条件下复合体对镉离子的最大吸附量均大于单一针铁矿, 与pH为4.5条件下所得结果一致。在pH为6.5条件下, 复合体和单一针铁矿对镉离子的最大吸附量均高于pH为4.5条件下, 也即pH的提高有利于提高针铁矿和复合体对镉离子的最大吸附量。综合pH 4.5和pH 6.5两种条件来看, 4种体系对镉离子的最大吸附量依次均为GH-P > GH > G-P > G, 磷酸根离子的存在可促进镉离子在针铁矿和复合体表面的最大吸附量, 复合体对镉离子的最大吸附量高于针铁矿。
从镉离子在供试矿物表面的吸附亲和力常数(KL, 表 2)可以看出, 在相同pH条件下, 无论是否添加磷酸根离子, 镉离子在复合体表面的KL明显高于针铁矿体系。在pH 4.5条件下, 当磷酸根离子共存时针铁矿表面对镉离子的KL稍低于不添加磷酸根处理; 而对于复合体, 当磷酸根共存时KL则高于不添加磷酸根处理。在pH 6.5条件下, 无论是复合体还是单一针铁矿, 添加磷酸根的镉离子KL都明显高于无磷酸根体系。因此, 当pH较低时, 在针铁矿单一体系中, 磷酸盐的存在降低了镉离子在针铁矿表面的吸附亲和力; 当pH较高时, 磷酸盐的存在则增强了镉离子在针铁矿和复合体表面的吸附亲和力, 促进了镉离子的吸附。
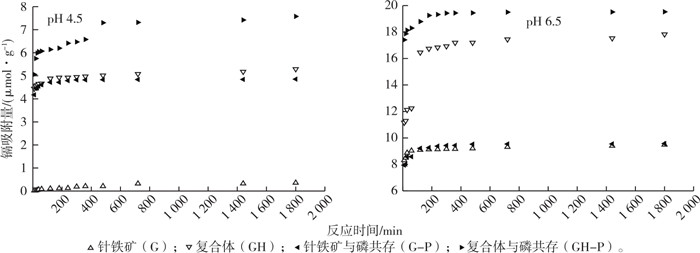
2.3 不同pH条件下镉在针铁矿和复合体表面的吸附动力学由图 4可知, 镉离子在针铁矿和复合体表面的吸附量随着时间延长而逐渐增加。反应初期, 随着时间延长, 吸附量增加较快, 曲线较陡; 反应120 min后, 吸附量的增加变缓, 曲线趋平, 表明吸附存在快速吸附和慢速吸附2个过程。用二级动力学方程对吸附曲线进行拟合, 获得较好的拟合效果(图 5), 这表明镉离子在针铁矿和复合体表面的吸附主要是化学过程, 并且吸附速度主要由吸附过程控制[9]。
|
图 4 镉离子在针铁矿和复合体表面吸附的动力学曲线 Fig. 4 The adsorption kinetics of phosphate by goethite (G) and complexes (GH) |
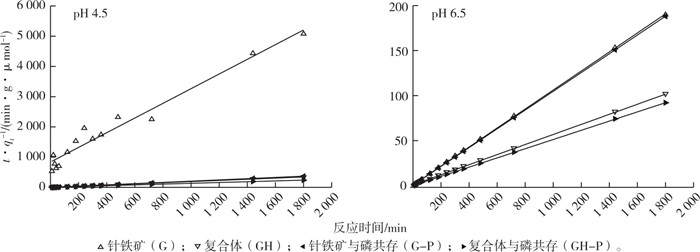
|
qt为t时刻镉的吸附量。 图 5 镉离子在针铁矿和复合体表面吸附的二级动力学曲线 Fig. 5 Kinetics modeling of phosphate adsorption on goethite (G) and complexes (GH) using the pseudo-second-order model |
由二级动力学拟合所得吸附参数(表 3)可以看出, 在pH 4.5条件下镉离子在复合体表面最大吸附量(qe)均高于针铁矿表面, 当无磷时增加11.78倍, 当磷共存时增加56.16%。在单一针铁矿表面, 磷共存时镉离子的最大吸附量也高于无磷时, 磷的存在提高了复合体表面对镉离子的最大吸附量。在pH 6.5条件下, 镉离子在复合体表面的最大吸附量也同样高于单一针铁矿表面; 磷存在也促进镉离子在针铁矿和复合体表面的吸附。
|
|
表 3 镉离子在针铁矿和复合体表面的二级动力学方程拟合参数 Table 3 The parameters of pseudo-second-order model (PSO) for the adsorption of Cd by goethite (G) and complexes (GH) |
同时, 镉离子在pH 6.5条件下的最大吸附量高于pH 4.5条件, pH升高增大了镉离子在矿物表面的吸附量。针铁矿和复合体对镉离子的动力学吸附量(qe)与镉离子在针铁矿和复合体表面的等温吸附所获得理论吸附量(Xm)基本一致。对比镉离子在矿物表面的吸附速率常数(k)可以看出, 在pH 4.5条件下, 磷共存时针铁矿对镉离子的吸附速率远大于无磷时, 而在复合体表面, 磷共存时镉离子吸附速率常数低于无磷时。在pH 6.5条件下, 无论是在针铁矿还是复合体表面,磷共存时镉离子的k值高于无磷时; 同时镉离子在复合体表面的k值明显低于单一针铁矿体系, 也即在pH 6.5条件下磷酸根离子的存在可促进镉离子在矿物表面的吸附速率, 且镉离子在复合体表面的吸附速率较慢。对比初始吸附速率(h), 在pH 4.5条件下初始吸附速率变化规律与吸附速率常数(k)一致, 无磷时复合体对镉离子的初始吸附速率高于磷共存时, 而对于单一针铁矿, 磷酸盐共存可提高镉离子的h值。在pH 6.5条件下, 无磷时镉离子在针铁矿表面的h值高于复合体; 磷共存时镉离子在复合体表面的h值要远高于单一针铁矿体系。无论是针铁矿还是复合体, 磷酸盐的存在提高了镉离子在其表面的h值, 也即在pH 6.5条件下磷酸盐的存在可提高镉离子在矿物表面的h值。
2.4 pH和离子强度对镉离子吸附的影响不同离子强度对针铁矿和复合体吸附镉离子的影响见图 6。无论是在pH 4.5还是pH 6.5条件下, 镉离子在针铁矿和复合体表面的吸附量都随着背景离子强度的增加而降低, 这可能是由于Na+的竞争吸附作用随离子浓度增加而加强, 抑制了针铁矿和复合体对镉离子的吸附。镉离子在针铁矿和复合体表面的吸附以物理吸附和化学吸附形式为主, 当重金属吸附量随着离子强度的增强而降低时, 可推测此时重金属离子与吸附剂形成较弱的非化学键, 吸附以物理吸附为主[9, 25]。
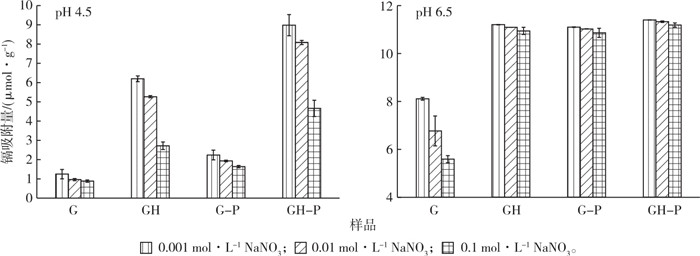
|
G为针铁矿; GH为复合体; G-P为针铁矿与磷共存; GH-P为复合体与磷共存。 图 6 电解质强度和pH对镉离子在针铁矿和针铁矿-胡敏酸复合体表面吸附的影响 Fig. 6 The effects of ionic strength and pH on Cd adsorption on goethite (G) and complexes (GH) |
同时也可以看出, 在pH 4.5、无磷条件下离子强度从0.001 mol·L-1增加到0.1 mol·L-1时, 针铁矿和复合体对镉离子的吸附量分别下降28.96%和35.16%;磷酸盐共存条件下离子强度从0.001 mol·L-1增加到0.1 mol·L-1时, 镉离子在针铁矿和复合体表面的吸附量降低23.02%和26.58%。在pH 6.5条件下, 离子强度从0.001 mol·L-1增加到0.1 mol·L-1时, 无磷时针铁矿和复合体对镉离子的吸附量分别降低32.90%和2.19%;磷共存时分别降低2.15%和1.86%。这说明磷酸根离子的存在有利于减缓离子强度增加对镉吸附的抑制作用。
3 讨论笔者研究中, 通过等温吸附试验和动力学试验发现重金属镉离子在针铁矿-胡敏酸复合体表面的吸附量和吸附强度都高于针铁矿。一方面是由于胡敏酸在针铁矿表面的吸附包被, 降低了矿物表面电势。胡敏酸的酸性官能团离子化, 使其带有较多负电荷, 当胡敏酸进入针铁矿表面的双电层结构时会带来更多的负电荷或者降低针铁矿表面的正电荷, 与带正电荷的镉离子产生强烈的静电引力, 促进镉离子在针铁矿表面的吸附。其次, 胡敏酸在针铁矿表面的吸附增加了矿物表面的位点浓度, 镉离子以Cd(OH)
当磷酸盐与镉离子共存时, 磷酸盐促进了镉离子在针铁矿和复合体表面的吸附量。在反应体系中带负电荷的磷酸盐通过内圈络合物结合在矿物和复合体表面, 降低矿物表面的电势和电荷零点, 使矿物表面带有较多负电荷, 减弱了矿物与镉离子之间的静电斥力, 进而促进镉离子吸附; 磷酸盐也可以与很多重金属离子发生络合等作用促进重金属离子的吸附, 借助衰减全反射傅里叶红外光谱技术(ATR-FTIR)发现磷酸盐在赤铁矿表面吸附过程中, 镉离子与磷酸根、赤铁矿形成Cd-P-赤铁矿三元复合物[26], 促进镉离子的吸附固定, 可以推断在笔者试验反应体系中同样存在类似三元复合物, 增强了镉离子在矿物表面的吸附稳定性。在针铁矿-HA复合体表面, 磷酸盐在矿物表面的吸附, 进一步增加了矿物表面的负电荷量, 降低了复合体表面的电势, 更有利于镉离子的吸附; 同时HA本身带有较多的羧基、酚羟基等官能团, 这些官能团与金属镉水合离子结合, 形成Cd-HA-矿物三元复合体, 且磷酸根离子也可以与镉离子形成三元复合体, 胡敏酸和磷酸根两者共同促进镉离子在矿物表面的吸附[26]。因此磷酸盐主要通过影响反应体系电势、矿物位点浓度以及与镉离子和矿物形成络合配位来促进镉离子的吸附固定。另外, 在较低pH条件下, 针铁矿表面—OH和OH-较少, 表面基团以水合基为主[27], 造成镉离子在针铁矿表面的羟基置换率相对低于高pH条件; 同时针铁矿表面存在磷酸根离子和镉离子共同的吸附位点, 且酸性条件下更有利于磷酸根离子的吸附[21], 因此降低了镉离子在针铁矿表面的亲和力, 造成pH 4.5条件下磷酸根共存时镉在针铁矿表面的吸附亲和力常数(KL, 表 2)低于无磷体系。
磷酸根的存在也影响着镉离子在针铁矿和复合体表面的吸附速率。在针铁矿表面, 磷酸根共存下镉离子在针铁矿表面的吸附速率常数(k)远高于无磷条件下镉离子吸附速率常数。在整个反应体系中离子半径较大的磷酸根(0.22 nm)吸附在针铁矿表面位点的同时, 也占据或堵塞针铁矿表面空隙, 减少矿物表面的微孔数量或比例, 减弱离子半径较小的镉离子(0.097 nm)的离子内扩散作用[28], 提高镉离子在针铁矿表面的化学吸附过程和吸附速率。而在复合体表面磷酸根对镉离子吸附速率的影响与体系pH环境紧密相关。在pH 6.5条件下, 磷酸盐的存在促进镉离子在复合体表面的吸附速率, 而在pH 4.5条件下镉离子在复合体表面的吸附速率却显著降低(表 3)。在酸性环境中(pH 4.5)胡敏酸以类似球形状态存在, 而在偏中性及碱性环境中胡敏酸颗粒伸展, 呈纤维状甚至类片状结构存在[29]。在pH 4.5条件下胡敏酸分子吸附在矿物表面的同时形成较多空隙, 这为镉离子在针铁矿表面的离子内扩散作用提供了条件, 减缓镉离子在复合体表面的吸附过程; 在偏中性环境(pH 6.5)中, 胡敏酸以类似纤维状或类片状结构吸附在矿物表面, 占据较多的吸附位点, 与单一针铁矿相比, 降低了镉离子在复合体表面的吸附速率(表 3)。因此, 推测pH对镉离子在针铁矿-胡敏酸复合体表面吸附速率的影响主要通过改变胡敏酸结构特征来实现。
4 结论相对于针铁矿, 胡敏酸吸附包被在针铁矿表面形成的复合体使其具有较低比表面积和电荷零点, 以及较高的表面位点浓度。重金属镉离子在胡敏酸与针铁矿形成的复合体表面具有较高的理论最大吸附量和吸附强度。在pH 6.5条件下胡敏酸包被降低了复合体对镉离子的吸附速率, 减弱了离子强度增加对镉离子吸附的抑制效应。磷酸盐共存对镉离子在针铁矿及复合体表面的吸附量和吸附速率具有明显的促进作用, 可以减弱离子强度对镉离子吸附的抑制效应。同时, 磷酸盐的存在也增强了pH 6.5条件下镉离子在针铁矿和复合体表面的吸附强度、吸附速率和初始吸附速率。
| [1] |
王玉军, 刘存, 周东美, 等. 客观地看待我国耕地土壤环境质量的现状:关于《全国土壤污染状况调查公报》中有关问题的讨论和建议[J]. 农业环境科学学报, 2014, 33(8): 1465-1473. [ WANG Yu-jun, LIU Cun, ZHOU Dong-mei, et al. A Critical View on the Status Quo of the Farmland Soil Environmental Quality in China:Discussion and Suggestion of Relevant Issues on Report on the National General Survey of Soil Contamination[J]. Journal of Agro-Environment Science, 2014, 33(8): 1465-1473.] (  0) 0) |
| [2] |
左清青, 王烁康, 赵陈晨, 等. 纳米羟基磷灰石对镉的吸附解吸及对镉污染土壤修复研究[J]. 环境工程, 2017, 35(3): 179-183, 151. [ ZUO Qing-qing, WANG Shuo-kang, ZHAO Chen-chen, et al. Adsorption and Desorption of Cd on nHAP and Remediation Test on Cd Contamination Soil[J]. Environmental Engineering, 2017, 35(3): 179-183, 151.] (  0) 0) |
| [3] |
黄荣, 徐应明, 黄青青, 等. 不同氮磷钾肥对海泡石钝化修复镉污染土壤的稳定性研究[J]. 生态与农村环境学报, 2018, 34(6): 547-553. [ HUANG Rong, XU Ying-ming, HUANG Qing-qing, et al. Effects of Nitrogen, Phosphate and Potassium Fertilizer on In-situ Remediation of Cd Polluted Paddy Soil With Sepiolete[J]. Journal of Ecology and Rural Environment, 2018, 34(6): 547-553.] (  0) 0) |
| [4] |
MOHAPATRA M, MOHAPATRA L, SINGH P, et al. A Comparative Study on Pb (Ⅱ), Cd (Ⅱ), Cu (Ⅱ), Co (Ⅱ)Adsorption From Single and Binary Aqueous Solutions on Additive Assisted Nano-Structured Goethite[J]. International Journal of Engineering, Science and Technology, 2010, 2(8): 89-103. (  0) 0) |
| [5] |
RANDALL S R, SHERMAN D M, RAGNARSDOTTIR K V, et al. The Mechanism of Cadmium Surface Complexation on Iron Oxyhydroxide Minerals[J]. Geochimica et Cosmochimica Acta, 1999, 63(19/20): 2971-2987. (  0) 0) |
| [6] |
杨咏华.镉离子(Ⅱ)在针铁矿表面化学吸附的理论研究[D].青岛: 中国海洋大学, 2008[. [YANG Yong-hua.Theoretical Research on Adsorption of Heavy Metal Cadmium Ion on Goethite[D].Qingdao: Ocean University of China, 2008.]] http://cdmd.cnki.com.cn/Article/CDMD-10423-2008175328.htm
(  0) 0) |
| [7] |
MUSTAFA G, SINGH B, KOOKANA R S. Cadmium Adsorption and Desorption Behaviour on Goethite at Low Equilibrium Concentrations:Effects of pH and Index Cations[J]. Chemosphere, 2004, 57(10): 1325-1333. DOI:10.1016/j.chemosphere.2004.08.087 (  0) 0) |
| [8] |
GRANADOS-CORREA F, CORRAL-CAPULIN N G, OLGUÍN M T, et al. Comparison of the Cd (Ⅱ)Adsorption Processes Between Boehmite (γ-AlOOH) and Goethite (α-FeOOH)[J]. Chemical Engineering Journal, 2011, 171(3): 1027-1034. DOI:10.1016/j.cej.2011.04.055 (  0) 0) |
| [9] |
管宇立, 赵转军, 赵立芳, 等. 碳铁共沉物对水中镉的吸附性能[J]. 工业水处理, 2018, 38(3): 25-29. [ GUAN Yu-li, ZHAO Zhuan-jun, ZHAO Li-fang, et al. Research on the Adsorption Capability of Iron-Carbon Co-Precipitant for Cadmium in Water[J]. Industrial Water Treatment, 2018, 38(3): 25-29.] (  0) 0) |
| [10] |
张桂银, 毕淑琴, 董元彦, 等. 有机酸对针铁矿和三羟铝石吸附镉离子的影响[J]. 河北农业大学学报, 2002, 25(4): 49-52. [ ZHANG Gui-yin, BI Shu-qin, DONG Yuan-yan, et al. Effects of Organic Acids on Sorption of Cadmiumion on Goethite and Bayerite[J]. Journal of Agricultural University of Hebei, 2002, 25(4): 49-52. DOI:10.3969/j.issn.1000-1573.2002.04.012] (  0) 0) |
| [11] |
魏世勇, 谭文峰, 刘凡. 土壤腐殖质-矿物质交互作用的机制及研究进展[J]. 中国土壤与肥料, 2009(1): 1-6. [ WEI Shi-yong, TAN Wen-feng, LIU Fan. Advances on the Study of Mineral-Humus Interactions in Soils[J]. Soil and Fertilizers Sciences in China, 2009(1): 1-6. DOI:10.3969/j.issn.1673-6257.2009.01.001] (  0) 0) |
| [12] |
李春玲, 罗庆军, 李春峰. Zn2+、Cd2+在腐殖酸上的吸附动力学与解吸作用研究[J]. 腐植酸, 2017(5): 20-25. [ LI Chun-ling, LUO Qing-jun, LI Chun-feng. Study of Adsorptive Kinetics and Desorption of Zn2+, Cd2+ on Humic Acid[J]. Humic Acid, 2017(5): 20-25.] (  0) 0) |
| [13] |
KAISER K, GUGGENBERGER G. Mineral Surfaces and Soil Organic Matter[J]. European Journal of Soil Science, 2003, 54(2): 219-236. DOI:10.1046/j.1365-2389.2003.00544.x (  0) 0) |
| [14] |
TOMBÁCZ E, LIBOR Z, ILLÉS E, et al. The Role of Reactive Surface Sites and Complexation by Humic Acids in the Interaction of Clay Mineral and Iron Oxide Particles[J]. Organic Geochemistry, 2004, 35(3): 257-267. DOI:10.1016/j.orggeochem.2003.11.002 (  0) 0) |
| [15] |
ALCACIO T, HESTERBERG D, CHOU J W, et al. Molecular Scale Characteristics of Cu (Ⅱ) Bonding in Goethite-Humate Complexes[J]. Geochimica et Cosmochimica Acta, 2001, 65(9): 1355-1366. DOI:10.1016/S0016-7037(01)00546-4 (  0) 0) |
| [16] |
COVELO E F, VEGA F A, ANDRADE M L. Sorption and Desorption of Cd, Cr, Cu, Ni, Pb and Zn by a Fibric Histosol and Its Organo-Mineral Fraction[J]. Journal of Hazardous Materials, 2008, 159(2/3): 342-347. (  0) 0) |
| [17] |
罗文倩, 魏世强. 镉在针铁矿、针铁矿-腐殖酸复合胶体中吸附解吸行为比较研究[J]. 农业环境科学学报, 2009, 28(5): 897-902. [ LUO Wen-qian, WEI Shi-qiang. Adsorption and Desorption Behaviors of Cadmium On/From Goethite and Its Compound Colloid With Humic Acids[J]. Journal of Agro-Environment Science, 2009, 28(5): 897-902. DOI:10.3321/j.issn:1672-2043.2009.05.006] (  0) 0) |
| [18] |
王丹丽, 王恩德. 针铁矿及腐殖质对水体重金属离子的吸附作用[J]. 安全与环境学报, 2001, 1(4): 1-4. [ WANG Dan-li, WANG En-de. Adsorption of Heavy Metal Ions in Aqueous-Solution Onto Goethite and Humin[J]. Journal of Safety and Environment, 2001, 1(4): 1-4. DOI:10.3969/j.issn.1009-6094.2001.04.001] (  0) 0) |
| [19] |
LI W, ZHANG S Z, SHAN X Q. Surface Modification of Goethite by Phosphate for Enhancement of Cu and Cd Adsorption[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2007, 293(1/2/3): 13-19. (  0) 0) |
| [20] |
范玉超, 夏睿智, 刘薇, 等. 模拟酸雨对磷基材料稳定化土壤Cu、Cd、Pb和P活性的影响[J]. 生态与农村环境学报, 2018, 34(5): 441-447. [ FAN Yu-chao, XIA Rui-zhi, LIU Wei, et al. Effects of Simulated Acid Rain on the Availability of Cu, Cd, Pb and P in a Contaminated Soil Immobilized by Phosphorus-Based Materials[J]. Journal of Ecology and Rural Environment, 2018, 34(5): 441-447.] (  0) 0) |
| [21] |
WANG H, ZHU J, FU Q L, et al. Phosphate Adsorption on Uncoated and Humic Acid-Coated Iron Oxides[J]. Journal of Soils and Sediments, 2016, 16(7): 1911-1920. DOI:10.1007/s11368-016-1383-8 (  0) 0) |
| [22] |
XIONG J, KOOPAL L K, WENG L P, et al. Effect of Soil Fulvic and Humic acid on Binding of Pb to Goethite-Water Interface:Linear Additivity and Volume Fractions of HS in the Stern Layer[J]. Journal of Colloid and Interface Science, 2015, 457: 121-130. DOI:10.1016/j.jcis.2015.07.001 (  0) 0) |
| [23] |
FEIN J B, BOILY J F, YEE N, et al. Potentiometric Titrations of Bacillus subtilis Cells to Low pH and a Comparison of Modeling Approaches[J]. Geochimica et Cosmochimica Acta, 2005, 69(5): 1123-1132. DOI:10.1016/j.gca.2004.07.033 (  0) 0) |
| [24] |
NIU Z W, FAN Q H, WANG W H, et al. Effect of pH, Ionic Strength and Humic Acid on the Sorption of Uranium (Ⅵ)to Attapulgite[J]. Applied Radiation Isotopes, 2009, 67(9): 1582-1590. DOI:10.1016/j.apradiso.2009.03.113 (  0) 0) |
| [25] |
LÜTZENKIRCHEN J. Ionic Strength Effects on Cation Sorption to Oxides:Macroscopic Observations and Their Significance in Microscopic Interpretation[J]. Journal of Colloid and Interface Science, 1997, 195(1): 149-155. DOI:10.1006/jcis.1997.5160 (  0) 0) |
| [26] |
ELZINGA E J, KRETZSCHMAR R. In situ ATR-FTIR Spectroscopic Analysis of the Co-Adsorption of Orthophosphate and Cd (Ⅱ)Onto Hematite[J]. Geochimica et Cosmochimica Acta, 2012, 117: 53-64. (  0) 0) |
| [27] |
刘凡, 介晓磊, 贺纪正, 等. 不同pH条件下针铁矿表面磷的配位形式及转化特点[J]. 土壤学报, 1997, 34(4): 367-374. [ LIU Fan, JIE Xiao-lei, HE Ji-zheng, et al. Coordination Forms and Transformations of Phosphate Adsorbed by Goethite Surface on Different pH[J]. Acta Pedologica Sinica, 1997, 34(4): 367-374. DOI:10.3321/j.issn:0564-3929.1997.04.003] (  0) 0) |
| [28] |
WANG K J, XING B S. Adsorption and Desorption of Cadmium by Goethite Pretreated With Phosphate[J]. Chemosphere, 2002, 48(7): 665-670. DOI:10.1016/S0045-6535(02)00167-4 (  0) 0) |
| [29] |
李学垣. 土壤化学[M]. 北京: 高等教育出版社, 2001: 22-23. [ LI Xue-yuan. Soil Chemistry[M]. Beijing: Higher Education Press, 2001: 22-23.]
(  0) 0) |




