2. 生猪健康养殖协同创新中心, 湖北 武汉 430070;
3. 淡水生态与生物技术国家重点实验室, 湖北 武汉 430072
2. The Cooperative Innovation Center for Sustainable Pig Production of Hubei Province, Wuhan 430070, China;
3. State Key Laboratory of Freshwater Ecology and Biotechnology, Wuhan 430072, China
凤眼莲(Eichhornia crassipes)是我国外来入侵物种之一, 在各类水体中泛滥成灾, 其具有纤维素、半纤维素含量高, 生长不占用土地等优点, 是能源产品生产的重要生物质来源[1-3]。生物质原料结构复杂, 其主要利用对象是构成植物细胞壁的原纤维丝。木质素、半纤维素和果胶等基础物质相互交联包裹,组成坚固的原纤维丝表层结构, 使得纤维素成分难以被利用[4-5]。如何高效释放出生物质原料中能被发酵阶段利用的糖进而提高乙醇等能源物质的生产效率,成为目前生物质能源化利用中最大的技术与经济挑战[6-8]。预处理是生物质原料释放可利用糖的关键步骤, 其目的是破坏原纤维丝顽固的外表层结构, 尽可能增大后续酶水解对结晶纤维素的可及度, 从而提高生物质利用效率[9-11]。生物脱胶是生物质利用的预处理方法之一, 其机理是通过特殊微生物对环境的适应性, 分泌果胶酶及半纤维素酶等酶系, 将大分子的果胶及半纤维素转化为小分子的生物可利用糖, 进而被脱胶菌株吸收利用[12]。目前脱胶菌多用于对苎麻的研究, 通过去除麻类物质中的胶质成分同时保留其纤维成分, 增强麻类纤维性能, 这种脱胶方法鲜有涉及其他类型植物[13]。笔者借鉴前人对苎麻脱胶菌的筛选方法, 从凤眼莲不同生长环境中筛选降解凤眼莲非纤维素的优良菌株, 并对其产酶特性和脱胶能力进行了探究。目前报道的脱胶菌株有放线菌属[14]、纤维单胞菌[15]、志贺菌属[16]和枯草芽孢杆菌[17]等, 这些都是对麻类的脱胶菌株, 而对解淀粉芽孢杆菌脱胶报道较少。该研究报道了一种解淀粉芽孢杆菌作为凤眼莲脱胶菌的效果,解淀粉芽孢杆菌本身也可以消耗蛋白质、脂肪和淀粉等有机物。具有果胶酶活性的解淀粉芽孢杆菌可以有效去除木质纤维素中的蛋白质和胶质成分,为生物预处理凤眼莲提供生物基础。
1 材料与方法 1.1 菌种来源与材料制备选取华中农业大学某生长凤眼莲的池塘水、池塘底泥和武汉南湖湖水分别作为菌种来源。选用华中农业大学周边随机采摘的健壮凤眼莲植株, 洗净晾干, 并将其根、叶与茎切离, 将茎切成约2 cm小段, 烘干备用。
分离培养基Ⅰ:w=0.01%的K2SO4 0.1 g, CaCl2 0.2 g, NaCl 0.2 g, MgSO4·7H2O 0.3 g, KNO3 0.5 g, (NH4)2SO4 0.5 g, K2HPO4 1 g, 琼脂20 g, 蒸馏水1 L; 分离培养基Ⅱ:果胶1 g, 琼脂5 g, pH值为7.0, 蒸馏水1 L。在培养皿中倒双层平板, 表层为5 mL培养基Ⅱ, 基层为10 mL培养基Ⅰ。
水解圈测定培养基Ⅰ:FeSO4 0.01 g, CaCl2 0.2 g, MgSO4·7H2O 0.5 g, NaCl 0.5 g, KH2PO4 1 g, NH4NO3 3 g, 果胶5 g, 琼脂20 g, pH值为7.0, 蒸馏水1 L; 水解圈测定培养基Ⅱ:20 g琼脂, 蒸馏水1 L。在培养皿中倒双层平板, 表层为10 mL培养基Ⅰ, 基层为10 mL培养基Ⅱ。
脱胶培养基[18]:凤眼莲茎5 g, 盐溶液150 mL, pH值约为7.0。盐溶液:MgSO4·7H2O 0.5 g, K2HPO4 0.5 g, (NH4)2SO4 5 g, 无菌水1 L。
斜面培养基:牛肉膏蛋白胨固体培养基。
1.2 菌种的分离与筛选 1.2.1 菌种的分离与纯化设置5个处理, 编号为A、B、C、D和E, 处理设置见表 1。取凤眼莲茎样和水, 按m(固):V(液)=1:30的比例置于锥形瓶中, 自然pH下(pH值约为7.0)35 ℃培养至纤维分散(约5 d), 得一次增殖培养液。另取凤眼莲茎, 同上处理加入一次增殖培养液, 得二次增殖培养液。取二次增殖培养液1 mL, 分别稀释10-5、10-6和10-7倍。分别取0.1 mL不同浓度稀释液于分离培养基中涂布, 35 ℃恒温培养2~3 d。挑选分离培养基中得到的菌群, 于斜面培养基上划线纯化、保存。
|
|
表 1 脱胶菌富集培养的不同处理 Table 1 Different treatments in enrichment culture of degumming bacteria |
将上述分离得到的菌株点接于水解圈测定培养基, 35 ℃培养2 d。采用刚果红平板染色法, 计算水解圈直径(H)与菌落直径(C)之比, 即H/C比值[19]。H/C比值较大的菌株即为初筛菌株。
1.3 酶活性测定将初筛得到的菌株置于脱胶培养基中培养, 测定果胶酶、木聚糖酶及纤维素酶活性。脱胶培养条件:温度35 ℃,振荡速率145 r·min-1,接种率4%,pH值7.0。每24 h取2 mL发酵液, 用DNS比色法测定果胶酶、木聚糖酶及纤维素酶活性[20]。
1.4 脱胶试验分别将复筛菌株接种于脱胶培养基中, 在最佳脱胶条件下培养。脱胶完成后取出样品, 用蒸馏水洗净后烘干称重, 计算样品的脱胶率, 可用减重率表示[21]。再次按上述步骤连续脱胶2次(共计脱胶3次)。减重率=(M0-M1)/M0×100 %。式中,M0为脱胶处理前样品干重, g;M1为脱胶处理后样品干重,g。
1.5 菌株的鉴定 1.5.1 革兰染色及菌株16S rRNA基因测序将筛选得到的脱胶最优菌株A1进行革兰染色后[22], 于显微镜下观察其形态特征。另取1支A1菌种管委托武汉擎科测序公司进行16S rRNA测序。
1.5.2 系统发育分析分离菌株测序结果提交GenBank进行BLAST比较, 从BLAST结果中挑选与该菌株碱基序列相似度在95%以上的菌株序列, 通过Clustal W进行多重序列比对, 并利用MAGE 6.0软件, 以Neighbor-Joining法构建系统发育树。
2 结果与讨论 2.1 初筛结果将经过富集培养、分离所得的优势菌群用于凤眼莲脱胶菌的初次筛选, 得到产生黄色透明圈的15株菌株。由表 2可知, A1、B3、B11和C11这4支菌株不是该分离培养基上最具优势的菌株, 但它们的水解圈直径均大于45 mm, 其菌落所产生的透明圈明显大于其他菌株, 故选择透明圈较大及H/C比值较高的5株菌株A1、B3、B11、C11和B13用于复筛。
|
|
表 2 凤眼莲脱胶菌的初筛结果 Table 2 Primary screening of Eichhornia crassipes degumming strains |
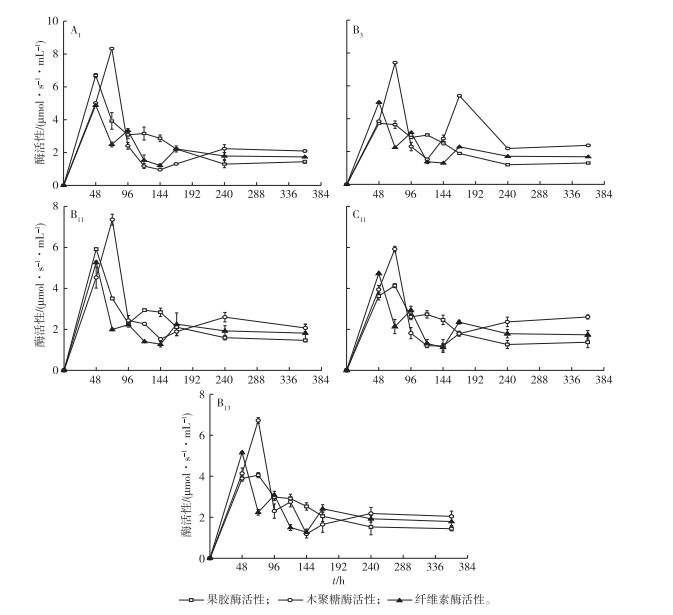
将上述5支菌株复筛, 其酶活性变化见图 1。
|
图 1 不同培养时间下5支菌株分泌的酶活性 Figure 1 Activities of the enzymes secreted by five different strains relative to cultivation time |
5支菌株分泌的果胶酶和木聚糖酶活性先升高再降低, 纤维素酶活性在培养48~72 h时均呈明显降低趋势, 再随着时间的延长纤维素酶活性又有所回升。A1、B3和B11菌株的果胶酶和木聚糖酶活性分别在48和72 h达到最高值, 木聚糖酶活性的最大值出现时间有一定的滞后性; C11和B13菌株的果胶酶与木聚糖酶活性在72 h达到最高值。上述现象可能是因为凤眼莲样品经物理破碎以及灭菌过程, 部分木质纤维素成分溶入发酵液中, 促使细菌产生纤维素酶、木聚糖酶和果胶酶以进行自身的发酵。当溶液中的纤维素和木聚糖等消耗后, 细菌开始利用凤眼莲外部的胶质成分, 此时纤维素成分浓度较低, 进而表现为果胶酶和木聚糖酶活性增加, 而纤维素酶活性降低。而当胶质结构被破坏后, 部分纤维素成分暴露出来, 使得纤维素酶活性又有所增加。在72 h时纤维素酶活性基本处于最低水平, 此时果胶酶与木聚糖酶活性较高。因此, 选定72 h作为最佳脱胶周期。
经过72 h脱胶后, 测得A1、B3、B11、C11和B13这5支菌株分泌的3种酶活性见表 3。A1菌株分泌的3种酶活性均较高, 其木聚糖酶活性明显高于其他菌株。脱胶效果主要可通过果胶酶活性与木聚糖酶活性来表征, 这2种酶活性越高, 脱胶效果越显著。A1菌株纤维素酶活性虽然在5种菌株中最高, 但绝对数值较低, 且与其他菌株(B11菌株除外)相比差异不显著。
|
|
表 3 不同菌株处理凤眼莲茎72 h时分泌的3种酶活性 Table 3 Activities of the three kinds of enzymes secreted by different strains pretreating Eichhornia crassipes stem for 72 h |
选取A1、B3、B11、B13和C11这5支菌株进行凤眼莲脱胶试验, 经过1次脱胶后, 凤眼莲纤维在不同菌株作用下的分散程度不同, A1菌株处理后的凤眼莲茎纤维状较其他菌株更加明显, 部分茎已成丝状, 其纤维释放效果明显优于其他菌株。
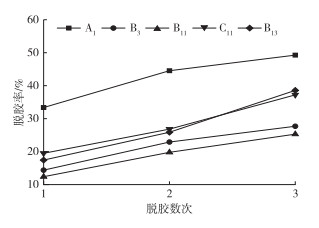
将凤眼莲连续脱胶3次, 计算3次脱胶的累计减重率, 结果见图 2。A1菌株第1次脱胶的减重率显著高于其他菌株, 其1次脱胶率可达33.37%。这与A1菌株具有较高的木聚糖酶和果胶酶酶活性有关。在累计3次脱胶后, A1菌株的脱胶速率变缓, 而木聚糖酶活性较低的C11菌株脱胶速率有所上升。但3次脱胶后, A1菌株脱胶减重率始终最高, 达到49.26%。杨丹等[13]研究表明, 在最佳条件下筛选得到的脱胶菌对苎麻胶质的1次去除率为25.94%。与之相比, 笔者研究中的A1菌株脱胶较为高效, 对凤眼莲生物脱胶具有极大的潜力。
|
图 2 不同菌株处理凤眼莲茎的累计减重率 Figure 2 Cumulative weight loss rate of Eichhornia crassipes stem treated by different strains |
将A1菌株进行革兰染色, 于显微镜下观察, 其染色结果为紫色, 显示为革兰阳性, 细菌为短杆状。
通过GenBank中的基因序列对比, A1菌株与解淀粉芽孢杆菌MPA1034(Bacillus amyloliquefaciens strain MPA 1034)、解淀粉芽孢杆菌亚种植物乳杆菌FZB 42(Bacillus amyloliquefaciens subsp.Plantarum strain FZB 42)、杀线虫剂芽孢杆菌(Bacillus nematocida strain B-16) 等十几株菌株序列的相似性分别高达99%, 选取同源性较高的6株菌株构建系统发育树。从图 3可以看出, A1菌株与Bacillus amyloliquefaciens subsp. Plantarum strain FZB42(登录号为NR 075005.1) 同源性最高。可初步判定A1属于解淀粉芽孢杆菌属(Bacillus amyloliquefaciens)。报道显示, 解淀粉芽孢杆菌与枯草杆菌亲缘性极大, 可以通过分泌胞外酶或酯肽类物质有效抑制细菌及真菌, 促进丁草胺的降解[23]。翟秋梅等[24]从罗布麻表皮中筛选出一株枯草芽孢杆菌(Bacillus subtilis FM208849), 对罗布麻有良好的脱胶效果。于丽萍等[25]从沤麻液中得到一株枯草芽孢杆菌(Bacillus subtilis HW201), 可在达到传统工艺沤麻效果的同时降低沤麻周期。吴皓琼等[26]对枯草芽孢杆菌(Bacillus subtilis HW201) 沤麻条件进行了优化, 证实该菌在沤麻过程中有脱胶能力。解淀粉芽孢杆菌与枯草杆菌亲缘关系较为接近, 因此解淀粉芽孢杆菌中极有可能携带类似枯草芽孢杆菌中脱胶酶的基因。李超等[27]从富营养化水中分离得到一株解淀粉芽孢杆菌DC1, 具有溶藻能力, 可以通过分泌胞外物质使鱼腥藻长链聚集成团后断裂, 进而溶解藻细胞。这些研究间接表明解淀粉芽孢杆菌可以分泌出某种破坏植物细胞壁的物质, 这对于植物细胞壁中纤维素等可利用成分的释放具有重要意义。

|
图 3 A1菌株的系统发育树 Figure 3 Phylogenetic tree of Strain A1 |
(1) 从凤眼莲生长的池塘底泥中分离得到一株高效的凤眼莲脱胶菌, 经16S rRNA鉴定,该菌株为解淀粉芽孢杆菌。
(2) 控制温度为35 ℃, 接种率为4%, pH值为7.0, 振荡速率为145 r·min-1条件下, A1菌株的最佳脱胶周期为72 h。
(3) A1菌株为比较理想的凤眼莲脱胶菌, 其1次脱胶减重率可达33.37%, 连续3次累计脱胶的减重率可达49.26%。
| [1] |
NIGAM J N. Bioconversion of Water Hyacinth (Eichhornia crassipes) Hemicellulose Acid Hydrolysate to Motor Fuel Ethanol by Xylose-Fermenting Yeast[J]. Journal of Biotechnology, 2002, 97(2): 107-116. DOI:10.1016/S0168-1656(02)00013-5 (  0) 0) |
| [2] |
MALIK A. Environmental Challenge Vis a Vis Opportunity:The Case of Water Hyacinth[J]. Environment International, 2007, 33(1): 122-138. DOI:10.1016/j.envint.2006.08.004 (  0) 0) |
| [3] |
BHATTACHARYA A, KUMAR P. Water Hyacinth as a Potential Biofuel Crop[J]. Electronic Journal of Environmental Agricultural and Food Chemistry, 2010, 9(1): 112-122. (  0) 0) |
| [4] |
DING S Y, HIMMEL M E. The Maize Primary Cell Wall Microfibril:A New Model Derived From Direct Visualization[J]. Journal of Agricultural and Food Chemistry, 2006, 54(3): 597-606. DOI:10.1021/jf051851z (  0) 0) |
| [5] |
赵晨, 崔馨月, 刘广青, 等. 提高玉米秸秆厌氧消化产气能力的预处理技术研究进展[J]. 生态与农村环境学报, 2015, 31(5): 640-646. ZHAO Chen, CUI Xin-yue, LIU Guang-qing, et al. Recent Progress in Study on Technology for Pretreating Corn Stalk to Improve Biogas Production Capacity of Anaerobic Digestors[J]. Journal of Ecology and Rural Environment, 2015, 31(5): 640-646. DOI:10.11934/j.issn.1673-4831.2015.05.004 (  0) 0) |
| [6] |
WYMAN C E. What Is (and Is Not) Vital to Advancing Cellulosic Ethanol[J]. Trends Biotechnology, 2007, 25(4): 153-157. DOI:10.1016/j.tibtech.2007.02.009 (  0) 0) |
| [7] |
李萍, 韦秀丽, 蒋滔, 等. 不同预处理方式对玉米秸秆结构及产气特性的模拟研究[J]. 生态与农村环境学报, 2014, 30(1): 84-89. LI Ping, WEI Xiu-li, JIANG Tao, et al. Simulation of Structure and Biogas Production Properties of Corn Stalk Relative to Pretreatment Method[J]. Journal of Ecology and Rural Environment, 2014, 30(1): 84-89. (  0) 0) |
| [8] |
HIMMEL M E, DING S Y, JOHNSON D K, et al. Biomass Recalcitrance:Engineering Plants and Enzymes for Biofuels Production[J]. Science, 2007, 315(5813): 804-807. DOI:10.1126/science.1137016 (  0) 0) |
| [9] |
MOSIER N, WYMAN C, DALE B, et al. Features of Promising Technologies for Pretreatment of Lignocellulosic Biomass[J]. Bioresource Technology, 2005, 96(6): 673-686. DOI:10.1016/j.biortech.2004.06.025 (  0) 0) |
| [10] |
YANG B, WYMAN C E. Pretreatment:The Key to Unlocking Low-Cost Cellulosic Ethanol[J]. Biofuels Bioproducts and Biorefining, 2008, 2(2): 26-40. (  0) 0) |
| [11] |
KADAM K L, CHIN C Y, BROWN L W. Flexible Biorefinery for Producing Fermentation Sugars, Lignin and Pulp From Corn Stover[J]. Journal of Industrial Microbiology and Biotechnology, 2008, 35(5): 331-341. DOI:10.1007/s10295-008-0322-0 (  0) 0) |
| [12] |
郑来久, 刘剑宇. 黄红麻微生物脱胶影响因素及机理研究[J]. 东华大学学报(自然科学版), 2004, 30(3): 66-70. ZHENG Lai-jiu, LIU Jian-yu. Influencing Factors and Mechanism of Microbial Degumming of Jute/Kenaf[J]. Journal of Donghua University(Natural Science), 2004, 30(3): 66-70. (  0) 0) |
| [13] |
杨丹, 王燕, 王茜, 等. 蜡样芽孢杆菌用于苎麻脱胶研究[J]. 中国农学通报, 2015, 31(3): 260-264. YANG Dan, WANG Yan, WANG Qian, et al. Research on Bacillus cereus for the Degumming of Ramie[J]. Chinese Agricultural Science Bulletin, 2015, 31(3): 260-264. (  0) 0) |
| [14] |
汪学军, 闵长莉, 杨艳, 等. 大麻微生物脱胶特异放线菌菌株的筛选与鉴定[J]. 纺织学报, 2014, 35(11): 102-106. WANG Xue-jun, MIN Chang-li, YANG Yan, et al. Isolation and Identification of Actinomycete Strain DM182 for Microbial Degumming of Hemp[J]. Journal of Textile Research, 2014, 35(11): 102-106. (  0) 0) |
| [15] |
董政娥, 丁若垚, 郑磊, 等. 亚麻粗纱碱性脱胶菌株的筛选鉴定及脱胶效果[J]. 印染助剂, 2013, 30(10): 16-19. DONG Zheng-e, DING Ruo-yao, ZHENG Lei, et al. Screening and Identification of Alkalophilic Degumming Strains of Flax Roving and Evaluation of Its Effects[J]. Textile Auxiliaries, 2013, 30(10): 16-19. DOI:10.3969/j.issn.1004-0439.2013.10.006 (  0) 0) |
| [16] |
蓝广芊, 左伟东, 许平震, 等. 苎麻生物脱胶特异菌株的筛选与鉴定[J]. 纺织学报, 2010, 31(8): 56-60. LAN Guang-qian, ZUO Wei-dong, XU Ping-zhen, et al. Screening and Identification of a Bacterium Strain for Specific Ramie Degumming[J]. Journal of Textile Research, 2010, 31(8): 56-60. (  0) 0) |
| [17] |
陈青, 韩双艳, 郑穗平, 等. 剑麻生物制浆脱胶菌株的筛选与鉴定及初步应用[J]. 农业工程学报, 2008, 24(6): 277-281. CHEN Qing, HAN Shuang-yan, ZHENG Sui-ping, et al. Screening and Identifying Strain of Bio-Pulping and Degumming of the Sisal and Its Preliminary Application[J]. Transactions of the CSAE, 2008, 24(6): 277-281. (  0) 0) |
| [18] |
马丽晓. 凤眼莲秸秆生物脱胶的研究[D]. 武汉: 华中农业大学, 2009. MA Li-xiao.Study on the Biological Degumming to Straw of Eichhornia crassipes[D].Wuhan:Huazhong Agricultural University, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10504-2010010261.htm (  0) 0) |
| [19] |
董鹤娟, 丁轲, 恒子钤, 等. 一株土壤源高产纤维素酶芽孢杆菌的分离与鉴定[J]. 家畜生态学报, 2013, 34(6): 48-52. DONG He-juan, DING Ke, HENG Zi-qin, et al. Isolation and Identifitication of a High Yield Cellulase bacillus Strain From Soil[J]. Acta Ecologiae Animalis Domastici, 2013, 34(6): 48-52. (  0) 0) |
| [20] |
金迪, 彭清净, 易浪波, 等. 一株纤维素降解细菌的筛选、鉴定及产酶条件分析[J]. 中国微生态学杂志, 2010, 22(4): 289-295. JIN Di, PENG Qing-jing, YI Lang-bo, et al. Isolation and Identification of a Cellulose-Decomposing Bacterium and Its Cellulase-Producing Conditions[J]. Chinese Journal of Microecology, 2010, 22(4): 289-295. (  0) 0) |
| [21] |
金钢. 大麻脱胶方法的研究进展[J]. 南京林业大学学报(自然科学版), 2009, 33(4): 140-144. JIN Gang. Research Progress of Degumming Technology of Cannabis Sativa[J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2009, 33(4): 140-144. (  0) 0) |
| [22] |
赵斌, 何绍江. 微生物学实验[M]. 北京: 科学出版社, 2002, 38-39. ZHAO Bin, HE Shao-jiang. Laboratory Experiments in Microbiology[M]. Beijing: Science Press, 2002, 38-39. (  0) 0) |
| [23] |
关晓欢, 姜华. 解淀粉芽孢杆菌研究进展[J]. 生物技术世界, 2013(1): 4-9. GUAN Xiao-huan, JIANG Hua. The Research on Development of Bacillus amyloliquefaciens[J]. Biotech World, 2013(1): 4-9. (  0) 0) |
| [24] |
翟秋梅, 薛卫巍, 薛永常, 等. 枯草芽孢杆菌FM208849产果胶酶发酵条件的优化[J]. 大连工业大学学报, 2010, 29(2): 93-97. ZHAI Qiu-mei, XUE Wei-wei, XUE Yong-chang, et al. The Optimization of Pectinase Fermentation From Bacillus subtilis FM208849[J]. Journal of Dalian Polytechnic University, 2010, 29(2): 93-97. (  0) 0) |
| [25] |
于丽萍, 郭立姝, 殷博, 等. 枯草芽孢杆菌(Bacillus subtilis) HW201的酶学特性及沤麻实验研究[J]. 黑龙江科学, 2013, 4(2): 18-22. YU Li-ping, GUO Li-shu, YIN Bo, et al. The Identification and Enzymatic Properties of the Bacillus subtilis Strain for Flax Retting[J]. Heilongjiang Science, 2013, 4(2): 18-22. (  0) 0) |
| [26] |
吴皓琼, 曹亚彬, 郭立姝, 等. 枯草芽孢杆菌HW201的亚麻生物脱胶条件优化[J]. 中国麻业科学, 2010, 32(5): 265-269. WU Hao-qiong, CAO Ya-bin, GUO Li-shu, et al. The Condition Optimization of Retting Flax With Bacillus subtilis HW201[J]. Plant Fiber Sciences in China, 2010, 32(5): 265-269. (  0) 0) |
| [27] |
李超, 吴为中, 吴伟龙, 等. 解淀粉芽孢杆菌对鱼腥藻的抑藻效果分析与机理初探[J]. 环境科学学报, 2011, 31(8): 1602-1608. LI Chao, WU Wei-zhong, WU Wei-long, et al. Ability of Bacillus amyloliquefaciens to Inhibit Growth of Anabaena flosaquae and the Inhibition Mechanism[J]. Acta Scientiae Circumstantiae, 2011, 31(8): 1602-1608. (  0) 0) |




