2. 江西中医药大学 科研处,江西 南昌 330004
2. Department of Scientific Research, Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, Jiangxi, China
1997年世界卫生组织(WHO)将肥胖症确定为一种疾病,大量研究也证明肥胖症是一种慢性非传染性疾病。从肥胖症的生理机制看,1901年已有临床证据推测下丘脑与肥胖症有关[1]。1954年,Stellar[2]提出了腹内侧核饱食中枢与外侧核饥饿中枢相互平衡并控制进食和体质量的假说,研究发现5-羟色胺、肽类递质等与食欲有关,从中枢调控角度探索了肥胖的发生机制。肥胖研究领域的一个重大突破是1994年“脂肪调节器”瘦素的发现,其在血液中的浓度与脂肪量成正比,可作用于下丘脑,抑制食欲,实现对脂肪的调控[3],随后发现的脂联素[4]、鸢尾素[5]也可通过不同途径调控脂肪量,这些重要蛋白可能成为控制肥胖的靶点。代谢角度的研究认为胰岛素抵抗与肥胖有关[6-7],很多活性成分可通过调节胰岛素影响糖脂代谢,一磷酸腺苷(AMP)依赖的蛋白激酶(AMPK)是一种细胞能量传感器,可调节胰岛素敏感性,AMPK的活性改变可影响胰岛素抵抗,从而引起细胞能量失衡,导致肥胖[8]。慢性炎症在肥胖的发病机制中起着至关重要的作用[9]。在肥胖的发展过程中,脂肪组织表现为脂肪细胞肥大、血管生成增多、免疫细胞浸润和细胞外基质过度生成等动态组织学改变,引发机体慢性炎症[9],而血管壁的慢性炎症反应可引起动脉粥样硬化[10]。流行病学研究显示,肥胖是心血管疾病的重要风险因素,也是死亡的独立预测因子[11]。鉴于肥胖对心血管的危害,探索高效的减脂途径对改善肥胖者心血管健康有重要意义。
高强度间歇训练(high-intensity interval training,HIIT)是WHO和美国运动医学会(ACSM)推荐的一种有效提高身体机能的运动方式[12],在超重/肥胖人群取得同样心血管健康收益的情况下,HIIT比中等强度训练节约时间[13]。HIIT可通过增加物质和能量代谢,减少脂肪堆积,达到减脂的目的[14],也对提高心肺机能、改善糖脂代谢、降低胰岛素抵抗有促进作用[15]。HIIT可刺激机体骨骼肌细胞膜表面葡萄糖转运蛋白4(GLUT4)表达及转位活性,提高胰岛素携糖转运进入肌细胞贮藏的效率,从而提高胰岛素敏感性[16]。HIIT影响炎症因子的研究发现,肥胖青少年经过24周HIIT训练后,血炎症因子显著改善[17]。目前很多研究从基因、mRNA、蛋白质等层面入手阐释HIIT的健康效益[15, 17-19]。随着研究的深入,人们逐渐认识到,某些基因表达的变化不一定能引起特定机能的改变,某些蛋白质可能因不具备活性,其浓度的变化不会对器官系统产生影响,某个基因和蛋白质的缺失会因其他基因和蛋白质的存在而使其功能得到补偿,而小分子代谢产物才是这一系列事件的最终结果,它能更直接、准确地反映生物体的病理和生理状况[20]。对运动减脂而言,通过探索肥胖人群运动前后小分子代谢物的变化,可从微观的物质代谢层面了解减脂的机制。在研究小分子代谢物的过程中,有效的分离与检测技术成为影响学科发展的重要因素,色谱-质谱技术可快速、准确和高通量地分离、鉴定与检测小分子代谢物[21],为从代谢组学层面探索运动减脂的机制提供借鉴。
代谢组学是20世纪90年代末发展起来的一门学科,其在新陈代谢的动态过程中,系统研究代谢产物的变化规律,揭示机体生命活动代谢本质,主要关注分子量在1 000 Da以内的小分子代谢物。1985年Nicholson等[22]利用核磁共振技术分析大鼠的尿液,发现尿液代谢物的变化与病理变化相关联,意识到这可能是生命科学研究的巨大突破。随后Dugas等[23]采用气相色谱-飞行时间质谱联用系统(GC⁃TOF/MS)分析特定代谢物与肥胖的关系,发现美国肥胖妇女的循环血多种代谢物水平高于体质量正常者,这些代谢物与高脂肪、高血脂和缺乏高强度身体活动相关。Romo⁃Hualde等[24]采用超高效液相色谱-串联四极杆飞行时间质谱(UPLC⁃QTOF)对硫辛酸(α⁃La)干预肥胖进行了尿样的代谢组学研究,发现14个代谢物与超氧化物歧化酶(SOD)呈正相关,推测α⁃La对减肥的有益作用是通过改善抗氧化性能实现的。目前UPLC⁃QTOF被广泛应用于肥胖、糖尿病、肿瘤生物标志物的筛选与鉴定[25-28],这些研究表明应用UPLC⁃QTOF可筛选和鉴定差异代谢物,有利于阐明运动减脂的代谢机制,对肥胖的预防有积极作用。
本文对超重/肥胖女大学生进行8周的HIIT干预后,采用UPLC⁃QTOF对其尿液进行代谢组学分析,通过筛选和鉴定HIIT运动前后差异代谢物,结合差异代谢物的代谢通路探讨HIIT减脂的机制。
1 研究对象与方法 1.1 研究对象受试者招募于江西中医药大学,对其进行疾病调查与身体形态机能测试。纳入标准:①女性,年龄18~22岁;②身体健康;③除体育课外,无规律体育锻炼习惯;④体质量指数(BMI) > 24 kg/m2;⑤同意参与试验并签署知情同意书。排除标准:①心血管疾病、肝病、肾病等慢性疾病患者;②近期有服用药物者;③不能完成全程运动干预者。共纳入16名受试者。
1.2 研究方法 1.2.1 形态学指标在入组后干预前进行形态学指标测试,完成8周HIIT干预后24 h进行第2次测试,早晨空腹测试。采用身高仪器测试身高,生物电阻抗身体成分分析仪(InBody 270)测试体质量,以及骨骼肌、脂肪占比等,计算BMI和腰臀比。
1.2.2 Beep test方法Beep test是评价心肺机能的一种负荷方法[29]。受试者在相隔20 m的两条线之间进行由慢到快的往返跑,节奏完全由音乐节拍器控制,在听到音乐带中“笛”样哨音指令后开始向对面跑,到达后停止,等待下一声哨音。初始跑速为8.5 km/h,每过1 min节奏加快一级(stage),速度增加0.5 km/h。受试者跑步速度逐渐加快,连续3次不能在规定时间内按要求踏上或踏过端线,或感到无法坚持运动时停止测试,通过受试者完成的水平评价最大耗氧量(VO2max)。
1.2.3 尿液预处理分别在运动方案实施前和完成运动方案后24 h取晨尿,-80 ℃保存。对收集的每例尿液进行预处理:尿液37 ℃解冻20 min,3 000 g(4 ℃)离心10 min,取上清液100 μL加甲醇400 μL沉淀蛋白,涡旋1 min后冰上孵化10 min,14 000 g(4 ℃)离心15 min,取上清液300 μL,0.22 μm微孔过滤,加入取样瓶,-80 ℃保存待测。待全部尿液收集处理完成后,对每例尿样逐一进行测试。
1.2.4 尿代谢组学测试(1)仪器性能及实验条件。色谱仪器为岛津LC⁃30A。色谱柱为ACQUITY UPLC BEH C18(1.7 μm,2.1 mm×100 mm);柱温为40 ℃;流速为0.3 mL/min;进样量为1 μL;流动相采用乙腈-0.1%甲酸水,二元梯度洗脱,流动相A为0.1%甲酸水溶液,流动相B为乙腈溶液,洗脱流程见表 1。
| 表 1 流动相梯度洗脱程序 Table 1 Gradient elution of mobile phase |
(2)质谱条件。质谱仪器为AB Sciex Triple TOF 5600+,使用电喷雾离子源(ESI),辅气和碰撞气为高纯氮气(99.99%),分辨率为35 000(FWHM)。每例样品分别采用正离子和负离子2种模式获取质谱信息,一级质谱母离子扫描范围为50~1 000 Da,同时进行二级质谱扫描,子离子扫描范围为50~1 000 Da。
(3)数据预处理与分析。UPLC⁃QTOS所得数据通过MarkerView v1.2.1(AB SCIEX)软件预处理,将处理后的变量矩阵导入SIMCA⁃P 14.1软件进行无监督的主要成分分析(PCA)和有监督的正交化偏最小二乘判别分析(OPLS⁃DA),通过OPLS⁃DA模型找到组间区分贡献最大的主成分。利用排列实验和CV⁃ANOVA方法对模型的有效性进行进一步验证,如果随机排列后模型的R2Y值和Q2值都小于模型值表示实际模型有效,CV⁃ANOVA所得P < 0.05表明模型建立成功,组间差异具有统计学显著性。依据OPLS⁃DA模型分析得出变量重要投影值(variable importance in projection,VIP),以VIP > 1.5为标准筛选运动前后区分显著性水平的代谢标志物,结合t检验,将VIP > 1.5且P < 0.05者视为运动前后具有明显差异的代谢标志物。依据不同的加合离子模式结合监测到差异物对应的质荷比(m/z)在HMDB数据库中搜索,m/z值偏差在5×10-6以内,将初步筛选处理的化合物结合MEDTLIN和HMDB等数据库提供的二级离子质谱碎片进行进一步验证,最终确定代谢物。
1.3 干预方案受试者在Beep test测试过程中通过Polar表记录最大心率,推算心率储备(heart rate reserve,HRR)[30]。通过HRR监控各受试者的运动强度。对受试者进行8周HIIT干预,每周4~5次,每次包括35%~40% HRR强度的准备活动,共5 min,然后执行10~15组间歇训练,高强度为75%~80% HRR持续1 min,间歇强度为35%~40% HRR持续1 min,执行完成后进行5 min(35%~40% HRR)整理活动。负荷监控:通过Polar表的实时心率指导训练强度。训练期间通过健康教育规范受试者的生活习惯。不能完成总量的75%者视为未完成训练任务,其中2名受试者未完成训练任务。通过24 h回顾法对受试者训练期间的其中3 d进行膳食调查。
1.4 统计学方法数据统计分析采用SPSS 19.0软件完成,连续变量采用均数±标准差(x±s)表示,用平均偏差(mean deviation,MD)和95%置信区间(95% CI)反映运动前后差异程度,组间比较采用t检验方法进行检验,P < 0.05为差异具有统计学意义。
2 结果 2.1 运动期间膳食情况24 h回顾法调查结果显示,受试者早、中、晚餐能量占比分别为(33.4±3.7)%、(34.3±6.7)%、(32.3±8.0)%,蛋白质、脂肪、糖摄入能量比例分别为(15.5±3.1)%、(20.6±3.2)%、(63.9±4.3)%,可见经健康教育规范营养结构后,受试者三餐能量比例和三大供能物质能量摄入比例均符合中国居民膳食营养素参考摄入量[31]。
2.2 形态机能情况由表 2可知,8周HIIT后超重/肥胖女大学生体质量和BMI均无显著变化,骨骼肌占体质量百分比较HIIT干预前显著提高(0.745%,P=0.016 < 0.05),脂肪占体质量百分比显著下降(-1.891%,P=0.011 < 0.05),腰臀比显著下降(0.02%,P=0.001 < 0.05),心肺机能指标VO2max显著提高(2.392 mL·kg-1·min-1,P=0.023 < 0.05),提示8周HIIT不仅可改善超重/肥胖女大学生身体成分,而且可显著提高其心肺机能。
| 表 2 HIIT前后身体形态指标和VO2max变化 Table 2 Changes of body composition and VO2max before and after HIIT |
从色谱-质谱法测得的各代谢物的m/z离子强度及其随时间变化曲线(图 1)看,设置的流动相梯度洗脱程序能较好地区分各m/z的离子,便于查找和区分代谢物,同时可观察到HIIT干预前后部分时段代谢物离子强度有区别,如负离子模式下在11~13 min区间,HIIT干预后部分代谢物离子强度显著降低,正离子模式下在26~29 min区间,HIIT干预后部分代谢物离子强度显著提高。
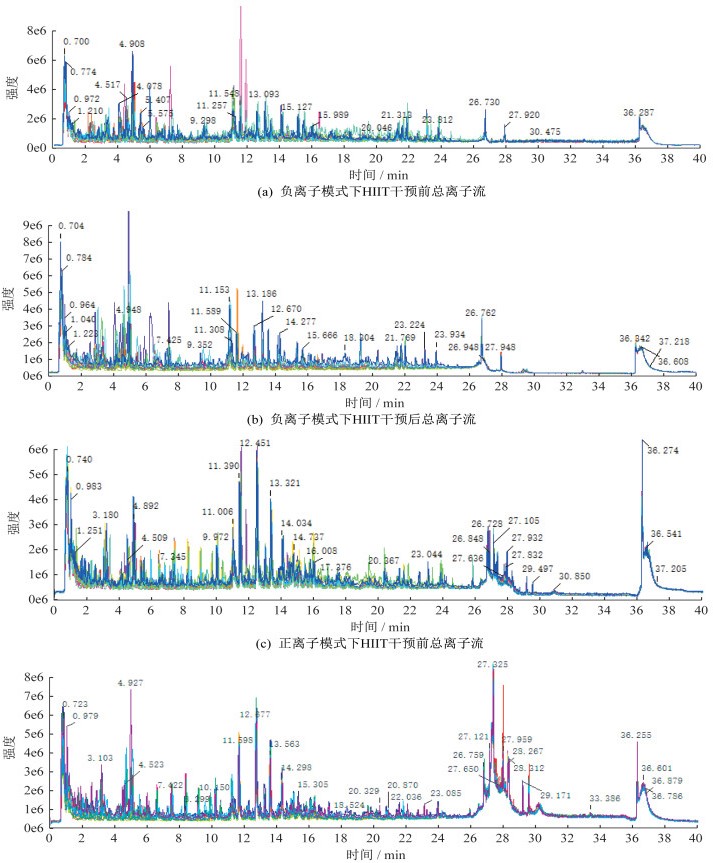
|
| 图 1 HIIT干预前后总离子流 Figure 1 Total ion flow chart before and after HIIT intervention |
所得数据通过MarkerView v1.2.1软件进行预处理,处理后的变量矩阵导入SIMCA⁃P 14.1软件进行多元统计分析。经过PCA对处理后的变量矩阵数据进行降维,去除噪声,结果显示负离子模式下HIIT干预前后主成分t[1]、t[2]和t[3]三维区分效果较好(图 2a),正离子模式下HIIT干预前后主成分t[1]、t[2]和t[3]三维区分效果较好(图 2b)。可见HIIT干预后超重/肥胖女大学生尿代谢物轮廓发生变化。为进一步在PCA模型的基础上筛选差异代谢物,采用OPLS⁃DA对数据进行分析,由OPLS⁃DA模型得分(图 2c、2d)可以看出,正、负离子模式下HIIT干预前后离子区分良好,无重叠,无交叉,正、负离子模式下OPLS⁃DA模型均具有良好的拟合度和预测能力。随机排列实验可对OPLS⁃DA模型进行有效性检验,采用SIMCA⁃P 14.1软件对数据正、负离子模式下OPLS⁃DA模型进行200次排列实验,结果显示,随机排列后的正离子和负离子模式下OPLS⁃DA模型R2Y值和Q2值均小于实际模型值(图 3),由此可推断正离子和负离子模式的实际OPLS⁃DA模型是有效的。
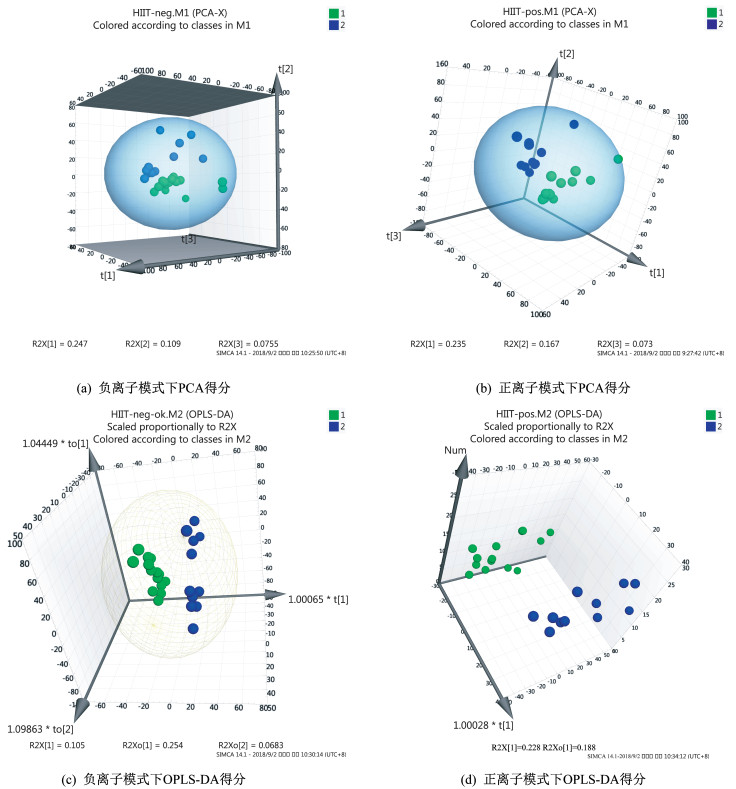
|
| 图 2 HIIT干预前后PCA和OPLS-DA得分 Figure 2 Scores of PCA and OPLS-DA before and after HIIT intervention |
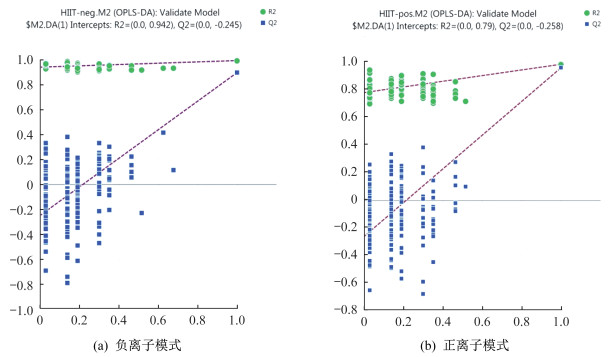
|
| 图 3 HIIT前后OPLS-DA模型排列实验结果(n=200) Figure 3 An OPLS-DA model permutation experiment before and after HIIT |
在正离子和负离子模式下OPLS⁃DA模型的基础上进行运动前后VIP和P值的计算,将VIP > 1.5且P < 0.05的代谢物作为差异代谢物。在PeakView 1.2.1软件中将潜在差异代谢物的m/z、MS/MS二级图谱与HMDB、MEDLIN等生物学数据库进行比对,最终在负离子模式下鉴定出9个代谢物,在正离子模式下鉴定出7个代谢物,结果见表 3。
| 表 3 HIIT干预前后差异代谢物特征汇总 Table 3 Summary of characteristics of differential metabolites before and after HIIT intervention |
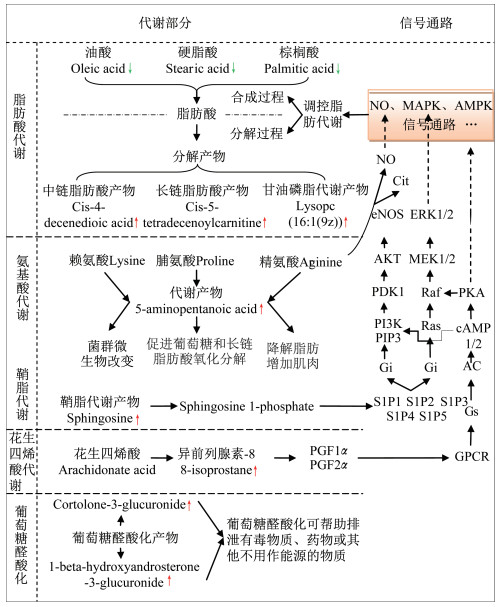
将16种差异代谢物导入MetPA(metabolic pathway analysis)系统,用相应软件(Database and MetaboAnalyst 4.0)进行代谢通路分析,结果显示,HIIT干预超重/肥胖女大学生主要涉及脂肪酸生物合成、亚油酸代谢、鞘脂代谢、线粒体脂肪酸的伸长、甘油磷脂代谢、赖氨酸降解、脂肪酸代谢、精氨酸与脯氨酸代谢等8条代谢通路变化,其中脂肪酸生物合成通路富集分析值最大,说明该通路涉及的差异代谢物最多(图 4)。脂肪酸生物合成共涉及49个化合物,本文鉴定的差异代谢物中油酸、硬脂酸和棕榈酸均属于该通路中的化合物(图 5),因此HIIT减脂机制可能与该代谢通路有较大关联。此外,鞘脂代谢的拓扑影响值最大(图 4),说明鞘脂代谢通路中合成或分解鞘氨醇的路径最多,因此,提示HIIT减脂过程中鞘脂代谢的鞘氨醇表现较为活跃。
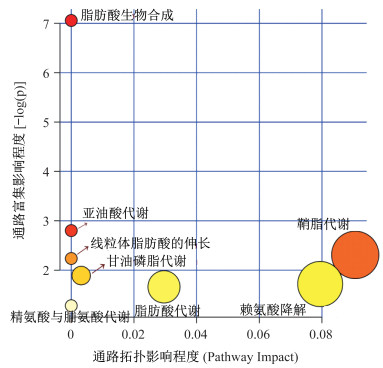
|
| 图 4 通路拓扑影响程度代谢通路分析 Figure 4 Metabolic pathway analysis 注:圆圈表示一个或一组化合物的代谢通路,圆圈颜色(从黄到红)表示代谢通路中富集分析值,颜色越红代表差异代谢物在该通路中的富集显著性越可靠;圆圈大小表示在代谢通路中拓扑分析的影响值,越大代表影响越大。 |
|
| 图 5 HIIT干预前后差异生物标志物代谢通路网络模型 Figure 5 Models of metabolic pathways of different biomarkers before and after HIIT intervention 注:↑或↓标注的代谢物为本文鉴定出的差异代谢物,分别表示HIIT干预后该代谢物离子强度上调或下调;“代谢部分”为差异代谢物相关的代谢通路,“信号通路”为代谢物通过相应的信号通路调控脂肪酸的合成与分解。 |
肥胖人群脂代谢调控能力与脂肪组织、血中游离脂肪酸(FFA)有一定联系。在正常情况下,血中FFA可被吸收入脂肪组织,肥胖人群脂肪组织含量多,吸收FFA能力有限,造成FFA“溢出”到血液循环[32],过多FFA可导致骨骼肌、肝脏和心脏中的异位脂质沉积,影响胰岛素抵抗,对机体产生不良影响[33]。FFA直接作用于各种组织中的G蛋白偶联受体(GPCR),可调节食欲、平衡能量[33-34],另外FFA的增加与脂质过度积累和炎症途径的激活有关[35],因此,肥胖人群异位脂质沉积增加导致脂代谢调控能力下降,脂质过氧化和慢性炎症增加导致其身体机能下降。
对超重/肥胖女大学生进行为期8周的HIIT干预结果显示,运动后体脂百分比显著下降,骨骼肌百分比和心肺机能显著提升,这些改善可能与运动导致的代谢物变化有关。本文采用MarkerView v1.2.1预处理后的数据,提取差异代谢物的离子强度,发现6个代谢物下调,10个代谢物上调(表 3),结合代谢物的代谢通路和细胞内信号转导情况,推导出HIIT干预后差异代谢物代谢通路网络调控模型(图 5)。其中:中链脂肪酸、长链脂肪酸和甘油磷脂的分解代谢中间产物在HIIT干预后增加,提示脂肪酸分解代谢增加;在HIIT干预后油酸、硬脂酸和棕榈酸下降,提示脂肪酸合成代谢降低。这些结果可能与HIIT干预后体脂百分比下降有关。多种途径可调控脂肪代谢:HIIT干预后鞘脂代谢中间产物鞘氨醇含量提高,鞘氨醇可被催化为鞘氨醇-1-磷酸(sphingosine-1-phosphate,S1P),通过一系列信号转导途径激活一氧化氮(NO)、丝裂原活化蛋白激酶(MAPK)信号通路,实现对脂肪代谢的调控;HIIT干预后花生四烯酸代谢中间产物异前列腺素-8在尿中增加,异前列腺素-8合成前列腺素F(PGF)的前体,而PGF可通过激活GPCR和AMPK途径实现对脂代谢的调控。另有研究[13]表明,HIIT可显著增加肾上腺素、去甲肾上腺素和生长激素,刺激脂肪分解,促进骨骼肌氧化酶的表达或活性上调,提升骨骼肌氧利用效率,减轻脂质氧化程度和慢性炎症。结果提示,8周HIIT干预超重/肥胖女大学生可通过提高其外周氧利用率、增加脂肪酸的氧化分解实现减脂目的。
3.2 脂肪酸分解与合成代谢通路脂肪酸分解作用加强是运动减脂的基础,本文结果显示,长链、中链脂肪酸和甘油磷脂分解代谢的中间产物在HIIT后增加,长链脂肪酸氧化供能在长时间运动时具有重要作用,可通过长链酰基辅酶A(CoA)合成酶在细胞质中活化至长链酰基CoA,经线粒体内外膜转位、催化生成酰基CoA,而后进入线粒体内进行β-氧化[36-37]。长链酰基CoA可被催化产生2-碳单位(Malonyl-CoA),Malonyl-CoA是线粒体生物能(ATP、NADH、FADH2)的碳底物,也可进行糖异生,是脂肪酸分解的重要途径[38]。研究[39]显示,长期运动使小鼠肌肉中Malonyl-CoA浓度下降可能是脂肪酸氧化增加的一个重要信号,但运动对人体骨骼肌组织Malonyl-CoA的水平影响不大,通过观察肉碱棕榈酰转移酶Ⅰ(CPTⅠ)对Malonyl-CoA的敏感性改变,推断运动使长链脂肪酸氧化加强[40]。本文结果显示,8周HIIT后长链脂肪酸、中链脂肪酸和甘油磷脂的部分中间代谢产物增加,推测HIIT干预后脂肪酸氧化分解增加,使异位脂肪沉积减少,对脂代谢调控有积极作用。
脂肪酸的合成和利用与肥胖发生密不可分,从新陈代谢的灵活性看,健康机体能适当调节氧化水平以适应各种代谢物的变化是新陈代谢健康的标志[41],然而,在人类和动物肥胖模型中发现脂肪酸运输或氧化过程存在一定缺陷[42-43]。其中,过氧化物酶体增殖激活受体α(PPARα)在脂肪酸氧化中扮演重要角色[44]。肥胖、胰岛素抵抗者在高脂饮食后,其骨骼肌PPARα无法上调,使骨骼肌利用脂肪酸能力下降[45];另外,PPARα的下调可通过激活脂酰辅酶A氧化酶(AOX)和细胞色素P450 4A(CYP4A)促进脂肪合成,导致脂肪堆积[46]。本文结果显示,油酸、硬脂酸和棕榈酸在HIIT干预后下降,提示HIIT干预可使脂肪酸合成降低,有利于减脂。运动可通过激活AMPK影响PPARα途径,对能量代谢进行调控[47-48],AMPK对细胞能量状态敏感[44],当运动和能量缺乏(AMP/ATP比率增加)时AMPK途径被激活[49],调节多种代谢过程[50],如:AMPK/PPARα途径可介导PGC⁃1基因表达,使线粒体数量和功能增加,促进脂肪酸氧化分解过程,抑制脂肪酸合成过程[51-52]。本文结果显示,HIIT可降低油酸、硬脂酸和棕榈酸合成,这可能是导致体脂下降的重要因素。
3.3 鞘脂代谢与S1P鞘脂水解产物S1P参与胰岛素抵抗和慢性炎症发展[53-54],并与肥胖发生和代谢紊乱有关[55]。本文结果显示,8周HIIT对鞘氨醇有影响,鞘氨醇磷酸化的产物S1P是重要的代谢调控因子,大约65%的S1P与血浆脂蛋白结合,50%与高密度脂蛋白有关,其余部分与白蛋白结合。在哺乳动物中循环血浓度高于细胞间液浓度[56],但循环血S1P水平似乎对代谢状态的变化很敏感,如禁食、肥胖、运动、糖尿病等对血浆S1P的变化都有影响。
在本文中,超重/肥胖女大学生经过8周HIIT干预后,尿鞘氨醇升高,可能与运动后循环血中脂质通量增加引起血浆中S1P浓度升高有关[57];红细胞神经酰胺水平降低,使红细胞释放S1P入血,也可引起血浆S1P浓度升高[58]。另外,有研究发现S1P可激活大鼠原代脂肪细胞的脂解作用[59],也可通过激活S1P受体参与巨噬细胞的抗炎作用[60]。S1P在病理应激环境下具有改善细胞存活的作用,较高的血浆S1P可能通过S1P受体信号转导调控肝脏、胰腺β细胞和骨骼肌等组织功能,使组织减少脂质积累、对抗凋亡途径[61]。血浆S1P浓度的增加可能是运动改善心血管健康和胰岛素敏感性的机制之一[58]。从这一角度看,HIIT对健康的收益与鞘氨醇代谢提高有关。
但也有报道显示,高血浆S1P不利于健康,如肥胖小鼠血浆中S1P增加[62],S1P可影响胰岛素受体的磷酸化[63],在人血浆中S1P水平与空腹胰岛素、HOMA⁃IR、HbA1c、总胆固醇和低密度脂蛋白胆固醇、BMI、腰围和体脂百分比等心血管功能障碍临床指标呈正相关[64]。S1P导致PAI⁃1、TNF⁃α、IL⁃6和趋化因子基因表达增加,对脂肪细胞有促炎、促血栓作用,在肥胖介导的心血管和代谢疾病的发病机制中可能起主要作用[62],这些研究预示高血浆S1P对健康产生不利影响。可见,S1P在肥胖和代谢功能障碍中的作用非常复杂,学者推断肥胖患者血浆S1P水平的升高也可能是裂解酶降解S1P下降所致,S1P清除率的降低也可能是肥胖患者循环S1P增加的原因[64]。因此,很难确定S1P的增加对肥胖症的形成有益还是有害。鞘脂代谢的协调以及S1P产生和清除途径的平衡是保持内稳态的基石。本文结果显示,HIIT干预后尿鞘氨醇浓度增加,推测运动可调节鞘脂代谢,提升S1P清除率,促进机体机能提高。运动影响鞘脂在血液和细胞中代谢的作用机制尚需深入研究。
3.4 花生四烯酸花生四烯酸(arachidonate acid)是人体必需的一种脂肪酸,是合成前列腺素的前体,而前列腺素对脂质代谢、血管弹性、免疫反应和血小板激活等具有重要的调节作用。本文结果显示,运动后尿液异前列腺素-8水平高于运动前。异前列腺素-8是由自由基催化花生四烯酸过氧化生成的类前列腺素类化合物,主要分布于细胞膜的磷脂结构域和循环血中的脂蛋白,一旦被磷脂酶裂解,就会释放到细胞外,并从尿液中排出。根据药物动力学和代谢研究结果,异前列腺素-8在人体内的半衰期约为16 min[65]。在氧化应激增加的条件下,血浆和尿液异前列腺素-8水平升高,可反映抗氧化不足和氧化应激[66]。异前列腺素具有较低的日变异性,已被用作健康受试者氧化应激的可靠生物标志物[65]。研究显示,肥胖成年人的异前列腺素浓度明显升高[65],向心性肥胖人群异前列腺素-8水平升高与肥胖独立相关[67]。
有关运动对异前列腺素影响的研究结果报道不一。未经训练、久坐、血脂异常的非胰岛素依赖型糖尿病患者进行8周的小强度训练(HR < 100次/min,或55%~65%VO2max)后,尿液异前列腺素无显著变化[68]。对超重者进行为期12个月的小强度训练后异前列腺素水平有所降低[69]。也有研究结果显示,一次急性运动后16 h,异前列腺素水平较运动前增加[54],对受试者进行2周70%~85% HRmax强度运动后异前列腺素水平较运动前增加[70],对成年男性2型糖尿病患者进行为期8周的高于通气阈运动(30 min),运动后异前列腺素水平较运动前增加[71]。总体而言,小强度运动后异前列腺素有下降趋势[72],急性运动和中大强度运动后异前列腺素水平升高[70-71, 73]。本文结果显示,8周HIIT后尿液异前列腺素-8升高,与前人[70-71, 73]研究结果一致,这一升高并不能表示运动后机体抗氧化能力下降,因为异前列腺素-8变化不仅与抗氧化系统有关,还与应激状况、饮食结构、生活方式等有关[74],高强度运动肌肉收缩以及应激激素的分泌可能是引起异前列腺素-8运动后升高的原因。
3.5 氨基酸代谢通路与葡萄糖醛酸化5-aminopentanoic acid是肠道菌群的代谢产物[75],肠道菌群的变化是肥胖发生的重要机制之一[76],而运动可通过调整肠道菌群改善肥胖[77]。本文发现,对超重/肥胖女大学生进行8周HIIT干预后,其体内5-aminopentanoic acid发生变化,推断HIIT提高身体机能、降低脂肪百分比可能与肠道菌群代谢有关。
5-aminopentanoic acid也是赖氨酸、脯氨酸、精氨酸代谢的中间产物。脯氨酸可促进脂肪酸氧化,精氨酸可使肌肉合成增加,这些功能与本文显示的降脂和增肌结果相吻合。另外,精氨酸是内皮型一氧化氮合酶(eNOS)/NO通路的重要物质基础,eNOS由2个还原结构域组成,参与氧化还原反应的还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)、黄素单核苷酸(FMN)、黄素腺嘌呤二核苷酸(FAD)和一些氧化酶在结构域上有其结合位点,eNOS也参与氧化还原反应的调控,NO是其催化产物,参与心血管构建,与心血管功能密切相关[78]。本文结果显示,以精氨酸为物质基础的eNOS/NO信号通路可能参与HIIT干预后的脂代谢调控和心血管构建,并与VO2max的提升有联系。
葡萄糖醛酸化过程可帮助机体排泄有毒物质、药物或其他不能用作能源的物质,重度肥胖对葡萄糖醛酸化有影响[79]。本文发现,对超重/肥胖女大学生进行8周HIIT干预后,葡萄糖醛酸化的产物cortolone-3-glucuronide和11-beta-hydroxyandrosterone-3-glucuronide显著提高,提示HIIT可增加超重/肥胖女大学生体内一些有害物质的排泄,对肝肾功能有保护作用,对代谢所需的内环境起稳定作用。
4 结论超重/肥胖女大学生进行8周HIIT可有效减脂和提升身体机能。本文分析鉴定的16种差异代谢物可能与减脂机制有关。HIIT引起尿中葡萄糖醛酸化代谢物增加,有利于机体代谢废物和毒素的排出,为脂代谢提供良好的内环境,而HIIT引起的赖氨酸、脯氨酸、精氨酸和鞘氨醇的部分代谢产物变化可能参与脂肪酸的代谢调控,使受试者干预后脂肪酸分解过程加强,油酸、硬脂酸和棕榈酸合成量降低,可能是HIIT减脂的重要途径之一。
作者贡献声明:
苏利强:提出论文选题,设计论文框架,搜集统计数据,撰写论文;
陈海春:提出论文选题,调研文献,核实数据,修改论文;
温岱宗:审核、指导修改论文;
袁恩:测试指标,核实数据;
周立分:测试指标,核实数据。
| [1] |
FRÖHLICH A. Ein fall von tumor der hypophysis cerebri ohne akromegalie[J].
Wein Klinical Rund, 1901, 15: 883-886 (  0) 0)
|
| [2] |
STELLAR E. The physiology of motivation[J].
Psychological Review, 1954, 61(1): 5-22 (  0) 0)
|
| [3] |
ZHANG Y, PROENCA R, MAFFEI M, et al. Positional cloning of the mouse obese gene and its human homologue[J].
Nature, 1994, 372(6505): 425-432 DOI:10.1038/372425a0 (  0) 0)
|
| [4] |
SCHERER P E, WILLIAMS S, FOGLIANO M, et al. A novel serum protein similar to C1q, produced exclusively in adipocytes[J].
The Journal of Biological Chemistry, 1995, 270(45): 26746-26749 DOI:10.1074/jbc.270.45.26746 (  0) 0)
|
| [5] |
TIMMONS J A, BAAR K, DAVIDSEN P K, et al. Is irisin a human exercise gene?[J].
Nature, 2012, 488(7413): E9-E10 DOI:10.1038/nature11364 (  0) 0)
|
| [6] |
YAMAGUCHI S, YOSHINO J. Adipose tissue NAD+ biology in obesity and insulin resistance:From mechanism to therapy[J].
BioEssays, 2017, 39(5): 1600227 DOI:10.1002/bies.201600227 (  0) 0)
|
| [7] |
KIM O K, JUN W, LEE J. Mechanism of ER stress and inflammation for hepatic insulin resistance in obesity[J].
Annals of Nutrition & Metabolism, 2015, 67(4): 218-227 (  0) 0)
|
| [8] |
ARAB SADEGHABADI Z, NOURBAKHSH M, PASALAR P, et al. Reduced gene expression of sirtuins and active AMPK levels in children and adolescents with obesity and insulin resistance[J].
Obesity Research & Clinical Practice, 2018, 12(2): 167-173 (  0) 0)
|
| [9] |
TANAKA M, ITOH M, OGAWA Y, et al. Molecular mechanism of obesity-induced 'metabolic' tissue remodeling[J].
Journal of Diabetes Investigation, 2018, 9(2): 256-261 (  0) 0)
|
| [10] |
WU G, LI H, ZHOU M, et al. Mechanism and clinical evidence of lipocalin-2 and adipocyte fatty acid-binding protein linking obesity and atherosclerosis[J].
Diabetes/Metabolism Research and Reviews, 2014, 30(6): 447-456 DOI:10.1002/dmrr.2493 (  0) 0)
|
| [11] |
BLAIR S N, BRODNEY S. Effects of physical inactivity and obesity on morbidity and mortality:Current evidence and research issues[J].
Medicine and Science in Sports and Exercise, 1999, 31(11 Suppl): S646-S662 (  0) 0)
|
| [12] |
BABRAJ J A, VOLLAARD N B, KEAST C, et al. Extremely short duration high intensity interval training substantially improves insulin action in young healthy males[J].
BMC Endocrine Disorders, 2009, 9: 3 DOI:10.1186/1472-6823-9-3 (  0) 0)
|
| [13] |
SU L, FU J, SUN S, et al. Effects of HⅡT and MICT on cardiovascular risk factors in adults with overweight and/or obesity:A meta-analysis[J].
PLoS One, 2019, 14(1): e0210644 DOI:10.1371/journal.pone.0210644 (  0) 0)
|
| [14] |
TERADA T, FRIESEN A, CHAHAL B S, et al. Feasibility and preliminary efficacy of high intensity interval training in type 2 diabetes[J].
Diabetes Research and Clinical Practice, 2013, 99(2): 120-129 DOI:10.1016/j.diabres.2012.10.019 (  0) 0)
|
| [15] |
WESTON K S, WISLOFF U, COOMBES J S. High-intensity interval training in patients with lifestyle-induced cardiometabolic disease:A systematic review and meta-analysis[J].
British Journal of Sports Medicine, 2014, 48(16): 1227-1234 DOI:10.1136/bjsports-2013-092576 (  0) 0)
|
| [16] |
施曼莉, 朱荣. 高强度间歇运动对骨骼肌糖原含量的影响及机制研究[J].
体育科学, 2015, 35(4): 66-71 (  0) 0)
|
| [17] |
TENORIO T R S, BALAGOPAL P B, ANDERSEN L B, et al. Effect of low-versus high-intensity exercise training on biomarkers of inflammation and endothelial dysfunction in adolescents with obesity:A 6-month randomized exercise intervention study[J].
Pediatric Exercise Science, 2018, 30(1): 96-105 DOI:10.1123/pes.2017-0067 (  0) 0)
|
| [18] |
COL N, DEMIRCIOGLU-KILIC B, NACAK M, et al. Adolescent obesity and the role of the fat mass and obesity-associated gene polymorphism[J].
Clinical and Investigative Medicine, 2017, 40(6): E235-E242 DOI:10.25011/cim.v40i6.29124 (  0) 0)
|
| [19] |
EATON M, GRANATA C, BARRY J, et al. Impact of a single bout of high-intensity interval exercise and short-term interval training on interleukin-6, FNDC5, and METRNL mRNA expression in human skeletal muscle[J].
Journal of Sport and Health Science, 2018, 7(2): 191-196 (  0) 0)
|
| [20] |
贾伟.
医学代谢组学[M]. 上海: 上海科学技术出版社, 2011: 6-7.
(  0) 0)
|
| [21] |
HU X, SHEN J, PU X, et al. Urinary time- or dose-dependent metabolic biomarkers of aristolochic acid-induced nephrotoxicity in rats[J].
Toxicological Sciences, 2017, 156(1): 123-132 (  0) 0)
|
| [22] |
NICHOLSON J K, TIMBRELL J A, SADLER P J. Proton NMR spectra of urine as indicators of renal damage.Mercury-induced nephrotoxicity in rats[J].
Molecular Pharmacology, 1985, 27(6): 644-651 (  0) 0)
|
| [23] |
DUGAS L R, CHORELL E, PLANGE-RHULE J, et al. Obesity-related metabolite profiles of black women spanning the epidemiologic transition[J].
Metabolomics, 2016, 12(3): 45 DOI:10.1007/s11306-016-0960-6 (  0) 0)
|
| [24] |
ROMO-HUALDE A, HUERTA A E, GONZÁLEZ-NAVARRO C J, et al. Untargeted metabolomic on urine samples after α-lipoic acid and/or eicosapentaenoic acid supplementation in healthy overweight/obese women[J].
Lipids in Health and Disease, 2018, 17(1): 103 DOI:10.1186/s12944-018-0750-4 (  0) 0)
|
| [25] |
KIM J Y, PARK J Y, KIM O Y, et al. Metabolic profiling of plasma in overweight/obese and lean men using ultra performance liquid chromatography and Q-TOF mass spectrometry (UPLC-Q-TOF MS)[J].
Journal of Proteome Research, 2010, 9(9): 4368-4375 DOI:10.1021/pr100101p (  0) 0)
|
| [26] |
WU X, ZHU J C, ZHANG Y, et al. Lipidomics study of plasma phospholipid metabolism in early type 2 diabetes rats with ancient prescription Huang-Qi-San intervention by UPLC/Q-TOF-MS and correlation coefficient[J].
Chemico-Biological Interactions, 2016, 256: 71-84 DOI:10.1016/j.cbi.2016.06.025 (  0) 0)
|
| [27] |
ZHAO G, HOU X, LI X, et al. Metabolomics analysis of alloxan-induced diabetes in mice using UPLC-Q-TOF-MS after Crassostrea gigas polysaccharide treatment[J].
International Journal of Biological Macromolecules, 2018, 108: 550-557 DOI:10.1016/j.ijbiomac.2017.12.057 (  0) 0)
|
| [28] |
KHAN I, NAM M, KWON M, et al. LC/MS-based polar metabolite profiling identified unique biomarker signatures for cervical cancer and cervical intraepithelial neoplasia using global and targeted metabolomics[J].
Cancers, 2019, 11(4): 511 DOI:10.3390/cancers11040511 (  0) 0)
|
| [29] |
CAVAR M, MARSIC T, CORLUKA M, et al. Effects of 6 weeks of different high-intensity interval and moderate continuous training on aerobic and anaerobic performance[J].
Journal of Strength and Conditioning Research, 2019, 33(1): 44-56 (  0) 0)
|
| [30] |
FERGUSON B. ACSM's guidelines for exercise testing and prescription 9th ed. 2014[J].
The Journal of the Canadian Chiropractic Association, 2014, 58(3): 328 (  0) 0)
|
| [31] |
程义勇. 《中国居民膳食营养素参考摄入量》2013修订版简介[J].
营养学报, 2014, 36(4): 313-317 (  0) 0)
|
| [32] |
BICKERTON A S, ROBERTS R, FIELDING B A, et al. Preferential uptake of dietary fatty acids in adipose tissue and muscle in the postprandial period[J].
Diabetes, 2007, 56(1): 168-176 (  0) 0)
|
| [33] |
VINK R G, ROUMANS N J, VAN DER KOLK B W, et al. Adipose tissue meal-derived fatty acid uptake before and after diet-induced weight loss in adults with overweight and obesity[J].
Obesity(Silver Spring), 2017, 25(8): 1391-1399 (  0) 0)
|
| [34] |
ICHIMURA A, HIRASAWA A, HARA T, et al. Free fatty acid receptors act as nutrient sensors to regulate energy homeostasis[J].
Prostaglandins & Other Lipid Mediators, 2009, 89(3-4): 82-88 (  0) 0)
|
| [35] |
VAITTINEN M, MANNISTO V, KAKELA P, et al. Interorgan cross talk between fatty acid metabolism, tissue inflammation, and FADS2 genotype in humans with obesity[J].
Obesity(Silver Spring), 2017, 25(3): 545-552 (  0) 0)
|
| [36] |
HOUTEN S M, WANDERS R J. A general introduction to the biochemistry of mitochondrial fatty acid beta-oxidation[J].
Journal of Inherited Metabolic Disease, 2010, 33(5): 469-477 DOI:10.1007/s10545-010-9061-2 (  0) 0)
|
| [37] |
RUPASINGHE H P, SEKHON-LOODU S, MANTSO T, et al. Phytochemicals in regulating fatty acid beta-oxidation:Potential underlying mechanisms and their involvement in obesity and weight loss[J].
Pharmacology Therapeutics, 2016, 165: 153-163 DOI:10.1016/j.pharmthera.2016.06.005 (  0) 0)
|
| [38] |
LEE J, CHOI J, SELEN ALPERGIN E S, et al. Loss of hepatic mitochondrial long-chain fatty acid oxidation confers resistance to diet-induced obesity and glucose intolerance[J].
Cell Reports, 2017, 20(3): 655-667 DOI:10.1016/j.celrep.2017.06.080 (  0) 0)
|
| [39] |
WINDER W W, AROGYASAMI J, ELAYAN I M, et al. Time course of exercise-induced decline in malonyl-CoA in different muscle types[J].
The American Journal of Physiology, 1990, 259(2 Pt 1): E266-E271 (  0) 0)
|
| [40] |
HOLLOWAY G P, BEZAIRE V, HEIGENHAUSER G J F, et al. Mitochondrial long chain fatty acid oxidation, fatty acid translocase/CD36 content and carnitine palmitoyltransferase Ⅰ activity in human skeletal muscle during aerobic exercise[J].
The Journal of Physiology, 2006, 571(Pt 1): 201-210 (  0) 0)
|
| [41] |
KELLEY D E. Skeletal muscle fat oxidation:Timing and flexibility are everything[J].
J Clin Invest, 2005, 115(7): 1699-1702 DOI:10.1172/JCI25758 (  0) 0)
|
| [42] |
BOYLE K E, ZHENG D, ANDERSON E J, et al. Mitochondrial lipid oxidation is impaired in cultured myotubes from obese humans[J].
International Journal of Obesity, 2012, 36(8): 1025-1031 DOI:10.1038/ijo.2011.201 (  0) 0)
|
| [43] |
SEILER S E, MARTIN O J, NOLAND R C, et al. Obesity and lipid stress inhibit carnitine acetyltransferase activity[J].
Journal of Lipid Research, 2014, 55(4): 635-644 DOI:10.1194/jlr.M043448 (  0) 0)
|
| [44] |
BOYLE K E, FRIEDMAN J E, JANSSEN R C, et al. Metabolic inflexibility with obesity and the effects of fenofibrate on skeletal muscle fatty acid oxidation[J].
Hormone and Metabolic Research, 2017, 49(1): 50-57 (  0) 0)
|
| [45] |
BOYLE K E, CANHAM J P, CONSITT L A, et al. A high-fat diet elicits differential responses in genes coordinating oxidative metabolism in skeletal muscle of lean and obese individuals[J].
The Journal of Clinical Endocrinology and Metabolism, 2011, 96(3): 775-781 DOI:10.1210/jc.2010-2253 (  0) 0)
|
| [46] |
HARDWICK J P, OSEI-HYIAMAN D, WILAND H, et al. PPAR/RXR regulation of fatty acid metabolism and fatty acid omega-hydroxylase(CYP4) isozymes:Implications for prevention of lipotoxicity in fatty liver disease[J].
PPAR Research, 2009, 2009: 952734 (  0) 0)
|
| [47] |
BUENO JUNIOR C R, PANTALEÃO L C, VOLTARELLI V A, et al. Combined effect of AMPK/PPAR agonists and exercise training in mdx mice functional performance[J].
PLoS One, 2012, 7(9): e45699 DOI:10.1371/journal.pone.0045699 (  0) 0)
|
| [48] |
SANTOS M H H, HIGUCHI M D L, TUCCI P J F, et al. Previous exercise training increases levels of PPAR-α in long-term post-myocardial infarction in rats, which is correlated with better inflammatory response[J].
Clinics(Sao Paulo), 2016, 71(3): 163-168 (  0) 0)
|
| [49] |
O'NEILL H M. AMPK and exercise:Glucose uptake and insulin sensitivity[J].
Diabetes & Metabolism Journal, 2013, 37(1): 1-21 (  0) 0)
|
| [50] |
LEE-YOUNG R S, GRIFFEE S R, LYNES S E, et al. Skeletal muscle AMP-activated protein kinase is essential for the metabolic response to exercise in vivo[J].
The Journal of Biological Chemistry, 2009, 284(36): 23925-23934 DOI:10.1074/jbc.M109.021048 (  0) 0)
|
| [51] |
VAVVAS D, APAZIDIS A, SAHA A K, et al. Contraction-induced changes in acetyl-CoA carboxylase and 5'-AMP-activated kinase in skeletal muscle[J].
The Journal of Biological Chemistry, 1997, 272(20): 13255-13261 DOI:10.1074/jbc.272.20.13255 (  0) 0)
|
| [52] |
TERADA S, GOTO M, KATO M, et al. Effects of low-intensity prolonged exercise on PGC-1 mRNA expression in rat epitrochlearis muscle[J].
Biochemical and Biophysical Research Communications, 2002, 296(2): 350-354 DOI:10.1016/S0006-291X(02)00881-1 (  0) 0)
|
| [53] |
HLA T, DANNENBERG A J. Sphingolipid signaling in metabolic disorders[J].
Cell Metabolism, 2012, 16(4): 420-434 DOI:10.1016/j.cmet.2012.06.017 (  0) 0)
|
| [54] |
BOON J, HOY A J, STARK R, et al. Ceramides contained in LDL are elevated in type 2 diabetes and promote inflammation and skeletal muscle insulin resistance[J].
Diabetes, 2013, 62(2): 401-410 (  0) 0)
|
| [55] |
FUCHO R, CASALS N, SERRA D, et al. Ceramides and mitochondrial fatty acid oxidation in obesity[J].
FASEB Journal, 2017, 31(4): 1263-1272 DOI:10.1096/fj.201601156R (  0) 0)
|
| [56] |
HAMMAD S M, AL GADBAN M M, SEMLER A J, et al. Sphingosine 1-phosphate distribution in human plasma:Associations with lipid profiles[J].
Journal of Lipids, 2012, 2012: 180705 (  0) 0)
|
| [57] |
HOROWITZ J F, KLEIN S. Lipid metabolism during endurance exercise[J].
The American Journal of Clinical Nutrition, 2000, 72(2 Suppl): 558S-563S (  0) 0)
|
| [58] |
BARANOWSKI M, CHARMAS M, DLUGOLECKA B, et al. Exercise increases plasma levels of sphingoid base-1 phosphates in humans[J].
Acta Physiologica(Oxford), 2011, 203(3): 373-380 DOI:10.1111/j.1748-1716.2011.02322.x (  0) 0)
|
| [59] |
JUN D J, LEE J H, CHOI B H, et al. Sphingosine-1-phosphate modulates both lipolysis and leptin production in differentiated rat white adipocytes[J].
Endocrinology, 2006, 147(12): 5835-5844 DOI:10.1210/en.2006-0579 (  0) 0)
|
| [60] |
HUGHES J E, SRINIVASAN S, LYNCH K R, et al. Sphingosine-1-phosphate induces an antiinflammatory phenotype in macrophages[J].
Circulation Research, 2008, 102(8): 950-958 DOI:10.1161/CIRCRESAHA.107.170779 (  0) 0)
|
| [61] |
BRUCE C R, RISIS S, BABB J R, et al. The sphingosine-1-phosphate analog FTY720 reduces muscle ceramide content and improves glucose tolerance in high fat-fed male mice[J].
Endocrinology, 2013, 154(1): 65-76 DOI:10.1210/en.2012-1847 (  0) 0)
|
| [62] |
SAMAD F, HESTER K D, YANG G, et al. Altered adipose and plasma sphingolipid metabolism in obesity:A potential mechanism for cardiovascular and metabolic risk[J].
Diabetes, 2006, 55(9): 2579-2587 DOI:10.2337/db06-0330 (  0) 0)
|
| [63] |
RAPIZZI E, TADDEI M L, FIASCHI T, et al. Sphingosine 1-phosphate increases glucose uptake through trans-activation of insulin receptor[J].
Cellular and Molecular Life Sciences, 2009, 66(19): 3207-3218 DOI:10.1007/s00018-009-0106-3 (  0) 0)
|
| [64] |
ANDREWS Z, KOWALSKI G M, CAREY A L, et al. Plasma sphingosine-1-phosphate is elevated in obesity[J].
PLoS One, 2013, 8(9): e72449 DOI:10.1371/journal.pone.0072449 (  0) 0)
|
| [65] |
TRAN V, TINDULA G, HUEN K, et al. Prenatal phthalate exposure and 8-isoprostane among Mexican-American children with high prevalence of obesity[J].
Journal of Developmental Origins of Health and Disease, 2017, 8(2): 196-205 DOI:10.1017/S2040174416000763 (  0) 0)
|
| [66] |
LEE S G, WANG T, VANCE T M, et al. Validation of analytical methods for plasma total antioxidant capacity by comparing with urinary 8-isoprostane level[J].
Journal of Microbiology and Biotechnology, 2017, 27(2): 388-394 (  0) 0)
|
| [67] |
COSTABILE G, DELLA PEPA G, BOZZETTO L, et al. Urine 8-isoprostane in relation to adiposity and insulin resistance in individuals at high cardiometabolic risk[J].
Metabolic Syndrome and Related Disords, 2015, 13(4): 187-191 DOI:10.1089/met.2014.0119 (  0) 0)
|
| [68] |
MORI T A, DUNSTAN D W, BURKE V, et al. Effect of dietary fish and exercise training on urinary F2-isoprostane excretion in non-insulin-dependent diabetic patients[J].
Metabolism:Clinical and Experimental, 1999, 48(11): 1402-1408 DOI:10.1016/S0026-0495(99)90150-6 (  0) 0)
|
| [69] |
DUGGAN C, TAPSOBA J D, WANG C Y, et al. Dietary weight loss, exercise, and oxidative stress in postmenopausal women:A randomized controlled trial[J].
Cancer Prevention Research(Philadelphia), 2016, 9(11): 835-843 DOI:10.1158/1940-6207.CAPR-16-0163 (  0) 0)
|
| [70] |
DONE A J, TRAUSTADOTTIR T. Aerobic exercise increases resistance to oxidative stress in sedentary older middle-aged adults.A pilot study[J].
Age(Dordrecht), 2016, 38(5-6): 505-512 (  0) 0)
|
| [71] |
FAYH A P T, BORGES K, CUNHA G S, et al. Effects of n-3 fatty acids and exercise on oxidative stress parameters in type 2 diabetic:A randomized clinical trial[J].
Journal of the International Society of Sports Nutrition, 2018, 15: 18 DOI:10.1186/s12970-018-0222-2 (  0) 0)
|
| [72] |
NIKOLAIDIS M G, KYPAROS A, VRABAS I S. F(2)-isoprostane formation, measurement and interpretation:The role of exercise[J].
Progress in Lipid Research, 2011, 50(1): 89-103 DOI:10.1016/j.plipres.2010.10.002 (  0) 0)
|
| [73] |
NORDIN T C, DONE A J, TRAUSTADOTTIR T. Acute exercise increases resistance to oxidative stress in young but not older adults[J].
Age(Dordrecht), 2014, 36(6): 9727 (  0) 0)
|
| [74] |
VAN'T ERVE T J. Strategies to decrease oxidative stress biomarker levels in human medical conditions:A meta-analysis on 8-iso-prostaglandin F2α[J].
Redox Biology, 2018, 17: 284-296 DOI:10.1016/j.redox.2018.05.003 (  0) 0)
|
| [75] |
SYRJANEN S, PⅡRONEN P, MARKKANEN H. Free amino-acid content of wax-stimulated human whole saliva as related to periodontal disease[J].
Archives of Oral Biology, 1987, 32(9): 607-610 DOI:10.1016/0003-9969(87)90032-X (  0) 0)
|
| [76] |
KOLIADA A, SYZENKO G, MOSEIKO V, et al. Association between body mass index and Firmicutes/Bacteroidetes ratio in an adult Ukrainian population[J].
BMC Microbiology, 2017, 17(1): 120 DOI:10.1186/s12866-017-1027-1 (  0) 0)
|
| [77] |
DENOU E, MARCINKO K, SURETTE M G, et al. High-intensity exercise training increases the diversity and metabolic capacity of the mouse distal gut microbiota during diet-induced obesity[J].
American Journal of Physiology, Endocrinology and Metabolism, 2016, 310(11): E982-E993 DOI:10.1152/ajpendo.00537.2015 (  0) 0)
|
| [78] |
QIAN J, FULTON D. Post-translational regulation of endothelial nitric oxide synthase in vascular endothelium[J].
Frontiers in Physiology, 2013, 4: 347 (  0) 0)
|
| [79] |
LLORET-LINARES C, LUO H, ROUQUETTE A, et al. The effect of morbid obesity on morphine glucuronidation[J].
Pharmacological Research, 2017, 118: 64-70 DOI:10.1016/j.phrs.2016.08.031 (  0) 0)
|
 2020, Vol. 44
2020, Vol. 44


