2. 福建师范大学 运动机能评定重点实验室,福建 福州 350017
2. Key Laboratory of Motor Function Evaluation, Fujian Normal University, Fuzhou 350017, Fujian, China
糖尿病诱导的血管病变是导致糖尿病致残、致死的主要原因。研究[1]表明, 炎症参与了2型糖尿病及血管并发症的发病过程, 2型糖尿病属于慢性炎症性疾病。糖尿病诱导的血管炎症受到多种因素影响, 包括高血糖、胰岛素抵抗、脂质代谢紊乱和氧化应激等, 其中高血糖和氧化应激能够直接激活NF-κB炎症信号通路, 诱导炎症基因的表达。因此, 降低血管氧化应激程度, 抑制炎症信号对缓解糖尿病血管并发症具有重要意义。目前对糖尿病的治疗还没有比较完善的方法, 临床治疗主要以控制血糖为主, 二甲双胍是治疗2型糖尿病常用的双胍类药物。糖尿病并发症不仅与血糖水平有关, 而且还受到遗传、年龄、糖尿病病程和其他心血管风险因素的影响。除了临床干预外, 生活方式的改善, 尤其是科学的运动锻炼已被认为是预防和治疗2型糖尿病的推荐方法。规律性有氧运动可以降低机体慢性炎症, 对心血管具有保护作用[2], 但其作用机制还并不清楚。本文拟通过对2型糖尿病大鼠进行8周有氧运动和二甲双胍干预, 评价有氧运动、二甲双胍和两者联合治疗对2型糖尿病大鼠血管炎症的影响, 并初步探讨其影响机制。
1 研究方法 1.1 实验动物6周龄清洁级雄性SD大鼠45只[吴氏实验动物中心提供, 合格证号SCXK(闽)2012-0001], 体质量200~250 g, 分笼饲养, 自由进食饮水。室温控制在22~24 ℃, 湿度在50%~70%, 昼夜循环。适应性喂养1周后, 随机选取6只作为正常组, 并以普通饲料喂养, 其余39只为糖尿病组, 采取高脂饲料喂养(15%蔗糖, 15%猪油, 5%蛋黄粉, 0.2%胆酸钠, 64.8%基础饲料)。4周喂养后, 大鼠禁食12 h, 高脂饮食组大鼠腹腔注射链脲佐菌素(STZ, 溶于0.1 mol/L柠檬酸缓冲液), 注射剂量为30 mg/kg, 正常组同时腹腔注射相同容量的柠檬酸缓冲液。注射后注意观察大鼠的摄食、饮水和排尿变化。STZ注射后第3、7、14天进行血糖监测, 最终空腹血糖值大于11.1 mmol/L的SD大鼠, 确定为2型糖尿病。
1.2 研究设计 1.2.1 实验分组正常对照组(Con)6只。糖尿病模型组分为4组:糖尿病对照组(DM)7只; 糖尿病二甲双胍干预组(DM+Met)7只, 给予喂食二甲双胍药物; 糖尿病运动干预组(DM+Exe)9只, 进行有氧运动干预; 糖尿病药物运动干预组(DM+Exe+Met)9只, 同时进行有氧运动和二甲双胍干预。干预时间为8周。
1.2.2 给药方法二甲双胍的喂食剂量与方法参考已有研究[3-4]。将药物溶入饮水瓶中, 第1周剂量为150 mg.(kg·d)-1, 第2周为300 mg.(kg·d)-1, 第3周调整为400 mg.(kg·d)-1, 该剂量一直保持到实验结束, 每日监控大鼠饮水量, 每周根据体质量变化调整一次药物剂量。
1.2.3 运动方案运动采用游泳方式。正式运动干预前, 先进行1周适应性游泳训练, 第1次游泳时间为15 min, 之后逐次增加10 min, 共5次。正式干预为1 h/d, 5d/周, 共8周。第1~4周无负重游泳, 第5~8周为1%体质量负荷。游泳池为圆形塑料桶, 尺寸为60 cm(直径)×75 cm(高), 水深45~50 cm, 水温控制在32~35 ℃, 每桶容纳3只大鼠同时游泳。游泳过程中, 时刻监控大鼠游泳状况, 防止大鼠溺水淹死。
1.2.4 样本制备最后1次运动结束后24 h处死, 处死前12 h禁食。血液标本以4 ℃, 3 500 r.m-1离心10 min, 取上清液, -20 ℃保存。迅速剥离主动脉放入冷冻管中, -80 ℃保存待用。
1.3 指标检测 1.3.1 血糖检测大鼠禁食12 h, 尾部采血, 使用血糖仪和血糖试纸(罗氏卓越血糖仪及配套试纸)测定大鼠血糖浓度。
1.3.2 血清样本检测总胆固醇(TC)、甘油三酯(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)和总抗氧化能力(T-AOC)采用相应试剂盒检测(南京建成生物工程研究所), 胰岛素(Insulin)、白介素-1β(IL-1β)、白介素-10(IL-10)、单核细胞趋化蛋白-1(MCP-1)、肿瘤坏死因子-α(TNF-α)和血管细胞黏附分子-1(VCAM-1)采用ELISA检测法测定(南京建成生物工程研究所提供), 以上指标检测均按照试剂盒说明书进行操作。
1.3.3 血管SOD活性和MDA浓度检测先将主动脉按1:9比例加入生理盐水、研磨, 制作10%组织匀浆液, 然后采用BCA法测量组织匀浆液的蛋白浓度(江苏碧云天生物技术研究所提供), 最后按照SOD和MDA检测试剂盒说明书进行操作(南京建成生物工程研究所提供), 并根据计算公式计算出组织匀浆液SOD活性和MDA浓度。
1.3.4 聚丙烯酰胺凝胶电泳(Western Blotting)将主动脉混合裂解液放入预冷的玻璃匀浆器中进行研磨, 提取主动脉总蛋白, 并采用BCA法检测蛋白浓度。95 ℃加热变性, -80 ℃保存备用。制备分离胶和浓缩胶, 将蛋白样品加入到上样孔中, 打开电源, 直到溴酚蓝到达电泳槽底部。电泳完成后, 取下凝胶, 转膜1.5 h。转膜后5%脱脂奶粉封闭1 h, 一抗NF-κBp65、IκBα、GAPDH 4 ℃孵育过夜(Abcam, 美国), 洗膜, 二抗室温孵育1 h, 洗膜。ECL化学发光显色、拍照, 并进行蛋白条带灰度检测。
1.3.5 荧光定量PCR采用Trizol法提取主动脉总RNA, 并测定RNA浓度。使用Revertaid First Strand cDNA Synthesis Kit(Thermo fisher, 美国)和SYBR Premix Ex TaqTM Ⅱ(Takara, 日本)试剂盒进行反转录和qPCR反应。引物序列:NF-κBp65:forward:5’-AGAGAAGC ACAGATACCACTAAGA-3’, reverse:5’-GTTCAGCCTCATAGAAGCCATC-3’; IκBα:forward:5’-CGAGCATTCTATTGTGGTGATTCA-3’, reverse:5’-CTACAGTCTATGGCGGTTCAAC-3’; VCAM-1:forward:5’-GTGAAGGAGTGAATCTGGTTGG-3’, reverse:5’-TCAGCGTCAGTGTGGATGTA-3’; GAPDH:forward:5’-ACGGCAAGTTCAACGGCACAG-3’, reverse:GAAGACGCCAGTAGACTCCACGAC-3’。
1.4 数据统计运用SPSS 19.0统计软件, 数据采用平均数±标准误表示, 组间差异分析采用单因素方差分析(one-way ANOVA), P<0.05为具有显著性差异。
2 研究结果 2.1 有氧运动和二甲双胍对大鼠糖脂代谢的影响从8周有氧运动和二甲双胍干预后大鼠糖脂代谢的基本指标可见, DM组大鼠TC和TG明显高于Con组。8周干预后, DM+Exe组和DM+Exe+Met组大鼠的糖脂代谢指标出现了不同程度的下降, 但均无统计学意义(P>0.05)。DM组HDL-C水平显著低于正常组(P<0.05), 干预组大鼠HDL-C和LDL-C出现了一定程度的缓解状态。在血糖代谢方面, DM组空腹血糖(FBG)、空腹胰岛素(FINS)显著高于Con组(P<0.01), 胰岛素敏感指数(ISI)较低, DM+Met组和DM+Exe+Met组大鼠FBG下降幅度较为显著, DM+Exe组虽然血糖低于糖尿病对照组, 但无统计学差异。3种干预方式均显著改善了糖尿病大鼠胰岛素水平, 其中DM+Exe+Met组在增加胰岛素敏感性上的效果更加突出(表 1)。
| 表 1 大鼠糖脂代谢指标(X-±SEM) Table 1 Indicators of glycolipid metabolism in rats |
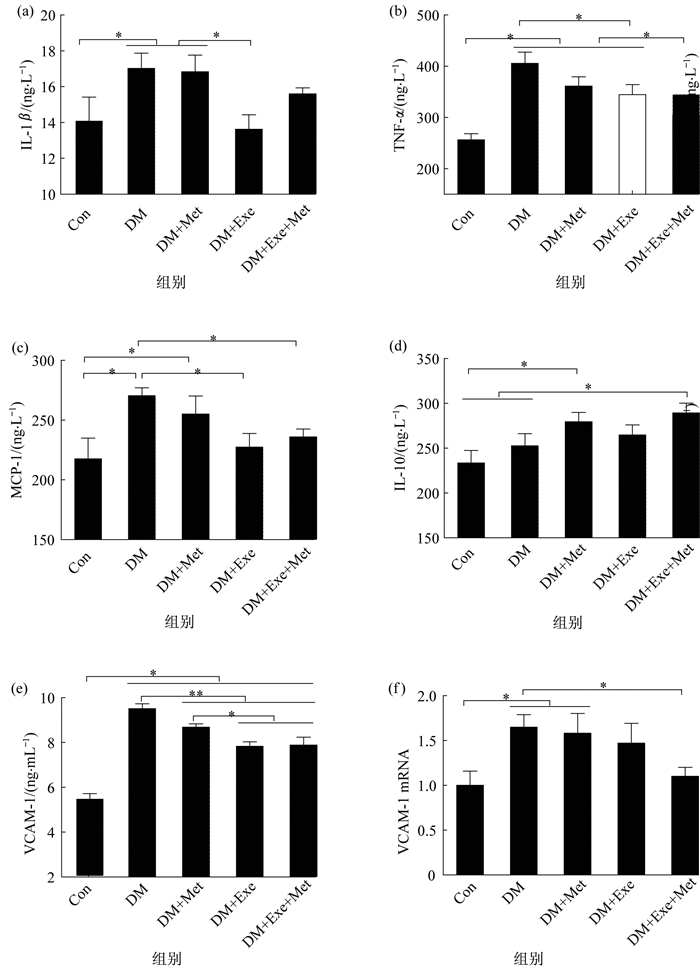
8周干预后对大鼠血清炎症指标及主动脉细胞黏附因子mRNA表达进行了检测(图 1)。从图 1可见, DM组血清IL-1β、TNF-α、MCP-1和VCAM-1浓度均显著高于正常组(P<0.01)。从干预结果看, 干预组糖尿病大鼠IL-1β、TNF-α、MCP-1和VCAM-1都有下降的趋势, 但变化程度各不相同。DM+Met组降低幅度较小, DM+Exe组IL-1β、TNF-α、MCP-1和VCAM-1水平显著低于DM组(P<0.05), DM+Exe+Met组血清TNF-α浓度显著低于DM组、DM+Met组和DM+Exe组(P<0.05), MCP-1浓度显著低于DM组(P<0.05)。Con组和DM组血清IL-10浓度较低, DM+Met组和DM+Exe+Met组血清IL-10浓度显著高于正常对照组(P<0.05), 其中DM+Exe+Met组显著高于DM组(P<0.05)。在主动脉VCAM-1基因转录水平上, DM组VCAM-1mRNA表达水平显著高于正常对照组, 其中, DM组和DM+Met组与NC组相比, 具有统计学差异(P<0.05), 而DM+Met+Exe组VCAM-1mRNA表达水平显著低于DM组(P<0.05), DM组、DM+Exe组和DM+Met组之间无明显差异。
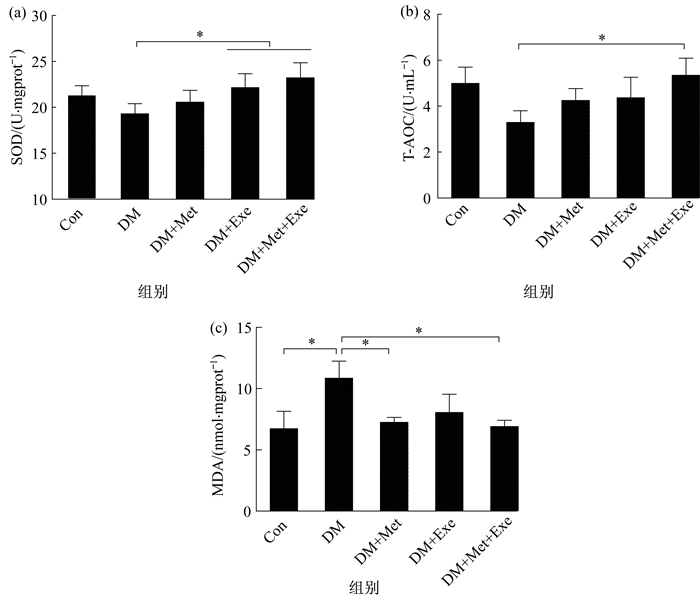
2.3 有氧运动和二甲双胍对2型糖尿病大鼠血管氧化应激指标的影响8周有氧运动和二甲双胍干预后, 对大鼠氧化应激相关指标进行了检测, 包括血管组织SOD活性和MDA浓度以及血清总抗氧化能力(T-AOC)(图 2)。从图 2可见, DM组大鼠SOD和T-AOC水平最低, 其中, DM+Exe组和DM+Exe+Met组大鼠血管组织SOD活性显著高于DM组(P<0.05), 在血清T-AOC上, 仅DM+Exe+Met组大鼠与DM组相比, 具有统计意义(P<0.05)。MDA反应了脂质过氧化及细胞损伤状况, 从图 2可见, DM组大鼠血管组织MDA浓度显著高于Con组, 有氧运动和二甲双胍干预组大鼠血管组织MDA浓度均低于DM组, 其中DM+Met组和DM+Exe+Met组大鼠MDA浓度与DM组相比, 具有统计学差异(P<0.05)。
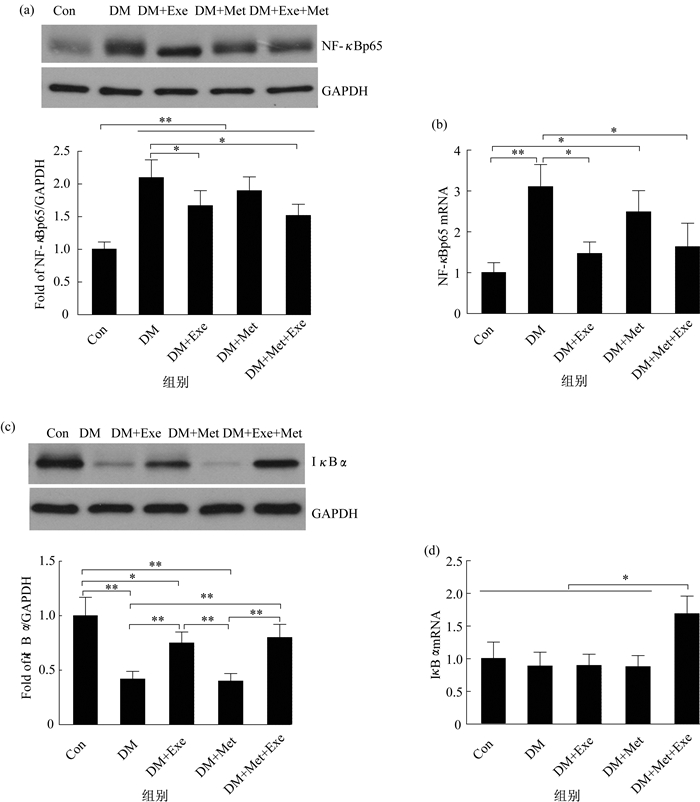
2.4 有氧运动和二甲双胍对2型糖尿病大鼠血管NF-κBp65和IκB蛋白及mRNA表达的影响NF-κBp65与抑制剂IκB在生理状态下以失活状态结合在细胞质中, 当细胞受到刺激时, IκB被降解, NF-κBp65与IκB分离并转位至细胞核中激活炎症靶基因。本文从NF-κBp65与IκBα蛋白和mRNA的表达变化来反应NF-κB信号的激活状态(图 3)。从图 3可见, DM组大鼠血管NF-κBp65蛋白表达量都显著高于正常组, 8周有氧运动和二甲双胍干预后, 干预组NF-κBp65蛋白表达都低于DM组, 其中DM+Exe组、DM+Exe+Met组与DM组相比, 具有显著性差异(P<0.05)。NF-κBp65mRNA表达与蛋白表达表现出类似的变化趋势, DM+Exe组和DM+Exe+Met组大鼠NF-κBp65mRNA表达水平显著低于DM组(P<0.05)。
|
图 1 大鼠血清炎症因子及主动脉细胞黏附因子mRNA表达的变化 Figure 1 Changes of serum inflammatory factors and mRNA expression of aortic cell adhesion factor in rats 注:n=(6~9)/group, *表示P<0.05, **表示P<0.01, 图 2同此 |
Con组大鼠血管组织IκBα蛋白表达最高, 并显著高于DM组、DM+Met组和DM+Exe组(P<0.01, P<0.05)。8周干预后, DM+Exe组和DM+Exe+Met组IκBα蛋白表达著高于DM组和DM+Met组(P<0.01)。在IκBα mRNA表达上, DM+Exe+Met组表达显著高于其他组(P<0.05), 除DM+Exe+Met组之外, 其他各组大鼠血管组织IκBα mRNA表达无显著差异。
3 分析与讨论 3.1 有氧运动和二甲双胍对2型糖尿病大鼠血管炎症标志物的影响长期高血糖诱导的氧化应激损伤血管内皮细胞, 并激活炎症信号通路, 促使血管发生炎症反应。炎症因子由多种组织细胞分泌并释放到循环血液中, 因此, 循环血液中炎症因子浓度并不能反映特异性组织的炎症状态, 但血管是储存和运输血液的主要器官, 血管腔内的内皮细胞不断受到循环血液的刺激, 可认为循环血液中炎症因子浓度在一定程度上反映血管的炎症状态。本文选取了促炎因子、趋化因子、细胞黏附分子、抗炎因子4种类型细胞因子以及主动脉细胞黏附分子基因表达反映血管炎症。促炎因子IL-1β和TNF-α主要由单核巨噬细胞分泌, 能够激活内皮细胞炎症信号通路, 促使下游炎症因子和细胞黏附分子的释放, 形成炎症反应的正反馈循环。MCP-l是由单核巨噬细胞、脂肪细胞、内皮细胞等细胞分泌, 主要功能是趋化单核细胞和T淋巴细胞, 诱导单核细胞、内皮细胞表达黏附分子, 诱导炎症细胞向血管炎症部位迁移[5]。细胞黏附分子VCAM-1特异表达于血管组织, 其主要功能是促进白细胞和血管内皮细胞的黏附, 在血管炎症反应和血管平滑肌增生中发挥重要作用[6]。许多研究[7-9]将VCAM-1作为血管炎症的重要指标。VCAM-1通常以可溶形式存在于血液中, 血清中VCAM-1浓度可反映血管VCAM-1的表达量[10]。抗炎因子IL-10是由免疫和非免疫细胞分泌的一种抗炎因子, 主要生物功能是抑制炎症因子的产生, 对单核细胞黏附内皮细胞具有抗炎作用[11]。
|
图 2 有氧运动与二甲双胍对大鼠SOD、T-AOC和MDA影响 Figure 2 Effects of aerobic exercise and metformin on SOD, T-AOC and MDA in rats |
近年来研究显示, 二甲双胍不仅具有降血糖功能, 同时还具有抗炎作用[12]。本文结果显示, 二甲双胍虽然能够降低IL-1β, TNF-α、MCP-1和VCAM-1水平, 但影响幅度相对较小, 近期的研究也显示了类似的结果[3]。有氧运动与联合干预可以不同程度地降低血清IL-1β、TNF-α、MCP-1和VCMA-1水平, 说明有氧运动与联合干预可以改善血管炎症, 但对不同炎症因子的影响不同。之前的研究显示, 长期规律性运动可以降低血清IL-1β、TNF-α和MCP-1水平, 缓解机体炎症[13-14]。从本文数据看, 运动组血清IL-1β浓度明显降低, 而联合干预组浓度虽然有所下降, 但无统计学差异, 这可能是由于二甲双胍通过某种途径限制了运动效应, 但其机制并不清楚。此外, 有氧运动与联合干预均可以显著降低血清TNF-α、MCP-1和VCAM-1浓度, 说明有氧运动和二甲双胍对降低糖尿病大鼠血清炎症标志物具有一定的作用。
虽然发现了运动能够缓解机体炎症这一作用特征, 但其作用机制还并不清楚。研究[15]认为, 运动具有抗炎效应, 骨骼肌细胞分泌的IL-6具有抗炎作用, 能够抑制TNF-α和IL-1β分泌, 同时还能促进抗炎因子如IL-10和IL-1ra的分泌。本文对IL-10进行了检测, 发现二甲双胍和运动联合干预能够显著提高糖尿病大鼠IL-10的浓度, 说明二甲双胍和运动联合干预具有直接抗炎作用。Babbitt等[16]对高血压人群进行6个月的有氧运动干预后发现, 有氧运动可增加IL-10浓度, 但无显著性差异, 这与本文结果相似。此外, 该研究还发现最大摄氧量变化可以预测IL-10浓度的变化, 认为心肺耐力改善与血清IL-10浓度的增加有关。
|
图 3 有氧运动和二甲双胍对大鼠主动脉NF-κB信号影响 Figure 3 Effects of aerobic exercise and metformin on NF-κB Signal in rat aorta 注:n=6/group, (a)为NF-κBp65蛋白表达, (b)为NF-κBp65 mRNA表达, (c)为IκBα蛋白表达, (d)为IκBαmRNA表达 |
高血糖、胰岛素抵抗、脂质代谢紊乱等因素均可能诱导血管炎症的发生。本文数据显示, 二甲双胍、有氧运动及联合治疗均可改善2型糖尿病大鼠血糖, 但二甲双胍和联合干预组与有氧运动组相比在控制血糖方面具有更加明显的优势。二甲双胍主要是通过降低肝脏糖异生作用, 抑制肠系膜细胞吸收, 维持血糖平衡[17]。运动可以通过增加骨骼肌对血糖的吸收降低血糖[18]。数据还显示了联合干预在改善糖尿病大鼠胰岛素敏感性上要优于单纯药物和运动的治疗效果, 这说明二甲双胍和运动在改善胰岛素敏感性上可能存在协同效应, 这与之前的研究结果一致[4, 19]。运动能够通过影响胰岛素信号转导通路逆转胰岛素抵抗的发生, 改善胰岛素敏感性[20], 二甲双胍可能是通过激活骨骼肌AMPK信号来增加外周胰岛素敏感性[21]。由此可见, 有氧运动和二甲双胍可能部分通过降低血糖和胰岛素改善糖尿病大鼠血管炎症。
3.3 有氧运动和二甲双胍对2型糖尿病大鼠血管氧化应激的影响氧化应激在许多疾病的发病机制中发挥重要作用。糖尿病状态下高血糖和脂质代谢紊乱能够引起氧化应激信号通路的激活, 诱导机体产生过多的ROS, 损伤血管内皮细胞, 并通过激活NF-κB炎症信号, 诱导炎症基因如MCP-1, ICAM-1和VCAM-1的表达[22-23]。氧化应激不仅参与了糖尿病的发病过程, 也构成了糖尿病并发症的发病机制[24]。因此, 降低氧化应激对减轻血管内皮损伤, 缓解血管炎症起到重要作用。
本文数据显示了8周有氧运动与联合干预能够明显缓解糖尿病大鼠血管氧化应激。之前研究[12]显示, 二甲双胍具有抗氧化功能。虽然在本文中, 单纯给予二甲双胍处理并不能显著降低糖尿病大鼠血管氧化应激, 但仍可看出二甲双胍的抗氧化作用。大量研究[25-27]表明, 长期运动可以提高机体抗氧化功能, 但其机制并不清楚。近年来, 有研究报道[28]规律性长期运动能够激活啮齿类动物多种组织细胞抗氧化转录因子Nrf2信号及其下游抗氧化基因的表达, 认为Nrf2信号在运动抗氧化效应中发挥重要作用。内皮细胞Nrf2是血流切应力敏感性转录因子[29], 运动诱导的血流切应力可能是激活内皮Nrf2信号的原因之一。有氧运动、二甲双胍和联合干预能够减轻糖尿病大鼠血管氧化应激, 同时对血管炎症又能起到一定的疗效作用。基于此, 可以推测有氧运动和二甲双胍有可能通过降低氧化应激缓解糖尿病大鼠血管炎症。
3.4 有氧运动和二甲双胍对2型糖尿病大鼠主动脉NF-κB信号的影响核转录因子NF-κB介导的信号传导是炎症反应中最重要的信号通路。该信号参与细胞炎症反应, 促进凝血和促炎基因的表达, 在动脉粥样硬化和糖尿病血管并发症中发挥关键的作用。在生理状态下, NF-κB亚基p65与抑制剂IκB以失活状态结合在细胞质中, 当细胞受到促炎因子如TNF-α、IL-1β或ROS等刺激时, 细胞内IKK信号被激活, 导致IκB磷酸化, 并被蛋白酶降解, 细胞质内p65脱离IκB, 并转位至细胞核, 激活下游特定靶基因如TNF-α、VCAM-1、MCP-1、IL-1β等的表达[30]。高糖和脂质诱导的血管内皮NF-κB信号通路激活, 能够增加局部炎症反应, 损伤内皮细胞功能, 促进内皮细胞凋亡[31]。
本文显示, 糖尿病对照组主动脉NF-κBp65表达水平显著高于正常对照组, 但仅通过NF-κBp65还不能判断该炎症信号通路的激活。因此, 对NF-κBp65抑制剂IκBα进行了检测, 发现糖尿病对照组IκBα蛋白表达量明显低于正常组, 说明糖尿病对照组大鼠血管细胞NF-κBp65可能已经脱离IκB转位至细胞核。同时, 数据显示了糖尿病对照组已表现出较高的IL-1β、TNF-α、MCP-1和VCAM-1浓度水平, 而这些细胞因子又受到NF-κB信号的调控, 可以推测, 糖尿病可能通过激活NF-κB信号促进下游炎症因子的表达。IL-1β和TNF-α的增加可以继续激活NF-κB信号, 形成正反馈循环, 进一步加重炎症反应[32]。8周有氧运动和联合干预能够明显下调NF-κBp65蛋白和mRNA表达水平, 上调IκBα蛋白表达, 同时有氧运动和联合干预组血清IL-1β、TNF-α、MCP-1和VCAM-1浓度明显低于糖尿病对照组, 说明有氧运动和联合干预可能通过抑制NF-κB信号来减轻血管炎症。单纯二甲双胍处理并不能影响NF-κB信号。虽然研究表明二甲双胍具有抗炎作用, 但是否通过NF-κB信号达到抗炎作用还存在争议[33-34]。有研究[35]显示, 8周游泳干预能够明显降低动脉粥样衰老大鼠动脉NF-κB信号以及TNF-α和VCAM-1蛋白表达。还有研究[36]显示, 运动可以通过降低TLR4, 抑制内皮细胞NF-κB信号的激活, 减少黏附分子的表达, 与本文结果相似。因此可以认为, 有氧运动及联合干预可能部分通过抑制血管NF-κB信号及下游IL-1β、TNF-α、MCP-1和VCAM-1等炎症因子表达, 缓解糖尿病大鼠血管炎症。
4 结论有氧运动和二甲双胍均能降低2型糖尿病大鼠血管炎症, 其中有氧运动和联合干预对血管炎症的治疗效果优于二甲双胍干预。有氧运动和二甲双胍可能通过改善2型糖尿病大鼠血糖代谢, 降低血管氧化应激缓解血管炎症。有氧运动与二甲双胍可能部分通过抑制血管NF-κB信号缓解2型糖尿病大鼠的血管炎症。
| [1] |
DONATH M Y, SHOELSON S E. Type 2 diabetes as an inflammatory disease[J].
Nat Rev Immunol, 2011, 11(2): 98-107 DOI:10.1038/nri2925 (  0) 0)
|
| [2] |
GOLBIDI S, LAHER I. Exercise and the aging endothelium[J].
Journal of Diabetes Research, 2013(22): 1-12 (  0) 0)
|
| [3] |
JENKINS N T, PADILLA J, ARTURO A, et al. Arce-Esquivel Effects of endurance exercise training, metformin, and their combination on adipose tissue leptin and IL-10 secretion in OLETF rats[J].
J Appl Physiol, 2012, 113(12): 1873-83 DOI:10.1152/japplphysiol.00936.2012 (  0) 0)
|
| [4] |
LINDEN M A, FLETCHER J A, MORRIS E M, et al. Combining metformin and aerobic exercise training in the treatment of type 2 diabetes and NAFLD in OLETF rats[J].
Am J Physiol Endocrinol Metab, 2013, 306(3): 300-310 (  0) 0)
|
| [5] |
夏婷婷.MCP-1等炎症因子在胰岛素抵抗促进动脉粥样硬化发展中关系的研究[D].沈阳: 中国医科大学, 2007: 6-7
(  0) 0)
|
| [6] |
穆伟.动脉粥样硬化中血管细胞黏附分子-1的表达和基因干预研究[D].济南: 山东大学, 2015: 15-17
(  0) 0)
|
| [7] |
HOPKINS P N. Molecular biology of atherosclerosis[J].
Physiological Reviews, 2013, 93(3): 1317-1542 DOI:10.1152/physrev.00004.2012 (  0) 0)
|
| [8] |
LI W P, ZHAO W W, WU Q, et al. Puerarin improves diabetic aorta injury by inhibiting NADPH oxidase-derived oxidative stress in STZ-induced diabetic rats[J].
Journal of Diabetes Research, 2016: 1-9 (  0) 0)
|
| [9] |
吴爵非.携VCAM-1单抗磁性靶向微泡评价动脉粥样硬化斑块早期炎症[D].广州: 南方医科大学, 2011: 1-2
(  0) 0)
|
| [10] |
张婧.sVCAM-1在COPD患者检测中的临床意义[D].大连: 大连医科大学, 2014: 27-29
(  0) 0)
|
| [11] |
SIKKA G, MILLER K L, STEPPAN J, et al. Interleukin 10 knockout frail mice develop cardiac and vascular dysfunction with increased age[J].
Experimental Gerontology, 2013, 48(2): 128-135 DOI:10.1016/j.exger.2012.11.001 (  0) 0)
|
| [12] |
MONTALVO M A, MERCKEN E M, MITCHELL S J, et al. Metformin improves healthspan and lifespan in mice[J].
Nature Communications, 2013, 4(7): 375-381 (  0) 0)
|
| [13] |
PLAISANCE EP, GRANDJEAN PW. Physical activity and high sensitivity C-reactive protein[J].
Sports Medicine, 2006, 36(5): 443-458 DOI:10.2165/00007256-200636050-00006 (  0) 0)
|
| [14] |
TEIXEIRA D L E, PINTO R, OLIVEIRA J, et al. Differential effects of acute(extenuating) and chronic(training) exercise on inflammation and oxidative stress status in an animal model of type 2 diabetes mellitus[J].
Mediators of Inflammation, 2011(1): 1-8 (  0) 0)
|
| [15] |
PEDERSEN B K, FEBBRAIO M A. Muscles, exercise and obesity:skeletal muscle as a secretory organ[J].
Nat Rev Endocrinology, 2012, 8(8): 457-465 DOI:10.1038/nrendo.2012.49 (  0) 0)
|
| [16] |
BABBITT D M, DIAZ K M, FEAIRHELLER D L, et al. Endothelial activation microparticles and inflammation status improve with exercise training in african americans[J].
International Journal of Hypertension, 2013: 1-8 (  0) 0)
|
| [17] |
PHIELIX E, SZENDROEDI J, RODEN M. The role of metformin and thiazolidinediones in the regulation of hepatic glucose metabolism and its clinical impact[J].
Trends Pharmacol Sci, 2011, 32(10): 607-616 DOI:10.1016/j.tips.2011.06.006 (  0) 0)
|
| [18] |
HANSEN M, PALSØE M K, JØRN W, et al. The effect of metformin on glucose homeostasis during moderate exercise[J].
Diabetes Care, 2015, 38(2): 293-301 DOI:10.2337/dc14-1480 (  0) 0)
|
| [19] |
SMITH A C, MULLEN K L, JUNKIN K A, et al. Metformin and exercise reduce muscle FAT/CD36 and lipid accumulation and blunt the progression of high-fat diet-induced hyperglycemia[J].
Am J Physiol Endocrinol Metab, 2007, 293(1): 172-181 DOI:10.1152/ajpendo.00677.2006 (  0) 0)
|
| [20] |
米春娟, 任维, 高峰. 运动改善心血管胰岛素敏感性及其信号转导机制[J].
生理科学进展, 2012, 43(4): 306-309 DOI:10.3969/j.issn.0559-7765.2012.04.016 (  0) 0)
|
| [21] |
NATALI A, FERRANNINI E. Effects of metformin and thiazolidinediones on suppression of hepatic glucose production and stimulation of glucose uptake in type 2 diabetes:a systematic review[J].
Diabetologia, 2006, 49(3): 434-441 DOI:10.1007/s00125-006-0141-7 (  0) 0)
|
| [22] |
MADAMANCHI N R, RUNGE M S. Mitochondrial dysfunction in atherosclerosis[J].
Circ Res, 2007, 100(4): 460-473 DOI:10.1161/01.RES.0000258450.44413.96 (  0) 0)
|
| [23] |
SUNG F L, ZHU T Y, AU-YEUNG K K, et al. Enhanced MCP-1 expression during ischemia/reperfusion injury is mediated by oxidative stress and NF-kappaB[J].
Kidney Int, 2002, 62(4): 1160-1170 DOI:10.1111/j.1523-1755.2002.kid577.x (  0) 0)
|
| [24] |
张小勇.NADPH氧化酶在高糖引起的血管内皮细胞损伤中的作用机理研究[D].北京: 北京协和医学院, 2008: 94-98
(  0) 0)
|
| [25] |
KUMAR R, NEGI P S, SINGH B, et al. Cordyceps sinensis promotes exercise endurance capacity of rats by activating skeletal muscle metabolic regulators[J].
Journal of Ethnopharmacol, 2011, 136(1): 260-266 DOI:10.1016/j.jep.2011.04.040 (  0) 0)
|
| [26] |
JR A A, DUZZIONI M, REMOR A P, et al. Moderate-intensity physical exercise protects against experimental 6-hydroxydopamine-induced hemiparkinsonism through Nrf2-antioxidant response element pathway[J].
Neurochemical Research, 2016, 41(1-2): 64-72 DOI:10.1007/s11064-015-1709-8 (  0) 0)
|
| [27] |
JIANG H K, MIAO Y, WANG Y H, et al. Aerobic interval training protects against myocardial infarction-induced oxidative injury by enhancing antioxidase system and mitochondrial biosynthesis[J].
Clin Exp Pharmacol Physiol, 2014, 41(3): 192-201 DOI:10.1111/1440-1681.12211 (  0) 0)
|
| [28] |
DONE A J, TRAUSTADÍTTIR T. Nrf2 mediates redox adaptations to exercise[J].
Redox Biology, 2016, 10: 191-199 DOI:10.1016/j.redox.2016.10.003 (  0) 0)
|
| [29] |
MCSWEENEY S R, WARABI E, SIOW R C. Nrf2 as an endothelial mechanosensitive transcription factor:going with the flow[J].
Hypertension, 2015, 67(1): 20-29 (  0) 0)
|
| [30] |
PENG L, PAN X, YIN G Q. Natural hirudin increases rat flap viability by anti-inflammation via PARs/p38/NF-κB pathway[J].
BioMed Research International, 2015, 2015(12): 1-7 (  0) 0)
|
| [31] |
ZHAI H, CHEN Q J, GAO X M, et al. Inhibition of the NF-κB pathway by R65 ribozyme gene via adeno-associatedvirus serotype 9 ameliorated oxidized LDL induced human umbilical vein endothelial cell injury[J].
Int J Clin Exp Pathol, 2015, 8(9): 9912-9921 (  0) 0)
|
| [32] |
LAWRENCE T, GILROY D W. Chronic inflammation:A failure of resolution?[J].
Int J Exp Path, 2007, 88(2): 85-94 (  0) 0)
|
| [33] |
KIM H G, HIEN T T, HAN E H, et al. Metformin inhibits P-glycoprotein expression via the NF-κB pathway and CRE transcriptional activity through AMPK activation[J].
Br J Pharmacol, 2011, 162(5): 1096-108 DOI:10.1111/j.1476-5381.2010.01101.x (  0) 0)
|
| [34] |
WOUDENBERGVRENKEN T E, ROSA LCDL, BUISTHOMAN M, et al. Metformin protects rat hepatocytes against bile acid-induced apoptosis[J].
PLoS One, 2013, 8(8): e71773 DOI:10.1371/journal.pone.0071773 (  0) 0)
|
| [35] |
LEE J, CHO J Y, KIM W K. Anti-inflammation effect of exercise and Korean red ginseng in aging model rats with diet-induced atherosclerosis[J].
Nutrition Research and Practice, 2014, 8(3): 284-291 (  0) 0)
|
| [36] |
FRANCESCOMARINO S D, SCIARTILLI A, VALERIO V D, et al. The effect of physical exercise on endothelial function[J].
Sports Medicine, 2009, 39(10): 797-812 DOI:10.2165/11317750-000000000-00000 (  0) 0)
|
 2019, Vol. 43
2019, Vol. 43


