2. 首都体育学院 运动科学与健康学院,北京 100191
2. School of Sport Science and Health, Capital University of Physical Education and Sports, Beijing 100191, China
骨量的维持是由骨形成与骨吸收相耦联的动态过程,一旦成骨细胞功能降低,破骨细胞功能增强,2种细胞功能失去动态平衡,即可发生骨丢失。近年来诸多研究证实,Wnt信号通路对骨重建起着重要作用[1-3],因而成为新的研究热点。Wnt/β-catenin信号通路为Wnt信号经典通路,既可以通过调节成骨细胞的分化和特异基因的表达、增强成骨细胞活性、促进骨基质的形成及矿化等环节影响成骨作用[4],也可通过影响破骨细胞的发生和骨吸收而影响破骨作用[5],实现对骨量的调控。
运动的健骨效应已得到广泛关注,中等强度有氧运动是增加骨量的有效途径[6],其作为一种有效的预防和康复手段可以有效改善骨质疏松患者骨代谢,但健骨效应的机制不甚明了。近期有研究[7]表明,14周的中等强度跑台运动可促进去卵巢大鼠腰椎(L5)Wnt3α/β-catenin信号通路激活,改善骨强度;而对股骨的作用机制如何?不同持续时间的运动对其影响效应又如何?本文拟探讨中等强度有氧运动对骨量的影响机制,为运动防治骨质疏松提供实验依据。
1 研究对象与方法 1.1 实验对象及分组3月龄雌性SD大鼠100只,体重(270±10)g,购于北京维通利华实验动物技术有限公司。大鼠的饲养、训练均于北京大学实验动物中心(SPF级实验室)进行,分笼饲养,每笼3只,自由饮水、进食,以国家标准啮齿类动物常规饲料喂养。环境温度(20±2)℃,相对温度55%~58%,12 h昼/夜循环照明。
大鼠适应性喂养1周后,用随机数字表法将大鼠分为4组:基础对照组(BC,n=10)、单纯去卵巢组(OVX,n=30)、假手术组(SHAM,n=30)、去卵巢+运动组(OVX+T,n=30)。OVX组大鼠行双侧卵巢切除术,术后3 d,随机分为OVX4组(n=10)、OVX8组(n=10)、OVX12组(n=10),分别常规饲养4周、8周和12周。SHAM组按照OVX组模型制作方法进行,手术步骤同OVX组,取双侧卵巢周围与卵巢等体积脂肪切除,术后3 d,随机分为SHAM4组(n=10)、SHAM8组(n=10)、SHAM12组(n=10),分别常规饲养4周、8周和12周。OVX+T组大鼠行卵巢切除术,术后3 d,随机分为3组:OVX+T4组(n=10)、OVX+T8组(n=10)、OVX+T12组(n=10),分别进行为期4周、8周、12周的中等强度跑台运动。
OVX组术后行大鼠阴道脱落细胞监测,4~5d/周,观察脱落细胞成熟程度,以确定去卵巢手术效果。术后2周内大鼠阴道脱落细胞镜检陆续显现为动情间期变化,证明OVX模型建造成功。
1.2 运动方案采用段氏PT2000型鼠类跑台运动。起始跑速为12 m/min,坡度0°,20 min/次;隔日跑速增加3 m/min,运动持续时间增加10 min。第2周起,跑速为18 m/min,60 min/次,坡度5°,5 d/周。负荷设定参照国际通用的Bedford运动负荷标准[8]。
1.3 组织取样及处理于末次运动后24~36 h称重,并以3.45 mL/kg体重腹腔注射10%水合氯醛麻醉,测定大鼠全身骨密度(BMD)后,心脏取血处死。取大鼠右侧股骨,去除肌肉、肌腱等软组织后,以生理盐水纱布包裹置于冻存管中,于-80 ℃保存,用于Wnt3a及β-catenin mRNA及蛋白的测定。
1.4 测试指标与方法(1) BMD测定。以双能X线骨密度仪(DXA;Lunar Prodigy,GE Inc.,USA)测定大鼠全身BMD,用enCORE(小动物分析软件-版本10.50.086)进行分析。每日实验前,以随机附带模块对DXA进行质控检测。
(2) Wnt3α及β-catenin mRNA测定。采用qRT-PCR方法测定。取股骨上1/2,于研磨机内液氮环境下研磨成粉,以Trizol法(Trizol试剂盒)提取总RNA。采用紫外分光光度计测定RNA浓度,并通过A230 nm、A325 nm和A260 nm/A280 nm的值,观察样本被污染的程度及RNA纯度。各靶基因引物的设计与合成由北京天一辉远生物技术公司完成,引物序列见表 1。
| 表 1 各靶基因及引物序列 Table 1 The target genes and primer sequences |
取1 μg总RNA,逆转录合成cDNA,以SYBR Premix Ex TaqTMⅡ试剂盒(宝生物工程有限公司)进行荧光定量PCR测试。95 ℃ 30 s预变性后,95 ℃ 3 s→60 ℃ 30 s,40 cycles;同时设置溶解曲线,95 ℃ 15 s→65 ℃ 60 s→95 ℃ 15 s。待测基因的相对表达量采用2-△△CT方法[9]分析,其中△△CT=(CT实验组待测基因-CT实验组参照基因)-(CT对照组待测基因-CT对照参照基因)。
(3) 采用Western Blot方法测定Wnt3α及β-catenin蛋白表达。取右股骨上1/2,于研磨机内液氮环境下研磨成粉,置于研钵中,加入含有蛋白酶抑制剂的组织裂解液,于冰上匀速研磨15 min。4 ℃,13 000 r/min,离心15 min,取上清。以BCA法进行蛋白浓度测定,按试剂盒(普利莱基因技术有限公司)说明书完成。取各标本蛋白140 μg,加5×loading buffer,混匀,100 ℃煮沸15 min。将样品加入SDS-PAGE胶中,浓缩胶100 V,分离胶120 V,恒压电泳。采用湿式转膜法将蛋白转移至PVDF膜,冰浴中,300 mA恒流转膜160 min。用5%BSA室温封闭1 h后,分别加入适当浓度的Wnt3α、β-catenin和β-actin一抗,4 ℃孵育过夜。TBST清洗后,加入适当浓度HRP标记的二抗,室温孵育1 h。清洗后,与Super ECL底物发光液反应,X光胶片压片、曝光,经显影、定影后,扫描仪扫描,用Gel-Pro Analyzer软件测定条带光密度值。将Wnt3α及β-catenin的光密度值分别与相应的β-actin比值作为其蛋白的相对表达量。
1.5 数据处理采用SPSS 16.0软件进行数据统计分析,结果以平均数±标准差(M±SD)表示。属正态分布者,采用One-way ANOVA分别对同期各组间实验数据以及各组不同时间点的实验数据进行组间差异性检验。出现显著性时用LSD(L)方进行组间多重比较检验。P<0.05表示差异有显著性,P<0.01表示差异具有非常显著性。
2 研究结果 2.1 骨密度(BMD)的变化SHAM组大鼠BMD表现为随月龄增长而稳定增加,与BC组相比,SHAM各组BMD均显著增加(P<0.05,P<0.01,P<0.01),但各组间无显著性差异。OVX组大鼠BMD呈缓慢下降趋势,OVX8、OVX12均显著低于同期SHAM组(P<0.01,P<0.01)。OVX+T组大鼠BMD呈现出随运动时间增加而升高的趋势;OVX+T4组仍显著低于同期SHAM组(P<0.05),且与同期OVX组相比无显著性差异;OVX+T8组显著高于OVX+T4组(P<0.05),且与同期SHAM组相比无显著性差异;OVX+T12组显著高于OVX+T4组(P<0.05),与OVX+T8组相比升高幅度较小,无显著性差异,与同期OVX组比较显著升高(P<0.01),且与同期SHAM组相比无显著性差异(表 2)。
| 表 2 大鼠全身BMD Table 2 The BMD of the whole body in rats |
随月龄增长,SHAM组及OVX组各组间Wnt3α mRNA表达较为稳定,各组间无显著性差异,且同期两组间均无显著性差异。随着运动时间的延长,OVX+T各组Wnt3α mRNA表达呈升高趋势;OVX+T4组显著高于同期SHAM和OVX组(P<0.01);OVX+T8组与OVX+T4组相比升高幅度较小,无显著性差异,与同期SHAM和OVX组相比显著升高(P<0.01);OVX+T12组与OVX+T4组相比显著升高(P<0.05),且显著高于同期SHAM和OVX组(P<0.01)(表 3)。
| 表 3 Wnt3a mRNA相对表达量(2-△△CT) Table 3 The relative expression of Wnt3a mRNA (2-△△CT) |
随月龄增长,SHAM组及OVX组各组间Wnt3α蛋白表达较为稳定,各组间无显著性差异;OVX组表达略低于SHAM组,但无显著性差异。随运动时间延长,OVX+T各组Wnt3α蛋白表达呈升高趋势;OVX+T4组、OVX+T8组与同期SHAM和OVX组相比均显著升高(P<0.05),但两组间无显著性差异;OVX+T12组与OVX+T4组相比显著升高(P<0.05),且显著高于同期SHAM和OVX组(P<0.01)(表 4、图 1)。
| 表 4 Wnt3a蛋白相对表达量 Table 4 The relative expression of Wnt3a protein |

|
图 1 大鼠Wnt3α蛋白表达 Figure 1 The expression of Wnt3a protein in rats |
随月龄增长,SHAM组各组间β-catenin mRNA表达较为稳定,各组间无显著性差异。OVX组各组表达均显著低于同期SHAM组(P<0.01),且OVX8组表达量最高,显著高于OVX4组(P<0.01)。OVX+T各组表达量均显著高于同期SHAM组和同期OXV组(P<0.01);且OVX+T4组表达量最高,显著高于OVX+T8组和OVX+T12组(P<0.05)(表 5)。
| 表 5 β-catenin mRNA相对表达量(2-△△CT) Table 5 The relative expression of β-catenin mRNA(2-△△CT) |
随月龄增长,SHAM组及OVX组各组间β-catenin蛋白表达较为稳定,各组间无显著性差异。OVX+T各组β-catenin蛋白表达以OVX+T8组表达量最高,显著高于OVX+T4组和OVX+T12组(P<0.01,P<0.05),且显著高于同期SHAM组和同期OXV组(P<0.01)。OVX+T12组与同期OVX组相比显著升高(P<0.05)(表 6、图 2)。
| 表 6 β-catenin蛋白相对表达量 Table 6 The relative expression of β-catenin protein |

|
图 2 大鼠β-catenin蛋白表达 Figure 2 The expression of β-catenin protein in rats |
目前普遍认为,以DXA方法测试BMD是评价骨量的“金标准”[10]。本研究结果显示,SHAM组大鼠BMD表现为随月龄增大而稳定增加,至12周组达到最大值,说明本研究选择的3月龄大鼠BMD尚未达到峰值,BMD的增加为自然增长状态。该结果与沈辉等[11]的研究报道一致。本研究所用大鼠为3月龄大鼠,造模耗时最长为12周,6月龄大鼠骨尚处在快速生长期(在雌性大鼠的生长发育过程中,6月龄为快速生长期,6~9月龄进入骨生长静止期,骨代谢相对稳定,10月龄达到峰值骨量);因此,3~6月龄期间,促进骨骼生长和骨量蓄积的各种因素(遗传、生长激素及甲状腺激素等内分泌因素等)将有利于大鼠骨量的增加。
本研究结果显示,OVX组大鼠BMD呈现缓慢下降态势,OVX8组及OVX12组均显著低于同期SHAM组(P<0.01)。表明去卵巢对大鼠骨量的直接作用结果显著,全面抑制大鼠的骨量。去卵巢导致雌激素骤降是大鼠全身BMD下降的根本原因。雌激素是骨代谢的主要调控激素,通过与成骨细胞和破骨细胞上的雌激素受体结合,行使其促进骨形成,抑制骨吸收的骨保护作用[12]。另一方面,雌激素通过上调OPG(骨保护蛋白,可抑制破骨细胞的分化和成熟)表达发挥骨保护作用。当雌激素骤减,OPG表达受抑,破骨细胞分化和成熟加剧[13-14]。此外,雌激素水平对骨重建阈值具有下调作用。当雌激素减少,骨重建阈值提高,导致原先能够使得骨进行保留型骨重建的应变只能进行废用型骨重建(低骨量和骨微结构退变为特征),进而使BMD降低。 本研究结果显示,OVX+T运动组大鼠BMD呈现出随运动时间增长而增加的态势,OVX+T8组和OVX+T12组虽均低于同期SHAM组,但已无统计学意义。与同期OVX组比较,OVX+T12组BMD显著升高(P<0.01)。结果显示,4~8周运动干预尚未明显的骨量增加,经12周中等强度跑台运动干预,运动的力学负荷刺激效果显著,骨量增加显著。运动导致骨量显著增加出现的时间节点为8周,8~12周之间效果持续,这与我们前期的另一项动物实验研究结果基本一致[15]。表明持续8~12周的中等强度跑台运动对骨骼产生良性刺激,BMD显著增加。而运动导致骨量增加的机制,一方面与有氧跑步运动增加了机体的机械负荷刺激有关,这种刺激通过参与做功的肌群产生肌力以及对骨的直接作用,影响和促进了大鼠骨建造和骨重建过程[16-17];另一方面,与运动刺激部分抵消废用型骨重建过程有关,OVX大鼠因雌激素减少导致骨重建阈值下调,骨的基础多细胞单位数目增加并增强骨转换,机体发生废用型骨重建过程,骨代谢平衡被破坏[18],中等强度跑台运动负荷可能通过增加骨骼载荷以增加骨骼的应变,使之达到骨重建阈值进行保留型骨重建,而部分抵消因雌激素骤降所带来的不利效应。运动可以缓解/抵抗因雌激素水平降低所导致的骨量下降,延缓骨质疏松的发生;而其中的机械力传导机制是否与Wnt/β-catenin途径有关,则成为探讨大鼠骨量变化机制的关键。
3.2 中等强度跑台运动对Wnt/β-catenin通路的影响及经该通路对骨量的作用机制Wnt信号通路包括3条细胞内信号传导通路[19]:Wnt/β-catenin通路、Wnt/PCP(平面细胞极性)通路、Wnt/Ca2+通路,其中Wnt/β-catenin通路又被称为经典Wnt通路,是一种作用广泛的信号通路。Wnt蛋白作为Wnt/β-catenin通路的起始因子,主要包括Wnt3α等,通过作用于细胞膜表面的受体,激活细胞的第二信使,引起细胞质内β-catenin降解复合物的生成,导致β-catenin的积累,致使β-catenin进入细胞核内,促进基因的转录,从而发挥其生物学效应,影响细胞的增殖、分化。
Wnt/β-catenin通路在骨重建过程中发挥着重要作用[1-3]。Wnt/β-catenin通路在骨形成过程中扮演重要角色[20],可促进具有多分化潜能的间充质干细胞向成骨细胞方向分化;在成骨细胞的增殖和分化阶段,可诱导骨形态发生蛋白表达促进其分化。目前研究发现,Wnt/β-catenin信号通路不仅直接诱导成骨细胞分化,亦可促进成骨细胞矿化[21]。在有些情况下,Wnt/β-catenin信号通路也会下调成骨细胞的凋亡,进而促进骨形成[19]。此外,Wnt/β-catenin信号通路也可通过影响破骨细胞的发生和骨吸收而影响破骨作用[5],其可通过增加成骨细胞和骨细胞OPG分泌,间接抑制破骨细胞分化和骨吸收[22-23]。Wnt配体也可直接影响破骨细胞及其前体,形成自分泌环:在早期,β-catenin的激活有利于前体细胞的增殖;而在后期,Wnt3α会抑制破骨细胞形成[24](图 3)。
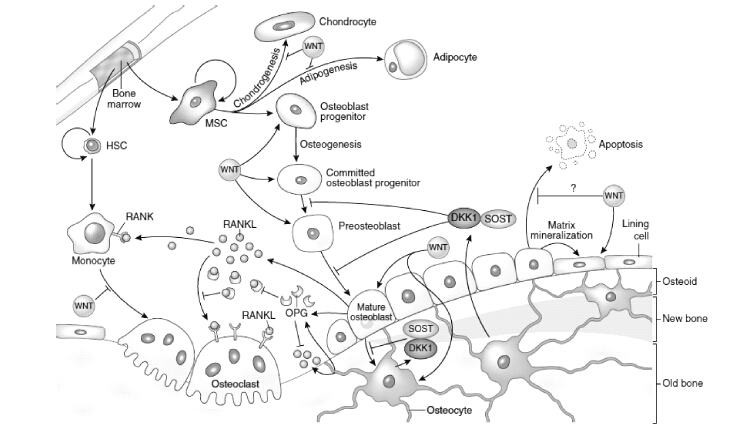
|
图 3 Wnt/β-catenin信号通路对骨细胞的作用机制[19] Figure 3 The regulation mechanism of Wnt/β-catenin signaling on osteocyte |
Wnt蛋白作为Wnt/β-catenin信号通路的起始因子,能够影响细胞的增殖、分化;β-catenin是Wnt/β-catenin通路中的关键因子,其量的积累是Wnt经典通路的关键环节,是应力刺激的关键调控点[25]。有研究发现[26],大鼠去卵巢4周、8周时,骨组织中β-catenin mRNA表达量显著下降,表明去卵巢大鼠骨组织中Wnt/β-catenin信号通路受到抑制,骨密度降低。Bu等[7]研究发现,大鼠去卵巢14周时,第5腰椎(L5)骨组织中β-cantenin mRNA表达量显著低于假手术组,同时L5骨强度显著下降。也有对去卵巢大鼠股骨研究发现[27],去卵巢12周时,股骨骨密度显著下降,同时骨组织中β-catenin mRNA表达量显著下降。提示Wnt/β-catenin信号通路的抑制可能是绝经后骨质疏松症发病机制之一。而另有研究[28]发现,大鼠去卵巢12周时,股骨骨密度显著下降,而骨组织中β-cantenin mRNA及蛋白表达与正常对照组相比显著增加(P<0.05),表明Wnt/β-catenin信号通路被激活。究其原因,Wnt/β-catenin信号通路在去势大鼠中的功能状态可能与去卵巢的时间有关。本研究结果显示,大鼠去卵巢后,骨组织中β-catenin mRNA表达量显著下降,去卵巢4周、8周、12周时均显著低于其同期假手术组(P<0.01),表明去卵巢后Wnt/β-catenin信号通路受到抑制,与上述大多数研究结果一致。
本研究对去卵巢大鼠分别进行4周、8周、12周不同时间的有氧运动干预,发现运动各组的Wnt3α mRNA及蛋白表达均显著高于同期去卵巢组及假手术组,并且随运动时间的延长,表达量逐渐增加。由于细胞外Wnt3α的增加,可与膜上受体结合,引起细胞质内β-catenin的累积,促使β-catenin进入细胞核内,促进成骨细胞的增殖和分化。本研究也发现,运动各组的β-catenin mRNA表达量也显著高于同期去卵巢组及假手术组;运动8周和12周时,β-catenin蛋白表达量也显著高于同期去卵巢组,表明中等强度跑台运动可激活Wnt3α/β-catenin信号通路,改善去卵巢大鼠的骨量下降。这与Bu等[7]研究结果一致,即对去卵巢大鼠进行14周的中等强度跑台运动干预后发现,运动后L5骨组织中β-cantenin mRNA表达量显著高于单纯去卵巢组,同时L5骨强度显著增大,表明有氧运动可激活Wnt3α/β-catenin信号通路,改善去卵巢大鼠的骨量及骨强度下降。提示中等强度跑台运动可以通过激活Wnt3α/β-catenin信号通路,参与运动优化大鼠骨骼的机械力传导,增强成骨效应,进而改善去卵巢致骨质疏松大鼠的骨量下降。
4 结束语中等强度跑台运动有效增加去卵巢大鼠股骨Wnt和β-catenin基因及蛋白的表达,激活Wnt/β-catenin信号通路,进而改善去卵巢大鼠骨密度;运动增加去卵巢大鼠骨量的机制与Wnt/β-catenin信号通路参与了骨骼机械力传导,成骨效应增强密切相关。
| [1] |
Clevers H, Nusse R. Wnt/beta-catenin signaling and disease[J].
Cell , 2012, 149 : 1192-1205 DOI:10.1016/j.cell.2012.05.012 ( 0) 0)
|
| [2] |
周君, 何成奇. Wnt/β-catenin信号通路在骨重建中的作用研究进展[J].
中国康复医学杂志 , 2015 (5) : 513-516 ( 0) 0)
|
| [3] |
Issack P S, Helfet D L, Lane J M. Role of Wnt signaling in bone remodeling and repair[J].
Journal of Hospital for Special Surgery , 2008, 4 (1) : 66-70 ( 0) 0)
|
| [4] |
De Boer J, Siddappa R, Gaspar C, et al. Wnt signaling inhibits osteogenic differentiation of human mesenchymal stem cells[J].
Bone , 2004, 34 (5) : 818-826 DOI:10.1016/j.bone.2004.01.016 ( 0) 0)
|
| [5] |
Glass D A, Bialek P, Ahn J D, et al. Canonical Wnt signaling in differentiated osteoblasts controls osteoclast differentiation[J].
Developmental cell , 2005, 8 (5) : 751-764 DOI:10.1016/j.devcel.2005.02.017 ( 0) 0)
|
| [6] |
邹军, 章岚, 任弘, 等. 运动防治骨质疏松专家共识[J].
中国骨质疏松杂志 , 2015 (11) : 1291-1302 ( 0) 0)
|
| [7] |
Bu S, Chen Y, Wang S, et al. Treadmill training regulates beta-catenin signaling through phosphorylation of GSK-3beta in lumbar vertebrae of ovariectomized rats[J].
Eur J Appl Physiol , 2012, 112 : 3295-3304 DOI:10.1007/s00421-011-2306-4 ( 0) 0)
|
| [8] |
Bedford T G, Tipton C M, Wilson N C, et al. Maximum oxygen consumption of rats and its changes with various experimental procedures[J].
Journal of Applied Physiology Respiratory Environmental&Exercise Physiology , 1979, 47 (6) : 1278-1283 ( 0) 0)
|
| [9] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ct method[J].
Methods , 2001, 25 (4) : 402-408 DOI:10.1006/meth.2001.1262 ( 0) 0)
|
| [10] |
Watts N B. Fundamentals and pitfalls of bone densitometry using dual-energy X-ray absorptiometry (DXA)[J].
Osteoporosis International , 2004, 15 (15) : 847-54 ( 0) 0)
|
| [11] |
沈辉, 潘时中. 大鼠切除卵巢骨质疏松模型的实验研究[J].
福建医科大学学报 , 2004, 38 (2) : 152-154 ( 0) 0)
|
| [12] |
Shiraishi A, Takeda S, Masaki T, et al. Alfacalcidol inhibits bone resorption and stimulates formation in an ovariectomized rat model of osteoporosis: distinct actions from estrogen[J].
Journal of Bone and Mineral Research , 2000, 15 (4) : 770-779 ( 0) 0)
|
| [13] |
李荀.运动经雌激素-受体途径对骨量的影响效应及其机制[D].北京:首都体育学院,2012:30-34
http://cdmd.cnki.com.cn/article/cdmd-10029-1013180102.htm ( 0) 0)
|
| [14] |
郑陆, 陈晓红, 李荀, 等. 中等强度运动ERβ和RANKL/OPG变化及对骨量的调控机制[J].
西安体育学院学报 , 2015, 32 (5) : 599-605 ( 0) 0)
|
| [15] |
陈晓红, 郑陆, 王智强. 过度运动致骨量降低动物模型的建造[J].
中国运动医学杂志 , 2009, 28 (6) : 660-664 ( 0) 0)
|
| [16] |
Nordsletten L, Kaastad T S, Madsen J E, et al. The development of femoral osteopenia in ovariectomized rats is not reduced by high intensity treadmill training:A mechanical and densitometric study[J].
Calcified Tissue International , 1994, 55 (6) : 436-442 DOI:10.1007/BF00298557 ( 0) 0)
|
| [17] |
Iwamoto J, Takeda T, Ichimura S. Effect of exercise on tibial and lumbar vertebral bone mass in mature osteopenic rats:Bone histomorphometry study[J].
Journal of Orthopaedic Science , 1998, 3 (5) : 257-263 DOI:10.1007/s007760050051 ( 0) 0)
|
| [18] |
Shapiro L F, Freeman K. The relationship between estrogen, estrogen receptors and periodontal disease in adult women: a review of the literature[J].
The New York State Dental Journal , 2014, 80 (3) : 30-34 ( 0) 0)
|
| [19] |
Baron R, Kneissel M. WNT signaling in bone homeostasis and disease:from human mutations to treatments[J].
Nature Medicine , 2013, 19 (2) : 179-192 DOI:10.1038/nm.3074 ( 0) 0)
|
| [20] |
Peter V N, Barry S. Wnt signaling and osteoblast ogenesis[J].
Reviews in Endocrine&Metabolic Disorders , 2006, 7 (12) : 33-39 ( 0) 0)
|
| [21] |
Silvcrio K G, Davidson K G, James R G, et al. Wnt/β-catenin pathway regulates bone morphogenetic protein(BMP2)-mediated differentiation of dental follicle cells[J].
Periodontal Res , 2012, 47 (3) : 309-319 DOI:10.1111/jre.2012.47.issue-3 ( 0) 0)
|
| [22] |
Kramer I, Halleux C, Keller H, et al. Osteocyte Wnt/beta-catenin signaling is required for normal bone homeostasis[J].
Molecular&Cellular Biology , 2010, 30 (12) : 3071-3085 ( 0) 0)
|
| [23] |
Glass D A, Bialek P, Ahn J D, et al. Canonical Wnt signaling in differentiated osteoblasts controls osteoclast differentiation[J].
Developmental Cell , 2005, 8 (5) : 751-764 DOI:10.1016/j.devcel.2005.02.017 ( 0) 0)
|
| [24] |
Santiago F, Oguma J, Brown A M C, et al. Noncanonical Wnt signaling promotes osteoclast differentiation and is facilitated by the human immunodeficiency virus protease inhibitor ritonavir[J].
Biochemical and Biophysical Research Communications , 2012, 417 (1) : 223-230 DOI:10.1016/j.bbrc.2011.11.089 ( 0) 0)
|
| [25] |
Jansen J H, Eijkenm, Jahr H, et al. Stretch-induced inhibition of Wnt/β-catenin signaling in mineralizing osteoblasts[J].
Orthop Res , 2010, 28 (3) : 390-396 ( 0) 0)
|
| [26] |
王燕, 刘岩, 马剑侠, 等. Wnt/LRP5/β-catenin 信号通路在绝经后骨质疏松发病中的作用[J].
中华妇产科杂志 , 2011, 46 (10) : 769-772 ( 0) 0)
|
| [27] |
Xia B, Xu B, Sun Y, et al. The effects of Liuwei Dihuang on canonical Wnt/β-catenin signaling pathway in osteoporosis[J].
Journal of Ethnopharmacology , 2014, 153 (1) : 133-141 DOI:10.1016/j.jep.2014.01.040 ( 0) 0)
|
| [28] |
周君, 何红晨, 刘慧芳, 等. 去卵巢对大鼠Wnt/β-catenin 信号通路的影响[J].
中国老年学杂志 , 2014, 34 (8) : 2152-2154 ( 0) 0)
|
 2016, Vol. 40
2016, Vol. 40


