2. 北京体育大学 运动人体科学学院,北京 100084;
3. 井冈山大学 体育学院,江西 吉安 343009
2. Sport Science College, Beijing Sport University, Beijing 100084, China;
3. Physical Education College, Jinggangshan University, Ji'an 343009, Jiangxi, China
骨骼肌是人体运动系统的动力来源。长时间和(或)大负荷运动,特别是离心运动后,骨骼肌纤维会出现损伤(exercise-induced muscle damage, EIMD),可造成延迟性肌肉酸痛(delayed onset muscle soreness, DOMS)和肌力下降,从而影响人体的运动和日常生活。一直以来,EIMD都是运动生理学和运动医学研究的重点课题。研究表明,骨骼肌细胞凋亡[1]、自噬[2]与坏死[3]在EIMD过程中均有出现,其中细胞自噬是关键的细胞降解过程,可选择性清除受损线粒体等细胞器以延缓细胞衰老[4-5]以及抑制细胞凋亡[6],并通过线粒体自噬而作用于线粒体质量控制(mitochondrial quality control, MQC)。
线粒体自噬(mitophagy)是指在活性氧(reactive oxygen species, ROS)、细胞衰老、营养缺乏等应激作用下,细胞内的线粒体出现去极化损伤,损伤的线粒体被特异性包裹进入自噬体中,并与溶酶体融合后降解,从而维持细胞内环境稳定[7],自噬体特征蛋白为微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3, LC3)。为适应机体代谢需求,自噬引起的线粒体选择性减少与线粒体生物发生相互作用,从而保持线粒体数量的稳定。在酵母和哺乳动物细胞中,线粒体分裂要早于线粒体自噬,损伤的线粒体分裂为易被包裹的片断后被选择性地自噬清除,从而控制线粒体的质量[8]。此外,正常情况下已损伤的线粒体可与邻近的、完整的线粒体融合,并恢复其功能。然而,当线粒体损伤程度超过其修复能力时,线粒体自噬启动,清除受损线粒体[9]。以上研究提示,线粒体自噬与线粒体生物发生、线粒体动态变化、线粒体修复共同参与MQC,对线粒体数量与功能的维持具有重要作用。
目前,对骨骼肌线粒体自噬的相关研究较鲜见,对骨骼肌细胞中线粒体自噬的变化情况及其诱导机制的认识尚不明确。线粒体自噬的直接动力来自于线粒体自噬蛋白及其相关的受体蛋白,研究线粒体自噬蛋白及其相关蛋白在运动后不同时相的变化尤为必要,可在进一步证明大负荷运动诱发线粒体自噬的同时,有助于探明骨骼肌线粒体结构和数量的变化是否与线粒体自噬的发生有某种关联。目前的研究表明,在哺乳动物体内,除Nix、Bnip3和FUNDC1是与低氧环境关系密切的线粒体自噬途径外,介导包括骨骼肌线粒体自噬途径的主要为PINK1/Parkin[10-11]。其中PINK1(PTEN-induced putative kinase protein 1)位于Parkin(Parkinson protein 2, E3 ubiquitin protein ligase)上游,PINK1/Parkin途径介导了受损线粒体表面结构或功能蛋白的多聚泛素化,并以此作为被自噬体选择包裹的标志,在哺乳动物细胞自噬依赖的对去极化线粒体的降解过程中发挥着关键作用[12-14]。然而,目前尚未见从PINK1/Parkin途径探究大负荷运动诱导骨骼肌线粒体自噬机制的相关报道。因此,本实验拟通过建立大负荷运动诱导的骨骼肌损伤动物模型,观察线粒体自噬蛋白PINK1/Parkin及其介导的自噬体膜标志物LC3的表达变化,明确是否发生了线粒体自噬;再进一步分析骨骼肌线粒体结构和数量的变化是否与线粒体自噬的发生有某种关联,且这种关联是否通过PINK1/Parkin途径诱发;此外,从分子水平上探讨大负荷运动诱导骨骼肌线粒体自噬的机制。
1 材料与方法 1.1 实验动物及分组8周龄雄性Sprague-Dawley(SD)大鼠48只,体质量为(212.19±6.64) g(动物等级为SPF级,使用许可证号为SCXK(京)2012-0001,北京维通利华实验动物技术有限公司提供)。用标准大鼠饲料分笼饲养于北京体育大学科研实验中心动物房内,获得北京体育大学运动科学实验伦理委员会批准,保持室内相对湿度为40%~70%,温度为20~26 ℃,室内12 h明暗自动切换,自由摄食、饮水。
所有大鼠适应性喂养3 d后随机分为对照组(control, C)和运动组(exercise, E)。其中,E组根据运动后不同时间点又分为运动后即刻组(E0)、运动后12 h组(E12)、运动后24 h组(E24)、运动后48 h组(E48)和运动后72 h组(E72),每组8只。
1.2 运动方案使用小动物电动跑台对大鼠进行运动训练。所有运动组大鼠在正式实验前进行适应性跑台训练3 d,具体方案如下:第1天跑台坡度为0°,速度为16 m/min,运动时间为5 min;第2天跑台坡度为0°,速度为16 m/min,运动时间为10 min;第3天休息。适应训练后的第2天开始正式实验,运动方案参照Armstrong[15]的离心运动模型,采取持续性下坡跑,跑台坡度为- 16°,速度为16 m/min,运动时间为90 min。
1.3 取材及样品制备按照实验设计时间点,将大鼠分批称重后于腹腔内注射体积分数为10%的水合氯醛(3.5 mL/kg)进行麻醉,腹主动脉取血后迅速分离大鼠比目鱼肌,剪取约1 mm×1 mm×1 mm的小块比目鱼肌放入预冷至4 ℃的体积分数为2.5%的戊二醛固定液中,用于电镜检测;再切取100 mg新鲜的比目鱼肌放入离心管内称重后,按照碧云天动物组织线粒体分离试剂盒(C3606)说明书差速离心提取骨骼肌线粒体,随后加入适量的线粒体储存液,重悬线粒体以待测线粒体酶活性,另加入适量临用前添加了PMSF的线粒体裂解液裂解线粒体,以测线粒体蛋白表达;最后,用锡纸包裹剩余的比目鱼肌并将其置于液氮中,之后转至-80 ℃冰箱中保存,备用。
1.4 测试指标与方法 1.4.1 采用透射电子显微镜观察骨骼肌线粒体超微结构的变化将比目鱼肌从戊二醛固定液中取出,首先用0.1 mol/L的磷酸缓冲液冲洗,再用体积分数为1%的锇酸固定,然后用0.1 mol/L的磷酸缓冲液再次冲洗,之后进行脱水处理(乙醇溶液的体积分数为50%、70%、90%、100%),然后用环氧树脂Spurr将其包埋,再将其纵切制成超薄切片,待样品干燥后采用透射电镜观察线粒体的超微结构。
对于每一张组织切片,先在低倍视野(×500~×1 000)下确定观察区域,之后在高倍视野(×2 000-×8 000)下观察其超微结构,主要观察线粒体的分布、大小、形态以及嵴的结构、自噬体的形成变化。随机拍摄肌膜下和肌原纤维间照片各10张,每组每个部位下骨骼肌线粒体照片共30张[16]。使用IPP6.0图像分析软件测定线粒体的数量。
1.4.2 酶联免疫吸附法(ELISA)检测比目鱼肌线粒体CS的含量CS是线粒体数量的定量酶标。采用大鼠柠檬酸合成酶(CS) ELISA分析试剂盒(美国USCNLIFE公司)检测酶的含量。检测步骤严格按照ELISA试剂盒说明书进行。
1.4.3 蛋白质免疫印迹(Western Blot)方法测定比目鱼肌PINK1及线粒体Parkin、LC3的蛋白含量将称取的各组(每组n=6)比目鱼肌置于研钵中,加入液氮,将组织研磨成粉末,然后按照1 mg组织加入10 μL裂解液的比例进行裂解,再置于离心机内(参数:4 ℃、12 000 g)离心10 min,取上清液。用BCA蛋白定量试剂盒测定蛋白浓度后统一调整,使上样量保持一致。然后,以4:1比例加入5倍上样缓冲液,在98 ℃下煮沸5 min后分装样品保存。
取样品加样:样品体积20 μL/孔,蛋白的质量浓度1.5 μg/μL。随后进行SDS-PAGE电泳,电泳后转至聚偏氟乙稀(polyvinylidene fluoride, PVDF)膜,封闭经一二抗孵育后放入凝胶成像系统(美国BIO-RAD公司)中显像。所用抗体为:Anti-PINK1和Anti-Parkin及Anti-LC3及Anti-COXⅣ(英国Abcam公司)、Anti-GAPDH(美国Santa Cruz公司)、Goat Anti-Mouse IgG(H+L), HRP和Goat Anti-Rabbit IgG(H+L), HRP(北京中杉金桥生物技术公司)。使用Gel-pro软件分析蛋白条带灰度值,蛋白表达量用“目的蛋白/内参”计算,即骨骼肌目的蛋白PINK1/内参GAPDH、骨骼肌线粒体目的蛋白(Parkin、LC3)/内参COXⅣ。
1.5 统计学分析使用IPP图片分析软件对所获得的电镜图片进行定量分析。使用SPSS 16.0统计软件对组间数据进行单因素方差分析(One-way ANOVA),数据以“均数±标准差”(mean±SD)表示。进行方差分析之前先进行方差齐性检验,若方差齐性,则采用LSD法进行事后检验;若方差不具齐性,则将原始数据转换至齐性后再作统计。对于不能转换至齐性的数据直接用Tamhane’s T2的统计结果进行分析。P<0.05认为差异具有统计学意义。
2 结果 2.1 骨骼肌线粒体超微结构变化本实验使用透射电镜观察了一次大负荷运动后不同时相骨骼肌线粒体超微结构的变化,如图 1所示。由图 1可见:C组大鼠骨骼肌中的线粒体小,且均匀分布于Z线两侧,肌膜下的线粒体较少;线粒体双膜结构清晰完整,嵴结构饱满密集,多呈细长杆状和椭圆形,大小均一。经过一次大负荷运动,运动后即刻组的骨骼肌线粒体分布不均匀,在肌膜下大量积聚[17],此时线粒体开始变大、肿胀,大小不一,嵴结构不清晰。运动后12 h,Z线部分断裂,肌膜下线粒体大量积聚,线粒体肿胀,变圆,部分膜结构不清晰,嵴变清晰但少而稀,此时线粒体损伤最为严重。运动后24 h,Z线较为清晰,肌膜下线粒体数量减少,线粒体形态有所恢复,虽然依旧很大很圆,但膜结构较清晰,嵴变得多而密。运动后48 h,线粒体再次出现损伤表现,但线粒体损伤程度小于运动后12 h的表现,运动后72 h线粒体的形态已经基本恢复到正常水平。进一步观察后还发现,C组大鼠骨骼肌细胞内未观察到明显的自噬体(双层膜结构),经过一次大负荷运动后,骨骼肌细胞内有大量自噬体形成,出现了大量的处于不同成熟阶段的自噬体[18](如图 1中箭头所指):在运动后即刻至12 h出现了早期的自噬小泡包裹尚可识别的线粒体,运动后24 h至48 h出现了后期的自噬小泡包裹薄层状结构,运动后72 h未观察到明显的自噬体。

|
图 1 运动后不同时相线粒体超微结构与自噬体的变化 Figure 1 Ultrastructural and autophagic changes of mitochondria at different time after exercise |
各组大鼠肌膜下线粒体数量的计量学统计结果显示,与C组相比,E组各时相肌膜下线粒体数量均呈现上升趋势,其中运动后24 h、72 h肌膜下线粒体数量明显升高(P<0.05)[17] (表 1)。
| 表 1 运动后不同时相骨骼肌膜下线粒体的数量 Table 1 Quantity of subsarcolemmal mitochondria in skeletalmuscle at different time after exercise |
| 表 2 运动后不同时相骨骼肌线粒体CS的含量 Table 2 Content of CS in skeletal muscle mitochondria atdifferent time after exercise |
实验结果显示(表 2),大负荷运动后不同时相大鼠比目鱼肌线粒体中CS含量呈现先减少后增加的趋势。与C组相比,线粒体CS含量在运动后0 h明显减少(P<0.05),运动后12 h有所增加,运动后24 h再次减少至最低(P<0.05,分别减少了45.8%、41.2%和50.1%),运动后48 h和72 h逐渐增加,于运动后72 h达到最高,但尚未恢复至C组水平。
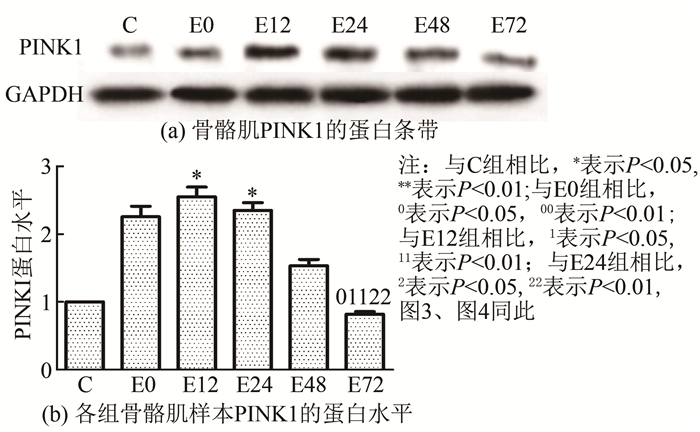
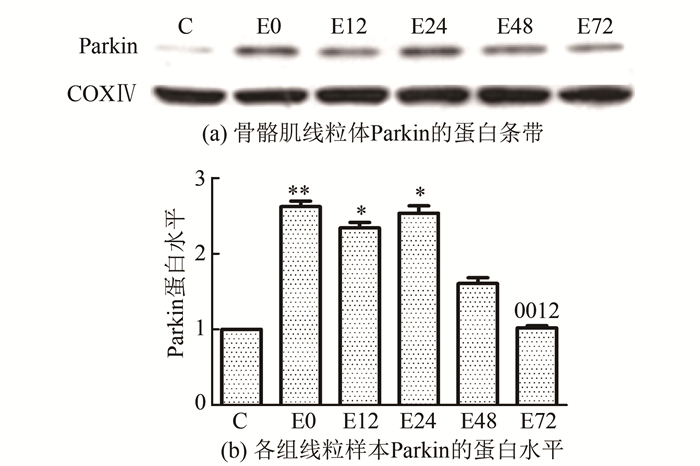
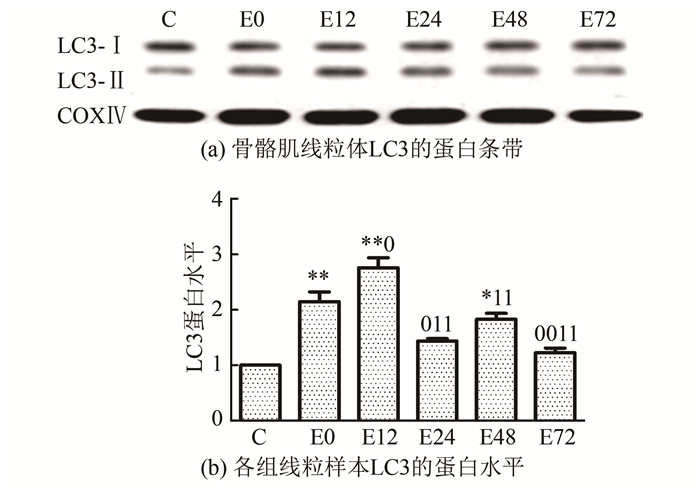
2.3 骨骼肌PINK1和线粒体中Parkin、LC3蛋白表达的变化实验结果显示(图 2~图 4),大负荷运动后,不同时相骨骼肌PINK1和线粒体中Parkin、LC3蛋白表达总体上均呈现先升高后降低的趋势。首先,骨骼肌PINK1在运动后即刻至12 h逐渐升高,12 h组较C组显著升高了1.55倍(P<0.05),此时出现最高峰,此后逐渐下降。其次,线粒体中Parkin蛋白表达在运动后即刻、12 h和24 h均显著性升高(P<0.01或P<0.05),比C组分别增高了1.62倍、1.34倍和1.54倍,并持续维持在高水平,最高峰出现在运动后即刻;运动后48 h和72 h逐渐降低,运动后72 h恢复至C组水平,此时明显低于运动后即刻、12 h和24 h水平(P<0.01或P<0.05)。LC3-Ⅱ/Ⅰ比值在运动后即刻、12 h和48 h较C组差异均具有显著性(P<0.01或P<0.05),比C组分别升高了1.14倍、1.76倍和82.7%,最高峰出现在运动后12 h,此时明显高于运动后即刻水平(P<0.05),运动后24 h至72 h逐步回落,运动后72 h仍略高于C组。
|
图 2 运动后不同时相骨骼肌PINK1蛋白相对表达量的变化 Figure 2 Changes of the relative protein expression of PINK1 inskeletal muscle at different time after exericse |
|
图 3 运动后不同时相骨骼肌线粒体Parkin蛋白相对表达量的变化 Figure 3 Changes of the relative protein expression of Parkin inskeletal muscle mitochondria at different time afterexericse |
|
图 4 运动后不同时相骨骼肌线粒体LC3蛋白相对表达量的变化 Figure 4 Changes of the relative protein expression of LC3 inskeletal muscle mitochondria at different timeafter exericse |
骨骼肌损伤形态学研究是EIMD发生机制探索的基础。研究表明,剧烈的、非习惯负荷运动,尤其是离心运动[19-22]可引起骨骼肌线粒体超微结构的变化。前期研究发现:一次离心运动后即刻肌纤维超微结构的改变程度较小,运动后1~2 d变化程度逐渐加剧,并见炎症细胞浸润[20];此外,4周离心运动可导致骨骼肌线粒体在肌膜下聚积,大小不一;肌纤维内线粒体肿胀,嵴稀少,呈空泡化,表现出严重的结构异常[21]。李世成等[22]指出, 骨骼肌线粒体结构损伤在离心运动后12~24 h最为严重,呈现明显的线粒体肿胀、嵴紊乱等。故本实验参照Armstrong等[15]的运动方案对大鼠进行一次持续性下坡跑,致使肌纤维损伤发生,复制出EIMD模型,选取运动后即刻(0 h)、12 h、24 h、48 h和72 h这5个时相点,并提取离心运动最易损伤的慢肌(比目鱼肌)进行研究。笔者发现,大负荷运动后比目鱼肌线粒体出现明显肿胀、肌膜下积聚等超微结构异常变化,出现了大量的处于不同成熟阶段的具有双层膜结构的自噬体,且运动后的这种变化具有明显的时相性:运动后即刻骨骼肌轻微损伤,线粒体开始变大、肿胀,嵴小部分缺损;随着时间延长,损伤程度加深,运动后12 h的损伤最为严重,线粒体多见空泡变性、肿胀、嵴部分缺损、紊乱;运动后24 h有所缓解,至48 h出现“二次损伤”表现,但此时线粒体的损伤程度小于运动后12 h的表现;运动后72 h接近恢复至正常水平。此外,笔者发现运动后有大量自噬体形成,在运动后即刻和12 h表现为早期的自噬小泡包裹尚可识别的线粒体,在运动后24 h和48 h表现为后期的自噬小泡包裹薄层状的结构。本实验结果与李世成等[22]的文献报道一致,提示一次大负荷运动可引起骨骼肌细胞发生自噬现象。
此外,研究证实EIMD的发生与骨骼肌细胞内线粒体功能改变紧密相关,因此,研究运动对线粒体机能的影响越来越受人们的重视。笔者在前期研究中发现,一次大负荷运动后,线粒体的氧化磷酸化功能受损,表现为电压依赖性阴离子通道(voltage-dependent anion channel, VDAC)和细胞色素C(cytochrome, Cyt C)蛋白表达均显著上调[21]。有报道指出,不同运动方式和负荷还能使线粒体数量和质量发生变化,其中有氧耐力运动可以引起线粒体数量和体积的增加[23],而一次或重复大负荷运动则会导致线粒体严重受损,线粒体数量减少[24-25]。在目前的离体及在体实验中,已将柠檬酸合成酶(citrate synthase, CS)作为反映线粒体数量变化的客观指标[26-27]。研究证实,线粒体功能破坏,如呼吸链受抑制或者mtDNA损耗均不会对CS造成影响,因此,CS的含量变化是定量线粒体的理想标志[26-27]。本实验结果显示,大负荷运动后线粒体内CS的含量呈减少的趋势,在运动后24 h减少至最低(P<0.05),此研究结果与董贵俊等[24]的报道基本一致,提示一次大负荷运动可显著下调骨骼肌线粒体的数量。以上研究结果表明,大负荷运动可致使骨骼肌线粒体受损,数量减少,导致细胞氧化磷酸化功能障碍。
3.2 大负荷运动诱导大鼠骨骼肌损伤的可能机制研究证实,运动或骨骼肌收缩为骨骼肌乃至整个机体带来积极的健康效益的同时也产生的许多负面效应,如ROS的产生、非功能或损伤细胞组件(线粒体、内质网和核糖体等)的聚集、衰老或错误折叠蛋白的累积等[28],这些代谢废物可通过细胞自噬转运至溶酶体内消化降解,从而完善肌细胞质量控制[29]。为了维持细胞的正常生理活动状态,受损或多余的线粒体需要被及时清除,这主要通过自噬途径实现(即线粒体自噬)[30]。在正常的生理条件下,线粒体自噬现象相对稳定,但生理与病理状态会诱发其增强或者减弱。
PINKl/Parkin介导的线粒体自噬是近年来研究的热点,但对其在运动诱导线粒体自噬中扮演的角色仍知之甚少。Vainshtein等[31]认为,一次力竭性运动后,骨骼肌线粒体融合分裂和自噬能力增强,表现为Parkin、Drp1表达上调。樊申元等[32]研究发现,帕金森小鼠PINK1 mRNA表达明显下调,而8周耐力训练可上调其PINK1 mRNA、Parkin蛋白含量及LC3-Ⅱ/Ⅰ比值,从而改善神经线粒体功能。崔迪等[33]对小鼠进行6周高脂膳食干预后,小鼠骨骼肌中的PINK1/Parkin、Nix/Bnip3信号在转录及翻译水平上均存在不同程度的异常,但耐力训练可改善线粒体自噬水平,稳定线粒体功能,而且PINK1/Parkin信号相对于Nix/Bnip3信号的变化在骨骼肌中更加敏感。崔迪等[34]还发现,P53抑制剂致使健康小鼠骨骼肌PINK1的转录异常高水平可通过耐力训练得到改善。以上说明,适度的运动训练可在一定程度上激活自噬水平,这有利于维持骨骼肌稳态以及介导运动适应;当不良应激作用于机体时,自噬水平的过度激活可能会导致线粒体和细胞功能异常。
本研究观察了一次大负荷运动后大鼠比目鱼肌PINK1和线粒体中Parkin、LC3在不同时相的蛋白表达情况,结果显示三者均呈现先升高后降低的趋势。自噬因子PINK1的蛋白表达水平和研究中线粒体损伤的情况基本一致。大负荷运动引起线粒体上降解PINK1的蛋白酶体催化作用被抑制,使得PINK1在线粒体上大量聚集,在12 h左右出现聚集的高峰,而此时正是本模型的骨骼肌细胞和线粒体损伤最为严重的时间点。而此后的时相蛋白酶体作用开始活跃,减少了PINK1在线粒体上的累积,线粒体的结构逐渐恢复,这与骨骼肌损伤恢复过程的时程也是基本吻合的。
此外,胞浆蛋白Parkin在线粒体中的表达在运动后即刻至24 h显著上调(P<0.01或P<0.05),最高峰出现在运动后即刻,随后48 h和72 h逐渐降低,提示一次大负荷运动可诱导Parkin线粒体转位增加。Kim等[35]指出,无论是PINK1和Parkin共表达还是Parkin定位于线粒体上表达都会引起线粒体大量聚集。综合上述结果推测,正常情况下,Parkin游离于胞浆,一次大负荷运动导致线粒体损伤后,PINK1随即开始在线粒体上表达,经过一系列作用加强了Parkin泛素连接酶的活性,使得大量Parkin从胞浆转移至线粒体,二者可能参与了肌膜下线粒体的聚集过程。然而,PINK1如何募集Parkin到线粒体的分子机制仍不明确,另外大负荷运动诱导Parkin转位从而启动线粒体自噬的分子机理也有待进一步研究。
此前通过电镜观察到线粒体超微结构的变化及线粒体自噬体的形成,仅能初步证明大负荷运动诱导线粒体自噬的发生,需要进一步结合自噬体标记分子的蛋白水平表达才能确定大负荷运动是否诱发了线粒体自噬。因此,采用Western Blot方法检测自噬体标记物LC3在线粒体中的表达。结果显示,LC3-Ⅱ/Ⅰ比值在运动后显著上调,最高峰出现在运动后12 h,此后24 h至72 h逐步回落。由此可以看出,本研究结果与电镜下观察到的结果相符,表明大负荷运动可引起大鼠骨骼肌细胞内线粒体自噬体的积聚。结合线粒体形态结构的变化可知,一次大负荷运动后即刻,线粒体开始变大、肿胀,嵴结构不清晰,此时也已经出现了线粒体自噬蛋白PINK1、Parkin和LC3表达上调,说明PINK1在线粒体上大量聚集,Parkin、LC3也定位至线粒体。运动后12 h发现线粒体结构严重破坏,此时的蛋白表达也发生相应的变化。透射电镜观察到线粒体在运动后即刻和12 h左右是损伤最为严重的时间点,此时PINK1、Parkin和LC3也分别出现表达的高峰。此后的时相蛋白酶体作用开始活跃,减少了PINK1在线粒体上的累积,胞浆中Parkin的转位及自噬的发生相继减少,线粒体的结构逐渐恢复,这与骨骼肌损伤恢复过程的时程是基本吻合的。本实验结果表明,一次大负荷运动诱导了骨骼肌线粒体自噬的发生。
细胞死亡的方式主要可以分为三大类,即细胞凋亡、细胞坏死和细胞自噬性死亡。目前,对于EIMD机理的研究主要基于以上3种死亡方式:①大负荷运动可能通过上调Omi的表达,促进XIAP与Omi相互结合,进而激活Caspase-9和Caspase-3的活性,促使细胞凋亡的发生,这一过程已在前期研究中证实[36];②肌肉在离心运动中被过度拉伸后会丢失一些肌细胞膜蛋白,从而导致骨骼肌细胞凋亡或坏死[37];③第3种死亡方式即自噬性死亡,这种细胞死亡方式往往伴有特征性双层膜包裹的自噬体的形成,而目前国内外尚未见相关报道。本实验中的Western Blot结果显示,大负荷运动后,线粒体与自噬体膜标记物LC3结合增多,说明自噬体对待降解线粒体的识别和结合不存在障碍,线粒体自噬明显被激活,而PINK1及其下游Parkin参与其中。大负荷运动诱导线粒体自噬过度增加,增加的自噬体过度地与线粒体结合,这其中可能还包括很多健康的线粒体,致使线粒体数量显著减少,细胞活力不能维持,最终引发自噬性细胞死亡或凋亡。目前,线粒体自噬性死亡已被认为是细胞死亡的形式之一[38-39]。据此推测,由大负荷运动引起的线粒体自噬的程度可能是导致线粒体丢失,以及随后的能量代谢障碍致使骨骼肌细胞损伤的一个重要因素。大负荷运动可导致线粒体受损,因而诱导过度的线粒体自噬性清除,这可能会加重线粒体丢失,使得线粒体供能出现障碍,这一发现是对EIMD发生机制的重要探索,但仍有待进一步验证。基于大负荷运动对于线粒体自噬的影响,选择有针对性的线粒体自噬抑制剂和其他干预方式进行保护,有可能为预防EIMD提供新线索。
本文在细胞水平上发现了大负荷运动可导致线粒体结构损伤和数量减少,在分子水平上发现了大负荷运动能够诱导线粒体自噬过度发生,分析了线粒体自噬在运动致线粒体结构数量丢失中的可能作用。以上结果表明,对于一次90 min的大负荷运动,随着骨骼肌对大负荷的耐受性减弱,嵴的密集程度减弱,嵴的结果被破坏,线粒体数量减少,功能受损较重,在引发这些线粒体丢失现象的同时还诱导了线粒体自噬的过度发生,这可能是大负荷运动导致骨骼肌损伤的重要原因之一。
4 结论一次大负荷运动后骨骼肌线粒体结构和数量均受损,有大量的自噬体形成,导致骨骼肌损伤,原因可能是大负荷运动通过激活PINK1/Parkin信号介导线粒体自噬的过度发生,从而影响了线粒体的数量和功能;然而,大负荷运动诱导胞浆Parkin实现线粒体转位及自噬的调控机制仍不明确,有待于后续研究进一步阐明。
| [1] |
SANDRI M, CARRARO U, PODHORSKA-OKOLOV M, et al. Apoptosis, DNA damage and ubiquitin expression in normal and mdx muscle fibers after exercise[J].
FEBS Letters, 1995, 373(3): 291-295 DOI:10.1016/0014-5793(95)00908-R (  0) 0)
|
| [2] |
GREEN D R. Apoptosis:Death deceiver[J].
Nature, 1998, 396(6712): 629-630 DOI:10.1038/25248 (  0) 0)
|
| [3] |
RAJ D A, BOOKER T S, BELCASTRO A N. Striated muscle calcium-stimulated cysteine protease (calpain-like) activity promotes myeloperoxidase activity with exercise[J].
Pflügers Archiv, 1998, 435(6): 804-809 DOI:10.1007/s004240050587 (  0) 0)
|
| [4] |
HO T T, WARR M R, ADELMAN E R, et al. Autophagy maintains the metabolism and function of young and old stem cells[J].
Nature, 2017, 543(7644): 205-210 DOI:10.1038/nature21388 (  0) 0)
|
| [5] |
GARCIA-PRAT L, MARTINEZ-VICENTE M, PERDIGUERO E, et al. Autophagy maintains stemness by preventing senescence[J].
Nature, 2016, 529(7584): 37-42 DOI:10.1038/nature16187 (  0) 0)
|
| [6] |
TAN T, ZIMMERMANN M, REICHERT A S. Controlling quality and amount of mitochondria by mitophagy:Insights into the role of ubiquitination and deubiquitination[J].
Biological Chemistry, 2016, 397(7): 637-647 (  0) 0)
|
| [7] |
YOULE R J, NARENDRA D P. Mechanisms of mitophagy[J].
Nature Reviews Molecular Cell Biology, 2011, 12(1): 9-14 DOI:10.1038/nrm3028 (  0) 0)
|
| [8] |
WESTERMANN B. Mitochondrial fusion and fission in cell life and death[J].
Nature Reviews Molecular Cell Biology, 2010, 11(12): 872-884 DOI:10.1038/nrm3013 (  0) 0)
|
| [9] |
KIM I, RODRIGUEZ-ENRIQUEZ S, LEMASTERS J J. Selective degradation of mitochondria by mitophagy[J].
Archives of Biochemistry and Biophysics, 2007, 462(2): 245-253 DOI:10.1016/j.abb.2007.03.034 (  0) 0)
|
| [10] |
YOSHⅡ S R, MIZUCSHIMA N. Autophagy machinery in the context of mammalian mitophagy[J].
Biochimica et Biophysica Acta, 2015, 1853(10): 2797-2801 DOI:10.1016/j.bbamcr.2015.01.013 (  0) 0)
|
| [11] |
PICKRELL A M, YOULE R J. The role of PINK1, parkin, and mitochondrial fidelity in Parkinson's disease[J].
Neuron, 2015, 85(2): 257-273 DOI:10.1016/j.neuron.2014.12.007 (  0) 0)
|
| [12] |
PARK J, LEE S B, LEE S, et al. Mitochondrial dysfunction in Drosophila PINK1 mutants is complemented by Parkin[J].
Nature, 2006, 441(7097): 1157-1161 DOI:10.1038/nature04788 (  0) 0)
|
| [13] |
CLARK I E, DODSON M W, JIANG C, et al. Drosophila pink1 is required for mitochondrial function and interacts genetically with parkin[J].
Nature, 2006, 441(7097): 1162-1166 DOI:10.1038/nature04779 (  0) 0)
|
| [14] |
YANG Y, GEHRKE S, IMAI Y, et al. Mitochondrial pathology and muscle and dopaminergic neuron degeneration caused by inactivation of Drosophila PINK1 is rescued by Parkin[J].
Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(28): 10793-10798 DOI:10.1073/pnas.0602493103 (  0) 0)
|
| [15] |
ARMSTRONG R B, OGILVIE R W, SCHWANE J A. Eccentric exercise-induced injury to rat skeletal muscle[J].
Journal of Applied Physiology:Respiratory, Environmental and Exercise Physiology, 1983, 54(1): 80-93 (  0) 0)
|
| [16] |
黄志辉, 刘浩, 李宪航. 有氧运动对衰老大鼠心肌、肝脏细胞凋亡及线粒体膜电位的影响[J].
西安体育学院学报, 2007, 28(1): 78-80 (  0) 0)
|
| [17] |
刘慧君, 姜宁, 赵斐, 等. 急性运动中骨骼肌线粒体移动相关基因表达与线粒体动力学的关系[J].
天津体育学院学报, 2010, 25(2): 118-121 (  0) 0)
|
| [18] |
DAS S, MITROVSKY G, VASANTHI H R, et al. Antiaging properties of a grape-derived antioxidant are regulated by mitochondrial balance of fusion and fission leading to mitohphagy triggered by a signaling network of Sirt1-Sirt3-Foxo3-PINK1-PARKIN[J].
Oxidative Medicine and Cellular Longevity, 2014, 2014: 345105 (  0) 0)
|
| [19] |
孙良, 赵刚. 运动性骨骼肌损伤后不同时刻大鼠肱三头肌超微结构及肌酸激酶的变化[J].
沈阳体育学院学报, 2015, 34(3): 74-78 (  0) 0)
|
| [20] |
高晓娟. 急性离心运动及针刺干预对骨骼肌细胞外基质的影响[D]. 北京: 北京体育大学, 2011: 1-23
(  0) 0)
|
| [21] |
张媛, 漆正堂, 郭维, 等. 耐力训练对高脂膳食大鼠骨骼肌线粒体脂肪氧化及PGC-1α基因表达的影响[J].
天津体育学院学报, 2010, 25(3): 193-196 (  0) 0)
|
| [22] |
李世成, 焦海舟. 大鼠离心运动后骨骼肌微细损伤机制的研究[J].
湛江师范学院学报, 2006, 27(3): 90-95 (  0) 0)
|
| [23] |
李雪, 袁琼嘉, 熊若虹. 不同负荷运动对大鼠大脑皮质超微结构的影响[J].
成都体育学院学报, 2006, 32(3): 111-113 (  0) 0)
|
| [24] |
董贵俊, 吕晨曦, 葛新发, 等. 一次和重复大强度离心运动前后大鼠骨骼肌超微结构变化[J].
中国运动医学杂志, 2013, 32(2): 142-148 (  0) 0)
|
| [25] |
陈彩珍, 卢健, 苏有存. 抗阻训练对D-半乳糖衰老模型大鼠骨骼肌线粒体膜的影响[J].
西安体育学院学报, 2011, 28(1): 83-86 (  0) 0)
|
| [26] |
WATTS J A, KLINE J A, THORNTON L R, et al. Metabolic dysfunction and depletion of mitochondria in hearts of septic rats[J].
Journal of Molecular and Cellular Cardiology, 2004, 36(1): 141-150 DOI:10.1016/j.yjmcc.2003.10.015 (  0) 0)
|
| [27] |
HARGREAVES I P, DUNCAN A J, WU L, et al. Inhibition of mitochondrial complex Ⅳ leads to secondary loss complex Ⅱ-Ⅲ activity:Implications for the pathogenesis and treatment of mitochondrial encephalomyopathies[J].
Mitochondrion, 2007, 7(4): 284-287 DOI:10.1016/j.mito.2007.02.001 (  0) 0)
|
| [28] |
SANCHEZ A M, BERNARDI H, PY G, et al. Autophagy is essential to support skeletal muscle plasticity in response to endurance exercise[J].
American Journal of Physiology.Regulatory, Integrative and Comparative Physiology, 2014, 307(8): 956-969 DOI:10.1152/ajpregu.00187.2014 (  0) 0)
|
| [29] |
NEEL B A, LIN Y, PESSIN J E. Skeletal muscle autophagy:A new metabolic regulator[J].
Trends in Endocrinology and Metabolism:TEM, 2013, 24(12): 635-643 DOI:10.1016/j.tem.2013.09.004 (  0) 0)
|
| [30] |
TOLKOVSKY A M. Mitophagy[J].
Biochimica et Biophysica Acta, 2009, 1793(9): 1508-1515 DOI:10.1016/j.bbamcr.2009.03.002 (  0) 0)
|
| [31] |
VAINSHTEIN A, TRYON LD, PAULY M, et al. Role of PGC-1α during acute exercise-induced autophagy and mitophagy in skeletal muscle[J].
American Journal of Physiology Cell Physiology, 2015, 308(9): 710-719 DOI:10.1152/ajpcell.00380.2014 (  0) 0)
|
| [32] |
樊申元, 靳二辉. 耐力训练对帕金森模型小鼠中脑线粒体自噬相关基因表达的影响[J].
中国康复医学杂志, 2015, 30(5): 437-442 (  0) 0)
|
| [33] |
崔迪, 邱守涛, 王海燕, 等. 耐力运动对营养性肥胖小鼠骨骼肌细胞自噬及线粒体自噬的影响[J].
体育科学, 2014, 34(12): 63-71 DOI:10.3969/j.issn.1000-677X.2014.12.008 (  0) 0)
|
| [34] |
崔迪, 贺杰, 孙婧瑜, 等. 耐力训练与p53抑制剂PFT-α对小鼠骨骼肌线粒体自噬相关基因表达的影响[J].
天津体育学院学报, 2013, 28(5): 422-426 (  0) 0)
|
| [35] |
KIM Y, PARK J, KIM S, et al. PINK1 controls mitochondrial localization of Parkin through direct phosphorylation[J].
Biochemical and Biophysical Research Communications, 2008, 377(3): 975-980 DOI:10.1016/j.bbrc.2008.10.104 (  0) 0)
|
| [36] |
赵晓琴. Omi在离心运动诱导骨骼肌细胞凋亡及针刺干预中的作用[D]. 北京: 北京体育大学, 2014: 1-16
(  0) 0)
|
| [37] |
BIRAL D, JAKUBIEC-PUKA A, CIECHOMSKA I, et al. Loss of dystrophin and some dystrophin-associated proteins with concomitant signs of apoptosis in rat leg muscle overworked in extension[J].
Acta Neuropathologica, 2000, 100(6): 618-626 DOI:10.1007/s004010000231 (  0) 0)
|
| [38] |
KIM E H, SOHN S, KWON H J, et al. Sodium selenite induces superoxide-mediated mitochondrial damage and subsequent autophagic cell death in malignant glioma cells[J].
Cancer Research, 2007, 67(13): 6314-6324 DOI:10.1158/0008-5472.CAN-06-4217 (  0) 0)
|
| [39] |
CHAKRABARTI L, ENG J, IVANOV N, et al. Autophagy activation and enhanced mitophagy characterize the Purkinje cells of pcd mice prior to neuronal death[J].
Molecular Brain, 2009, 2: 24 DOI:10.1186/1756-6606-2-24 (  0) 0)
|
 2018, Vol. 42
2018, Vol. 42


