2. 中国科学院力学研究所高温气体动力学国家重点实验室,北京 100190;
3. 中国科学院大学工程科学学院,北京 100049
2. State Key Laboratory of High Temperature Gas Dynamics, Institute of Mechanics, CAS, Beijing 100190, China;
3. School of Engineering Science, University of Chinese Academy of Sciences, Beijing 100049, China
火焰是由燃烧辐射光子导致的, 这种燃烧发光包括碳颗粒等宽带辐射和具有特殊光谱特征的化学自发光, 其中化学发光由化学反应产生的处于电子激发高能级的分子产生.在激发态分子寿命内, 处于高能级的分子向低能级跃迁, 有两种路径:(1)与其他分子碰撞猝灭, 将能量转移为分子动能; (2)释放一个光子实现能量转移, 即为化学自发光[1].碳氢燃料燃烧中常见的电子激发态组分有: CH(A2Δ, B2Σ-), OH(A2Σ+), C2(d2Пg), CO2(A1B2).为方便描述, 这些跃迁辐射的激发态组分通常记为CH*, OH*, C2*, CO2*等.在过去很长一段时间内, 由于化学发光机理复杂, 人们多用其定性显示火焰结构, 定量研究基本沉寂.近年来, 伴随新型智能可控发动机对传感器需求等的提高[2-3], 以及化学发光与释热、当量比的关系[4-5]的关联, 迫切需要加速化学自发光的反应机理相关研究.
关于OH*化学发光的机理研究较为成熟, 其生成反应通道主要有3个
| $ \text{H}+\text{O}+\text{M}=\text{O}{{\text{H}}^{*}}+\text{M} $ | (R1) |
| $ \text{H}+\text{OH}+\text{OH}=\text{O}{{\text{H}}^{*}}+{{\text{H}}_{\text{2}}}\text{O} $ | (R2) |
| $ \text{CH}+{{\text{O}}_{2}}=\text{O}{{\text{H}}^{*}}+\text{CO} $ | (R3) |
其中, R1反应为氢氧燃烧导致OH*的主要反应, R3可能是碳氢燃烧的主要反应通道.
尽管大多研究工作对于OH*的主要生成反应通道看法一致, 但是不同的研究得到的反应速率系数差距显著.例如, 针对R1反应, Petersen等[6]通过激波管实验获得其速率系数为6×1014 exp(-6 940 cal·mol-1/RT) cm6·mol-2·s-1, 其中, R表示气体常数, T为温度.然而Kathrotia等[7]的结果为1.5(±0.4)×1013 exp(-25 kJ·mol-1/RT)cm6·mol-2·s-1.这两个结果在1 800 K时, 相差至少10倍.更有甚者, Kopp等[8]通过激波加热H2/O2, 得到基于压力的速率常数要比Kathrotia结果又小1个量级, 可见研究者们得到的速率系数差别非常大.
R3的反应速率系数集中于1010~1011量级, 其中Smith等[9]通过甲烷空气预混火焰得到速率系数为1.8×1011 cm3·mol-1·s-1被Kathrotia等[10]认为较为合理.
对于CH*自发光, 由于其前驱物(C2H, O原子)难以测定, CH*浓度预测相比OH*要复杂很多. CH*主要来自于两个激发态向基态的跃迁(~430 nm和~390 nm).由于430 nm处发光强度较大, 研究人员普遍针对这一激发态开展研究, 其生成反应包括
| $ {{\text{C}}_{2}}+\text{OH}=\text{C}{{\text{H}}^{*}}+\text{CO} $ | (R4) |
| $ {{\text{C}}_{\text{2}}}\text{H}+\text{O}=\text{C}{{\text{H}}^{*}}+\text{CO} $ | (R5) |
| $ {{\text{C}}_{\text{2}}}\text{H}+{{\text{O}}_{2}}=\text{C}{{\text{H}}^{*}}+\text{C}{{\text{O}}_{2}} $ | (R6) |
有关各通道反应速率常数的精确性评价, 目前尚无定论.这3个反应中, R5被多个研究者[9, 11-12]认为是生成CH*的主要反应.但是Smith等[9]通过定量实验得到k4=1.1×1013 cm3/(mol·s), k5=2.5×1012 cm3/(mol·s), 认为R4的贡献低于10%. Bozkurt等[13]则认为R6可以忽略.对于R5的速率常数, 研究者们分歧也很大, Joklik等[14]得到的结果为7.0×1012 cm3 mol-1s-1, 比Grebe等[11]的结果要大一个数量级. Hall等[15]却认为该反应系数与温度相关, 且CH*的主要生成反应为R4并非R5.
相对于OH*和CH*, C2*与CO2*的研究很少, C2*的化学反光主要波长范围是436~546 nm, 其中最强的一条辐射带在516 nm附近. Kathrotia等[10]认为其生成反应物主要是C3和O, 然而Tereza等[16]研究反射激波后的碳氢化合物, 认为CH与C反应还有C自身反应是C2*的主要生成反应. CO2*则在250~700 nm都有比较强的辐射, 其主要的生成反应普遍认为是CO+O+M=CO2*+M[17-18], 但速率常数方面研究较少.此外还有一些其他能态会导致CO2发光.
此外, 释热分布诊断一直是发动机中燃烧诊断的难题, 目前尚无有效手段.基于化学自发光的测试技术为此带来了新的视角.众多研究都试图解析化学发光分布与燃烧释热分布的关系.不过绝大部分工作都还停留在实验室层流火焰中.通过燃烧反应计算方法能为关联发光与释热分布, 以及评估化学发光反应机理提供便利, 一直是相关研究的常用手段. Kathrotia等[19]曾通过化学自发光模拟, 指出与OH*, CH*相比, C2*不适合标识释热率; 胡悦等[20]同样认为OH*更加适合标识释热率; Hossain等[21]通过对冲扩散火焰的模拟, 深入分析了用CH*强度预测释热率的能力.较多研究工作采用反应模拟与实验相结合的方式分析发光机理, 如Panoutsos等[22]对比了实验数据与多个详细机理模型下OH*/CH*随着当量比的变化, 发现最佳的模型与实验结果在一个量级内, 但仍有可观的差距. Nori等[23]用燃料流量归一化发光的实验数据, 与模拟对比, 认为Devriendt等[24]提出的CH*的速率系数与实验数据吻合很好.
大部分前人研究都利用光强或强度比的相对值与数值模拟进行对比, 本工作通过精细的光谱强度标定, 定量测量了系列当量比下的甲烷/空气预混层流火焰的各发光组分的强度, 并与一维火焰模拟下的众多机理模型、常数进行对比, 评估了不同反应通道的重要性.
1 实验设备及测量结果实验直接测量的化学发光强度远小于火焰真正的辐射强度, 这主要是由测量系统收集立体角、光经过透镜及光纤的衰减、光谱仪的响应等诸多因素导致的.如何标定光学系统, 获得辐射强度的绝对值是本实验的关键.本工作采用波长分辨的已知辐照度的标准石英卤钨灯来标定探测系统对不同光源不同波长的响应情况.
实验所用发光火焰由直径为50 mm的平面燃烧炉产生, 空气流量固定为18 sLpm, 并控制甲烷流量使当量比在0.7~1.33之间变化.流量计为精度为1.5% F.S, 甲烷与空气的量程分别为6 sLpm和60 sLpm, 所以当量比最大的可能误差为0.11.光学收集系统前端为焦距50.8 mm、直径10 mm的石英透镜, 其后20 mm处为光纤阵列, 收集光并将其导入光谱仪.为保证火焰区域全部纳入收集立体角, 须调节透镜与燃烧炉距离, 本次实验燃烧炉位于透镜光轴上, 即如图 1所示物距为170 mm.为保证甲烷出口298 K, 且当量比不被周围空气改变, 炉底通冷却水, 甲烷空气周围通有氮气保护.为保证光学收集系统响应系数标定的准确度, 标定所用标准灯也安置于光轴上, 物距为500 mm(标准灯标准参数), 实验对外部环境严密遮光并保持收集系统参数设置与火焰采集实验相同.此时透镜处的辐照度(波长分辨)为已知绝对量.标定实验与火焰采集实验是时间异步的, 为方便展示所以同时体现在图 1中.
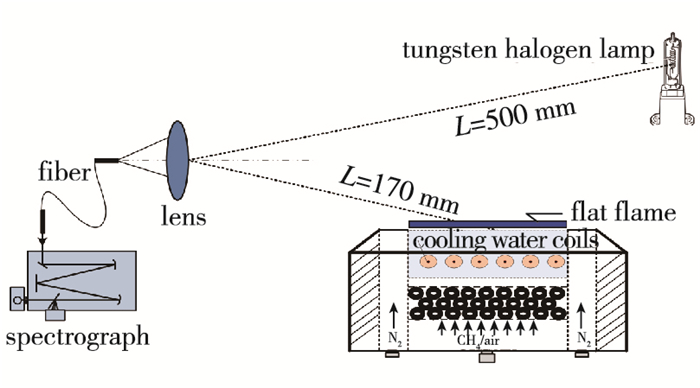
|
| 图 1 实验设备示意图 Fig.1 Schematic diagram of the optical setup |
图 2所示为标定实验获得的采集系统的光谱响应, 采集系统设置与燃烧实验完全相同.这样火焰的发光绝对量可以通过如下公式获得
| $ P=S \cdot \mathit{\Phi }_{\lambda} / R $ | (1) |
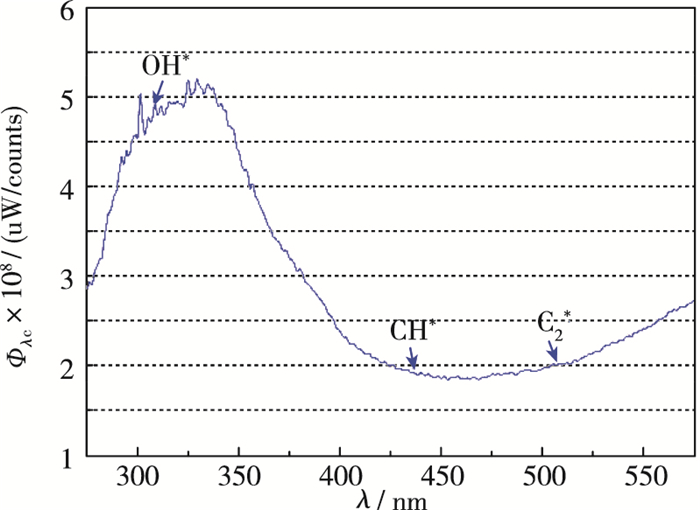
|
| 图 2 光路采集系统的信号响应 Fig.2 Responsivity of the optical system |
其中, S为实验采集信号, Φλ为波长分辨的响应系数, R为收集立体角.其中每种化学自发光的组分强度先去除CO2*宽带辐射背景, 然后积分窄带辐射谱获取.
2 化学发光反应机理模型验证工作主要是基于Chemkin化学反应计算工具箱中一维层流预混火焰模型进行的燃烧计算.反应机理采用目前最为认可的GRI-3.0[30]机理作为主机理, 然后在此基础上加入化学发光反应机理.由于化学发光反应模型研究繁多, 且结果差别较大, 本文针对前人的OH*和CH*的生成反应R1~R6进行了综合对比, 将其反应的通道以及相应的速率常数列于表 1:反应的速率系数表示为k=ATBexp(- Ea/RT), 其中,B为温度指数,Ea为活化能,其单位为cal/mol, R的单位是cal/(mol·K).
| 下载CSV 表 1 OH*和CH*的化学发光组分反应机理 Tab.1 Reaction mechanism of chemiluminescent species OH* and CH* |
通过一维层流预混燃烧模拟得到的直接结果为激发态组分的摩尔浓度, 因而须对整个火焰各波段的辐射进行发光强度的计算, 以实现模拟与实验的定量对比分析.对模拟出的自由基浓度ic进行如下处理:首先根据激发态浓度以及火焰面积计算出激发态总量, 然后根据OH*与CH*的跃迁机率计算光子量, 并最终实现实验与计算的对比[23].
| $ P_{\rm s}=A_{\mathrm{f}} \cdot \int\limits_{0}^{L} i_{\mathrm{e}} \mathrm{d} x \cdot A_{\mathrm{E}} $ |
其中,ic是某激发态组分的浓度分布(mol/cm3), L表示该组分在一维分布(流向)上的距离, Af代表平面燃烧炉的面积, AE表示该组分的Einstein系数A.
3 结果及分析 3.1 激发态测量结果以及释热率位置计算结果图 3所示为测得的不同当量比下的发光光谱.波长范围为150~600 nm.可以看出最明显的发光来自于OH*(A2Σ+X2П 309 nm处)和CH*(A2ΔX2П 430 nm处), 而C2*(d3Пga3Пu 516 nm处)在高当量比下才会产生, 基带主要是CO2*的宽带辐射.此时得到的结果为直接测量数据, 对去除基带后的测量数据进行沿波长积分获得各组分的总强度, 并且通过公式(1)结合标定数据最终计算出OH*与CH*在各个工况下所辐射光子的总强度, 其结果如图 4所示.
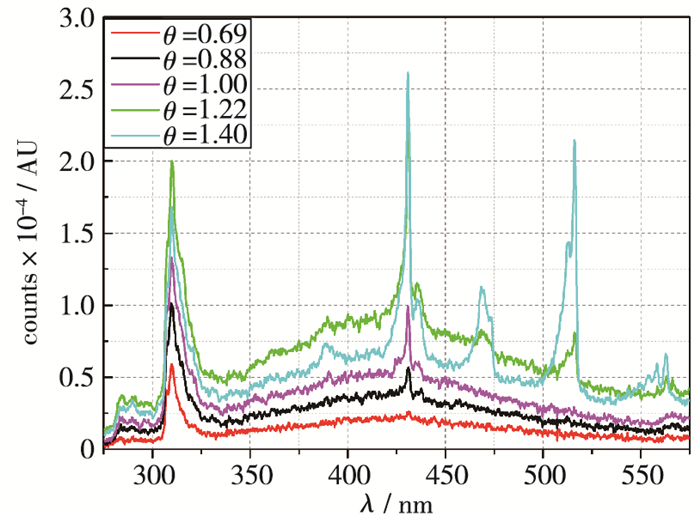
|
| 图 3 250~600 nm的化学发光信号 Fig.3 Chemiluminescence signals from 250 to 600 nm |
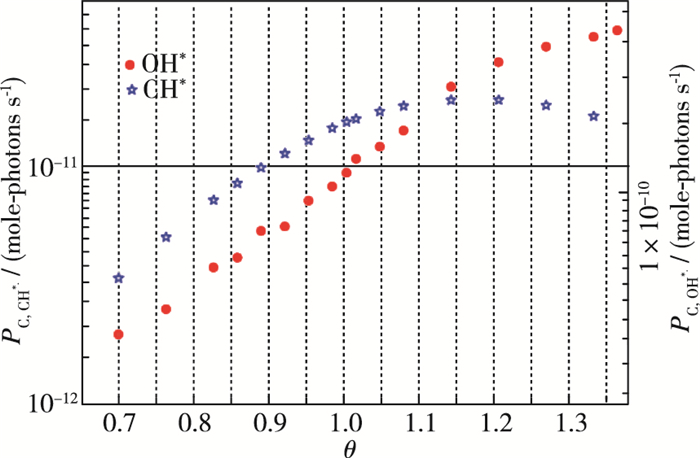
|
| 图 4 CH*与OH*的光子辐射速率 Fig.4 Emission rates of CH*and OH* chemiluminescence |
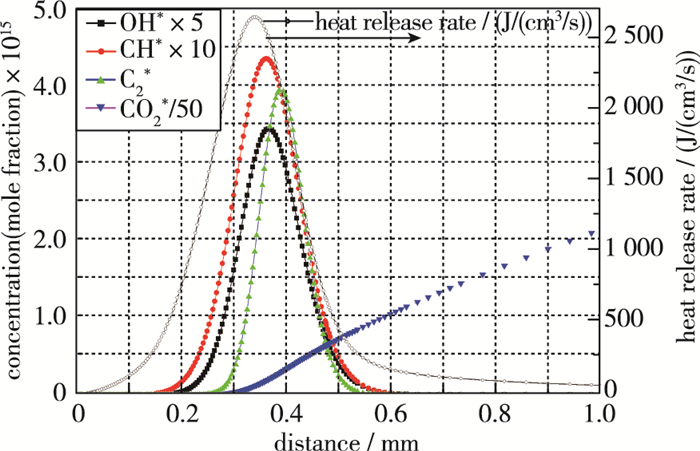
关于放热率的生成计算同样采用Chemkin的一维燃烧模型, 选取了当量比1.0, 甲烷流量1.9 sLpm工况下各种发光组分(OH*, CH*, C2*, CO2*)的分布及与释热分布对比.模拟中, OH*相关子机理采用单独的R3反应通道及Porter等[27]给出的常数; CH*子机理采用Smith等[25]的数据; C2*采用Kojima等[31]机理, CO2*采用了Kopp等[17]的反应机理及速率常数.得到各种激发态物质以及释热率的一维分布如图 5所示.
|
| 图 5 放热率以及激发态组分分布 Fig.5 Profiles of the heat release rate and excited species(OH*, CH*, C2* and CO2*) |
4种激发态组分中, 产生量最多的是CO2*, 但是其与释热率分布基本没有相关性. OH*, CH*, C2*分布形状与释热分布相似, 且3种激发态物质产生的绝对量基本在一个量级上.其中与释热率在位置上最为接近的是OH*与CH*, 并且间隔在0.1 mm内, 说明在本实验中这两种组分都可以很好地标记释热率.
这一结果表明, 在层流火焰中可以使用OH*, CH*发光表征释热分布的位置.不过在真实的发动机湍流火焰中, 尚无充足证据表明可以用发光强度表示释热率分布, 但至少可以用这些化学自发光指示剧烈燃烧和释热的大致区域[32].在化学自发光的未来应用研究中, 须特别关注剪切率、自吸收效应等对发光-释热关系的影响.
3.2 激发态组分的生成通道对比(a) OH*自发光
将R1, R2和R3反应通道单独计算出的OH*强度与实验结果分别绘制于图 6和图 7中.如图 6所示, 针对R1和R2通道, 虽然不同研究工作得到的速率常数不同, 但是该机理模拟的OH*强度随着当量比的变化趋势一致:都在当量比小于1.0时, 发光随当量比增加, 而在当量比大于1.0时则相反, 并且θ=1.0两侧强度随着当量比分布较为对称.这与实验获得的OH*发光强度随当量比的分布特征不符.这说明R1与R2都不是生成OH*的主要通道.
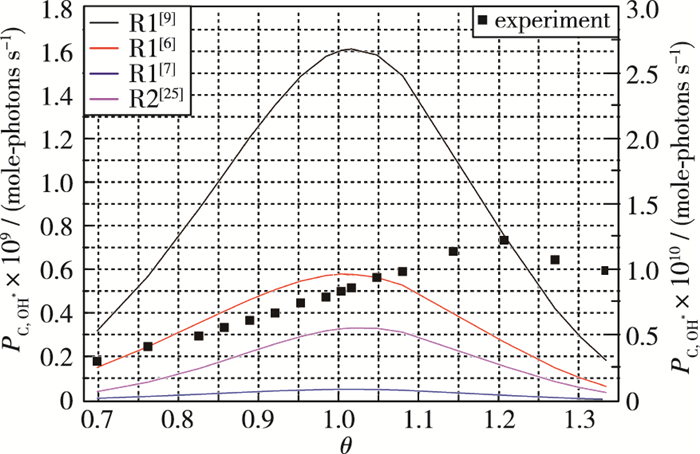
|
| 图 6 实验与R1和R2通道计算OH*发光量对比 Fig.6 OH* intensity comparisons between experimental results and simulations of R1 and R2 |
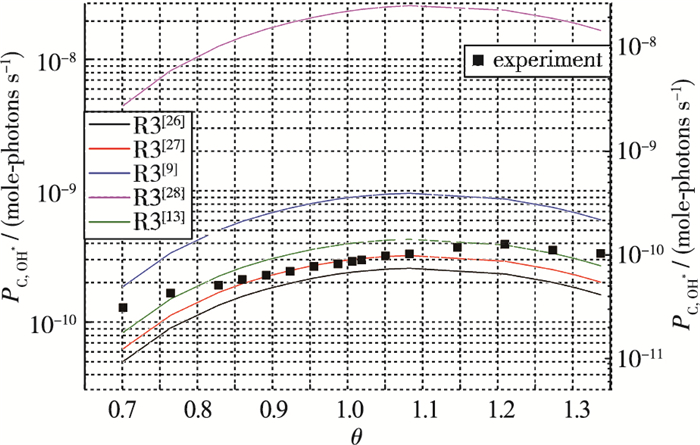
|
| 图 7 实验与R3通道计算OH*发光量对比 Fig.7 OH* intensity comparisons between experimental results and simulations of R3 |
从图 7可见, 实验测得OH*与R3反应通道的模拟结果变化趋势十分接近, OH*自发光都在当量比1.1~1.2之间达到最值.虽然不同研究人员给出的速率系数在计算OH*趋势上相似, 但OH*绝对强度相差很大, 这主要是由不同研究者的速率常数不同所致.例如, 基于Hall等[28]给出的OH*生成系数所计算的结果比实验结果大了两个数量级, 明显准确度不如其他研究者给出的系数.实验结果与基于Bozkurt等[13], Carl等[26], Porter等[27]给出的速率系数所计算得到的结果非常接近, 处于同一量级.因此, 速率常数应在1010量级, 才更为接近实验值.相近的速率常数中, Bozkurt等[13]的结果更为接近实验值, 在θ=0.9附近实验值比模拟值小约30%, 其中部分原因是实验值的OH基态自吸收, 根据Sadanandan等[33]的实验结论, 即使在常压层流火焰中, OH*的自吸收也较为严重, 且在当量比0.9左右最大, 能够达到30%左右.
由图 6, 7的发光强度随当量比变化趋势可知, R3确实为甲烷/空气火焰中OH*的主要生成通道, 这与大多数研究者的认识相同[9, 13].根据实验和模拟定量对比, 可知Bozkurt等[13]的速率常数更为准确: k3=8×1010 cm3/(mol·s).
(b) CH*自发光
相比OH*发光, CH*的生成反应机理并不成熟.此处逐一对比分析3个反应通道的CH*生成量, 如图 8所示.对于通道R4来说, 生成的CH*的量普遍在10-12~10-11之间, 但是使用Hall等[15]的速率系数计算得到的CH*比Smith等[9]的大一个数量级以上.对于通道R5, 仅有Hall等[15]的小于实验结果, 与实验结果最为接近的Bozkurt等[13]比实验值偏大, 约为实验值的2倍(恰当当量比时).

|
| 图 8 实验R4, R5和R6通道计算CH*发光量对比 Fig.8 CH* intensity comparisons between experimental results and simulations of R4, R5 and R6 |
从模拟结果看, R5通道导致的CH*生成量都位于10-11~10-10之间, 远大于R4的贡献率.在前人研究中, R6通道的速率常数分歧较大, 部分研究人员认为其贡献率不及R5通道.从图 8可见, 3个通道中仅有R6产生的CH*随当量比单调增加. R4跟R5通道的模拟结果都是随着当量比先增加, 在当量比为1.2左右时开始减少, 然而实验测得的CH*随着当量比增加而单调增多.因此, 针对较大当量比工况, R6通道与实验结果的趋势更为接近.这至少说明在较大当量比的甲烷/空气火焰中R6起主导作用.
同时考虑3个反应通道时, 模拟值CH*比实验值大一个量级.当然, 模拟工况和实验并非完全相同, 模拟中未考虑自吸收和非绝热, 都会导致模拟值稍大于实际情况[34].即使考虑这些影响, 现有机理常数仍明显高估了CH*生成率, 因此须开展更为详细的机理验证实验, 以修正、优化反应速率常数.
4 结论为分析碳氢燃料燃烧的化学自发光生成机理, 以及自发光与释热率、当量比的关系, 在甲烷/空气预混层流火焰上, 定量测量了不同当量比下各发光组分的辐射强度.并利用多种反应通道和常数进行一维模拟计算.结果表明:在释热分布方面, 排除了CO2*作为释热标识的可能性; 在化学发光机理方面, 探究了OH*和CH*的各自3个可能生成通道.模拟与实验的定量对比表明, 对于甲烷/空气火焰, 生成OH*的主要通道为R3 (CH+O2=OH*+CO), 速率常数应为1010量级; 对于CH*, 当量比比较大时, R6 (C2H+O2=CH*+CO2)反应不可忽略, 但现有反应机理明显高估CH*生成量, 需要优化速率常数.
致谢 感谢国家自然科学基金(11372329,11802315)和中国科学院科研仪器设备研制项目(YZ201637)的资助与支持.| [1] |
Gaydon A G. The spectroscopy of flames[M]. 2nd ed. New York: John Wiley & Sons, 1974.
|
| [2] |
林鑫, 李飞, 王宽亮, 等. 旋流火焰燃烧温度场二维吸收光谱诊断[J]. 气体物理, 2019, 4(2): 55-61. Lin X, Li F, Wang K L, et al. Diode laser absorption tomography for swirling flame diagnostics[J]. Physics of Gases, 2019, 4(2): 55-61. (in Chinese) |
| [3] |
余西龙, 曾徽, 林鑫, 等. 可调谐二极管激光吸收光谱诊断技术:原理和应用[J]. 气体物理, 2016, 1(5): 52-63. Yu X L, Zeng H, Lin X, et al. Tunable diode laser absorption spectroscopy:principle and application[J]. Physics of Gases, 2016, 1(5): 52-63. (in Chinese) |
| [4] |
Higgins B, McQuay M Q, Lacas F, et al. An experi-mental study on the effect of pressure and strain rate on CH chemiluminescence of premixed fuel-lean methane/air flames[J]. Fuel, 2001, 80(11): 1583-1591. |
| [5] |
Hardalupas Y, Orain M. Local measurements of the time-dependent heat release rate and equivalence ratio using chemiluminescent emission from a flame[J]. Combustion and Flame, 2004, 139(3): 188-207. |
| [6] |
Petersen E, Kalitan D, Rickard M. Calibration and chemical kinetics modeling of an OH chemiluminesence diagnostic[R]. AIAA 2003-4493, 2003.
|
| [7] |
Kathrotia T, Fikri M, Bozkurt M, et al. Study of the H+O+M reaction forming OH*:Kinetics of OH*, chemiluminescence in hydrogen combustion systems[J]. Combustion and Flame, 2010, 157(7): 1261-1273. |
| [8] |
Kopp M, Brower M, Mathieu O, et al. CO2*, chemiluminescence study at low and elevated pressures[J]. Applied Physics B, 2012, 107(3): 529-538. |
| [9] |
Smith G P, Luque J, Park C, et al. Low pressure flame determinations of rate constants for OH(A) and CH(A) chemiluminescence[J]. Combustion and Flame, 2002, 131(1/2): 59-69. |
| [10] |
Kathrotia T, Riedel U, Seipel A, et al. Experimental and numerical study of chemiluminescent species in low-pressure flames[J]. Applied Physics B, 2012, 107(3): 571-584. |
| [11] |
Grebe J, Homann K H. Blue-green chemiluminescence in the system C2H2/O/H. formation of the emitters CH(A2Δ), C2(d3Πg) and C2H*[J]. Berichte der Bunsengesellschaft Fã1/4r Physikalische Chemie, 1982, 86(7): 587-597. |
| [12] |
Elsamra R M I, Vranckx S, Carl S A. CH(A2Δ) Formation in hydrocarbon combustion:the temperature dependence of the rate constant of the reaction C2H+O2CH(A2Δ)+CO2[J]. Journal of Physical Chemistry A, 2005, 109(45): 10287-10293. |
| [13] |
Bozkurt M, Fikri M, Schulz C. Investigation of the kinetics of OH* and CH* chemiluminescence in hydrocarbon oxidation behind reflected shock waves[J]. Applied Physics B, 2012, 107(3): 515-527. |
| [14] |
Joklik R G, Daily J W, Pitz W J. Measurements of CH radical concentrations in an acetylene/oxygen flame and comparisons to modeling calculations[J]. Symposium (International) on Combustion, 1988, 21(1): 895-904. |
| [15] |
Hall J M, de Vries J, Amadio A R, et al. Towards a kinetics model of CH chemiluminescence[R]. AIAA 2005-1318, 2005.
|
| [16] |
Tereza A M, Demidenko T S, Garmash A A, et al. Experimental study of the emission of electronically excited CH*, C2*, OH*, and CO2* during ignition of hydrocarbons behind reflected shock waves[J]. Journal of Physics:Conference Series, 2016, 774(1): 012080. |
| [17] |
Kopp M M, Mathieu O, Petersen E L. Rate Determina-tion of the CO2* Chemiluminescence Reaction CO+O+M$\rightleftharpoons $CO2*+M[J]. International Journal of Chemical Kinetics, 2015, 47(1): 50-72. |
| [18] |
Vlasov P A, Zhiltsova I V, Smirnov V N, et al. Chemical ionization of n-hexane, acetylene, and methane behind reflected shock waves[J]. Combustion Science and Technology, 2017, 190(1): 57-81. |
| [19] |
Kathrotia T, Riedel U, Warnatz J. A numerical study on the relation of OH*, CH*, and C2* chemiluminescence and heat release in premixed methane flames[C]. Proceedings of the 4th European Combustion Meeting. Vienna: Combustion Institute, 2009: 1-5.
|
| [20] |
胡悦, 谭建国, 吕良. 甲烷-空气预混火焰中OH*标识放热率的数值模拟研究[J]. 推进技术, 2018, 39(4): 835-842. Hu Y, Tan J G, Lyu L. Numerical evaluation of heat release rate measurement using OH* chemiluminescence in premixed methane-air flames[J]. Journal of Propulsion Technology, 2018, 39(4): 835-842. (in Chinese) |
| [21] |
Hossain A, Nakamura Y. A numerical study on the ability to predict the heat release rate using CH* chemiluminescence in non-sooting counterflow diffusion flames[J]. Combustion and Flame, 2014, 161(1): 162-172. |
| [22] |
Panoutsos C S, Hardalupas Y, Taylor A M. Numerical evaluation of equivalence ratio measurement using OH* and CH* chemiluminescence in premixed and non-premixed methane-air flames[J]. Combustion and Flame, 2009, 156(2): 273-291. |
| [23] |
Nori V N, Seitzman J M. CH* chemiluminescence modeling for combustion diagnostics[J]. Proceedings of the Combustion Institute, 2009, 32(1): 895-903. |
| [24] |
Devriendt K, Van Look H, Ceursters B, et al. Kinetics of formation of chemiluminescent CH(A2Δ) by the elementary reactions of C2H(X2 Σ+) with O(3P) and O2(X3Σg-):A pulse laser photolysis study[J]. Chemical Physics Letters, 1996, 261(4/5): 450-456. |
| [25] |
Smith G P, Park C, Luque J. A note on chemiluminescence in low-pressure hydrogen and methane-nitrous oxide flames[J]. Combustion and Flame, 2005, 140(4): 385-389. |
| [26] |
Carl S A, Van Poppel M, Peeters J. Identification of the CH+O2→OH(A)+CO reaction as the source of OH(A-X) Chemiluminescence in C2H2/O/H/O2 atomic flames and determination of its absolute rate constant over the range T=296 to 511 K[J]. Journal of Physical Chemistry A, 2003, 107(50): 11001-11007. |
| [27] |
Porter R P, Clark A H, Kaskan W E, et al. A study of hydrocarbon flames[J]. Symposium (International) on Combustion, 1967, 11(1): 907-917. |
| [28] |
Hall J M, Petersen E L. An optimized kinetics model for OH chemiluminescence at high temperatures and atmospheric pressures[J]. International Journal of Chemical Kinetics, 2006, 38(12): 714-724. |
| [29] |
Bulewicz E M, Padley P J, Smith R E. Spectroscopic studies of C2, CH and OH radicals in low pressure acetylene+oxygen flames[J]. roceedings of the Royal Society of London. A. Mathematical and Physical Sciences, 1970, 315(1520): 129-147. |
| [30] |
Smith G P, Golden D M, Frenklach M, et al. Available at http://www.me.berkeley.edu/grimech/mech.
|
| [31] |
Kojima J, Ikeda Y, Nakajima T. Basic aspects of OH(A), CH(A), and C2(d) chemiluminescence in the reaction zone of laminar methane-air premixed flames[J]. Combustion and Flame, 2005, 140(1/2): 34-45. |
| [32] |
Gamba M, Mungal M G. Ignition, flame structure and near-wall burning in transverse hydrogen jets in supersonic crossflow[J]. Journal of Fluid Mechanics, 2015, 780: 226-273. |
| [33] |
Sadanandan R, Meier W, Heinze J. Experimental study of signal trapping of OH laser induced fluorescence and chemiluminescence in flames[J]. Applied Physics B, 2012, 106(3): 717-724. |
| [34] |
Wang K L, Li F, Wu Y, et al. Quantitative measure-ments of chemiluminescence in a laminar methane-air premixed flame and comparison to numerical methods[J]. Energy & Fuels, 2018, 32(4): 5536-5543. |



