| 高发酵性能酸奶直投式发酵剂嗜热链球菌菌株的筛选 |
乳酸菌中嗜热链球菌是酸奶及奶酪生产过程中非常重要的发酵菌株,优点是可以赋予发酵产品特殊质地以及风味等。其菌株的活力对发酵剂特性有直接影响,因而会影响终产品的质量。目前我国大多是以国外进口的直投式发酵剂作为生产酸奶的菌株,虽然国内也有少量自主研发产品出现,但大多缺点明显,菌株活力低、发酵性能差等,与国外产品相去甚远。所以,自主研发高活力、性能稳定的,活性高的发酵剂菌株势在必行。
Badel[1]等人研究菌株产生胞外多糖(EPS)增加发酵乳的粘稠度,Duboc[2]等人证明了胞外多糖多聚物作为增稠剂、胶凝剂改善酸奶的品质,孟利[3]等人证明其有改善肠道微环境、抗癌、增强人体免疫力等生理作用,提高了产品的营养保健功能。通过对分离自新疆地区传统酸奶中的20株菌的生长、产酸的能力和产胞外多糖(exopolysaccharides, EPS)的能力以及尿素分解能力等指标的测定,得到一株有较高发酵性能的嗜热链球菌菌株,命名为QLMCC19。
1 实验材料和方法 1.1 菌株实验所用嗜热链球菌株除S.thermophilus YL外都来自于新疆传统的发酵乳。S.thermophilus YL和L.bulgaricus JB均是从市场上销售的伊利及佳宝酸奶中分离得到的。
1.2 培养基和实验仪器M17培养基;CDM培养基;尿素琼脂平板。pH计(METTLER TOLEDO,FE20),分光光度计(Eppendorf BioPhotometer,RS232-);真空浓缩仪(Eppendorf Concentrator 5301,AG 22331 Hamburg);数字式粘度计(上海精天电子仪器,DV-1)。
1.3 实验方法 1.3.1 Lysozyme/phenol法从纯培养物中提取总DNA以及发酵乳的制备方法涉及到的两种发酵乳:检测酸度的发酵乳以及感官品评的发酵乳。检测酸度是用发酵乳为12%(W/V)的脱脂奶粉, 110 ℃下灭菌15 min,放凉,然后按2%将嗜热链球菌接入其中,42 ℃下培养3 h,检测该发酵乳的总酸度。感官品评的发酵乳用的纯牛奶以巴氏灭菌法处理,再加入6%的白砂糖,嗜热菌株和L.bulgaricus JB以1:2比例接入到纯牛奶中,42 ℃下培养6 h,经过室温后熟和低温冷藏后,由实验室的人员进行品尝并作出评价。
1.3.2 酸奶基本属性测定分别对发酵乳的酸度测定以及发酵乳活菌数测定、菌株利用半乳糖能力分析、菌株脲酶活性检测、发酵乳脱水收缩性进行测定。
1.3.3 菌株产胞外多糖(EPS)的能力分析将嗜热链球菌接种于LM17液体培养基上,在42 ℃下静置培养24 h。在10 000×g, 1 min离心,收取菌体,悬浮于TPM buffer,调整浓度为5×108 个/mL。将菌体与刚果红染料按1:1体积混合均匀。25 ℃下静置避光30 min,16 000×g,离心5 min,上清液以及染色液以TPM buffer作空白对照,在490 nm下检测刚果红染料吸收值,每种重复3次。
2 结果与讨论 2.1 嗜热链球菌菌株的筛选首先,选取正向引S139F 5'-TGGAATTCAGCGCGAGAGTCTACG-3'和反向引物S1252R5'-TAGTCGACTGACTAATACCGATACG-3', 对乳酸菌进行嗜热链球菌快速鉴定筛选[4]。从实验室的乳酸菌库中得到20株菌中7株菌的PCR扩增条带为1113bp(图 1)
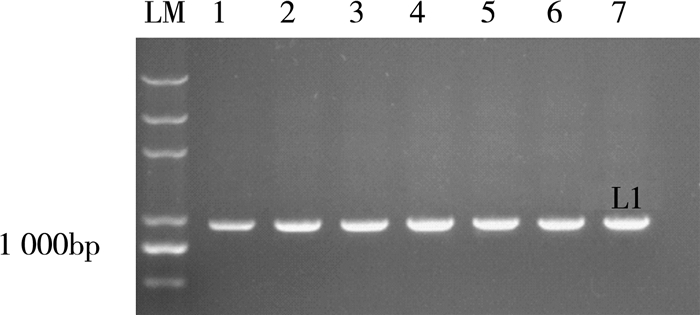 |
| L1为对照菌S.thermophilus YL 图 1 利用PCR技术检测分离到的嗜热链球菌 |
由图 1得,该条带与对照菌株S.thermophilus YL目的条带一致,是嗜热链球菌,将其命名为QLMCC01-QLMCC20。
2.2 嗜热链球菌菌株的生长以及产酸能力的比较筛选酸奶发酵剂的非常重要指标之一是该菌株的产酸能力。嗜热链球菌发酵的末端产物主要是乳酸,发酵方式同型乳酸发酵。菌株把原料奶中的乳糖转变成乳酸,令pH值降低进而酸化,使酪蛋白凝集沉淀,即凝乳。酸奶的质量与发酵剂的产酸能力是直接相关的,用生长速度快及产酸能力强的发酵剂能缩短时间并节约成本。酸度可分为总酸度和有效酸度。总酸度是指所有酸性物质的总量,其中包括已解离的酸浓度;有效酸度即样品中游离状态的氢离子浓度,以pH计测定。对筛选到的20株菌的生长及产酸能力测定,结果如图 2、图 3所示。
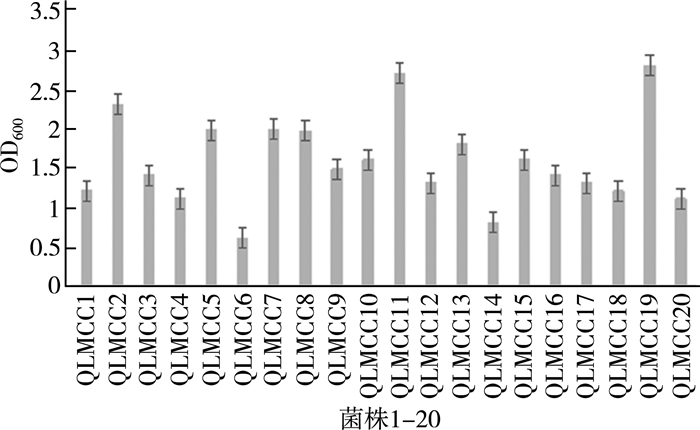 |
| 图 2 不同嗜热链球菌菌株生长能力 |
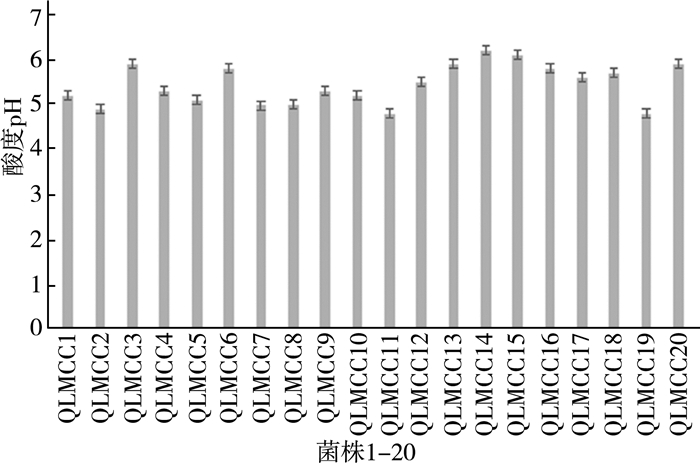 |
| 图 3 不同菌株产酸能力 |
由图 2得出,不同菌株的生长能力差别很大,QLMCC11和QLMCC19在培养24 h后,OD600值接近到3.0,而QLMCC06、QLMCC14的生长能力较弱,培养24 h后OD600值不到1.0。因此,不同的酸奶中菌株的生长能力差别较大。
由图 3得出, 生物量高的菌株产酸能力强,如QLMCC07、QLMCC19。也有菌株,比如QLMCC03,产酸能力最强,但生物量却不高。
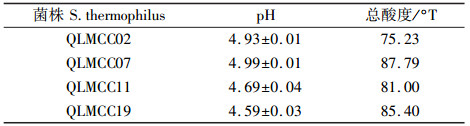
随后,选取4份pH小于5.0的发酵乳,然后进行总酸度滴定,结果如表 1所示。
| 表 1 部分嗜热链球菌菌株的产酸能力比较 |
 |
酸奶酸度的测定方法是以氢氧化钠标准溶液滴定,使用的浓度为0.1 mol/L氢氧化钠标准溶液的毫升数乘以10,得到酸度°T [5]。
根据酸奶统一国家标准(GB2746—1999),发酵乳的酸度需要大于70°T,原味酸奶的优良口感酸度一般在85~95 °T[6]。由表 1可得,选取的4株嗜热链球菌菌株都已达到国家标准,其中菌株QLMCC07和菌株QLMCC19的酸度最适合,口感良好。
2.3 嗜热链球菌的菌株半乳糖利用能力研究嗜热链球菌可利用的糖类有乳糖、蔗糖、葡萄糖、果糖以及半乳糖,其中半乳糖、果糖只能被个别菌株利用。大部分的菌株不能通过Leloir途径利用半乳糖,被LacS泵出细胞外[7]。半乳糖经嗜热链球菌泵出胞外后能缓解“乳糖不耐症”,但在制备过程中会造成碳源浪费。所以需要筛选能够利用半乳糖的菌株,以此来提高碳源利用率。通过分析20株菌的半乳糖利用能力得出,菌株QLMCC02、QLMCC14、QLMCC18株菌具有能力利用半乳糖,占总菌株的15%。这个比例高于“少数菌株有半乳糖利用能力”的规律,如图 4所示。
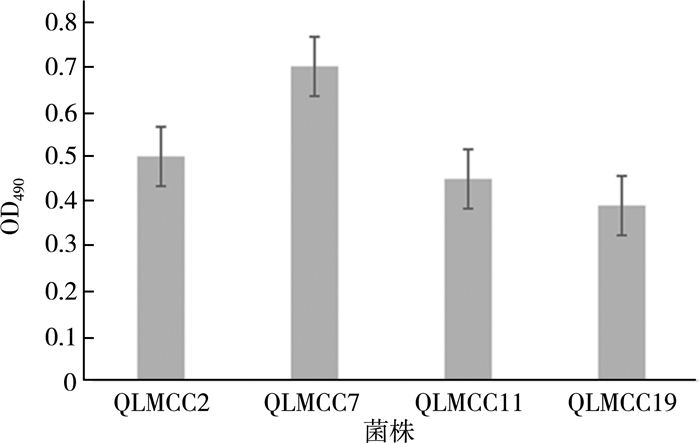 |
| 图 4 半乳糖为碳源的CDM中生长能力 |
由图 4可得,QLMCC14和QLMCC18在半乳糖为唯一碳源的CDM中OD600 nm达到0.613±0.03和0.652±0.04。鉴于这两株菌在培养基中的生物量比较高,认为菌株的生长能力与该菌株利用半乳糖的能力有关,具有利用半乳糖能力的菌株可有效利用碳源,具有最大的生长能力。
2.4 嗜热链球菌的脲酶活性分析嗜热链球菌是发酵剂中唯一具有脲酶活性的菌株,在其发酵过程中能将尿素转变成氨,不仅提供了额外的氮源,还产生风味物质以及有助于菌株抵抗酸胁迫[8]。分析20株嗜热菌株的脲酶活性,发现菌株都可以分解尿素,但是不同菌株脲酶活性是不同的(表 2)。
| 表 2 少部分嗜热链球菌脲酶的活性检测 |
 |
我们以没有脲酶活性的菌株L.ATCC11842为阴性对照(表 2),该菌株不能分解尿素,在嗅甲酚紫平板上不会改变颜色pH(6.0)。嗜热链球菌有脲酶活性,能分解尿素使pH升高,使溴百里酚蓝发生反应,变成蓝绿色。表 2B、C、D依次是脲酶的活性由强减弱的颜色。当前,脲酶活性未被列入筛选发酵剂的指标,但脲酶活性在菌株抵抗酸胁迫压力这方面意义很重要。
2.5 嗜热链球菌产胞外多糖(EPS)的能力分析嗜热链球菌是乳品发酵剂常用的菌株之一[9]。通过相关文献数据可知,嗜热链球菌的多糖产量甚至可以大于50 mg /L[10]。发酵乳粘度的测定是在4 ℃下取适量酸奶放入烧杯,用DV-1的三号转子以60 r/min、扭矩10%~100%进行测定,时间为30 s。发酵过程中产生EPS能够令发酵乳有“可拉丝”的现象,质地粘稠,是酸奶粘稠的主要原因。除此之外,EPS也有消除发酵乳脱水收缩、维持产品结构等优点[11]。所以,EPS产量高是优良的乳品发酵菌株的必要条件。较低温度下,菌体生长速度也较慢,因此细胞壁的合成速度也减慢,从而使较多的磷酸异戊二烯被菌体用于合成EPS[12]。以刚果红结合EPS法分析20株嗜热链球菌的产EPS的能力。刚果红的特征值吸收峰在490 nm处,记为A。与EPS结合高速离心后,刚果红和EPS产生螯合物沉淀下来,刚果红浓度降低,然后检测490 nm处吸收值,标记为B。用A与B的差值来显示嗜热链球菌产EPS的能力,AB差值的大小证明该菌株EPS产量的多少。结果如图 5所示。
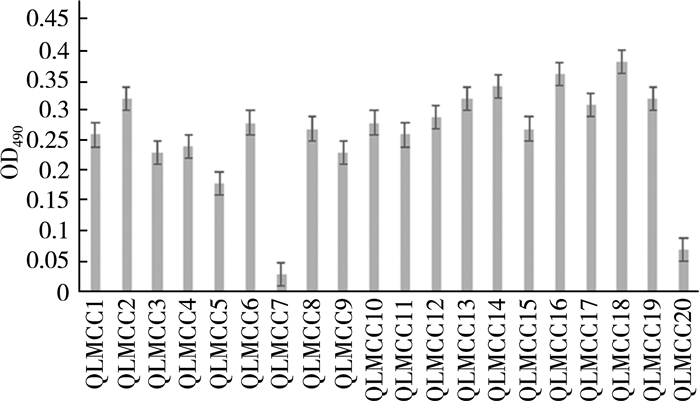 |
| 图 5 嗜热链球菌EPS的产量 |
由图 5得,不同菌株EPS产生能力是不一样的。在这20株菌株中,QLMCC16和QLMCC18产EPS的能力较强,但QMCC07和QLMCC20产EPS的能力相对较弱,且明显比其他嗜热链球菌低。
2.6 其他发酵乳指标检测分析以及感官品评综合评价以上菌株的生长、产酸、胞外多糖产量等,选出四株嗜热菌株:QLMCC02、QLMCC03、QLMCC18和QLMCC19。以从市售伊利酸奶分离出的S.thermophilus YL作为阳性对照进行实验,对该发酵乳进行活菌数的检测和感官品评等评价。选择以凝乳时间、酸度、脱水收缩等特征来品评菌株的发酵能力。结果如表 3所示。
| 表 3 感官品评 |
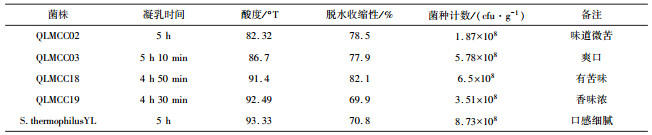 |
脱水性检测的方法是取20 g样品,4 ℃低速离心(1 000 r/min, 10 min), 后取上清液,再检测重量。
脱水收缩性公式:脱水收缩性=上清液重量(g)/样品重量(g)×100%。
菌株发酵能力较强,能将牛奶凝固时间控制在5 h 10 min内。由表 2得,QLMCC19凝乳时间最少,只有4 h 30 min。其发酵酸奶的酸度都维持在85~95°T之间,酸度适宜。此菌株脱水收缩性低持水性较好,乳清析出少。其中,QLMCC19和S.thermophilus YL持水性最好,有光泽,颗粒度好,有堆积感和拉丝感,入口饱满、清爽、有粘连感、硬度适中、空口留香,而QLMCC03和QLMCC02持水性较差,有涩口感,颗粒度差,堆积感差等。此外,酸奶中嗜热链球菌活菌数都达到108,符合国家制定标准[13]。综上,选择QLMCC19为最优发酵菌株,其冻干后菌量为1 011 cfu/g,发酵出的酸奶各项指标都达到市售酸奶的水平,同时缩短发酵时间,提高效率,节约成本。
将筛选出的菌株QLMCC19接到甘油管中,放到4 ℃冷藏保存。
3 结论与展望以性能优良的嗜热链球菌作为目的菌株,以酸奶发酵剂的几个重要指标对菌株比较和筛选。选出的菌株QLMCC19在发酵过程中持水性较好,EPS产量较高,用这株菌株作为发酵剂可以从根本上解决酸奶硬度不够、黏糊状的现象,排除添加明胶等添加剂来维持酸奶硬度的影响[14]。选择冷冻干燥保护剂甘油来保存菌株QLMCC19。与液体发酵剂相比,选出的QLMCC19菌株可以直接投入到发酵罐中生产酸奶,贮藏在普通冰箱中即可,运输成本和贮藏成本都低,使用过程中的方便性、低成本性和品质稳定性突出。实验中还发现菌株QLMCC19可利用半乳糖,产酸能力强、发酵时间短,是一株性能优良的发酵剂潜力菌株,该菌株的发现为研究和开发乳酸菌直投式发酵剂打下了基础。
| [1] |
BADEL S, BEMARDI T, MICHAUDP. New perspective for lactobacilli exopolysaccharides[J]. biotechnology advances, 2011(29): 54-66. |
| [2] |
DUBOC P., MOLLET B. Applications of exopolysaccharides in the dairy industry[J]. Int Dairy, 2001(11): 759-768. |
| [3] |
孟利, 张兰威. 乳酸菌胞外多糖的生理功能及其在食品中的应用[J]. 现代食品科技, 2005, 21(4): 133-136. |
| [4] |
VAN DEN BOGAARD P T, HOLS P, KUIPERS O P, et al. Sugar utilisation and conservation of the gal-lac gene cluster in streptococcus thermophilus[J]. Systematic and Applied microbiology, 2004(27): 10-17. |
| [5] |
刘冬梅, 李理, 梁世中, 等. 直投式酸奶发酵剂研究进展[J]. 中国乳品工业, 2005, 33(1): 29-33. |
| [6] |
LU W, KONG W, YANG P, et al. A one-step PCR-based method for specific identification of 10 common lactic acid bacteria and bifidobacterium in fermented milk[J]. International Dairy Journal, 2015, 25(1): 7-12. |
| [7] |
谢继志, 肖宏斌. 酸奶中乳酸菌数及酸度的检测与评价[J]. 中国乳品工业, 2002, 30(1): 23-25. |
| [8] |
徐成勇, 吴昊, 郑思聪, 等. 酸乳后酸化影响因子的初步研究[J]. 食品与发酵工业, 2007, 32(12): 10-14. |
| [9] |
HOLS P, HANCY F, FONTAINE L, et al. New insights in themolecular biology and physiology of streptococcus thermophilusrevealed by comparative genomics[J]. FEMS microbiology reviews, 2005, 29(3): 435-463. |
| [10] |
DELORME C. Safety assessment of dairy microorganisms:streptococcus thermophilus[J]. International Journal of Foodmicrobiology, 2008, 126(3): 274-277. |
| [11] |
IYERR, TOMAR S, MAHESWARI T U, et al. Streptococcus thermophilus strains:multifunctional lactic acid bacteria[J]. International Dairy Journal, 2010, 20(3): 133-141. DOI:10.1016/j.idairyj.2009.10.005 |
| [12] |
HAN J, XIE H, ZHAO J H. Fast assaying of extra polysaccharidesconcentration and optimizing the conditions of fermentation ofbacillus subtilis[J]. Food Science and Technology, 2007(6): 69-70. |
| [13] |
HOLS P, HANCE F, FONTAINE L, et al. New insights in the molecular biology and physiology of streptococcus thermophilus revealed by comparative genomics[J]. FEMS microbiology reviews, 2005(29): 435-463. |
| [14] |
DUBOC P, MOLLET B. Applications of exopolysaccharides in the dairy industry[J]. International Dairy Journal, 2001, 11(1): 759-768. |
 2018, Vol. 32
2018, Vol. 32


