| 麦麸多肽抗氧化及吸湿保湿性能的测定 |
2. 青岛科技大学 海洋科学与生物工程学院,青岛 266042
2. College of Marine Science and Biological Engineering, Qingdao University of Science and Technology, Qingdao 266042, China
随着社会的发展和人民生活水平的提高,各种生物多肽的开发和研究价值日益提升。多肽是一种涉及生物体内各种细胞功能的生物活性物质,具有降血压、降胆固醇、抗氧化和抗衰老等生理功能[1]。大豆、玉米等蛋白均可在蛋白酶中酶解得到其多肽[2],小麦麸皮作为小麦加工的副产品,含有至少15%以上的蛋白质,是一种潜在的植物蛋白资源[3]。麸皮可减少对人体有害的饱和脂肪酸的摄入,同时可提供一些人体必需的氨基酸和其他的生物活性物质[4]。但由于口味不佳、在实际生产中多被作为动物饲料等,只有小部分麦麸被应用到食品包装或被制成高纤维产品[5-6],很少有大规模的深加工和再利用,造成了资源浪费[7]。近年来对麦麸多肽的研究利用已经越来越多,成为食品、医药和生物研究方面的一大热点。
利用蛋白酶酶解麦麸蛋白可制备麦麸多肽,研究其抗氧化性能和抑菌性等[4, 8],但对其吸湿保湿性能的研究目前还未见报道。从麦麸多肽本身结构特点推测其可能具有较好的吸湿保湿性能,再加上多肽类固有的抗氧化能力,有望成为新型化妆品保湿剂。
通过超声法提取麦麸蛋白,利用酶解法制备麦麸多肽,测定其抗氧化及吸湿保湿性能,探究了麦麸多肽抗氧化能力和在不同环境中的吸湿保湿能力,为进一步探究麦麸多肽在化妆品保湿剂及天然抗氧化剂等方面的综合利用提供理论依据。
1 材料与仪器 1.1 材料麦麸(夏津县发达面粉厂);麦麸蛋白(实验室自制);碱性蛋白酶(2×105 U/g)、风味蛋白酶(8×105 U/g)(南宁庞博生物工程有限公司);鱼胶原蛋白肽(陕西柏威生物科技有限公司);胶原蛋白肽(西安南斯生物科技有限公司);小麦低聚肽(河南鼎天化工产品有限公司);大豆低聚肽(西安四季生物科技有限公司);2, 2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS)、过硫酸钾、亚油酸,均为分析纯(上海麦克林生化科技有限公司);氢氧化钠、氢氧化钾、盐酸、甲醛、三氯化铁、三氯化铁、铁氰化钾、水杨酸、双氧水、硫酸亚铁,均为分析纯(国药集团化学试剂有限公司)。
1.2 仪器SHA-BA水浴恒温振荡器;PHS-3C pH计;TG1650-WS离心机;FD-1A-50冷冻干燥机;UV-1800PC紫外分光光度计;K9860全自动凯氏定氮仪。
2 实验 2.1 麦麸蛋白的提取称取适量40目筛的小麦麸皮,按照料液比为1:19加入0.02 mol/L KOH溶液,用玻璃棒搅匀,置于超声清洗仪50 ℃下反应60 min。反应完后,在6 000 r/min转速下于离心机中离心10 min,收集上清液,调pH至4.8,静置4 h后再在相同转速下离心10 min,洗涤沉淀至中性,沉淀冷冻干燥得到蛋白质干粉。
2.2 麦麸多肽的制备称取适量麦麸蛋白,配成2.0%的蛋白悬浮液,按照1:2的配比加入风味蛋白酶和碱性蛋白酶进行酶解反应。其中酶添加量为10 000 U/g,温度设置为50 ℃,pH 8.0下酶解5 h。酶解液95 ℃下灭酶10 min后,恢复室温,过滤,滤液冷冻干燥得到麦麸多肽。
2.3 麦麸蛋白及多肽基本成分分析水分的测定采用直接干燥法,参照GB/T 5009.3-2016;灰分的测定参照GB/T 5009.4-2016;蛋白质的测定采用凯氏定氮法,参照GB/T 5009.5-2016;总糖含量测定按照苯酚硫酸法SN/T 4260-2015。
2.4 抗氧化性能的测定 2.4.1 还原性能的测定[9]以水为溶剂,分别配置麦麸多肽质量浓度为0.5、1.0、2.0、4.0、6.0、10.0、20.0 mg/mL的待测样。取1.0 mL待测样,依次加入2.5 mL pH = 6.6的磷酸盐缓冲液和2.5 mL质量分数为1%的铁氰化钾溶液,混匀,于50 ℃的水浴锅中保温20 min。再加入2.5 mL质量分数为10%的三氯乙酸溶液,混匀,于3 000 r/min离心10 min。取5.0 mL的上清液,与5.0 mL的蒸馏水混匀,加入1.0 mL 1%的三氯化铁溶液,混匀、静置10 min,于波长700 nm处测定吸光度并以维生素C(Vc)为对照。
2.4.2 羟基自由基清除能力的测定[10]以蒸馏水为溶剂,分别配置麦麸多肽质量浓度为0.5、1.0、2.0、4.0、6.0、10.0、20.0 mg/mL的待测样。取2.0 mL待测样,依次加入2.0 mL 6.0 mmol/L的FeSO4溶液和2.0 mL 6.0 mmol/L的H2O2溶液,混匀,静置10 min。再加入2.0 mL 6.0 mmol/L的水杨酸溶液,混匀,置于37 ℃水浴锅中30 min后,于3 000 r/min离心10 min。取上清液,于波长510 nm处测定吸光度,记为A1;将蒸馏水代替水杨酸反应的吸光度记作A2;将蒸馏水代替待测样反应的吸光度记作A3。
羟基自由基清除率(%)=(A1-A2)/(A3-A2)×100%
2.4.3 ABTS自由基清除能力的测定[11-12]取5 mL 7 mmol/L的ABTS和88 μL 140 mmol/L的过硫酸钾,在室温下避光静置过夜,形成ABTS自由基工作液。使用前用磷酸盐缓冲液稀释至734 nm处的吸光度为0.700 ± 0.002。取4 mL ABTS自由基工作液,加入1 mL麦麸多肽溶液,混合10 s,在25 ℃下静置6 min,在734 nm处测定吸光度(A1);同时取4 mL ABTS自由基工作液,加入1 mL无水乙醇溶液,于734 nm处测定吸光度(A2)。
ABTS自由基清除率(%)=(A2-A1)/A2×100%
2.4.4 抑制亚油酸氧化能力的测定以无水乙醇为空白,Vc为对照,将1.0 mL不同质量浓度的麦麸多肽溶液加入1.0 mL 0.1 mol/L的磷酸盐缓冲溶液,再加入2 mL 50 mmol/L的亚油酸溶液,混匀,密封后于60 ℃下避光放置,每24 h测定吸光度[13]。然后取出适量样品,加入75%的乙醇、30%硫氰酸铵溶液和20 mmol/L的氯化亚铁溶液,混合均匀。5 min后在500 nm波长下测定吸光度(A1),加入亚油酸时吸光度为A0。
抑制率(%)=(A0-A1)/A0×100%
2.5 麦麸多肽吸湿保湿性能的测定 2.5.1 吸湿性能的测定在室温下,分别准确称取0.50 g样品各两组于干燥瓶中,然后分别置于2个不同的干燥器中,其中一个是饱和硫酸铵水溶液(RH = 81%),另一个是饱和碳酸钾水溶液(RH = 43%)。放置12 h、24 h、36 h、48 h、60 h、72 h……240 h后分别进行称重,比较麦麸多肽与市面小麦低聚肽、大豆低聚肽、胶原蛋白肽、鱼胶原蛋白肽的吸湿性能,计算吸湿率。
吸湿率(%)=(mn-m0)/ m0×100%,
式中:mn为放置后样品的质量;m0为放置前样品的质量。
2.5.2 保湿性能的测定在室温下,将含水量为10%的样品置于不同的干燥瓶中,干燥器里面置入干硅胶。放置12 h、24 h、36 h、48 h、60 h、72 h后分别进行称重,比较麦麸多肽与市面小麦低聚肽、大豆低聚肽、胶原蛋白肽、鱼胶原蛋白肽的保湿性能,计算水分残存率。
水分残存率(%)= Hn/ H0×100%,
式中:Hn为放置后样品的质量;H0为放置前样品的质量。
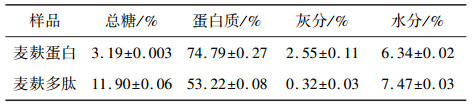
3 结果与分析 3.1 麦麸蛋白及多肽成分分析麦麸蛋白及多肽的成分分析如表 1所示。可见冻干的麦麸蛋白中蛋白质含量达到74.79%,水分含量为6.34%,总糖含量为3.19%。经过碱性蛋白酶及风味蛋白酶酶解后的麦麸蛋白中蛋白质含量减少为53.22%,水分含量达到7.47%,总糖含量升至11.90%。说明利用碱提取方法得到的蛋白质主要为糖蛋白。
| 表 1 麦麸蛋白和多肽基本成分分析 |
 |
3.2 麦麸多肽抗氧化性能的测定 3.2.1 还原性能测定
抗氧化剂的抗氧化能力与其还原能力相关。麦麸多肽的还原能力如图 1所示,吸光度越大表示还原能力越强。结果显示:麦麸多肽和Vc都具有还原能力,且随着浓度质量分数增大其还原能力也增强,但是麦麸多肽的还原能力要小于相同浓度质量分数的Vc。
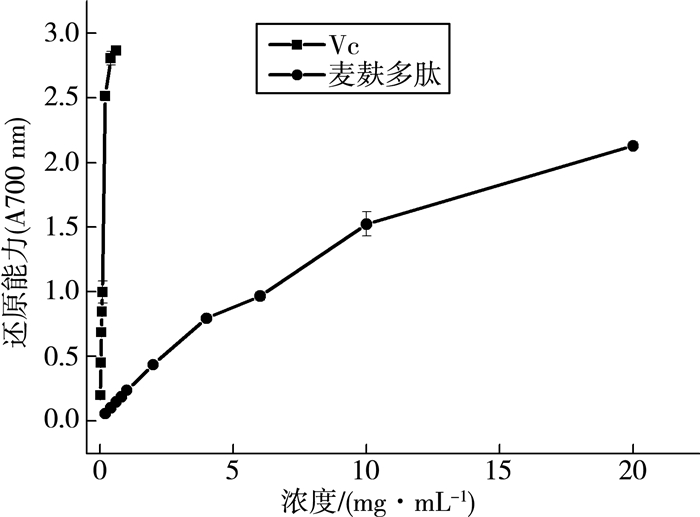 |
| 图 1 麦麸多肽还原能力的测定 |
3.2.2 羟基自由基清除能力的测定
羟基自由基是一种活性很强的自由基,麦麸多肽对羟基自由基的清除能力如图 2所示。结果显示:麦麸多肽和Vc都具有清除羟基自由基的能力,且随着浓度质量分数增大其清除能力也增强,但是麦麸多肽的清除能力要远小于相同浓度质量分数的Vc。
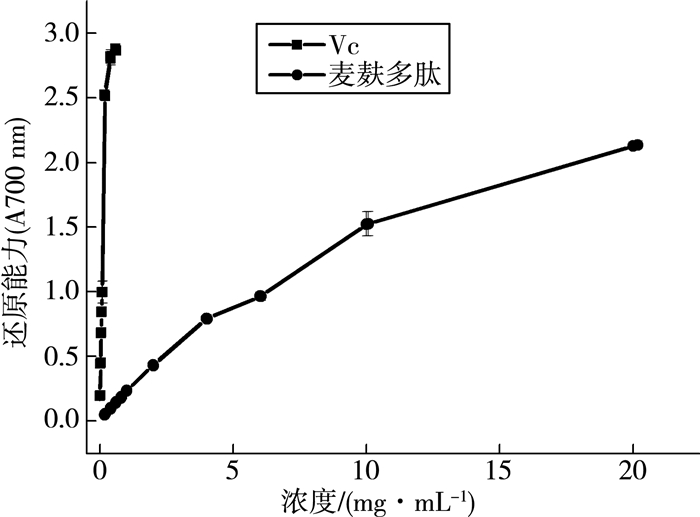 |
| 图 2 麦麸多肽羟基自由基清除能力的测定 |
3.2.3 ABTS自由基清除能力的测定
麦麸多肽对ABTS自由基的清除能力如图 3所示。结果显示:麦麸多肽和Vc一样具有清除ABTS自由基的能力,且随着浓度质量分数增大,其清除能力都呈现先增大后趋于平稳的趋势;二者的清除能力基本相同,麦麸多肽在浓度质量分数0.6 mg/mL时达到最大清除能力,对ABTS的清除能力能达到90%左右。
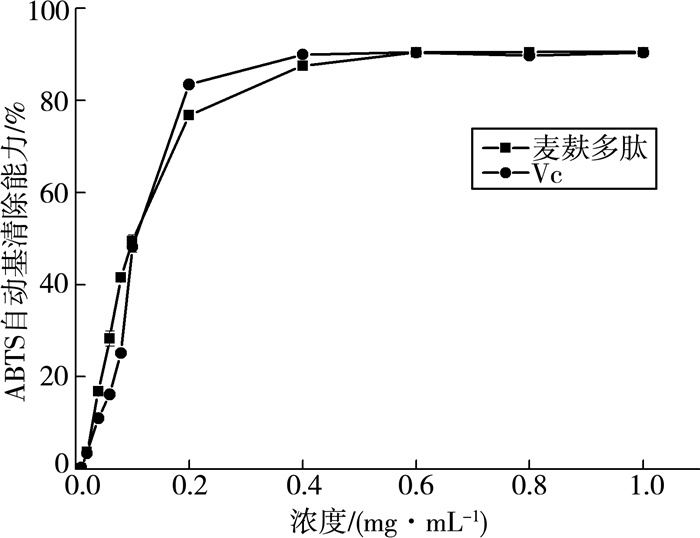 |
| 图 3 麦麸多肽ABTS自由基清除能力的测定 |
3.2.4 抑制亚油酸氧化能力的测定
麦麸多肽对亚油酸自氧化的抑制性能测定如图 4所示。由图可见:麦麸多肽能显著抑制亚油酸的自氧化作用,抑制效果随其质量分数的增大而增强;且当麦麸多肽的质量分数为10 mg/mL时,48 h内对亚油酸自氧化能力的抑制作用能达到100%,其抑制亚油酸氧化能力要强于0.5 mg/mL的Vc。
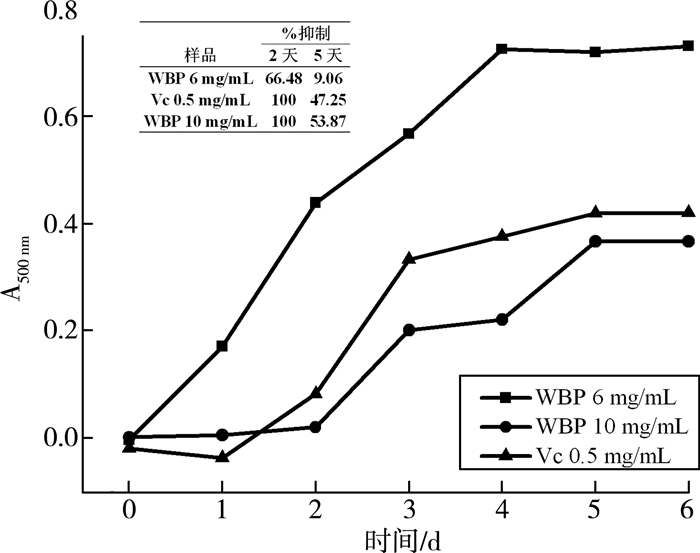 |
| 图 4 麦麸多肽抑制亚油酸氧化能力的测定 |
3.3 麦麸多肽吸湿保湿性能的测定 3.3.1 吸湿性能测定
吸湿性是物质吸附或摄取水分的能力,蛋白质或者多肽可通过氨基酸侧链和肽键与水分子间的相互作用来实现。由图 5可知:在湿度为43%的情况下,各样品的吸湿性曲线都是先增大后趋于平缓。说明随着时间的增长,吸附水分子的亲水基团得到饱和,吸湿率稳定在最大值。图 6显示:在湿度为81%时,麦麸多肽具有明显比较高的吸湿性能,随着时间增加,麦麸多肽的吸湿性能持续上升,直至全部溶解;而同为来源于植物蛋白的小麦低聚肽和大豆低聚肽在72 h后就达到最大值,最大吸湿能力也才30%左右,远小于麦麸多肽。
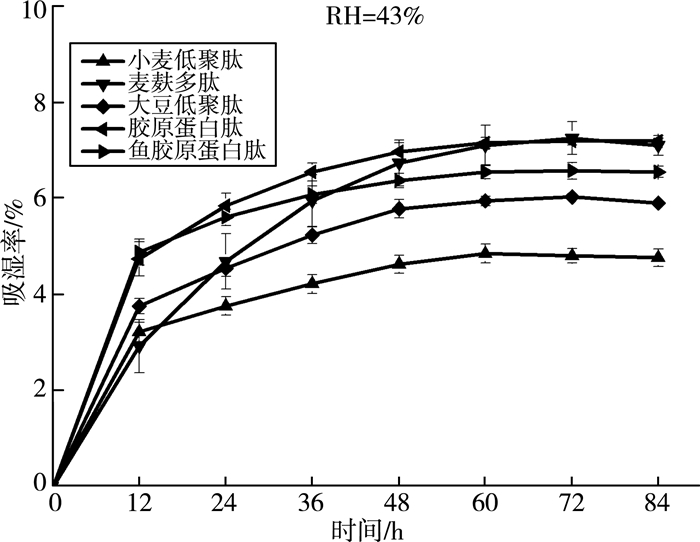 |
| 图 5 麦麸多肽吸湿率曲线(RH=43%) |
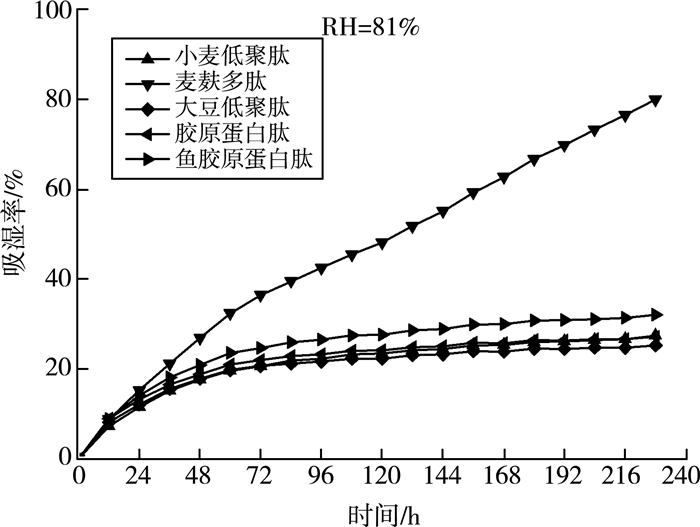 |
| 图 6 麦麸多肽吸湿率曲线(RH=81%) |
3.3.2 保湿性能测定
保湿性是蛋白质保持水分的能力,各样品在不同相对湿度环境中的保湿率见图 7。胶原蛋白肽的肽链中有多个氨基、羧基和羟基等亲水基团,能与水分子结合,防止水分蒸发,是很好的保湿剂。由图 8、图 9可知,麦麸多肽的保湿效果在湿度为43%及81%时最高,超过市面上的胶原蛋白肽和鱼胶原蛋白肽,在干硅胶中保湿效果明显低于其他蛋白肽。
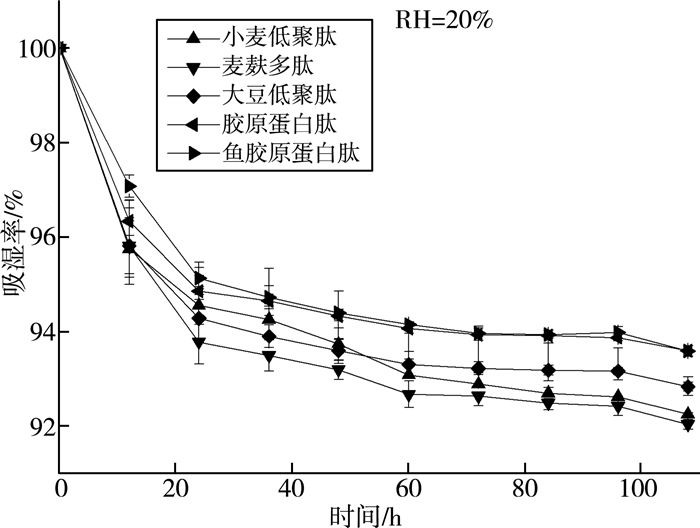 |
| 图 7 麦麸多肽保湿率曲线(RH=20%) |
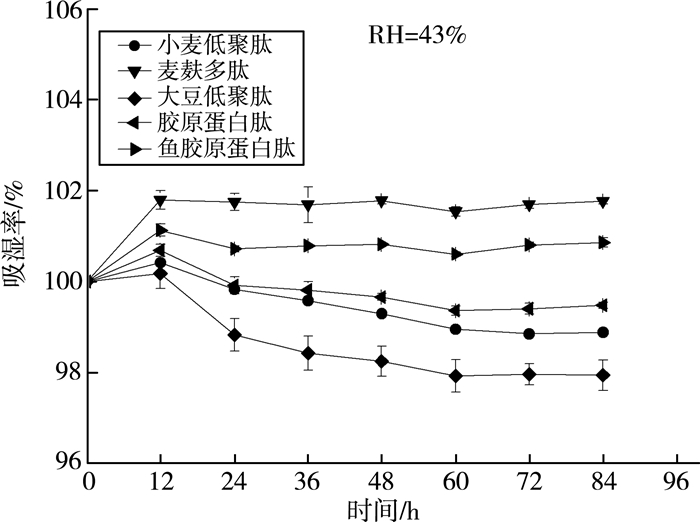 |
| 图 8 麦麸多肽保湿率曲线(RH=43%) |
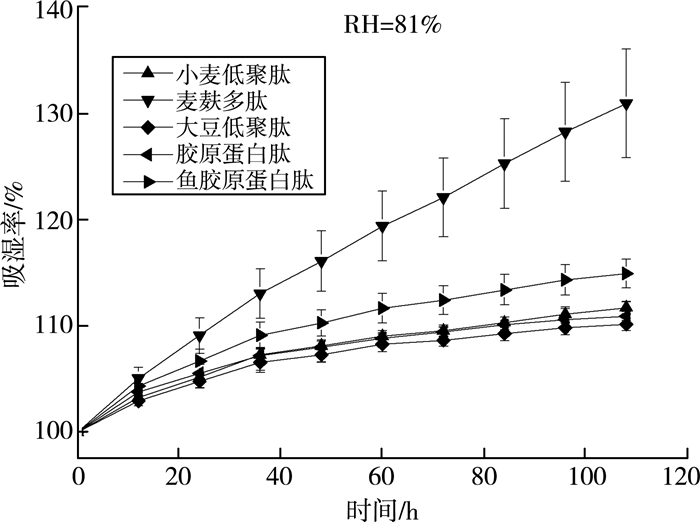 |
| 图 9 麦麸多肽保湿率曲线(RH=81%) |
4 结论
1) 麦麸多肽具有一定的还原能力和抗氧化能力,能清除羟基自由基和ABTS自由基,其中清除ABTS自由基能力与维生素C相当。
2) 麦麸多肽作为天然的抗氧化剂,能显著抑制亚油酸的自氧化作用,可减少油脂及油脂食品劣变,避免其降解产物产生较多的不良风味和有毒物质。在研究提升食品营养价值和其对维持人体健康方面具有广大前景。
3) 麦麸多肽具有一定的吸湿和保湿能力,在比较干燥的环境中保湿能力一般;在中等湿度环境中,吸湿保湿性能要略强于小麦低聚肽、大豆低聚肽、胶原蛋白肽以及鱼胶原蛋白肽;而在高湿度环境中,麦麸多肽显示出超强的吸湿保湿能力,吸湿保湿率远大于其他多肽,甚至最终可以完全溶解。
| [1] |
梅斯杰, 王笑颖. 多肽的功能及结构的研究进展[J]. 食品安全导刊, 2016(24): 143-146. |
| [2] |
ZHENG L, SU G, REN J, et al. Isolation and characterization of an oxygen radical absorbance activity peptide from defatted peanut meal hydrolysate and its antioxidant properties[J]. Journal of Agricultural and Food Chemistry, 2012, 60(21): 5431-5437. DOI:10.1021/jf3017173 |
| [3] |
郑学玲, 姚惠源, 李利民. 小麦加工副产品——麸皮的综合利用研究[J]. 粮食与饲料工业, 2001(12): 38-39. DOI:10.3969/j.issn.1003-6202.2001.12.017 |
| [4] |
汪东. 紫色小麦麸皮多肽抗氧化及抑菌活性的研究[D]. 泰安: 山东农业大学, 2014.
|
| [5] |
FlEISCHMAN E F, KOWALSKI R J, MORRIS C F, et al. Physical, textural, and antioxidant properties of extruded waxy wheat flour snack supplemented with several varieties of bran[J]. Journal of Food Science, 2016, 81(11): 2726-2733. DOI:10.1111/jfds.2016.81.issue-11 |
| [6] |
PAVLOVICH A A, ROUZAUD S O, ROMERO BARANZINI A L, et al. Relationships between chemical composition and quality-related characteristics in bread making with wheat flour-fine bran blends[J]. Journal of Food Quality, 2015, 38(1): 30-39. DOI:10.1111/jfq.2015.38.issue-1 |
| [7] |
徐忠, 薄凯, 张珍珠. 麦麸蛋白的碱法提取工艺及乳化性质研究[J]. 食品工业科技, 2006(9): 66-68. |
| [8] |
张辉. 超声辅助酶解制备麦麸抗氧化肽工艺的研究[J]. 食品科技, 2016(1): 219-224. |
| [9] |
孙永杰. 刺五加茎叶中总黄酮的提取及其抗氧化功效研究[D]. 长春: 吉林农业大学, 2012.
|
| [10] |
ZHANG Z, LV G, HE W, et al. Effects of extraction methods on the antioxidant activities of polysaccharides obtained from Flammulina velutipes[J]. Carbohydrate Polymers, 2013, 98(2): 1524-1531. DOI:10.1016/j.carbpol.2013.07.052 |
| [11] |
CHUN S, VATTEM D A, LIN Y, et al. Phenolic antioxidants from clonal oregano(Origanum vulgare) with antimicrobial activity against Helicobacter pylori[J]. Process Biochemistry, 2005, 40(2): 809-816. DOI:10.1016/j.procbio.2004.02.018 |
| [12] |
THAIPONG K, BOONPRAKOB U, CROSBY K, et al. Comparison of ABTS, DPPH, FRAP, and ORAC assays for estimating antioxidant activity from guava fruit extracts[J]. Journal of Food Composition and Analysis, 2006, 19(6-7): 669-675. DOI:10.1016/j.jfca.2006.01.003 |
| [13] |
RANATHUNGA S, RAJAPAKSE N, KIM S. Purification and characterization of antioxidative peptide derived from muscle of conger eel(Conger myriaster)[J]. European Food Research and Technology, 2006, 222(3-4): 310-315. DOI:10.1007/s00217-005-0079-x |
 2018, Vol. 32
2018, Vol. 32


