| 基于肠道微生态探讨肥胖者的健康管理策略 |
肥胖是由于长期能量摄入超过人体的消耗,体内脂肪过度积累所造成的一种营养障碍性疾病。根据世界卫生组织(WHO)标准,BMI指数>30 kg/m2被认定为肥胖。据WHO统计,全球每年约有340万人死于超重或肥胖[1]。肥胖已成为全球性公共卫生问题,是引起Ⅱ型糖尿病、高血压、高血脂等代谢性疾病的高风险因子。因此,采取有效的措施预防和控制肥胖是当今社会亟需解决的重要问题之一。
人类肠道微生物约有100余属,细胞总数高达1.0×1014,是人体细胞个数的10倍[2]。肠道微生物种类繁多,按照门类划分,80%~90%属于厚壁菌门和拟杆菌门,其次为放线菌门和变型菌门[3-4]。
研究表明,肠道菌群与宿主代谢及肥胖的发生有着千丝万缕的关系,并且比“肥胖基因”扮演的角色更为重要。肠道元基因组被誉为人类“第二套基因组”。寄主与微生物间的相互作用及关系,为通过微生物调节影响肥胖人群肠道健康提供了基础[5]。
1 肠道微生物影响肥胖的机制肥胖的发生与遗传和环境因素有关。权威报告指出,肠道微生物在脂肪含量增加和机体能量平衡中发挥着关键作用。肠道微生物与肥胖有关的作用机制包括以下几个方面[6]:1)增加肠道对膳食中能量的吸收;2)调节肝脏脂肪生成;3)通过影响肠道饱腹感激素水平调节食欲(如:GLP-1和人多肽-YY);4)通过脂多糖(LPS)-Toll样受体激活机体自身免疫能力。
2 肥胖相关肠道微生物种类变化近年来,尽管不同学者间存在争议,但多数研究结果表明肥胖人群与正常人群肠道微生物的组成差异主要体现在拟杆菌和厚壁菌两个细菌门上。
Ley[4]等指出:胖型小鼠相对于瘦型小鼠,其肠道中拟杆菌门丰度较低,厚壁菌门丰度较高。Turnbaugh[7]等进一步验证了胖型小鼠肠道中厚壁菌门与拟杆菌门的数量比值相对于瘦型小鼠高。Kasai[8]等采用分子生物学及新一代的测序方法,以日本肥胖及非肥胖人群为研究对象,对两类人群肠道微生物组成进行比较,结果表明肥胖者的拟杆菌门的数量相对非肥胖者减少,拟杆菌与厚壁菌门比值降低,证实了二者在肠道微生物组成上存在差异,且特定菌种与肥胖具有显著相关性。
3 影响肠道微生物的因素肠道微生物能够影响机体营养吸收和能量调节,尽管其导致肥胖的机制未完全解释清楚,却已被认定为引起代谢综合征和肥胖失调的重要因素。
影响肠道微生物的因素多种多样,其中主要包括饮食干预、抗菌素的应用、益生元和益生菌的应用、减肥手术和粪菌移植等。基于肠道微生物治疗肥胖,其影响和干预治疗效果的因素如图 1所示。
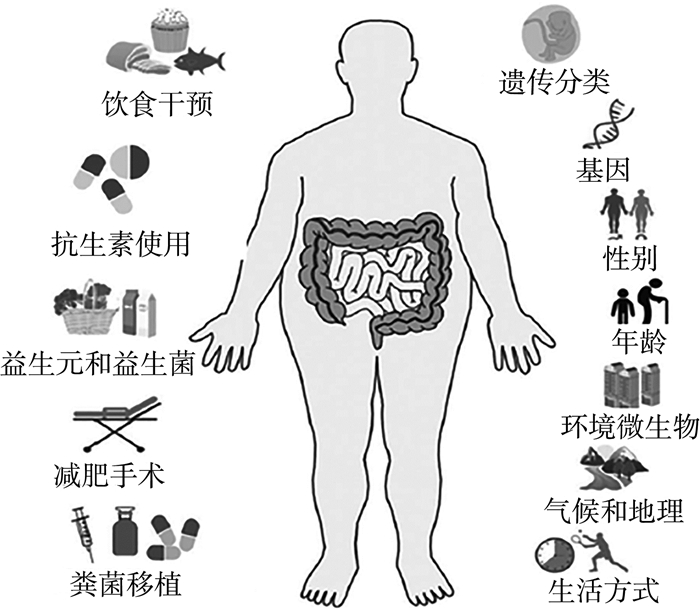 |
| 图 1 基于肠道微生物治疗肥胖,影响和干预治疗效果的因素[9] |
以肠道微生物为靶点,从饮食、益生菌和益生元的应用,运动和粪菌移植等方面探讨肥胖人群的健康管理策略,为肥胖人群提供健康指导,助其采取科学有效的途径减轻体重。
4 肥胖患者的健康管理策略 4.1 饮食膳食模式是影响肠道菌群的重要环境因素。膳食宏量营养素中的碳水化合物、蛋白质和脂肪的数量、种类和比例是影响肠道菌群构成的主要因素[9]。
Ley[10]等通过实验表明饮食和运动能够正交地改变与肥胖相关的肠道微生物的组成。肥胖人群摄入低能量的食物能导致肠道中拟杆菌门的含量随着时间的增长而增加,而且这种增长与体重的降低呈相关性。原因可能是因为当肠道中所含的厚壁菌门的比例高于拟杆菌门时,肠道菌群从食物中吸收能量的能力会增强[7]。
鉴于饮食模式与肠道菌群之间存在较大相关性,肥胖者可以从调节饮食出发,通过影响其肠道菌群环境来缓解肥胖。
为了使肥胖人群在降低能量吸收的同时满足自身营养均衡的要求,我们根据食物所提供营养作为指导对其进行分类,使用交通灯的颜色信号作为食物颜色指示(如表 1所示[11]),指导肥胖人群科学合理饮食。
| 表 1 健康饮食建议 |
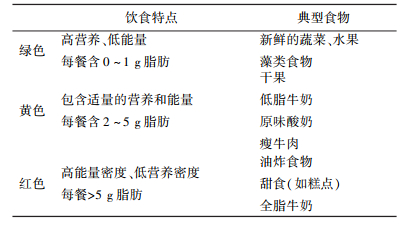 |
在饮食干预方面,建议以家庭为单位[12]进行饮食干预,逐渐形成健康的饮食习惯;减小摄入能量密度高、营养密度低的食物(红色);适当摄入高营养、低卡里路的食物(绿色);一日三餐饮食规律。
4.2 益生菌依照WHO的定义,益生菌(Probiotics)是“以适当的量给予人体时,能产生对健康有利效果的活细菌”。
George[13]等研究发现,益生菌制品能够显著降低肥胖者的BMI、体重和机体脂肪量。益生菌改善肠道微生物治疗肥胖,主要通过以下机制完成:通过影响肠道微生物改善代谢紊乱状态[14];选择性地增加益生菌的水平,如:肠道中的双歧杆菌[15];通过肠道微生物改变短链脂肪酸的生成量[16],其中丁酸盐即为短链脂肪酸的一种,被证实能降低肥胖的发生率[17]。
益生菌对减肥的效果依赖于其特定的种类和菌株[18]。常用的益生菌有:嗜酸乳杆菌、双歧乳杆菌、长形双歧杆菌、保加利亚乳杆菌、嗜热链球菌等。实验表明,乳酸菌和双歧杆菌能改变大多数肠道有益菌的丰度,并不同程度地降低高脂喂养的小鼠肥胖的发生[19]。
基于此,肥胖人群可适量摄入发酵酸奶和益生菌产品(如做成胶囊和药片形式的有益肠道细菌),有效补充肠道有益菌的数量。人体摄入的益生菌通过上消化道的存活率至关重要[20]。除发酵酸奶制品外,应更多地选择用壳聚糖和藻朊酸盐及以细胞为基础的微凝胶进行层层包裹的益生菌胶囊,增强微生物通过胃肠道的存活率[21-22]。同时,在服用益生菌制品时,要慎用抗生素,不能用开水冲化,使得到达肠道的益生菌存活率高,更大程度上改变人体对食物能量的转化利用率[23]。
鉴于不同益生菌制剂中细菌的种类不同、比例也不一样,肥胖者要寻找适合自己的益生菌制品,并摸索出适合自身情况的用量。
4.3 益生元益生元通常为低聚糖、短链多糖或抗性淀粉、膳食纤维等复杂多糖,具有以下特点:低热量或无热量,耐酸、耐消化酶水解,不被小肠吸收等。因此益生元可成为蔗糖替代品,是肥胖人群控制体重的理想选择。
益生元是除抗生素和益生菌外目前较受认可的对肠道菌群有调节作用的天然膳食性成分[24]。近期研究证实益生元干预对肥胖个体的葡萄糖、脂质和炎症具有有益影响,而这些代谢指标的改善又与厚壁菌门和拟杆菌门为主的菌群数量改变紧密相关。因此,通过膳食补充益生元,为改善与肥胖相关的肠道微生物组成与代谢紊乱、预防和治疗肥胖提供了新的思路。
4.4 运动研究表明,运动作为环境刺激性因素可有效调节肠道菌群的结构和成分、提高肠道菌群的丰度、增加有益菌数量、恢复菌群平衡,从而改善机体健康[25]。
Allen[26]等研究运动对胖人和瘦人的肠道微生物影响,第一次通过实验数据表明运动训练能够显著调节人类肠道微生物的组成和代谢能力。蒋兴宇[27]等通过利用16S rDNA高通量测序技术,对20名跑步运动志愿者和20名少动志愿者粪便中的肠道细菌组成进行分析。运动组中毛螺菌科和拟杆菌科的丰度显著高于少动组,普雷沃氏菌科和韦荣氏球菌科的丰度显著低于少动组。有三株可培养的菌株在运动组中数量显著增加,分别为:瘤胃球菌属的Ruminococcus-sp.5-1-39BFAA,双歧杆菌属的Bifidoba-cterium-adolescentis以及产丁酸盐菌属的Anaerostipes-hadrus。表明运动能调节肠道菌群的结构,提高肠道菌群的丰度。
基于上述研究,肥胖者应该养成长期运动的生活习惯,通过运动调节肠道菌群的结构,增大拟杆菌门与厚壁菌门比值,提高肠道中健康菌门的丰度,降低有害菌的丰度,并增大肠道菌群的多样性,缓解因肠道菌群失调而引起的肥胖。
科学研究表明,采用中低强度有氧运动进行运动干预,对于降低肥胖人群机体内脏脂肪有显著的效果。根据运动强度及能量消耗情况将运动进行分类,并以交通信号灯颜色对运动强度进行指示(如表 2所示):肥胖人群应增加中等强度有氧运动(绿色),尽量减少久坐不动行为(红色),坚持科学运动,不仅有利于短时间内减轻体重,对长时间的体重维持也至关重要。
| 表 2 健康运动建议 |
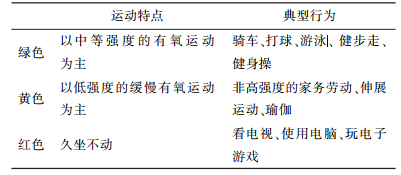 |
4.5 粪菌移植
在肥胖人群中,无论是否合并Ⅱ型糖尿病,均发现其肠道菌群存在病理性改变。粪菌移植(FMT)可将健康人粪便中功能菌群移植至病人胃肠道内,使肥胖者肠道微生物的组成和功能正常化,缓解因肠道微生态紊乱所造成的肥胖。
至目前为止,粪菌移植疗法[28]已在医治复发性高的难辨梭状芽孢杆菌性肠炎、伪膜性肠炎、慢性便秘等肠病治疗中取得较理想效果。粪菌移植疗法在治疗以上肠病中积累的宝贵经验,为其应用于肥胖治疗提供了有益借鉴。
将健康的瘦人供体的粪菌移植到肥胖患者体内6周后,受体胰岛素敏感性明显增强。这一改善同时伴随着肠道微生物多样性的增加(包括产丁酸的细菌,尤其是Roseburia intestinalis)。众所周知,丁酸盐在促进小鼠胰岛素敏感性方面发挥重要作用,因此丁酸盐增多可能是粪菌移植治疗效果的成因之一。
受遗传或环境因素影响,健康的直系亲属或亲密供菌者可最大程度减少传播疾病的风险,为最佳供菌者。粪菌移植主要通过上消化道和下消化道途径来实现。其中口腔粪菌胶囊、鼻胃管、鼻空肠管及胃镜等给入是上消化道的主要途径,结肠镜、灌肠等给入的是下消化道的主要途径[29]。考虑到糖类和脂肪酸的吸收与肥胖有关,而这些物质主要在小肠吸收,所以针对肥胖病人FMT的实现途径最佳选择为经鼻肠管输注[30]。
5 结论与展望主要在阐述影响肠道微生物变化的因素(如饮食、益生菌与益生元、运动及粪菌移植)的基础上,探讨从上述因素出发,通过调节肠道微生物的结构,为肥胖者提供合理的健康管理策略。
尽管上述因素影响肠道微生物变化的机制未能完全阐明,但是目前得到的相关实验结果却越来越引人注目。除上述因素外,抗生素的使用、年龄、生物钟变化、过度饮酒等都已被证实与肠道微生物的结构改变相关。
因此,应该尽可能系统地研究全部肠道菌群的总体变化,如某些特定菌群比例的变化规律,增进对肥胖等代谢性疾病的发生、发展机理的认识,为肥胖人群提供更加科学有效的健康管理策略。
| [1] |
HARRIS K, KASSIS A, MAJOR G, et al. Is the gut microbiota a new factor contributing to obesity and its metabolic disorders[J]. Journal of Obesity, 2012, 12(11): 1-14. |
| [2] |
BACKHED F, LEY R E, SONNE N B, et al. Host-bacterial mutualism in the human intestine[J]. Science, 2005(307): 1915-1920. |
| [3] |
ECKBURG P B, BIK E M, BERNS TEIN C N, et al. Diversity of the human intestinal microbial flora[J]. Science, 2005, 308(5728): 1635-1638. DOI:10.1126/science.1110591 |
| [4] |
LEY R E, BACKHED F, TURNB AUGH P, et al. Obesity alters gut microbial ecology[J]. Proceeding of the National Academy of USA, 2005, 102(31): 11070-11075. DOI:10.1073/pnas.0504978102 |
| [5] |
郑志昌, 陈映彤, 郭娟娟, 等. 益生元对早产儿、肥胖及老年群体肠道菌群调节机制的研究现状[J]. 食品科学, 2018, 39(1): 297-304. DOI:10.7506/spkx1002-6630-201801045 |
| [6] |
KOLEVA P T, BRIDGMAN S L, KOZYRSKYJ A L. The infant gut microbiome:evidence for obesity risk and dietary intervention[J]. Nutrients, 2015, 7(4): 2237-2260. DOI:10.3390/nu7042237 |
| [7] |
TURNBAUGH P J, LEY R E, MAH OWALD M A, et al. An obesity associated gut microbiome with increased capacity for energy harvest[J]. Nature, 2006(444): 1027-1031. |
| [8] |
KASAI C, SUGIMOTO K, MORITA N, et al. Comparison of the gut microbiota composition between obese and non-obese individuals in a Japanese population, as analyzed by terminal restriction fragment length polymorphism and next-generation sequencing[J]. BMC Gastroenterology, 2015, 15(1): 1-10. DOI:10.1186/s12876-014-0226-6 |
| [9] |
LI J, RAJOKA M S, SHAO D, et al. Strategies to increase the efficacy of using gut microbiotafor the modulation of obesity[J]. Etiology and Pathophysiology, 2017, 18(11): 1260-1271. |
| [10] |
LEY R E, TURNBAUGH P J, KLE I, et al. Microbial ecology:human gut microbes associated with obesity[J]. Nature, 2006, 444(7122): 1022-1023. DOI:10.1038/4441022a |
| [11] |
EPSTEIN L H, SQUIRES S. The stoplight diet for children[J]. Nutrition Education, 1988, 20(6): 349-350. DOI:10.1016/S0022-3182(88)80024-4 |
| [12] |
WILFLEY D E, BALANTEKIN K N. Family-based behavioral interventions for childhood obesity[J]. Pediatric Obesity, Contemporary Endocrinology, 2017(1): 555-567. |
| [13] |
GEORGE K J, LIN W, GERARD M, et al. Dietary alteration of the gut microbiome and its impact on weight and fat mass:A systematic review and meta-analysis[J]. Genes, 2018, 9(167): 1-20. |
| [14] |
YOO J Y, KIM S S. Probiotics and prebiotics:present status and future perspectives on metabolic disorders[J]. Nutrients, 2016, 8(3): 173. DOI:10.3390/nu8030173 |
| [15] |
CANI P D, NEYRINCK A M, FAVA F, et al. Selective increases of bifido bacteria in gut microflora improve high-fat-diet-induced diabetes in mice through a mechanism associated with endotoxaemia[J]. Dia betologia, 2007, 50(11): 2374-2383. |
| [16] |
BINDELS L B, DELZENNE N M, CANI P D, et al. Towards a more comprehensive concept for prebiotics[J]. Nat Rev Gastroenterol Hepatol, 2015, 12(5): 303-310. DOI:10.1038/nrgastro.2015.47 |
| [17] |
CANFORA E E, JOCKEN J W, BLAAK E E. Short-chain fatty acids in control of bodyweight and insulin sensitivity[J]. Nat Rev Endocrinol, 2015, 11(10): 577-591. DOI:10.1038/nrendo.2015.128 |
| [18] |
朱钦士. 肥胖与肠道细菌有关吗[J]. 生物学通报, 2013, 48(12): 20-25. |
| [19] |
WANG J, TANG H, ZHANG C, et al. Modulation of gut microbiota during probioti-mediated attenuation of metabolic syndrome in high fat diet-fed mice[J]. ISME, 2015, 9(1): 1-15. DOI:10.1038/ismej.2014.99 |
| [20] |
ZOUMPOPOULOU G, POT B, TSAKALIDOU E, et al. Dairy probiotics:beyond the role of promoting gut and immune health[J]. International Dairy, 2017(67): 46-60. |
| [21] |
ANSELMO A C, MCHUGH K J, WEBSTER J, et al. Layer-by-layer encapsulation of probiotics for delivery to the microbiome[J]. Adv Mater, 2016, 28(43): 9486-9490. DOI:10.1002/adma.201603270 |
| [22] |
LI W, ZHU Y, YE F, et al. Probiotics in cellulose houses:enhanced viability and targeted delivery of lactobacillus plantarum[J]. Food Hydrocoll, 2017(62): 66-72. |
| [23] |
ROUXINOLDIAS A L, PINTO A R, JANEIRO C, et al. Probiotics for the control of obesity-its effect on weight change[J]. Porto Biomed, 2016, 1(1): 12-24. DOI:10.1016/j.pbj.2016.03.005 |
| [24] |
TⅡHONEN K, OUWEHAND A C, RAUTONEN N. Human intestinal microbiota and healthy ageing[J]. Ageing Research Reviews, 2010, 9(2): 107-116. DOI:10.1016/j.arr.2009.10.004 |
| [25] |
于春霞, 傅力. 肠道菌群-运动干预防治代谢性疾病的新靶点[J]. 中国运动医学杂志, 2017, 36(5): 443-447. |
| [26] |
ALLEN J M, MAILING L J, WOODS G M, et al. Exercise alters gut microbiota composition and function in lean and obese humans[J]. Medicine & Science in Sports & Exercise, 2017, 11(6): 22-29. |
| [27] |
蒋兴宇, 赵霞, 邹凌云, 等. 适度运动对人体肠道菌群结构的影响[J]. 第三军医大学学报, 2017, 39(18): 1824-1830. |
| [28] |
CHRISTIAN C, ELAINE O P, EMMA A V, et al. Fecal microbiota-based therapeutics for recurrent clostridium difficile infection, ulcerative colitis and obesity[J]. EBioMedicine, 2016, 0929: 2352-3964. |
| [29] |
张发明, 龙楚彦, 李潘. 粪菌移植体系的整体整合医学思考[J]. 生命科学, 2017, 29(2): 1-9. |
| [30] |
葛晓龙, 丁超. 粪菌移植改善肥胖和糖尿病病人的研究进展[J]. 肠外与肠内营养, 2015, 22(6): 370-377. |
 2018, Vol. 32
2018, Vol. 32

