| 浸泡法制备MA1-xFAxPbI3钙钛矿太阳能电池 |
能源作为人类社会进步和文明发展不可或缺的动力[1],在经济和社会发展过程中扮演着重要的角色。随着经济和社会的快速发展,能源需求量也在不断增长。传统的化石能源面临着枯竭的危机,并且目前的能源结构对人类健康、环境、气候等产生众多负面影响,因此改变现有的能源结构,发展再生、可持续、环境友好型新能源是当务之急。太阳能是目前世界上储量最为丰富的能源,具有地理范围广、清洁无污染、能量巨大、可直接利用等优点,受到了各国能源行业的青睐[2]。其中钙钛矿太阳能电池(PSCs)由于其材料成本低廉、组装工艺简单、光电流电压较大、可开发的空间较高等优点[3],成为目前最具有商业化开发价值的太阳能电池。
在有机-无机钙钛矿ABX3分子结构中,A一般为有机阳离子,常见的有CH3NH3+(MA, IR=0.18 nm)、HC(NH2)2+ (FA, IR=0.23 nm);B一般为二价金属阳离子,常见的有Pb2+(IR=0.119 nm)、Sn2+(IR=0.110 nm);而X一般是卤素阴离子:I-(IR=0.220 nm)、Br-(IR=0.196 nm)、Cl-(IR=0.181 nm)[4]。
钙钛矿分子中可以容纳不同的阳离子和阴离子,为不同元素的组合提供了可能性。如A位可以是MA+、FA+、Cs+的混合,X位可以为I-、Br-、Cl-的混合[5-6]。离子的混合使得钙钛矿材料的带隙发生变化[7],直接影响太阳能电池的性能;然而,混合后的钙钛矿层在晶体结构和形貌上易发生严重的变化[8]。而有机部分FA+和MA+掺杂,可以保留无机部分完整的骨架[9-11],从而引起了人们的关注。FAPbI3的禁带宽度为1.4 eV[12],FA+的掺杂使得钙钛矿层的吸光范围变大,从而提高器件的短路电流密度。但是FAPbI3存在非钙钛矿晶相,当FA+掺杂过多时,会引起晶型向非钙钛矿相转变,所以FA+的掺杂量受到了限制[13]。Slimi[14]等人将FAPbI3和MAPbI3按一定比例混合制备钙钛矿薄膜,获得了不同禁带宽度的钙钛矿薄膜。Nazeeruddin[15]等人在一步法溶液中掺入10%~30%的FAI,获得高质量的钙钛矿薄膜,提高器件性能。以上研究是通过一步法对钙钛矿层进行整体掺杂。通过浸泡沉积法制备FA-MA掺杂的钙钛矿薄膜,优化掺杂工艺,系统比较了掺杂后钙钛矿薄膜在表面形貌、光学性质、结晶性及器件性能等方面的变化。
1 实验 1.1 原料的合成 1.1.1 碘化甲铵(MAI)的制备取30 g氢碘酸(55 wt%),加入用锡箔纸包裹的圆底烧瓶中,冰浴搅拌。用恒压漏斗将22.2 g甲胺水溶液(27 wt%)缓慢滴加到HI溶液中,连续搅拌2 h使其反应完全。将反应后的溶液在60 ℃避光旋转蒸发4 h,溶剂完全挥发获得淡黄色的粉末。将淡黄色粉末用无水乙醚洗涤三次,得到白色粉末,干燥后,加入适量无水乙醇在80 ℃下溶解并过滤,取过滤液放置冰箱12 h,瓶底有白色针状晶体析出。过滤后的白色晶体放置在70 ℃的真空干燥箱中,真空状态下干燥12 h。
1.1.2 碘化甲脒(FAI)的制备取10 g乙酸甲脒(99%),加入到用锡箔纸包裹的50 mL烧杯中。量取32 g氢碘酸(55 wt%),加入烧杯中,在50 ℃下用磁子搅拌10 min,使两者充分反应。在通风橱中于100 ℃干燥3 h得到黄色粉末,用无水乙醚洗三次得到白色粉末。干燥后,加入适量的无水乙醇,在80 ℃下溶解并过滤,将过滤液放置冰箱12 h,得到白色针状晶体。过滤,并用无水乙醚冲洗三次。将得到的白色粉末置于50 ℃真空干燥箱中,真空干燥12 h。
1.1.3 PbI2(DMSO)的制备取10 g PbI2和30 mL二甲基亚砜(DMSO),在60 ℃搅拌2 h,使PbI2充分溶解。用恒压漏斗将70 mL甲苯缓慢滴加到溶液中,滴加过程中有白色沉淀产生,连续搅拌使其反应完全。将白色沉淀过滤后,室温下放置3 h,得到PbI2(DMSO)2。然后置于60 ℃真空干燥箱中,真空干燥24 h,得到PbI2(DMSO)。
1.2 器件的组装首先,刻蚀好的导电玻璃(FTO)的清洗:分别用去离子水和洗涤剂清洗,再用去离子水、丙酮、异丙醇超声清洗15 min,干燥后臭氧处理15 min。其次,TiO2致密层的制备:在5 mL无水乙醇中,先加入65 μL用无水乙醇稀释至2 mol/L的HCl溶液,后加入350 μL的钛酸四丁酯溶液,搅拌均匀。在匀胶机上以3 000 r/min转速旋涂TiO2致密层30 s。旋涂结束后,在100 ℃加热板上加热10 min,随后在马弗炉中550 ℃退火30 min。
钙钛矿层的制备:配置1 M的PbI2(DMSO)的DMF溶液,常温搅拌2 h。用移液枪量取20 μL的PbI2(DMSO)溶液,全部铺展在致密层上,转速为4 000 r/min,旋涂时间30 s。旋涂结束后,静置2~3 min。将碘化铅液膜在10 mg/mL的MAI的异丙醇溶液中浸泡10 min后,再进行甲脒的掺杂。掺杂后取出,在异丙醇溶液中涮洗3 s,4 000 r/min旋涂10 s,使得残留异丙醇挥发,优化加热温度。
空穴传输层与电极的制备:在1 mL氯苯中加入72.3 mg的spiro-OMeTAD(2, 2′, 7, 7′-四[N, N-二(4-甲氧基苯基)氨基]-9, 9′-螺二芴)固体粉末,28.8 μL的4-叔丁基吡啶和18.8 μL锂盐溶液(520 mg双三氟甲烷磺酰亚胺锂溶解在1 mL的乙腈溶液中),常温搅拌24 h。spiro-OMeTAD溶液旋涂滴加在钙钛矿薄膜上,转速为3 000 RPM,旋涂时间20 s。旋涂结束后,放置一段时间,将空穴传输层残留的溶剂完全挥发,随后将基片放入过渡舱中充O2氧化6 h。最后,通过掩膜板控制蒸镀金属电极电池的面积为0.12 cm2,电池组装完成。
1.3 性能测试采用荷兰帕纳科生产的X′Pert PRO MPD型X射线衍射仪(XRD),在40 kV和40 mA条件下对薄膜进行物相和结晶性分析。采用日立公司生产的SU8020冷场发射扫描电子显微镜(SEM)来表征薄膜表面。采用安捷伦公司生产的CARY5 000型紫外可见近红外分光光度计(UV-Vis)表征样品的光学吸收性能。采用上海辰华生产的CHI760E型电化学工作站对制备的电池器件进行阻抗测试。采用北京衡工仪器有限公司的HGSS-W50太阳光模拟器,使用Keithley 2400数据源表,在光强为1 000 W/cm2的模拟光源下测试钙钛矿太阳能电池的J-V曲线。
2 结果与分析在实验中对钙钛矿活性层进行不同方式的掺杂,主要实验了三种掺杂工艺,具体工艺如下。
方法一:用移液枪取适量的PbI2(DMSO)溶液滴在制备好的TiO2致密层上,4 000 r/min旋涂30 s,放置2~3 min。放入MAI的异丙醇溶液中浸泡10 min,取出后立即放入异丙醇溶液中漂洗。随后在4 000 r/min、10 s下甩干多余的异丙醇溶液。再放入FAI(10 mg/mL)的异丙醇溶液中浸泡5 s。取出后放入异丙醇中漂洗,然后在4 000 rpm、10 s下甩干多余的异丙醇,140 ℃加热10 min。
方法二:用移液枪取适量的PbI2(DMSO)溶液,滴在制备好的TiO2致密层上。4 000 r/min旋涂30 s,放置2~3 min。放入MAI的异丙醇溶液中浸泡10 min,取出后立即放入异丙醇中漂洗,再放入FAI(10 mg/mL)的异丙醇溶液中浸泡5 s后立即放入异丙醇溶液中漂洗。在4 000 r/min、10 s下甩干多余的异丙醇溶液,再140 ℃加热10 min。
方法三:用移液枪取适量的PbI2(DMSO)溶液,滴在制备好的TiO2致密层上,4 000 r/min旋涂30 s,放置2~3 min。放入MAI的异丙醇溶液中浸泡10 min,取出后放入FAI(10 mg/mL)的异丙醇溶液中浸泡5 s,再用异丙醇漂洗。在4 000 r/min、10 s下甩干多余的异丙醇溶液,140 ℃加热10 min。
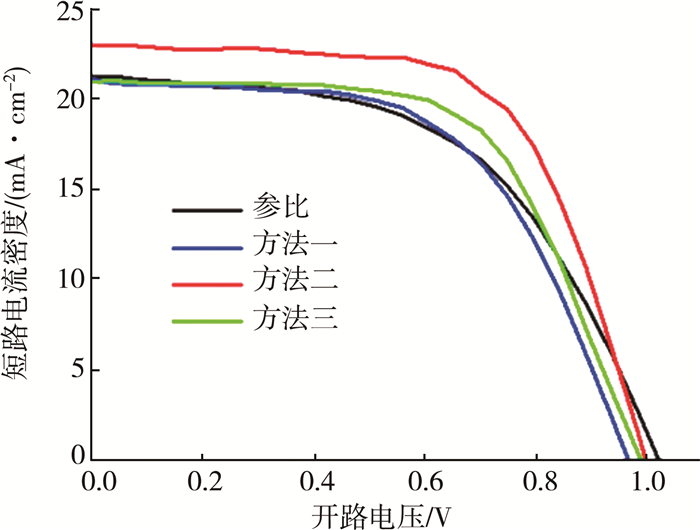
2.1 器件性能分析图 1显示了不同制备条件下器件的最优性能。从图中可以看出:方法二提升最为明显,方法三略微提升,方法一器件性能略微下降。
 |
| 图 1 不同制备工艺下的最优J-V曲线 |
方法一中再次浸泡时由于薄膜是甩干之后再浸泡,接触即发生FA+与MA+的交换,溶液接触的先后顺序易导致同一片基底上发生交互不均匀现象。在方法二的制备工艺中,残留的异丙醇溶液延缓了离子的交互作用,使得离子交互更加均匀。与方法三相比,方法二在将基片放入FAI溶液前用异丙醇漂洗的过程可以有效去除钙钛矿表面残留的MAI溶液,避免直接放入而导致FAI的溶液组份发生变化,即避免增添其他影响因素(不能通过单一控制基片在FAI溶液中的浸泡时长来控制FA+掺入量)。综合以上初步尝试,选取方法二作为掺杂工艺。
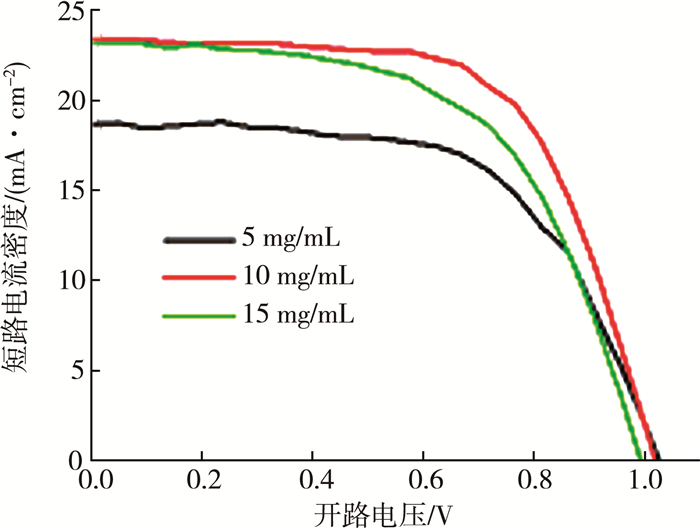
实验中初步使用10 mg/mL的FAI的溶液浓度是借鉴两步法中MAI在异丙醇中的浓度,但是MAI溶液是与PbI2(DMSO)反应生成MAPbI3,而FAI溶液是提供FA+与钙钛矿层中的MA+发生置换反应的,两者的作用不同,因此FAI的溶液浓度不能直接选用,需要进行调整优化。设计FAI的异丙醇溶液浓度分别为5 mg/mL、10 mg/mL、15 mg/mL三种。图 2为不同FAI浓度的异丙醇溶液浸泡5 s并在140 ℃加热10 min所得到的掺杂钙钛矿太阳能电池的最优J-V特性曲线。
 |
| 图 2 不同浸泡浓度下的最优J-V曲线 |
实验发现,当基片在5 mg/mL的FAI溶液中浸泡5 s时,器件的性能反而下降,推测为FA+与MA+交互反应没有异丙醇溶解少量的MA+快,所以有极少量的PbI2残留。于是将浸泡时间延长为15 s,但加热后发现钙钛矿膜出现白雾。通过性能对比和分析白雾现象,推测因为FAI浓度较低,导致阳离子交换比MA+溶解慢,而延长浸泡时间导致器件的整体成膜性能变差。当钙钛矿层在浓度为15 mg/mL的FAI溶液中浸泡5 s时,短路电流明显提高,开路电压下降明显,且填充降低,说明反应过快,从而导致钙钛矿成膜性变差。综上得出FAI的最优浓度为10 mg/mL(具体表现为:提高电流值的同时也不会对电压值有太大影响)。
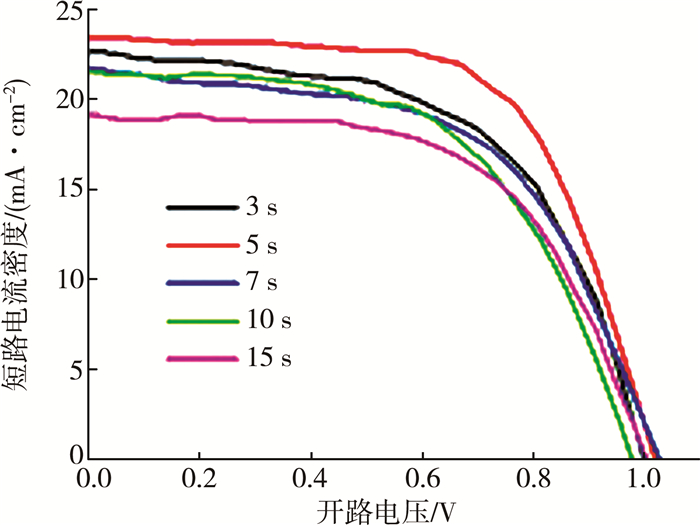
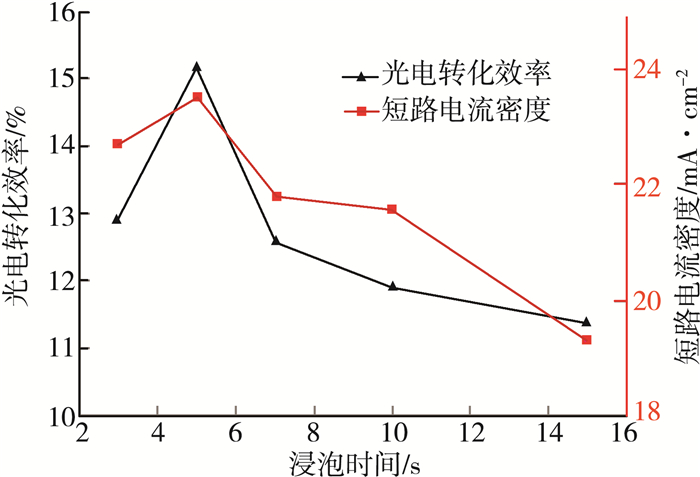
因为第二次浸泡时间会直接影响钙钛矿的成膜质量,拟设计3 s、5 s、7 s、10 s、15 s共5个浸泡时长,研究反应的时长对器件性能的影响。图 3为在10 mg/mL的FAI的异丙醇溶液中,不同的第二次浸泡时长所制备的掺杂钙钛矿太阳能电池的最优J-V特性曲线。图 4为不同浸泡时间下器件的光电转化效率及短路电流的变化。
 |
| 图 3 不同浸泡时间条件下的最优J-V曲线 |
 |
| 图 4 不同浸泡时间条件下光电转化效率和短路电流密度的变化 |
通过对在10 mg/mL的FAI异丙醇溶液中不同的浸泡时间的对比,发现浸泡时间过短则FA+掺杂过少,性能提升不明显,而延长第二次浸泡的时间,则会影响钙钛矿层的成膜质量,从而使电池的整体性能有所下降。通过对浸泡时间的优化,得出第二次浸泡时间为5 s时器件性能最优。由于第二次浸泡的过程中将FA+引入到MAPbI3中,而FAPbI3存在四方晶系的钙钛矿相和和六方晶系的非钙钛矿相[16-17]两种情况,拟设计100 ℃、110 ℃、120 ℃、130 ℃、140 ℃、150 ℃共6个退火温度进行处理。
图 5为不同退火温度处理掺杂钙钛矿太阳能电池的J-V特性曲线。可以看出:温度过低,器件性能提升不明显,可能是掺杂层在此退火温度下结晶性不好;温度过高,器件的性能有所降低,可能是随着加热温度的升高,底层MAPbI3的结晶性变差[18-19],从而影响载流子的传输。在140 ℃退火时器件性能最优,在此温度下,钙钛矿表层结晶性良好且不影响底层MAPbI3的结晶性。故FA+掺杂的最优退火温度为140 ℃。
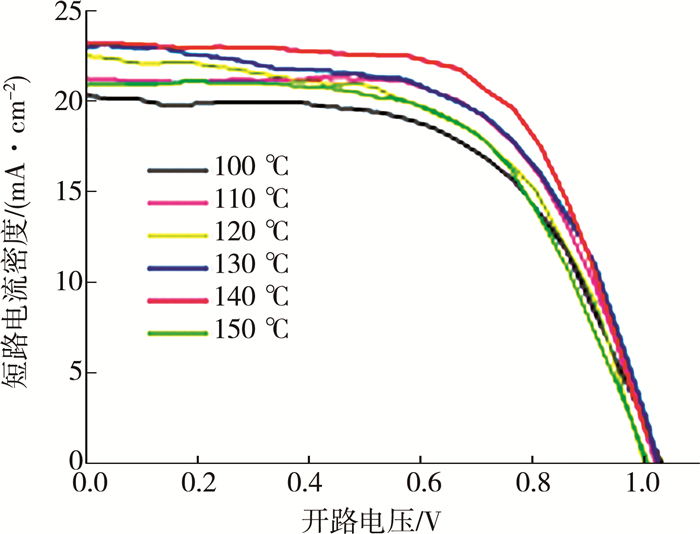 |
| 图 5 不同退火温度下制备的掺杂钙钛矿太阳能电池的J-V曲线 |
对比FAPbI3单晶的差示扫描量热图(图 6)发现,在加热过程中,六方晶系在150.2 ℃时通过吸收能量转变为四方晶系。由于FA+少量掺杂到四方相的MAPbI3晶格中,不足以形成六方相,因此退火温度低于相转变温度。
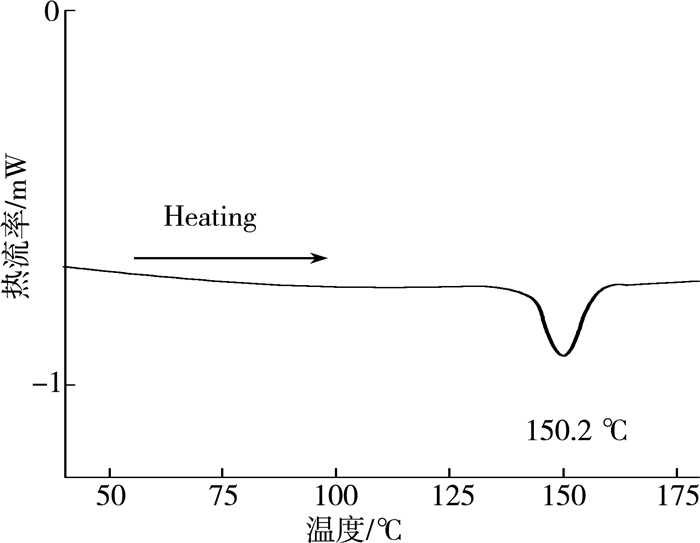 |
| 图 6 FAPbI3钙钛矿四方晶系和六方晶系相转变的差示扫描量热法显示图 |
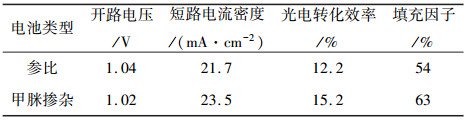
最终获得的最优掺杂电池和参比电池的各性能参数如表 1所示。从表中可以看出:掺杂后器件光电转化效率提升至15.2%。在各参数中,短路电流和填充因子的提升较为明显,主要存在两方面原因:首先,掺杂后的钙钛矿层禁带宽度发生变化,光吸收范围变广,从而提高器件的短路电流;另一方面,掺杂后钙钛矿的结晶性和表面形貌得到优化,使载流子有效收集,从而提高了短路电流和填充因子。
| 表 1 掺杂电池和参比电池的性能参数 |
 |
2.2 钙钛矿层的形貌分析
通过SEM来观察钙钛矿表层的形貌以及结晶情况,如图 7所示。图 7a是TiO2致密层的SEM图片,可以看出TiO2均匀致密,可以完全覆盖FTO层。实验中采用PbI2(DMSO)的DMF溶液作为两步法的前驱体溶液。传统PbI2所制得钙钛矿薄膜如图 7b所示:钙钛矿层可以完全覆盖致密层,但表面并不平整,晶粒大小分布不均匀,晶粒排列不致密,缺陷及孔洞较多,从而影响电子和空穴的传输,降低器件的整体效率。而通过PbI2(DMSO)前驱液制备的钙钛矿层,观察结果如图 7c所示:钙钛矿薄膜均匀致密,无空洞,表面较为平整,晶粒的直径为100~350 nm。图 7d显示:通过浸泡掺杂FA+的钙钛矿层的晶粒尺寸更大,分布更为均匀,表面更为平整。晶粒尺寸较大有助于提高器件的性能,载流子传输时通过的晶界较少,能量损失少,从而载流子传输效率更高,这也是短路电流提升的原因之一[20]。另外,钙钛矿层的平整连续,使得钙钛矿层可以完全被空穴传输层覆盖,空穴传输层表面均匀、平整且连续,而空穴传输层的平整连续有利于Au电极与空穴传输层形成良好的接触,这对载流子的收集十分有利。
 |
| 注:a.TiO2致密层;b.PbI2制备的钙钛矿层;c.PbI2(DMSO)制备的钙钛矿层;d.用10 mg/mL的FAI浸泡5 s、140 ℃加热10 min的钙钛矿层 图 7 钙钛矿表层形貌以及结晶情况的SEM图像 |
2.3 浸泡法FA掺杂钙钛矿层的作用机理
对FA+掺杂的钙钛矿层进行紫外可见吸收光谱测试,结果如图 8所示。对于在10 mg/mL的FAI的异丙醇溶液中浸泡不同时间的钙钛矿薄膜,可以观察到紫外起始吸收边存在明显的红移现象,表明通过离子交换FA+确实部分取代了MAPbI3中的MA+。带隙的变化是引起紫外吸收红移的主要原因,即FA+掺杂量的变化。因此,通过控制在FAI的异丙醇溶液中的浸泡时间可以系统地调控带隙变化。另外,在500~750 nm范围内,5 s浸泡实验条件下的钙钛矿薄膜相比于其他浸泡时间制备的钙钛矿薄膜吸收强度略大。
 |
| 图 8 不同浸泡时间的钙钛矿薄膜的紫外可见吸收光谱 |
图 9为MAPbI3薄膜和浸泡5 s时掺杂薄膜的禁带宽度。MAPbI3薄膜的禁带宽度为1.6 eV,掺杂后禁带宽度变小,为1.57 eV,表明FA+的掺杂改变钙钛矿层的禁带宽度,从而扩宽吸光范围,增大短路电流。
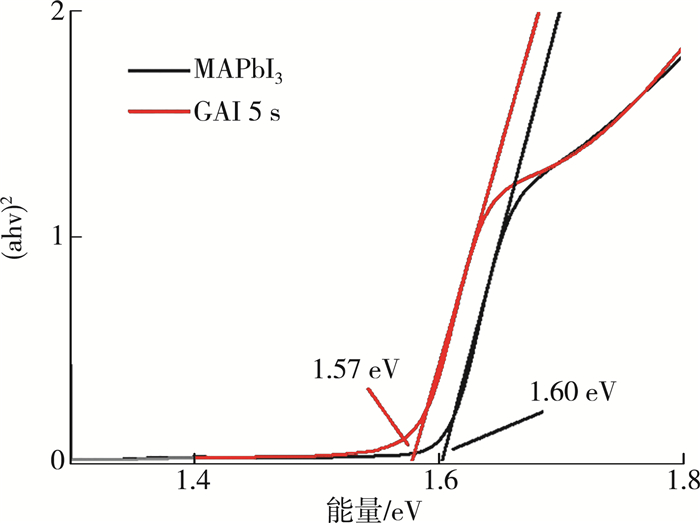 |
| 图 9 MAPbI3薄膜和浸泡5 s掺杂薄膜的禁带宽度 |
为了确定FA+掺杂后晶体晶相的变化,对掺杂钙钛矿薄膜进行了XRD分析,结果如图 10所示。比较通过PbI2(DMSO)制备的MAPbI3膜和不同浸泡时间掺杂FA+的钙钛矿层的XRD衍射花样,证明通过浸泡法在钙钛矿层中掺杂FA+制备混合阳离子钙钛矿太阳能电池是成功的。
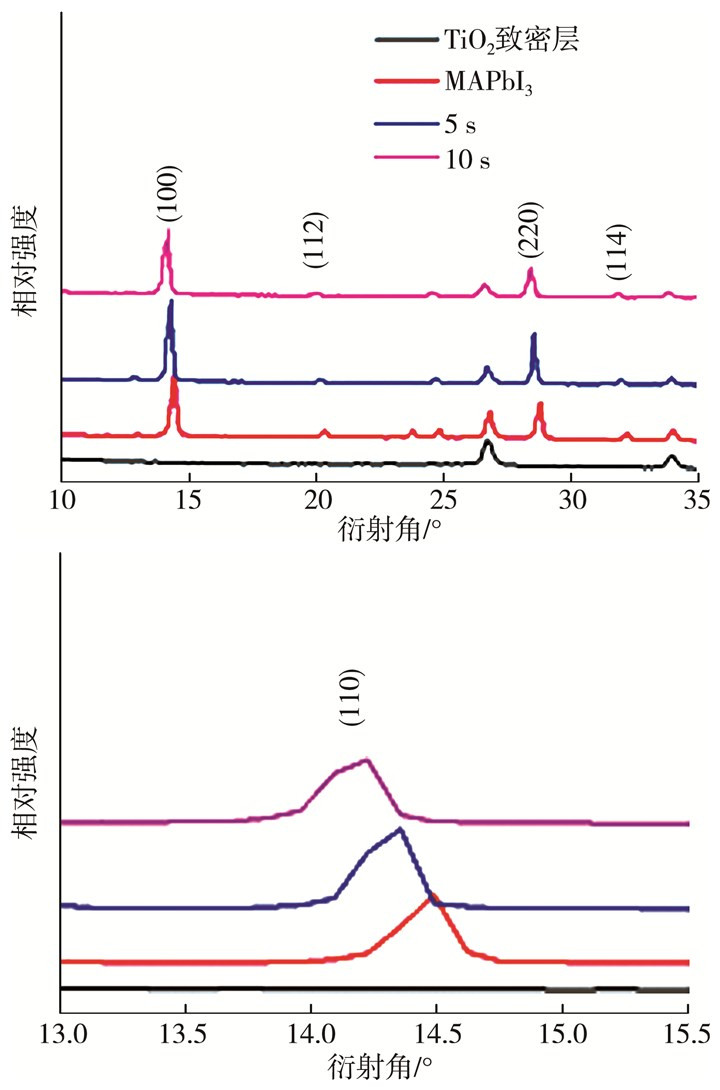 |
| 图 10 不同浸泡时间的钙钛矿薄膜的X射线衍射花样(a.10°-35°;b.13°~15.5°) |
从图 10a中可以看出:不同浸泡时间所得到的钙钛矿薄膜均属于四方晶系[21],尖锐的衍射特征峰证明钙钛矿薄膜拥有良好的结晶性。而且钙钛矿峰非常完整,没有PbI2的峰,说明两步法前驱液完全转化成钙钛矿。XRD半峰全宽(FWHM)主要由晶粒大小和应变控制,在Williams-Hall图中,线性拟合峰宽与散射矢量的y轴截距与晶粒直径成反比[22]。参比薄膜、浸泡5 s、浸泡10 s时的薄膜的FWHM分别为0.210°、0.177°、0.235°,可以发现浸泡5 s时钙钛矿的成膜性最好,同时MA1-xFAxPbI3的主要衍射峰随浸泡时间的延长而发生偏移。根据Vegard定律,当掺杂前后晶相不发生改变时,峰的偏移与掺杂量成正比[23-24]。图 10b提供了2θ在13°~15.5°的范围内浸泡不同时长的掺杂钙钛矿的XRD衍射花样。发现(110)峰的偏移是和浸泡时间相对应的,这主要是由于较大的FA+(IR=0.23 nm)逐渐取代离子半径较小的MA+(IR=0.18 nm),从而使晶格间距在一定程度上增大。另外,该结果与紫外可见光测试保持一致。
2.4 甲脒掺杂对钙钛矿电池的电子传输影响对电池的电化学阻抗谱测量进行了分析,解释了界面处电荷传输和载体重组的过程。如图 11所示,测试了参比电池和甲脒掺杂钙钛矿电池的阻抗,利用等效电路和器件的Nyquist图对拟合曲线进行了测量。在等效电路中,Rs是器件的串联电阻,Rhtm是空穴传输层的电荷转移电阻,Rrec是电荷的转移电阻,反映电荷重组的阻力[25-26],其值越大,说明电子和空穴复合越小[27]。从图中可以看出,甲脒掺杂电池的Rrec值要高于参考电池的Rrec值。由于掺杂后钙钛矿表面形貌更为平整,与空穴传输层接触良好,载流子在界面可以快速分离和传输。因此,甲脒掺杂的太阳能电池具有较高的电荷转移率和较低的载体重组率,证明短路电流提高的部分原因是载流子传输效率的影响。
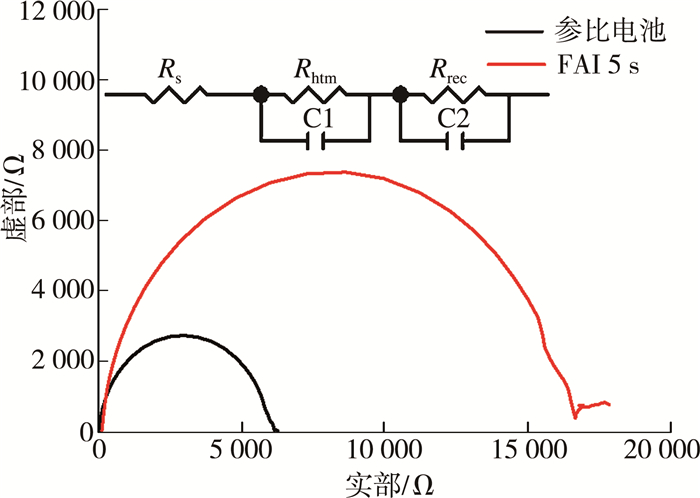 |
| 图 11 参比电池和FAI(10 mg/mL)浸泡5 s及140 ℃加热10 min的掺杂电池的Nyquist图和等效电路图 |
3 结论
主要对浸泡工艺下获得的MA1-xFAxPbI3掺杂的太阳能电池性能进行研究。通过严格控制浸泡浓度和时间、退火温度等条件,进行对比分析,确定最优掺杂条件:浓度10 mg/mL的FAI,浸泡5 s,140 ℃退火10 min。此条件下,钙钛矿薄膜的结晶情况得到极大地改善。主要是因为第一次成膜遗留的缺陷,在再次浸泡过程中得到快速重新结晶,钙钛矿晶体尺寸增大,有利于电子和空穴的传输,填充因子得到较大提高。根据阻抗分析推测,掺杂后载流子的复合减小,载流子的收集效率提高,从而提高了短路电流。通过XRD和紫外吸收分析,推测FA+已成功掺杂到钙钛矿层,对其禁带宽度具有良好的调节作用,使短路电流在开路电压不明显降低的情况下得到显著地提升。浸泡法FA+掺杂使得钙钛矿太阳能电池的光电转化效率相对参比电池提高了25%,最高达到15.2%。
| [1] |
UMBACH F. Global energy security and the implications for the EU[J]. Energy Policy, 2010, 38(3): 1229-1240. DOI:10.1016/j.enpol.2009.01.010 |
| [2] |
陈方, 刘晓倩, 魏香凤, 等. 钙钛矿太阳能电池ABX3层研究进展[J]. 齐鲁工业大学学报, 2016, 30(5): 1-8. |
| [3] |
栾梦雨, 刘晓倩, 陈方, 等. 有机-无机钙钛矿晶体生长调控研究进展[J]. 河南大学学报(自然科学版), 2016, 46(3): 276-285. |
| [4] |
CHONGHE L I, SOH K C K, PING W U. Formability of ABO3 perovskites[J]. Journal of Alloys & Compounds, 2004, 372(1): 40-48. |
| [5] |
SALIBA M, MATSUI T, DOMANSKI K, et al. Incorporation of rubidium cations into perovskite solar cells improves photovoltaic performance[J]. Science, 2016, 354(6309): 206-209. DOI:10.1126/science.aah5557 |
| [6] |
REHMAN W, MCMEEKIN D, PATEL J, et al. Photovoltaic mixed-cation lead mixed-halide perovskites:Links between crystallinity, photo-stability and electronic properties[J]. Energy & Environmental Science, 2016, 10(1): 361-369. |
| [7] |
MCMEEKIN D P, SADOUGHI G, REHMAN W, et al. A mixed-cation lead mixed-halide perovskite absorber for tandem solar cells[J]. Science, 2016, 351(6269): 151-155. DOI:10.1126/science.aad5845 |
| [8] |
GRATIA P, GRANCINI G, AUDINOT J N, et al. Intrinsic halide segregation at nanometer scale determines the high-efficiency of mixed cation/mixed halide perovskite solar cells[J]. Journal of the American Chemical Society, 2016, 138(49): 15821-15824. DOI:10.1021/jacs.6b10049 |
| [9] |
JING C, JIA X, LI X, et al. Mixed-organic-cation (FA)x(MA)1-xPbI3 planar perovskite solar cells with 16.48% efficiency via a low-pressure vapor-assisted solution process[J]. ACS Applied Materials & Interfaces, 2017, 9(3): 2449-2458. |
| [10] |
JI F, WANG L, PANG S, et al. A balanced cation exchange reaction toward highly uniform and pure phase FA1-XMAxPbI3 perovskite films[J]. Journal of Materials Chemistry A, 2016, 4(37): 14437-14443. DOI:10.1039/C6TA05727F |
| [11] |
LI G, ZHANG T, GUO N, et al. Ion-exchange-induced 2D-3D conversion of MA1-xFAxPbI3Cl perovskite into a high-quality MA1-xFAxPbI3 perovskite[J]. Angewandte Chemie-International Edition, 2016, 128(43): 13658-13662. |
| [12] |
SAIDAMINOV M I, ABDELHADY A L, MACULAN G, et al. Retrograde solubility of formamidinium and methylammonium lead halide perovskites enabling rapid single crystal growth[J]. Chemical Communications, 2015, 51(100): 17658-17661. DOI:10.1039/C5CC06916E |
| [13] |
BINEK A, HANUSCH F C, DOCAMPO P, et al. Stabilization of the trigonal high-temperature phase of formamidinium lead iodide[J]. Journal of Physical Chemistry Letters, 2015, 6(7): 1249-1253. DOI:10.1021/acs.jpclett.5b00380 |
| [14] |
SLIMI B, MOLLAR M, ASSAKER I B, et al. Perovskite FA1-xMAxPbI3 for solar cells:films formation and properties[J]. Energy Procedia, 2016, 102: 87-95. DOI:10.1016/j.egypro.2016.11.322 |
| [15] |
ZHANG Y, GRANCINI G, FENG Y, et al. Optimization of stable quasi-cubic FAxMA1-xPbI3 perovskite structure for solar cells with efficiency beyond 20%[J]. Acs Energy Letters, 2017, 2(4): 802-806. DOI:10.1021/acsenergylett.7b00112 |
| [16] |
HAN Q, BAE S H, SUN P, et al. Single crystal formamidinium lead iodide (FAPbI3):Insight into the structural, optical, and electrical properties[J]. Advanced Materials, 2016, 28(11): 2253-2258. DOI:10.1002/adma.201505002 |
| [17] |
ZHUMEKENOV A A, SAIDAMINOV M I, HAQUE M A, et al. Formamidinium lead halide perovskite crystals with unprecedented long carrier dynamics and diffusion length[J]. Acs Energy Letters, 2016, 1(1): 32-37. DOI:10.1021/acsenergylett.6b00002 |
| [18] |
LUAN M, SONG J, WEI X, et al. Controllable growth of bulk cubic-phase CH3NH3PbI3 single crystal with exciting room-temperature stability[J]. Crystengcomm, 2016, 18(28): 5257-5261. DOI:10.1039/C6CE00375C |
| [19] |
FAN B, PENG D, LIN S, et al. Enhanced efficiency of planar-heterojunction perovskite solar cells through a thermal gradient annealing process[J]. RSC Advances, 2015, 5(71): 58041-58045. DOI:10.1039/C5RA09691J |
| [20] |
WEI X, ZHANG M, LIU X, et al. Semitransparent CH3NH3PbI3 films achieved by solvent engineering for annealing-and electron transport layer-free planar perovskite solar cells[J]. Solar RRL, 2018. DOI:10.1002/solr.201700222 |
| [21] |
SAIDAMINOV M I, ABDELHADY A L, MURALI B, et al. High-quality bulk hybrid perovskite single crystals within minutes by inverse temperature crystallization[J]. Nature Communications, 2015, 6: 7586. DOI:10.1038/ncomms8586 |
| [22] |
HOKE E T, SLOTCAVAGE D J, DOHNER E R, et al. Reversible photo-induced trap formation in mixed-halide hybrid perovskites for photovoltaics[J]. Chemical Science, 2014, 6(1): 613-617. |
| [23] |
MACULAN G, SHEIKH A D, ABDELHADY A L, et al. CH3NH3PbCl3 single crystals:Inverse temperature crystallization and visible-blind UV-photodetector[J]. Journal of Physical Chemistry Letters, 2015, 6(19): 3781-3786. DOI:10.1021/acs.jpclett.5b01666 |
| [24] |
XU J, TANG Y B, CHEN X, et al. Synthesis of homogeneously alloyed Cu2-x(SySe1-y) nanowire bundles with tunable compositions and bandgaps[J]. Advanced Functional Materials, 2010, 20(23): 4190-4195. DOI:10.1002/adfm.201000771 |
| [25] |
CHEN B X, RAO H S, CHEN H Y, et al. Ordered macroporous CH3NH3PbI3 perovskite semitransparent film for high-performance solar cells[J]. Journal of Materials Chemistry A, 2016, 4(40): 15662-15669. DOI:10.1039/C6TA06232F |
| [26] |
ZHANG S, LU Y, LIN B, et al. PVDF-HFP additive for visible-light-semitransparent perovskite films yielding enhanced photovoltaic performance[J]. Solar Energy Materials & Solar Cells, 2017(170): 178-186. |
| [27] |
SUN C Y, GUO Y P, FANG B J, et al. Enhanced photovoltaic performance of perovskite solar cells using polymer P(VDF-TrFE) as a processed additive[J]. Journal of Physical Chemistry C, 2016, 120(24): 12980-12988. DOI:10.1021/acs.jpcc.6b05255 |
 2018, Vol. 32
2018, Vol. 32


