| 复合蛋白酶水解法制备麦麸多肽及其抗氧化性能研究 |
2. 青岛科技大学 海洋科学与生物工程学院,青岛 266042
2. College of Marine Science and Biological Engineering, Qingdao University of Science and Technology, Qingdao 266042, China
麦麸作为小麦加工行业的主要副产品,大部分被用作饲料成分或发酵工业,少部分制成高纤维产品[1-3]。麦麸蛋白含量占总重的16%~20%,其中六种必需氨基酸含量高于小麦谷蛋白[4]。蛋白质经蛋白酶适当的水解制备具有较高营养价值的多肽,同时提高其功能性和消化利用率,因此将蛋白大分子降解为多肽小分子更有利于麦麸的高附加值利用。酶法水解因其反应条件温和、效率高,被认为是获得食品级生物活性肽的常用方法。
多肽具有不同的生物活性。大量的研究证实,一些多肽具有潜在的抗氧化、降血压、降血脂、抑菌等功能,所以多肽研究越来越受到科学家的关注。张辉[5]利用超声辅助木瓜蛋白酶制备麦麸多肽,得到最优条件的麦麸抗氧化肽对OH和DPPH自由基的清除率分别为83.13%和78.86%,还原能力达到0.511。Dadzie[6]等人利用碱性蛋白酶制备小麦谷蛋白多肽,通过响应面优化所得多肽的水解度达到12.11%,ACE抑制能力达到78.93%,具有较高的降压功能。Xia[7]等人比较风味蛋白酶和碱性蛋白酶分别水解大麦蛋白所得酶解产物的抗氧化活性,发现碱性蛋白酶解产物具有较高的抗氧化性能。利用风味蛋白酶与碱性蛋白酶复合水解麦麸蛋白制备多肽,以麦麸蛋白多肽的水解度及还原能力为指标,用响应面法优化酶解条件,研究其抗氧化活性,为麦麸抗氧化肽的实际生产及在食品中的应用提供理论依据。
1 材料与仪器 1.1 材料麦麸(山东夏津发达面粉集团);麦麸蛋白(实验室自制);碱性蛋白酶(2×105 U/g)、风味蛋白酶(8×105 U/g)购自南宁庞博生物工程有限公司;2, 2′-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS)、过硫酸钾均为分析纯,购自上海麦克林生化科技有限公司;氢氧化钠、氢氧化钾、盐酸、甲醛溶液、三氯化铁、铁氰化钾等均为分析纯,购自国药集团化学试剂有限公司。
1.2 仪器SHA-BA水浴恒温振荡器;TG1650-WS高速离心机;FD-1A-50冷冻干燥机;UV-1800PC紫外分光光度计;K9860全自动凯氏定氮仪。
2 实验 2.1 麦麸蛋白的提取及多肽的制备取一定量过40目筛的小麦麸皮,按照1:19的料液比加入0.020 mol/L的KOH溶液,45 ℃下置于超声清洗仪中超声1 h,6 000 r/min离心10 min后收集上清液。调节pH为4.8,静置4 h后6 000 r/min离心10 min,洗涤沉淀至中性,冷冻干燥后得到蛋白质干粉[8]。
称取适量麦麸蛋白配成2%的蛋白悬浮液,按照不同的加酶量、温度、pH、时间,加入不同配比的风味蛋白酶和碱性蛋白酶,在恒温振荡器中进行酶解反应。酶解液95 ℃下灭酶10 min后,过滤得上清液。冷冻干燥得到麦麸多肽。
2.2 麦麸多肽制备单因素试验采用2.1酶解制备麦麸多肽,反应条件为:蛋白悬浮液浓度为2%,风味蛋白酶与碱性蛋白酶配比为1:1,酶添加量为8 000 U/g,酶解温度为50 ℃,时间为4 h,酶解pH为8。在其他条件不变的情况下,以水解度及还原能力为考查指标。分别选取风味蛋白酶与碱性蛋白酶配比为:3:1、2:1、1:1、1:2、1:3,酶添加量为(U/g):6 000、7 000、8 000、9 000、10 000、11 000,pH为:6.0、7.0、8.0、9.0、10.0,反应时间为(h):2、3、4、5、6,反应温度为(℃):40、45、50、55、60,进行单因素实验。
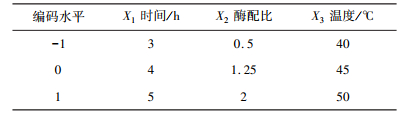
2.3 麦麸多肽制备工艺优化利用Design-Expert 8.0软件,设计Plackett-Burman实验,得到显著影响麦麸蛋白水解度及多肽还原能力的主要因素为:酶解时间、风味酶与碱性酶配比、酶解温度。因此选取酶解时间(X1)、风味酶与碱性酶配比(X2)、酶解温度(X3)三个因素,进行Box-Behnken中心组合设计实验。以蛋白水解度及还原能力作为评价指标,设计三因素三水平共17个试验点的响应面分析,其因素水平编码表见表 1。
| 表 1 响应面因素水平表 |
 |
2.4 水解度的测定
根据文献[9],按照凯氏定氮法测定总氮(TN),甲醛电位滴定法测定酶解液中游离氨态氮(AN)。水解度按式(1)计算:
| $ DH = \frac{{AN}}{{TN}} \times 100\% , $ | (1) |
式中:DH为水解度(%);AN为游离氨态氮含量(g);TN为麦麸蛋白总氮含量(g)。
2.5 抗氧化性能测定1) 还原性能及羟基自由基清除能力的测定根据王益莉[10-11]等人的检测方法。其中还原能力作为单因素及响应面的考查指标,直接取稀释10倍后的酶解液2.0 mL与2.0 mL 0.2 mol/L的磷酸盐缓冲溶液(pH=6.6)及2.0 mL 1%的铁氰化钾溶液混合。混合液于50 ℃,反应20 min,然后加入2.0 mL 10%的三氯乙酸溶液。取上清液2 mL与2 mL去离子水及0.4 mL 0.1%的FeCl3溶液,室温下反应10 min,于700 nm处测定吸光度。去离子水取代样品作为空白。每个样品平行测定三次。
2) 羟基自由基清除能力测定采用Fenton反应法。移取不同浓度的样品溶液各2.0 mL于试管中,加入9 mmol/L FeSO4 0.5 mL,9 mmol/L水杨酸-乙醇溶液0.5 mL,接着加入6.5 mL去离子水,最后加入8.8 mmol/L H2O2 0.5 mL,37 ℃水浴加热15 min后取出,测其吸光度(As)。用2 mL的去离子水替代样品作为空白(Ab),用0.5 mL去离子水替代FeSO4测定吸光度(A0)。每份样品平行操作3次,取均值。计算公式为:
| $ Y = \left( {1 - \frac{{{A_{\rm{s}}} - {A_0}}}{{{A_{\rm{b}}}}}} \right) \times 100\% $ | (2) |
式中:Y为对羟基自由基的清除率(%);As为样品溶液在510 nm处的吸光值;Ab为去离子水代替样品在510 nm处的吸光值;A0为去离子水代替FeSO4在510 nm处的吸光值。
3) ABTS自由基清除能力的测定根据徐亚元[12]等人的检测方法。取0.2 mL、7 mmol/L ABTS和0.2 mL、2.6 mmol/L过硫酸钾,在室温下避光静置过夜,形成ABTS自由基储备液;使用前用pH=7.4的磷酸盐缓冲溶液稀释40~50倍,要求其在30 ℃、734 nm波长下的吸光度为0.7±0.02,形成ABTS自由基工作液。加入不同浓度的麦麸多肽溶液0.2 mL、ABTS工作液0.8 mL,振摇10 s,混合均匀后在室温下避光反应6 min后,在734 nm处测定吸光度A。空白以0.2 mL 95%乙醇作对照测定吸光度值A0。计算公式为:
| $ Y = \frac{{{A_0} - A}}{{{A_0}}} \times 100\% $ | (3) |
式中:Y为对ABTS自由基的清除率(%);A为样品溶液在734 nm处的吸光值;A0为0.2 mL 95%乙醇代替样品溶液在734 nm处的吸光值。
3 结果与分析 3.1 单因素试验结果 3.1.1 酶配比对麦麸多肽水解度及还原能力的影响由图 1可知,麦麸多肽的水解度随着酶配比的降低呈降低趋势;而麦麸多肽的还原能力随着酶配比的降低先升高、后降低,并且在酶配比为1:1时麦麸多肽的还原能力最高,碱性酶的添加使得还原能力升高,此时水解度为25.98%。综合两个指标,选择酶配比为1:1为宜。
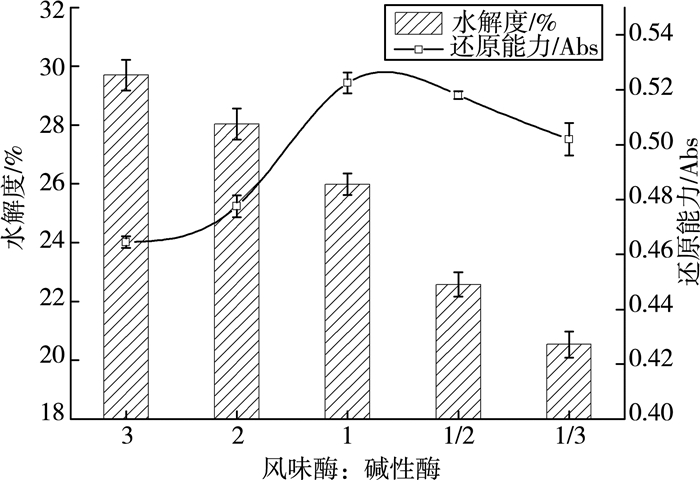 |
| 图 1 酶配比对麦麸多肽水解度及还原能力的影响 |
3.1.2 加酶量对麦麸多肽水解度及还原能力的影响
由图 2可知,麦麸多肽水解度及还原能力随着酶用量的增多呈逐渐升高的趋势。当酶用量为10 000 U/g时,麦麸多肽的还原性能达到最大值,且水解度较高。高于10 000 U/g底物时,水解度略有提高,但还原能力没有明显变化。这可能是因为酶浓度与底物之间的饱和度的影响,而且酶催化反应动力学表明,蛋白酶的过量存在会抑制酶的水解作用。考虑到抗氧化肽的制备,综合两个指标,选择加酶量为10 000 U/g为宜。
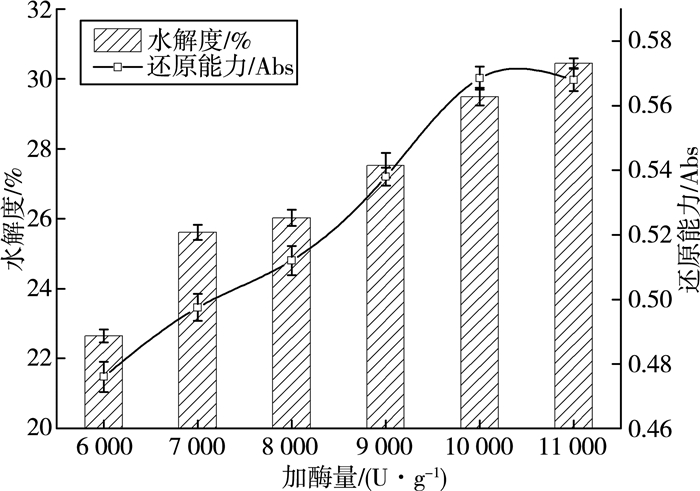 |
| 图 2 加酶量对麦麸多肽水解度及还原能力的影响 |
3.1.3 pH对麦麸多肽水解度及还原能力的影响
由图 3可知,麦麸多肽的水解度及还原能力随酶解pH的增大先升高、后降低。在pH为8时,麦麸多肽的水解度相对较高,还原能力达到最大值。pH大于9时,水解度及还原能力略有降低。主要原因是当pH较高时,会造成酶活性中心的构象甚至分子结构发生改变,进而使得蛋白酶活性降低,导致原料酶解不完全[13]。综合两个指标,选择pH=8为宜。
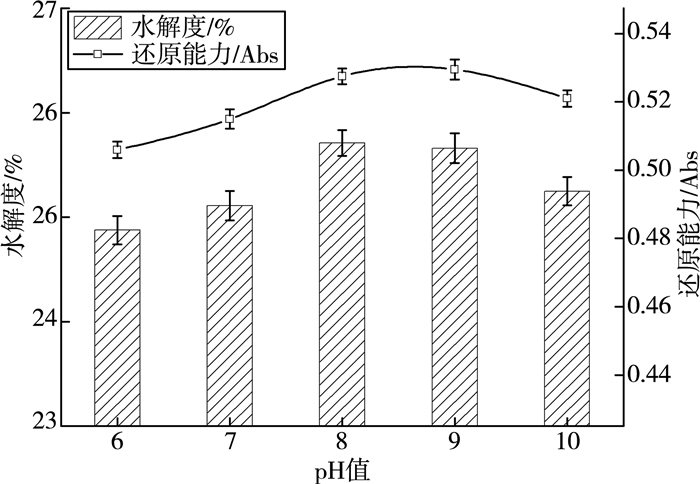 |
| 图 3 pH对麦麸多肽水解度及还原能力的影响 |
3.1.4 酶解时间对麦麸多肽水解度及还原能力的影响
由图 4可知,麦麸多肽的水解度及还原能力随时间的延长而升高。在酶解5 h以前,水解度和还原能力逐渐升高,继续延长酶解时间,水解度和还原能力不发生明显变化。这是因为随着时间的延长,底物浓度降低,酶解液中的酶解产物增多,过高的酶解产物和过低的底物浓度会对酶解反应产生抑制作用[14]。为节约时间成本,综合两个指标,选择5 h为宜。
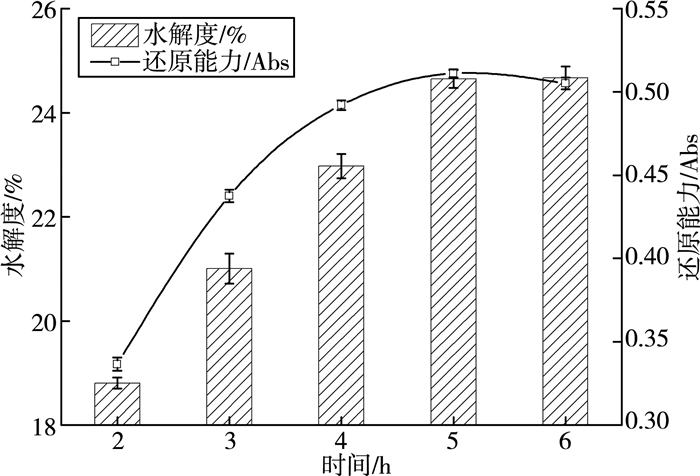 |
| 图 4 时间对麦麸多肽水解度及还原能力的影响 |
3.1.5 温度对麦麸多肽水解度及还原能力的影响
由图 5可知,酶解温度从40 ℃上升到50 ℃,麦麸多肽的水解度及还原能力显著升高;随着酶解温度的进一步升高,水解度却逐渐降低。这可能是因为每种酶都有其最佳的反应条件,更高或更低的温度将影响酶的催化反应速率和稳定性。温度升高,酶催化反应速度快,蛋白酶的稳定性变差。因此,综合两个指标,选择50 ℃为宜。
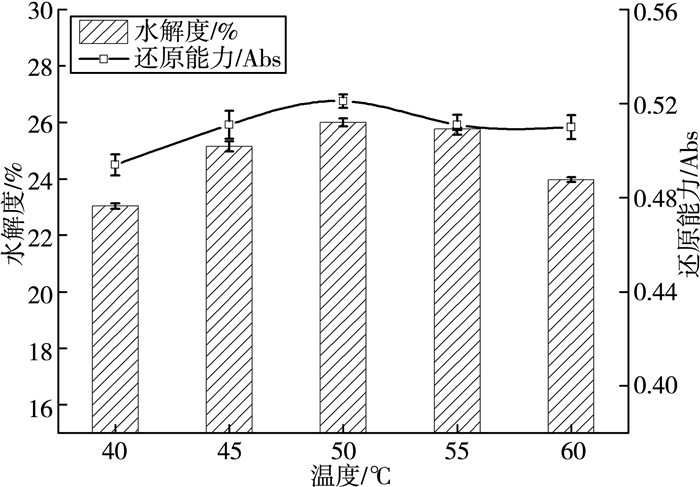 |
| 图 5 温度对麦麸多肽水解度及还原能力的影响 |
3.2 响应面优化试验结果
利用Design-Expert软件对实验结果进行二次回归分析,拟合得到的回归方程为:
| $ \begin{array}{l} \;\;\;\;\;{Y_1} = 23.75 + 2.93{X_1} + 1.60{X_2} + 1.60{X_2} + 1.70{X_3} - \\ 0.82{X_1}{X_2} - 0.078{X_1}{X_3} - 0.56{X_2}{X_3} - 1.57X_1^2 - \\ 0.000250X_2^2 - 1.09X_3^2 \end{array} $ | (4) |
| $ \begin{array}{l} \;\;\;\;{Y_2} = 0.38 + 0.082{X_1} - 0.050{X_2} + 0.045{X_3} - \\ 0.003375{X_1}{X_2} + 0.007875{X_1}{X_3} - 0.0025X_1^2 + \\ 0.006125X_2^2 - 0.017X_3^2 \end{array} $ | (5) |
对此模型进行方差分析与显著性检验,结果如表 2所示。
| 表 2 麦麸多肽水解度(Y1)和还原能力(Y2)的回归模型及方差分析 |
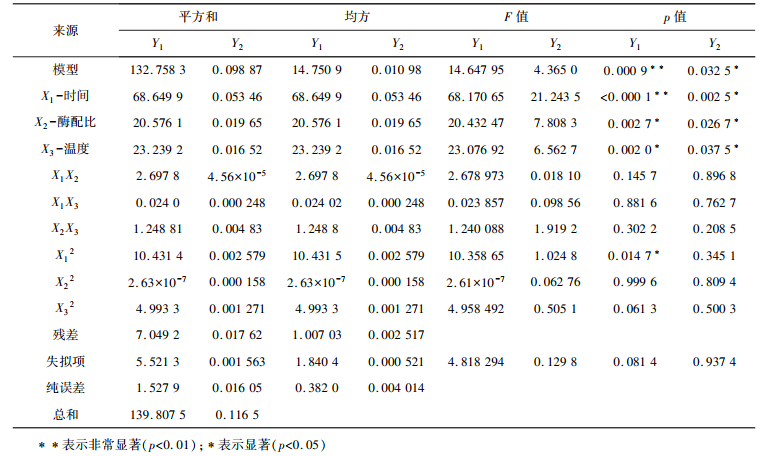 |
由表 2可知,麦麸多肽水解度及还原能力的测定模型回归均显著(p<0.01),失拟项不显著(p>0.05)。水解度测定决定系数R2=94.96%,校正决定系数R2=88.48%,说明88.48%的自变量可以利用回归方程解释蛋白的水解。还原能力的测定决定系数R2=84.88%,校正决定系数R2=65.43%。该模型的麦麸多肽水解度及还原能力测定预测值与实际实验所得值的拟合程度较好,可以用于酶解反应的理论推测。根据每组数据的概率值p,可以得出:在实验考查的范围内,影响麦麸多肽水解度的各因素按显著性排序依次为:时间>温度>酶配比,影响还原能力的各因素按显著性排序依次为:时间>酶配比>温度。
经过Design-Expert软件分析,麦麸多肽制备的最佳工艺参数为:酶解时间为5 h,风味酶与碱性酶配比为1:2,酶解温度为50 ℃。最佳酶解条件下进行验证实验,重复三次得到麦麸多肽水解度为26.24%,还原能力为0.53,分别与模型预测值相差0.82%和0.033,说明本优化的结果可靠。酶解液冻干得到麦麸多肽干粉,用于抗氧化性能的测定。
3.3 麦麸多肽抗氧化性能的测定麦麸多肽对羟基自由基及ABTS自由基的清除能力实验结果见图 6。由图 6可知,麦麸多肽及维生素C对ABTS自由基的半清除率浓度(IC50)大小分别为0.119 1 mg/mL和0.123 9 mg/mL;对羟基自由基的半清除率浓度(IC50)大小分别为15.32 mg/mL和0.46 mg/mL。实验结果表明麦麸多肽具有一定的自由基清除能力。
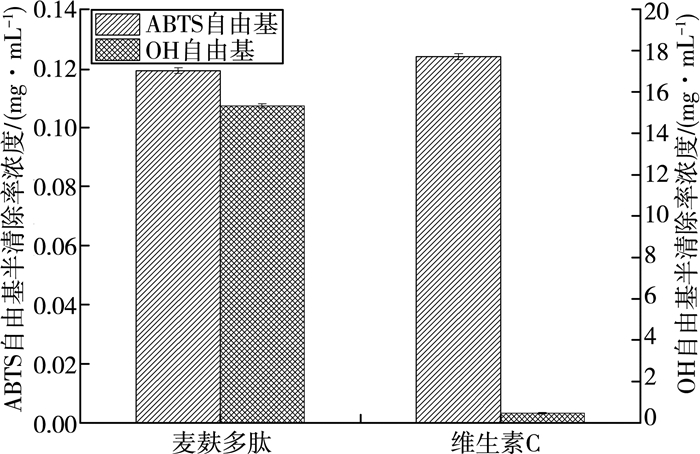 |
| 图 6 麦麸多肽的抗氧化性能 |
4 结论
1) 以水解度和还原能力为指标,研究风味蛋白酶与碱性蛋白酶配比、酶添加量、初始pH、反应时间和反应温度对麦麸多肽性能的影响。通过单因素试验和响应面优化,最终确定了复合酶解麦麸蛋白的最佳工艺条件为:底物百分含量2%,酶添加量10 000 U/g,风味酶和碱性酶配比1:2,温度50 ℃,pH 8.0,时间5 h。
2) 最优条件下得到的麦麸多肽的水解度为26.24%,还原能力为0.53,对OH自由基和ABTS自由基的半清除率浓度分别为15.32 mg/mL、0.1191 mg/mL。研究结果表明麦麸多肽具有一定自由基清除能力,为麦麸多肽的实际生产及在食品中的应用提供了理论依据。
| [1] |
ARTE E, RIZZELLO C G, VERNI M, et al. Impact of enzymatic and microbial bioprocessing on protein modification and nutritional properties of wheat bran[J]. Agricultural and Food Chemistry, 2015, 63(39): 8685-8693. DOI:10.1021/acs.jafc.5b03495 |
| [2] |
NORDLUND E, KATINA K, AURA A M, et al. Changes in bran structure by bioprocessing with enzymes and yeast modifies the in vitro digestibility and fermentability of bran protein and dietary fiber complex[J]. Cereal Science, 2013, 58(1): 200-208. DOI:10.1016/j.jcs.2013.05.006 |
| [3] |
ABRIL A P, SÁNDEZ O R, BARANZINI AL R , et al. Relationships between chemical composition and quality-related characteristics in bread making with wheat flour-fine bran blends[J]. Food Quality, 2015, 38(1): 30-39. DOI:10.1111/jfq.2015.38.issue-1 |
| [4] |
DEBRIER N, GOMAND S V, CELUSI I, et al. Extractability and chromatographic characterization of wheat (triticum aestivum l.)bran protein[J]. Food Science, 2015, 80(5): 967-974. DOI:10.1111/jfds.2015.80.issue-5 |
| [5] |
张辉. 超声辅助酶解制备麦麸抗氧化肽工艺的研究[J]. 食品科技, 2016(1): 219-224. |
| [6] |
DADZIE R G, MA H L, ABANO E E, et al. Optimization of process conditions for production of angiotensin I-converting enzyme (ACE)inhibitory peptides from vital wheat gluten using response surface methodology[J]. Food Science and Biotechnology, 2013, 22(6): 1531-1537. DOI:10.1007/s10068-013-0248-9 |
| [7] |
XIA Y, BAMDAD F, GANZIE M, et al. Fractionation and characterization of antioxidant peptides derived from barley glutelin by enzymatic hydrolysis[J]. Food Chemistry, 2012, 134(3): 1509-1518. DOI:10.1016/j.foodchem.2012.03.063 |
| [8] |
刘盼, 吉喆, 陈夫山. 微波/超声辅助常规碱液提取麦麸蛋白[J]. 齐鲁工业大学学报(自然科学版), 2018, 32(1): 6-12. |
| [9] |
杨文博, 张英华. 蛋白质水解度的测定方法研究[J]. 中国调味品, 2014(3): 88-90. |
| [10] |
王益莉, 顾飞燕, 李晨晨, 等. 槐米提取液的抗氧化性能及在乳液化妆品中的应用研究[J]. 日用化学工业, 2017(3): 159-163. |
| [11] |
刘玥, 刘晓兰, 郑喜群, 等. 复合蛋白酶水解玉米谷蛋白产物的抗氧化活性研究[J]. 食品与机械, 2015(1): 141-145. |
| [12] |
徐亚元, 周裔彬, 万苗, 等. 脱脂米糠抗氧化肽的制备工艺研究[J]. 中国油脂, 2014, 39(2): 28-32. |
| [13] |
王辛, 苏从毅, 王猛, 等. 酶法水解小麦蛋白技术的研究[J]. 现代面粉工业, 2013, 27(1): 42-44. |
| [14] |
任清, 张晓平. 酶解燕麦蛋白质制备抗氧化肽工艺研究[J]. 中国食品学报, 2014(12): 65-72. |
 2018, Vol. 32
2018, Vol. 32


