| 结直肠癌肿瘤标志物研究进展 |
结直肠癌(Colorectal cancer, CRC)是全球癌症死亡率第三的癌症。据估计,结直肠癌在我国每年新发病人数高达15万人,在消化道肿瘤中,结直肠癌的发病率仅次于胃癌,全球每年结直肠癌发病人数高达93万。大多数结直肠癌从良性或非癌形式开始(称为息肉)。因为大部分早期结直肠癌是无症状的,直到症状发展到更严重阶段,所以筛查项目的实施对于癌症发病率和死亡率的减少极其必要。如果在早期检测中发现息肉并从体内除去,就可预防结直肠癌的发生,所以早期检测CRC具有重要意义。CRC是一种多基因疾病,由致癌基因、肿瘤抑制基因、错配修复基因及结肠粘膜细胞中细胞周期调控基因的遗传改变和表观遗传改变引起[1]。虽然近些年的研究报道了一些分子生物标志物可以早期检测到CRC及其进展,但在CRC的筛查、预防和治疗上仍有很大不足。为了尽早的发现CRC及其预后,降低死亡率和改善生存率,相关学者一直在探索并验证能够作为检测及其预后的分子标志物。
1 核酸标志物核酸不止存在于细胞内,还存在于细胞外以游离状态存在,分布于全身各处,包括循环DNA、循环RNA以及新发现的微小RNA(miRNA)。通过检测血液中的核酸可以快速的检测出肿瘤的早期发生。血液中循环DNA不仅发生基因突变, 还包括了微卫星改变和甲基化等。一直以来核酸标志物(见表 1)的检测在肿瘤诊断方面的研究有着快速发展,到目前为止,相关学者已经发现了一些与结直肠癌发病有关的基因突变。
| 表 1 核酸标志物 |
 |
1.1 基因突变
基因突变是CRC发生发展过程中的主要因素,近年来有许多发现。结肠腺肿瘤息肉病基因(Adenomatous polyposis coli, APC)的失活是结直肠癌发生的早期关键,是结肠肿瘤发生的重要因素。生殖细胞突变易造成CRC家族性腺瘤性肉息病,使发生结直肠癌的可能性为80%~100%[2]。处于癌症后期的患者,APC的高表达和突变可以作为CRC临床结果的预后指标[3]。另外血管内皮生长因子(Vascular endothelial growth factor, VEGF)是CRC中的一种血管新生因子,在50%的CRC中有表达,在正常的结肠粘膜中表达量较低,所以VEGF也能在CRC治疗中提供有价值的预后信息[4]。磷酸酶基因(Phosphatase and tensin homolog protein, PTE)可以通过磷酸酶活性来调节细胞周期及细胞增殖、分化和凋亡,从而抑制肿瘤的发生[5]。PTEN缺乏与西妥昔单抗在CRC中的临床研究有关[6]。ERCC1是与DNA修复机制相关的核苷酸切除修复基因,通过分析奥沙利铂(抗肿瘤药)治疗前后ERCC1在转移性、Ⅱ期或Ⅲ期结直肠癌患者中的表达异常,证明CRCC1是一个可能的预测标志物[7]。生殖系和其他错配修复基因的突变意味着结直肠癌有40%~80%的几率会变成遗传性非息肉病性结肠癌,它是CRC的重要预测标志物,但对CRC的预后还需要进一步验证[8]。遗传性非息肉病性大肠癌(hereditary non-polyposis colorectal cancer, HNPCC)是最常见的遗传性结肠癌综合征,伴随染色体显性遗传,是早期检测CRC的诊断工具。HNPCC是四种MMR(MLH1,MSH2,MSH,PMS2) 基因之一中发现的生殖系突变,具有初期遗传综合征的年轻患者有结直肠癌的家族史[9]。SMAD4的突变导致功能丧失,与30%~40%CRC的发生有关,是有用的预后标志物[10]。MCC作为细胞周期的关键障碍,在细胞的生长和分化中起重要作用,MCC抑制Wnt/b连环蛋白信号转导说明MCC可能是检测CRC的良好预后标志[11]。另外,18q染色体的杂合性缺失(loss of heterozygosity, LOH)也可以预测CRC患者的短期存活率,与18q染色体等位基因正常的患者相比,Ⅱ阶段和Ⅲ阶段的结肠癌患者预后较差[12]。
1.2 微卫星不稳定(microsatellite instability, MSI)和DNA甲基化微卫星是整个基因组中1~6个碱基对的重复,正常人类基因组包含大约50万个微卫星。在DNA合成过程中,微卫星容易发生突变,大多数与碱基对错配有关。错配修复系统的作用是识别和修复DNA合成中微卫星发生的错误,MMR系统的基因突变导致DNA信息错误和微卫星不稳定[13]。大约有15%~20%的CRC患者表现出MSI,其中2%~4%与HNPCC有关[14]。MSI在CRC第二阶段中呈现高发病率,且MSI作为独特标记,在CRC早期阶段显示出较好的预后[15],因此MSI的筛查可能为检测CRC提供了很好的诊断工具。DNA甲基化主要发生在基因组特定部分如CpG岛。甲基化与突变相比较为稳定,所以甲基化可能是探索生物标志物的有利区域。DNA甲基化发生在CRC的第一步,MMR基因的高甲基化导致MSI散发性大肠癌(其中包括结直肠癌)[16]。
1.3 RNA标志物自microRNAs(miRNAs, miRs)在血浆中首次发现以来,在肿瘤相关领域已经取得了很大进展。虽然结肠镜检查仍是CRC诊断的标准筛查实验,但血浆中miRNAs的评估为生物标志物提供了新的领域。microRNAs(miRNAs, miRs)及其假定的靶基因失调可能影响结直肠癌的发生。近几年学者发现miR-21, miR-106a,miR-135和miR17-92在CRC患者中过度表达[17]。血清miR29a和miR92a在鉴别CRC患者中有较高诊断价值[18]。MCC和SMAD4的上调严重影响了miR-4260抑制剂在结直肠癌中的调解功能,miR-4260在人结直肠癌组织中升高的同时,MCC和SMAD4含量降低,这说明了miR-4260在结直肠癌靶向治疗中的临床相关性[19],因此对miR-4260的抑制可能是结直肠癌潜在的治疗手段。Wnt信号传导错误能影响细胞存活,抑制细胞死亡和分化,激活消化道息肉发展为癌。miRNA可以降低APC水平,miR-135a/b的过表达是APC的负调节因子并能导致Wnt活化,与CRC和肿瘤分期相关。
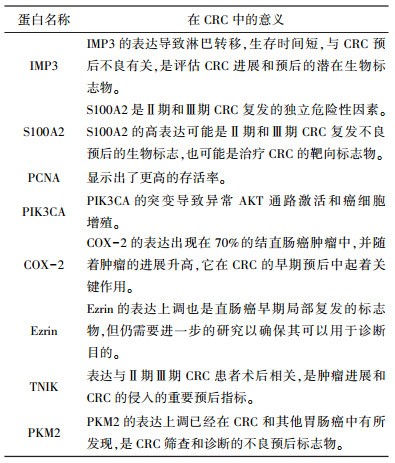
2 蛋白标志物癌细胞在原发部位或转移部位都会分泌特定的肿瘤蛋白至血液,其浓度与CRC的检测和预后有关,随着蛋白质检测技术和统计方法的进步,各类蛋白质标志物(见表 2)的检测和预后价值,及其相互组合后的作用正在被研究。目前,IMP3,S100A2,PCNA包括PKM2等酶在CRC筛查中都得到了很多关注。
| 表 2 蛋白标志物 |
 |
2.1 胰岛素样生长因子-ⅡmRNA结合蛋白3
胰岛素样生长因子-ⅡmRNA结合蛋白3(Insulin-like growth factor-Ⅱ mRNA-binding protein 3, IMP3) 在人胚胎发育的初始阶段表达,成年后含量变低。IMP3是检测处于有进一步转移风险患者的预后生物标志物,与正常结肠粘膜相比,IMP3在结肠癌患者中含量升高,IMP3在淋巴结转移中占93%,而在原发性结肠癌中占65%,在正常粘膜中占3.9%[20]。Lin[21]等总结说,IMP3将成为一种新型的癌胚核蛋白结合蛋白,这种蛋白在CRC中频繁表达。IMP3的表达导致淋巴转移,生存时间短,与CRC预后不良有关。所以IMP3可能是评估CRC进展和预后的潜在生物标志物。
2.2 S100钙结合蛋白A2S100钙结合蛋白A2(S100 calcium-binding protein A2, S100A2) 通过调节细胞周期来诱导肿瘤的发生和转移,Masuda[22]等研究了与Ⅱ期和Ⅲ期CRC患者复发相关的CRC中高表达的蛋白,S100A2在多种癌症中出现。S100A2蛋白过表达显示了CRC患者的低生存率和高复发率,所以S100A2是Ⅱ期和Ⅲ期CRC复发的独立危险性因素。S100A2的高表达可能是Ⅱ期和Ⅲ期CRC复发不良预后的生物标志和治疗CRC的靶向标志物。
2.3 酶类蛋白人体中的酶也可以作为CRC发生和发展的蛋白标志物。诱导型环氧化酶(Cyclooxygenase-2, COX-2) 影响着结直肠癌发生、血管生成和转移,在70%的结直肠癌肿瘤中发现COX-2的表达,并随着肿瘤的发展含量升高,所以它可以作为CRC的早期预后。端粒酶(Telomerase)是维持端粒保护染色体免受降解、功能基因丧失和保护细胞免于降解和死亡的酶。端粒酶活性是一种诊断标记,可作为恶性肿瘤的独立预后标记[23]。PKM2(Pyruvate kinase M2) 细胞溶质酶与能量代谢有关,在正常细胞和癌细胞中都有表达,有关学者已经在CRC和其他胃肠癌中发现PKM2的表达上调,提出它作为CRC血液筛查和诊断中的不良预后标志物[24]。
2.4 其他标志蛋白瘤腺中的细胞增殖高于良性上皮,单变量和多变量分析显示:高表达增殖细胞核抗原(Proliferating Cell Nuclear Antigen, PCNA)的原发性肿瘤患者,特别是结肠癌患者,有更高的治疗存活率[25]。埃兹蛋白(Ezrin)是ezrin/radixin/moesin家族的成员,在肿瘤发展过程中起关键作用。Ezrin的表达上调也是早期直肠癌局部复发的标志,但仍需要进一步的研究以确保其可以用于诊断目的[26]。原发性肿瘤中TNIK的蛋白表达与Ⅱ期Ⅲ期CRC患者术后相关,是肿瘤进展和CRC侵入的重要预后指标[27]。与健康患者相比,CRC患者的血清和血浆中IGFBP2水平升高,它参与癌细胞的增殖、迁移和侵袭,并作为CRC早期检测和进展的诊断工具[28]。
3 发病机理及分子途径突变和表观遗传变化能够激活致癌基因,使肿瘤抑制基因失活,从而促进结直肠癌的发展。从正常上皮发育至异常上皮,经致癌基因和肿瘤抑制基因的特异性遗传改变发展为CRC的过程,虽然分子基础还未完全清楚,但为CRC的发病机理显示了多种遗传途径。CRC发病机制是极其复杂的,任何一个相关基因或信号通路异常都可能导致癌变。
CRC有几个分子途径,其中三条与遗传和表观遗传学有关,如图 1所示。比如,微卫星不稳定和异常DNA超甲基化引起锯齿状息肉,APC抑制基因的失活和染色体不稳定引起遗传改变等。CRC是由肿瘤抑制基因和致癌基因的突变积累导致,如APC的失活导致Wingless/Wnt通路的激活,随后KRAS基因或P53基因发生突变,进一步转化为癌症。KRAS是原癌基因,作用于EGFR的下游,通过BRAF传递信号触发MAPK通路。KRAS和BRAF的突变激活了MAPK通路,诱导细胞增殖,阻止细胞凋亡,引起了55%~60%的CRC。除了RAS-RAF-MAPK途径,还有PI3K,WNT-APC-CTNNB1和TGFβ1-SMAD信号通路。从这些表观遗传改变中可以对CRC有更深入的研究,如各通路中常见突变基因的鉴定,有助于寻找CRC早期诊断标记,为将来CRC新的诊断和预后方法提供了可能。
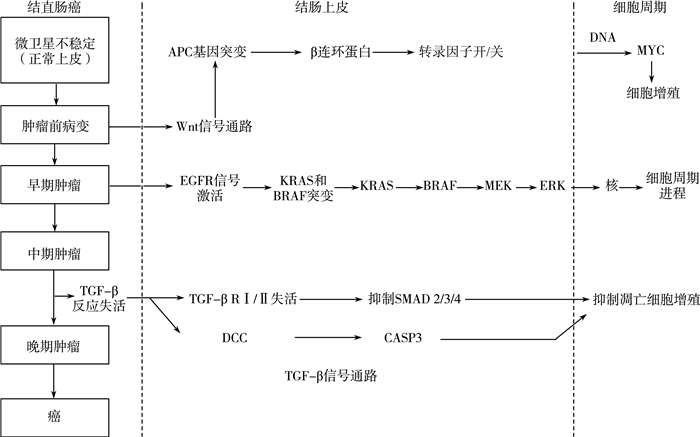 |
| 图 1 CRC信号通路中的遗传改变 |
4 讨论与展望
分子标志物作为癌症检测和患者预后的重要工具,它们也可用于限制肿瘤发展并检测其不同阶段。
1) APC,VEGF等DNA在粪便、血液和其他生物体液中CRC的早期非侵入性检测可以作为主要的检测和预后指标。目前已经研究了DNA相关的遗传和表观遗传学标志物的几种组合,但还没有非入侵性、特异性较好和成本低且有效的诊断,以及临床实践中适用于所有类型CRC患者的最佳预后生物标志物。
2) 除了突变等遗传改观外,微卫星不稳定和启动子区域的肿瘤抑制基因的高甲基化也得到了广泛研究。
3) miRNA作为CRC新型生物标志物的研究,一直备受关注且已取得很大进展,充分证明了其临床相关性,虽然还没有建立临床标准化检测体系,但随着miRNA研究的不断深入,必会为CRC的检测、预后提供新的机遇。
4) 目前蛋白质标志物如IMP3,COX-2在CRC筛查中备受关注,其浓度都可能与CRC相关。未来亟待解决的问题就是需要更多研究证明某些蛋白标志物在CRC检测和预后中的作用,为临床提供可能。
在组织或生物血清中组合的分子标志物可以更有灵敏度和特异性检测早期阶段的CRC,因此在临床中进一步研究可以更深入地分析结直肠癌的分子基础,验证非入侵性且成本较低的生物标志物的检测和预后价值,进行高效灵敏的CRC诊断,并为结直肠癌的个性化治疗做出推进。尽管分子生物标志物有很多种,但还没有适用于CRC广谱筛查的新型分子标志物,今后的研究必须提出一项生物标志物检测和预后参数。早期结直肠癌分子筛查法的创新也是一项突破性的工作,最终要确定具有成本效益的生物标志物,能在临床中方便测定,并有助于患者后期治疗。
| [1] |
MIGLIORE L, MIGHELI F, SPISNI R, et al. Genetics, cytogenetics, and epigenetics of colorectal cancer[J]. Journal of Biomedicine & Biotechnology, 2011(2): 792362. |
| [2] |
MYUTAN K, STEBBING J F, MARKS C G, et al. Predictive and prognostic factors in colorectal cancer:A personalized approach[J]. Cancers, 2011, 3(2): 1622-1638. |
| [3] |
CHEN T H, CHANG S W, HUANG C C, et al. The prognostic significance of APC gene mutation and miR-21 expression in advanced-stage colorectal cancer[J]. Colorectal Disease the Official Journal of the Association of Coloproctology of Great Britain & Ireland, 2013, 15(11): 1367-1374. |
| [4] |
FALCHOOK G S, KURZROCK R. VEGF and dual-EGFR inhibition in colorectal cancer[J]. Cell Cycle, 2015, 14(8): 1129-1130. DOI:10.1080/15384101.2015.1022071 |
| [5] |
LUO H Y, XU R H. Predictive and prognostic biomarkers with therapeutic targets in advanced colorectal cancer[J]. World Journal of Gastroenterology, 2014, 20(14): 3858-3874. DOI:10.3748/wjg.v20.i14.3858 |
| [6] |
JHAWER M, GOEL S, WILSON A J. PIK3CA Mutation/PTEN expression status predicts response of colon cancer cells to the epidermal growth factor receptor inhibitor cetuximab[J]. Cancer Research, 2008, 68(6): 1953-1961. DOI:10.1158/0008-5472.CAN-07-5659 |
| [7] |
GANGADHAR T, SCHILSKY R L. Molecular markers to individualize adjuvant therapy for colon cancer[J]. Nature Reviews Clinical Oncology, 2010, 7(6): 318-325. DOI:10.1038/nrclinonc.2010.62 |
| [8] |
SCARPA M, SCARPA M, CASTAGLIUOLO I, et al. Aberrant gene methylation in non-neoplastic mucosa as a predictive marker of ulcerative colitis-associated CRC[J]. Oncotarget, 2016, 7(9): 10322-10331. DOI:10.18632/oncotarget.v7i9 |
| [9] |
MORK M E, YOU Y N, YING J, et al. High prevalence of hereditary cancer syndromes in adolescents and young adults with colorectal cancer[J]. Journal of Clinical Oncology Official Journal of the American Society of Clinical Oncology, 2015, 33(31): 3544. DOI:10.1200/JCO.2015.61.4503 |
| [10] |
VOORNEVELD P W, JACOBS R J, KODACH L L, et al. A meta-analysis of SMAD4 immunohistochemistry as a prognostic marker in colorectal cancer[J]. Translational Oncology, 2015, 8(1): 18-24. DOI:10.1016/j.tranon.2014.11.003 |
| [11] |
YANG W, CAO Y, HUANG X, et al. Allele-specific expression of mutated in colorectal cancer (MCC) gene and alternative susceptibility to colorectal cancer in schizophrenia[J]. Scientific Reports, 2016, 6: 26688. DOI:10.1038/srep26688 |
| [12] |
POPAT S, HOULSTON R S. A systematic review and meta-analysis of the relationship between chromosome 18q genotype, DCC status and colorectal cancer prognosis[J]. European Journal of Cancer, 2005, 41(14): 2060-2070. DOI:10.1016/j.ejca.2005.04.039 |
| [13] |
VILAR E, GRUBER S B. Microsatellite instability in colorectal cancer-the stable evidence[J]. Nature Reviews Clinical Oncology, 2010, 7(3): 153. DOI:10.1038/nrclinonc.2009.237 |
| [14] |
MEROK M A, AHLQUIST T, et al. Microsatellite instability has a positive prognostic impact on stage Ⅱ colorectal cancer after complete resection:results from a large, consecutive Norwegian series[J]. Annals of Oncology, 2013, 1052(5): 221-227. |
| [15] |
MARISA L, DE Reyniès, Etienne-Grimaldi, et al. Gene expression classification of colon cancer into molecular subtypes:characterization, validation, and prognostic value[J]. PLoS Medicine, 2013, 10(5): 1-13. |
| [16] |
MIGHELI F, MIGLIORE L. Epigenetics of colorectal cancer[J]. Gastroenterology, 2012, 143(6): 1442-1460. DOI:10.1053/j.gastro.2012.09.032 |
| [17] |
KOGA Y, YASUNAGA M, TAKAHASHI A, et al. MicroRNA expression profiling of exfoliated colonocytes isolated from feces for colorectal cancer screening[J]. Cancer Prevention Research, 2010, 3(11): 1435-1442. DOI:10.1158/1940-6207.CAPR-10-0036 |
| [18] |
HUANG Z, HUANG D, NI S, et al. Plasma microRNAs are promising novel biomarkers for early detection of colorectal cancer[J]. International Journal of Cancer, 2010, 127(1): 118-126. DOI:10.1002/ijc.25007 |
| [19] |
XIAO J, LV D, ZHOU J, et al. Therapeutic inhibition of miR-4260 suppresses colorectal cancer targeting MCC and SMAD4[J]. Theranostics, 2017, 7(7): 1901-1913. DOI:10.7150/thno.19168 |
| [20] |
LI D, YAN D, TANG H, et al. IMP3 is a novel prognostic marker that correlates with colon cancer progression and pathogenesis[J]. Annals of Surgical Oncology, 2009, 16(12): 3499-3506. DOI:10.1245/s10434-009-0648-5 |
| [21] |
LIN L, ZHANG J, WANG Y, et al. Insulin-like growth factor-Ⅱ mRNA-binding protein 3 predicts a poor prognosis for colorectal adenocarcinoma[J]. Oncology Letters, 2013, 6(3): 740-744. |
| [22] |
MASUDA T, ISHIKAWA T, MOGUSHI K, et al. Overexpression of the S100A2 protein as a prognostic marker for patients with stage Ⅱ and Ⅲ colorectal cancer[J]. International Journal of Oncology, 2016, 48(3): 975-982. |
| [23] |
FERNADEZ-MARCELO T, SANCHEZ-PERNAUTE A, PASCUA I, et al. Clinical relevance of telomere status and telomerase activity in colorectal cancer[J]. Plos One, 2016, 11(2): 1-12. |
| [24] |
KAPOOR S. Pyruvate kinase M2 and its evolving role as a prognostic marker in systemic malignancies besides colorectal carcinomas[J]. Tumor Biology, 2013, 34(1): 611. DOI:10.1007/s13277-012-0528-7 |
| [25] |
AKAHASHI H, ISHIKAWA T, ISHIGURO M, et al. Prognostic significance of Traf2-and nckinteracting kinase(TNIK) in colorectal cancer[J]. Bmc Cancer, 2015, 15(1): 794. DOI:10.1186/s12885-015-1783-y |
| [26] |
JORGREN F, NILBERT M, RAMBECH E, et al. Ezrin expression in rectal cancer predicts time to development of local recurrence[J]. International Journal of Colorectal Disease, 2012, 27(7): 893-899. DOI:10.1007/s00384-011-1397-z |
| [27] |
ROWLAND A, DIAS M M, WIESE M D, et al. Meta-analysis of BRAF mutation as a predictive biomarker of benefit from anti-EGFR monoclonal antibody therapy for RAS wild-type metastatic colorectal cancer[J]. British Journal of Cancer, 2015, 112(12): 1888-1894. DOI:10.1038/bjc.2015.173 |
| [28] |
PATIL S S, GOKULNATH P, BASHIR M, et al. Insulin-like growth factor binding protein-2 regulates β-catenin signaling pathway in glioma cells and together contributes to poor patient prognosis[J]. Neuro-oncology, 2016, 18(11): 1487-1497. |
 2017, Vol. 31
2017, Vol. 31


