| 纳米木质素的制备及其荧光特性 |
木质素是继纤维素之后第二丰富的可再生自然资源,是一种高度支化的三维生物聚合物[1]。它是一种由苯基丙烷单元通过酯键和碳-碳键连接形成的无定形聚合物[2],由三个苯丙酸单元组成,如对羟基苯基(H)、愈创木基(G)和紫丁香基(S)[3]。木质素主要作为纸浆和纸张生产中的副产物获得,但不均匀的化学结构阻碍了木质素的工业应用[4-5]。然而,纸浆和造纸工艺以及木质素生物技术的发展以及木质素的独特化学结构迫使研究人员开发新的增值产品[6]。如美国第二代生物燃料开发计划至2022年将生产6 200万吨木质素。除了由木质素给出的生物质木质素结构的复杂性之外,目前应用的处理技术进一步增加了复杂性和不均匀性,这为木质素的下游加工和增值增加了额外的挑战。依据不同工艺来源,木质素大致分为:Kraft木质素(KL)、苏打木质素、木质素磺酸盐(LS)、有机溶剂木质素(OS)、蒸汽爆炸木质素、酶水解木质素(EHL)[7]。每种木质素具有许多独特的性质,如抗衰变和生物攻击、紫外吸收、高刚度和抗氧化,因此,木质素具有生产高价值产品的大容量原料的潜力。大多数木质素在水中具有较高的可溶性,这显示出制备水性木质素纳米粒子分散体的潜力。木质素纳米粒子和其纳米结构的制备在过去几年引起研究人员的兴趣,尤其是1~100 nm结构范围内的纳米结构材料。
纳米科学技术正在成为推动经济发展的主要驱动力之一,现有纳米材料主要来自不可降解的石油和矿物产品[8]。然而,随着能源匮乏和环境污染问题的日益突出,可再生的生物质原料越来越受到关注。木质素作为纸浆和造纸工艺的副产物,产量巨大且目前无法发挥其潜在价值。纳米木质素的开发提供一条木质素基产品高附加值利用的新途径[9]。相比微米及更大级别的木质素颗粒,纳米木质素颗粒拥有更大的比表面积。当和不同聚合物混合时,纳米颗粒能与聚合物基质密切相互作用,均匀分布在聚合物基质中。这些木质素纳米颗粒能提高复合材料的力学性能、热稳定性能和阻隔性能。
目前国内外纳米木质素的制备方法有:静电纺丝法[10]、溶剂凝胶法[11]、超临界法[12]、机械法和酶解法等。溶胶凝胶法制备的纳米木质素条件较为温和,整个溶胶-凝聚过程所需时间较长,而且制备的纳米材料分布并不均匀,产品得率也较少;机械法研磨的纳米木质素颗粒具有尺寸不均匀和宽粒度分布的缺点,但仍是纳米颗粒生产的简单方法;超临界法制备纳米木质素粒径形态、粒径大小分布是可控的,同时不易团聚,不足之处在于设备投资较大,不适合大规模生产。通过沉降法和静电自组装法制备纳米木质素,以期为纳米木质素作为荧光材料的开发提供借鉴。
1 实验材料与方法 1.1 实验材料木质素磺酸钙(calcium lignosulphonate)购自山东优索化工科技有限公司;阳离子聚丙烯酰胺(CPAM,分子量为600~1 200万)购自山东圣煌化工产品有限责任公司。
1.2 仪器与试剂紫外可见光分光光度计(安捷伦8453);荧光分光光度计(F-4500);Zeta电位与纳米粒径测定仪(马尔文Nano-ZS90);移液枪;磁力搅拌器;真空冷冻干燥机;扫描电子显微镜(日立Regulus8220)。
1.3 制备过程配制1 g/L的阳离子聚丙烯酰胺溶液和2 g/L的木质素磺酸钙溶液作为储备液,两者以质量比100:1混合;加入不同体积的去离子水,分别形成不同浓度的木质素胶体;冷冻干燥得纳米木质素颗粒。
1.4 表征方法利用Zeta电位和纳米粒径测定仪,在温度为25 ℃、木质素与阳离子质量比例为100:1的条件下,测量木质素在不同浓度下的粒径,所有样品重复测量3次。
使用荧光分光光度计获得荧光光谱,使用紫外可见光分光光度计获得紫外光谱。
用扫描电子显微镜以5 kV的加速电压拍摄复合材料的扫描电子显微照片(SEM)。在观察之前,在样品表面镀上一薄层金。
2 结果与讨论 2.1 纳米木质素形成过程带相反电荷的多电解质在宽范围的化学计量比下形成配合物,磺酸钙木质素溶解在水中呈现负电,通过加入聚丙烯酰胺阳离子溶液来制备胶体时,需注意加入阳离子的质量过多会导致胶体过早地絮凝并会减少木质素的吸附量。为优化木质素与阳离子的质量比,选取磺酸钙木质素与阳离子的质量比分别为1:1、10:1、100:1,发现前两种情况下木质素会絮凝,故选取质量比为100:1。
2.2 纳米木质素的粒径分析通过Zeta电位和纳米粒径测定仪测定不同浓度下纳米木质素粒径。如图 1所示,纳米木质素粒径随着木质素的浓度的增加而变大,在木质素浓度为100 g/L时,木质素粒径为112 nm,效果最好。
 |
| 图 1 (a) 不同浓度下纳米木质素粒径;(b)木质素浓度为100 mg/L条件下的SEM照片;(c)木质素浓度为100 mg/L条件下的木质素分布情况SEM照片 |
通过SEM观察研究基质中的木质素分散情况。如图 1(b)所示,具有约9 000 nm的大尺寸的附聚物存在于基质中。这表明共沉淀法将不可避免地发生木质素的聚集,形成微米级木质素聚合物。然而,图 1(c)清楚地显示木质素均匀分散,形成微米级颗粒。当木质素与阳离子共沉淀时,阳离子CPAM聚电解质可以稳定胶体木质素颗粒并抑制其聚集。
2.3 纳米木质素荧光强度分析荧光产生的原理是:物质吸收电磁辐射后受到激发,受激发原子或分子在去激发过程中再发射波长与激发辐射波长相同或不同的光;当激发光源停止辐照试样以后,再发射过程立刻停止。这种再发射的光称为荧光。
图 2不同浓度的木质素的紫外-可见吸收光谱显示:在不同浓度的木质素条件下,在波长为210 nm处吸收峰最大,证明荧光光谱的激发波长也可在210 nm处。
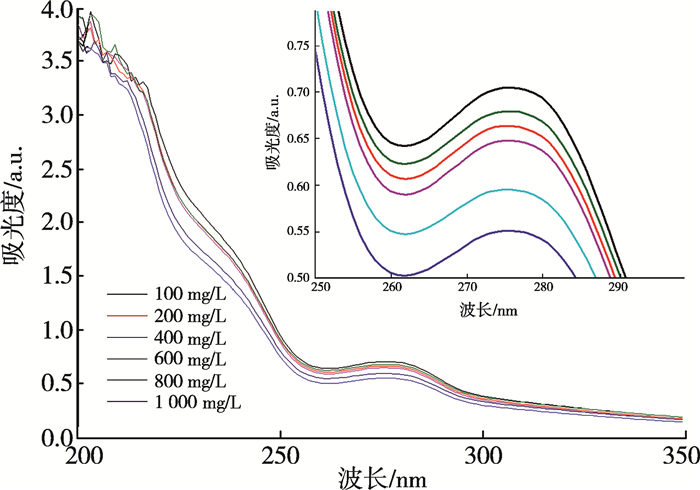 |
| 图 2 不同浓度的木质素在pH=7下的紫外-可见吸收光谱 |
图 3为不同浓度的木质素在激发波长为319 nm的荧光光谱。从光谱中可观察到,荧光强度随木质素的浓度增大而增强,达到600 mg/L时荧光强度达到215 a.u,随后随着浓度的增加,荧光强度减弱。
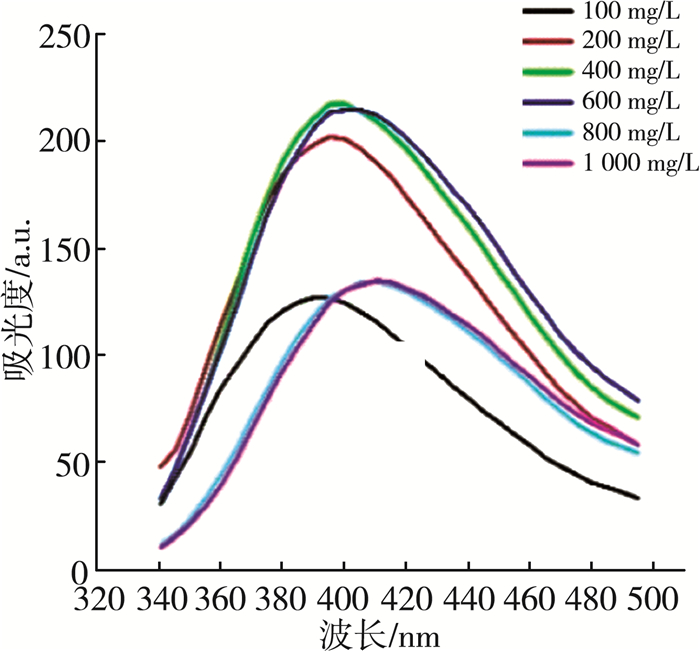 |
| 图 3 不同浓度的木质素的荧光光谱 |
制备的样品具有固有聚集行为的木质素的聚集诱导发射(AIE)特性。AIE机理与限制分子内运动有关,包括限制分子内旋转(RIR)和限制分子内振动(RIV),以及羰基团簇。四烯基乙烯(TPE)和六苯基甲硅烷(HPS)作为发光材料是最著名的螺旋桨状AIEgens,由于RIR机制,在高浓度溶液或固态下荧光发射增强[13-14]。所以随着木质素浓度的增加,木质素粒径增大,荧光发射增强。木质素浓度到达800 mg/L后,荧光强度随之减弱,这是由于磺酸盐木质素的AIE性质引起的。
2.4 不同体系下得到的纳米木质素和荧光光谱如图 4(a)为乙醇-NaOH水溶液不同比例下100 mg/L木质素粒径变化曲线。当乙醇分数低于70%时,木质素粒径随着乙醇分数的增加而减小,主要原因是分子间和分子内聚集。当乙醇分数为70%时,木质素粒径最小为145 nm。图 4(b)为乙醇分数为70%时木质素粒径分布,说明木质素颗粒分布比较均匀。
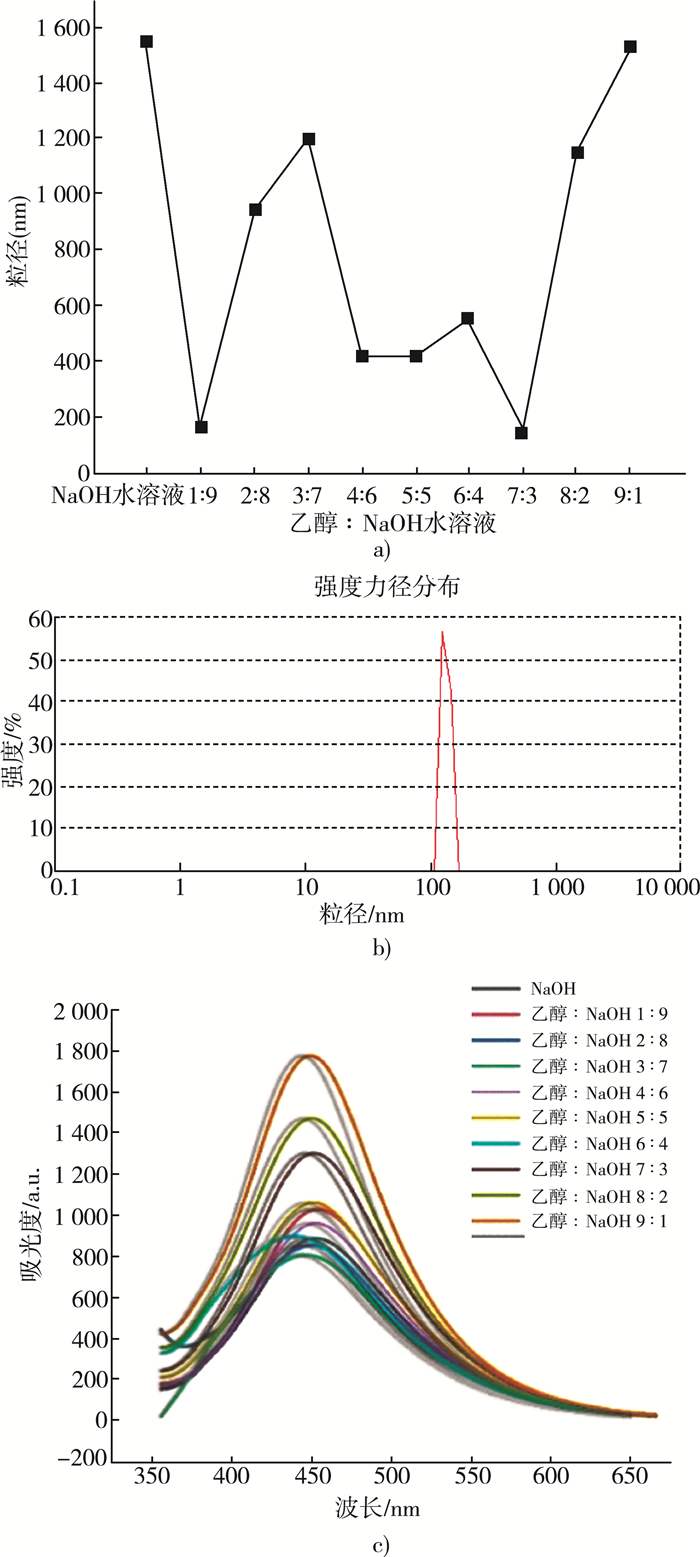 |
| 图 4 (a) 乙醇-NaOH水溶液不同比例下100 mg/L木质素粒径;(b)乙醇质量分数为70%时木质素粒径分布;(c)乙醇-NaOH水溶液不同比例下(100 mg/L,λex=335 nm)的木质素荧光光谱 |
图 4(c)显示了随着水分的增加,当激发波长为335 nm时,100 mg/L木质素在乙醇-NaOH水溶液体系下的荧光光谱,这是木质素聚集引起的猝灭(ACQ)现象。事实上,木质素磺酸钙不溶于乙醇,而是以氢键和π-π聚集产生的小聚集体的形式存在[15]。由于存在分子内聚集,因此随着水的加入,小聚集体生长形成大聚集体,出现ACQ现象。
3 结语生物质木质素结构复杂,而目前应用的处理技术普遍进一步增加了其复杂性和不均匀性,有碍于木质素的下游加工效率和经济效益增值。通过木质素磺酸盐-阳离子聚电解质复合物的吸附作用和乙醇-水体系聚集作用成功制备纳米木质素颗粒,同时得知纳米木质素可作为不错的荧光材料,为制备高附加值木质素提供了参考。
| [1] |
YAND W, KENNY J M, PUGLIA D. Structure and properties of biodegradable wheat gluten bionano-composites containing lignin nanoparticles[J]. Ind.Crop.Prod., 2015, 15(74): 48-56. |
| [2] |
VANHOLME R, MORREEL K, RALPH J, et al. Lignin engineering[J]. Curr.Opin.Plant Biol., 2008, 11(3): 78-85. |
| [3] |
VAINIO U, MAXIMOVA N, HORTLING B, et al. Morphology of dry lignins and size and shape of dissolved kraft lignin particles by X-ray scattering[J]. Langmuir, 2004, 20(22): 36-44. |
| [4] |
DOHERTY W O S, MOUSAVIOUN P, FELLOWS C M, et al. Value-adding to cellulosic ethanol:Lignin polymers[J]. Ind.Crops.Prod., 2011, 33(2): 59-76. |
| [5] |
SUHAS, CARROTT P J M, RIBEIRO CARROTT M M L, et al. Lignin-form natural adsorbent to activated carbon:A review[J]. Bioresour.Technol., 2007, 98(12): 1-12. |
| [6] |
FITZPATRICK M, CHAMPAGNE P, CUNNINGHAM M F, et al. A biorefinery processing perspective:Treatment of lignocellulosic materials for the production of value-added products[J]. Bioresour.Technol., 2010, 101(23): 15-22. |
| [7] |
VISHTAL A, KRASLAWSKI A. Challenges in industrial applications of technical lignins[J]. BioResources, 2011, 6(3): 47-68. |
| [8] |
BAURHOO B, RUIZ-FERIA C, ZHAO X. Purified lignin:Nutritional and health impacts on farm animals-A review[J]. Anim.Feed Sci.Techno, 2008, 144(3-4): 75-84. |
| [9] |
AGO M, OKAJIMA K, JAKES J E, et al. Lignin-based electrospun nanofibers reinforced with cellulose nanocrystals[J]. Biomacromolecules, 2012, 13(3): 18-26. |
| [10] |
SHULGA G, VITOLINA S, SHAKELS V, et al. Lignin separated from the hydrolyzate of the hydrothermal treatment of birch wood and its surface properties[J]. Cellulose Chem.Technol., 2012, 46(5-6): 7-18. |
| [11] |
PEREIRA A, MARTINS G, ANTUNES P, et al. Lignin from sugar cane bagasse:Extraction, fabrication of nanostructured films, and application[J]. Langmuir, 2007, 23(12): 52-59. |
| [12] |
FAN X, SUN J L, WANG F Z, et al. Photoluminescence and electroluminescence of hexaphenylsilole are enhanced by pressurization in the solid state[J]. Chem.Commun., 2008, 14(26): 89-91. |
| [13] |
LUO J D, XIE Z L, LAM J W Y, et al. Linear and hyperbranched polymers with high thermal stability and luminescence efficiency[J]. Chinese Journal of Polymer Science, 2001, 6(19): 85-90. |
| [14] |
DENG Y H, FENG X J, ZHOU M S, et al. Investigation of aggregation and assembly of alkali lignin using iodine as a probe[J]. Biomacromolecules, 2011, 12(4): 16-25. |
 2019, Vol. 33
2019, Vol. 33


