| 黑色素瘤靶向治疗研究进展 |
黑色素瘤, 又称恶性黑色素瘤, 是来源于黑色素细胞的一类恶性肿瘤, 常见于皮肤, 也见于黏膜、眼脉络膜等部位。黑色素瘤是皮肤肿瘤中恶性程度最高的瘤种, 容易出现远处转移且预后极差。近年来在世界各地区发病率呈持续增长趋势, 虽然在我国黑色素瘤的发病率低于欧美等西方国家, 但每年仍有约2万例的新患者且死亡率极高, 转移性黑色素瘤患者的中位生存期不足6个月, 所以早期诊断和治疗显得尤为重要。
目前对于早期患者最主要的治疗方式是手术切除, 由于中晚期患者的肿瘤恶性程度高, 标准化治疗的效果较差, 伴随诊断及个体化靶向治疗成为重要的治疗手段。由于个体遗传基因的差异, 针对癌症的治疗方法和效果也因人而异, 作为个体化医疗的主要手段, 靶向治疗通过基因或分子的选择, 有针对性地杀死恶性肿瘤细胞, 具有高效低毒的特点。伴随诊断是一种与靶向药物相关联的体外诊断技术, 通过检测人体内蛋白、基因突变的表达水平, 了解不同患者对特定药物的治疗反应, 筛选出最佳用药人群进行个体化治疗, 从而改善治疗预后并降低保健开支。包括癌症病因在内的分子基础推动了个体化或精准医疗的发展, 通过开发对实体靶向治疗来识别特定的肿瘤特征, 预测个体对特定疗法的反应能力是现代精准医学的最终目标。
1 靶向治疗的分子基础调控细胞生长和凋亡的信号通路为癌症的靶向治疗和伴随诊断提供了基础(见图 1), 丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)通路可以由局部微环境释放的生长因子(如干细胞因子, 刺激激素, 特定细胞类型的生长因子)激活, 正常物理条件下, 这些生长因子只通过细胞膜上的受体蛋白激酶对正常细胞生长的通路进行微弱刺激。在癌细胞中, EGFR、KIT、HER2和PDGFR等生长因子受体的基因突变可以激活MAPK通路。生长因子受体基因突变产生受体蛋白激酶激活RAS, 下游效应器RAF刺激MAPK级联反应, 导致MEK和ERK激酶的连续激活, 激活细胞质靶标或迁移到细胞核中磷酸化转录因子。MAPK级联反应也可以通过RAS和RAF的基因突变激活, 因此被称为RAS-RAF-MEK-ERK途径。MAPK通路与其他通路相交, 例如PI3K-AKT-mTOR通路。AKT能够调节细胞凋亡, 磷酸酶和PTEN可以阻止AKT的激活。致癌基因的激活或抑癌基因功能的丧失引起这些途径失调, 从而加快细胞周期, 血管生成, 抑制细胞凋亡, 造成肿瘤细胞的侵袭和转移。近几年开发了针对信号传导途径中基因突变的新型癌症治疗, 伴随诊断测试已经成为了有效治疗癌症的关键。
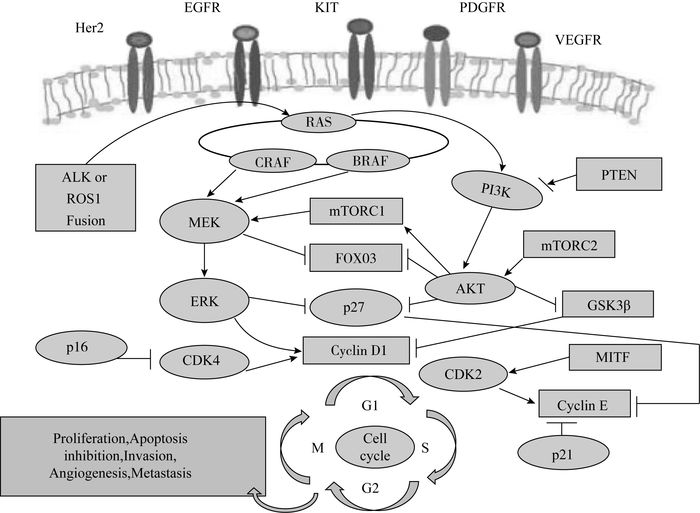 |
| 图 1 治疗癌症的生物学途径 |
2 体外伴随诊断试剂
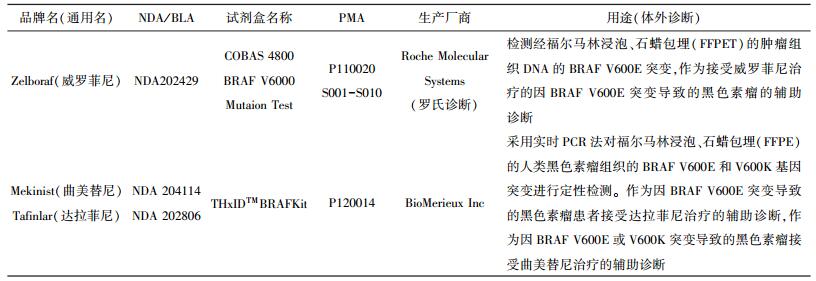
对细胞信号传导的深入研究, 为肿瘤的治疗提供了抑制信号通路的可能。BRAF突变发生于60%以上的恶性黑色素瘤中, 是很重要的基因治疗靶点。MAPK信号通路在超过80%的恶性黑素瘤中过度活化。突变的BRAF蛋白酶活性升高, 在BRAF基因的外显子11和15中已经鉴定了几种特异性激活突变, 最常见的是BRAF V600E突变和BRAF V600K突变。初步临床试验[1]显示, Ⅰ类RAF抑制剂威罗菲尼和达拉菲尼具有明显的抗肿瘤活性, 对晚期黑色素瘤和BRAF V600E突变患者有较高反应率。FDA批准了威罗菲尼和达拉菲尼治疗晚期黑色素瘤患者, 并有配套诊断试剂盒(见表 1)。BRAF突变测试已经成为RAF靶向治疗恶性黑色素瘤的关键步骤。COBAS 4800 BRAF V600突变测试分析患者是否选择威罗菲尼治疗, 该聚合酶链反应测试用于检测福尔马林浸泡的石蜡包埋组织样品中的V600E(1799T>A)突变DNA。通过454测序(下一代焦磷酸测序方法), 使用细胞株或肿瘤DNA的混合物以及带有低水平突变对偶基因的肿瘤试样来评估其灵敏性。在一个有328例黑色素瘤样本的试验小组[2]中, COBAS测试显示出比直接双向测序更高的敏感性和特异性, 是一种可重复的含量测定试验, 能够检测某些非V600E突变并且在检测BRAF V600E时要比直接测序法更精确。
| 表 1 FDA批准的黑色素瘤的伴随诊断试剂盒 |
 |
3 黑色素瘤靶向药物 3.1 BRAF抑制剂 3.1.1 威罗菲尼
为了确定威罗菲尼的疗效和安全性, 从2012年11月至2015年10月, 43名BRAF突变的转移性黑色素瘤患者[3]用威罗菲尼治疗, 中位随访时间为15.9个月, 评估无进展生存期(progression-free survival, PFS), 总生存期(overall survival, OS)和毒性。70%的患者有M1c期转移, 其中6例脑转移。在51.1%的患者中出现客观反应, 疾病控制率(disease control rate, DCR)达到79%。中位PFS为6.48个月, 中位OS为11.47个月, 且单变量(P=0.000613)和多变量分析(P=0.0168)中发现LDH水平和OS之间有显著相关性。最常见的不良反应包括滤泡性角化过度, 皮疹, 关节痛和光敏性, 7例患者(17%)出现了3级不良反应, 如皮肤鳞状细胞癌, QTcB间期延长, 皮疹, 关节痛。与以前发表的数据类似[4], 经过威罗菲尼治疗, BRAF V600E突变患者的生存率得到改善。
3.1.2 达拉菲尼达拉菲尼是一种有效的BRAF抑制剂, 它显示了颅内肿瘤活性。2014年至2017年的30例BRAF突变黑色素瘤患者[5]的脑转移(brain metastases, BM), 大脑局部控制后接受了达拉菲尼的治疗, 与2003年至2015年期间东部合作肿瘤机构的204名黑色素瘤患者的数据作对照, 结果颅内DCR为83%, 其中4例(13%)完全缓解(CR), 9例(30%)部分缓解(PR), 12例(40%)稳定型疾病(SD), 5例(17%)进行性疾病。中位随访时间为14个月, PFS和OS分别为5.5个月和8.8个月。Ⅲ期的250例临床试验[6]比较了达拉菲尼与达卡巴嗪的疗效, 达拉菲尼缓解率高达53%, PFS为5.1个月, 有显著改善。治疗会有头痛, 过度角化, 皮疹等不良反应。Ⅱ期临床试验数据显示达拉菲尼一二线治疗的结果都较为显著[7]。
3.2 MEK抑制剂 3.2.1 曲美替尼曲美替尼是2013年由FDA批准上市的口服片剂, 可用于治疗伴有BRAF V600突变的不可切除或转移性黑色素瘤患者。曲美替尼通过影响MAPK通路抑制癌细胞增殖。在Ⅲ期的322例BRAF V600E突变的黑色素瘤患者[8]中, 曲美替尼组PFS为4.8个月, 化疗组为1.5个月(曲美替尼组疾病进展比为0.45, 95%置信区间[confidence interval, CI], 0.33~0.63;P<0.001。6个月的总体生存率分别为81%和67%(疾病仅占比为0.54;95%CI为0.32~0.92;P=0.01), 与化疗相比, 曲美替尼在具有BRAF V600E或V600K突变的转移性黑色素瘤患者中改善了无进展和总生存率。曲美替尼治疗中没有发现皮肤鳞状细胞癌的发生, 但会存在皮疹和腹泻等不良反应。
MEK与BRAF同属于MAPK通路, 联合用药也是研究重点。在Ⅰ期和Ⅱ期临床试验[9]中, 达拉菲尼单药治疗的中位PFS为5.8个月, 反应率为54%, 达拉菲尼和曲美替尼联合治疗的中位PFS为9.4个月, 反应率为76%, 比单一治疗效果显著, 并且有较少的不良反应, 鳞状细胞癌分别为19%和7%, 尽管发热率增加, 但都在可控范围内。2014年FDA批准了曲美替尼和达拉菲尼联合治疗BRAF V600突变的不可切除或转移性黑色素瘤。
3.2.2 考比替尼考比替尼是一种新型口服MEK1/2抑制剂, 2015年由FDA批准与威罗菲尼联合治疗BRAF V600突变的不可切除性或转移性黑色素瘤患者。在Ⅱ期临床试验中[10], 考比替尼与威罗菲尼联合治疗的PFS为9.9个月, CR和PR共为68%, 威罗菲尼单药治疗PFS为6.2个月, CR和PR共为45%。在2015年SMR(Society for Melanoma Research)会议上的研究数据显示[11], 威罗菲尼与考比替尼联合治疗中位PFS为12.3个月, 平均随访时间18.5个月, 1年总生存率74.5%, BRAF抑制剂威罗菲尼单药治疗的中位PFS为6.9个月, 平均随访时间为12个月, 甚至高于达拉菲尼与曲美替尼联合治疗的数据, 且不良反应发生率比威罗菲尼单药治疗少。此联合治疗对威罗菲尼耐药的患者效果较差, 能否提高对BRAF抑制剂耐药患者的反应率仍在研究中。
3.3 C-KIT抑制剂 3.3.1 伊马替尼C-KIT基因属于原癌基因, 产物是Ⅲ型酪氨酸激酶, 伊马替尼是一种小分子酪氨酸激酶抑制剂, 有阻断一种或多种蛋白激酶的作用, 用于治疗慢性髓性白血病和恶性胃肠道间质肿瘤, 可用于治疗KIT某些外显子突变(11号和13号外显子突变较为常见)的黑色素瘤患者。2009年至2015年北大肿瘤医院对78例Kit突变的黑色素瘤患者进行了伊马替尼口服治疗[12], 中位PFS为3.9个月(95%CI:2.1~5.8个月), 中位OS为13.2个月(95%CI:10.1~16.3个月), DCR为60.6%, 客观缓解率(Objective Response Rate, ORR)为22.4%。与达卡巴嗪不足5%的有效率相比, 伊马替尼效果显著, 且一线治疗的PFS为7.0个月, 明显高于二三线治疗的患者。常见不良反应有皮疹, 消化道反应等, 属于可控范围。
3.3.2 尼罗替尼最近一项新的国际多中心随机开放性Ⅲ期临床试验[13]对尼罗替尼治疗42例晚期KIT突变的黑色素瘤患者进行了研究, ORR为26.2%(95%CI, 13.9%~42.0%)且均为部分反应, 11例患者中10例有11号外显子突变, 4例有L576P突变, 中位PFS和OS为4.2个月和18.0个月。尼罗替尼在治疗11号外显子或L576P突变的KIT突变患者中是潜在的靶向药物。
3.4 其他抑制剂PI3K-AKT-mTOR是癌症中的主要信号通路之一。mTOR是PI3K/AKT下游的关键激酶, 调节肿瘤细胞的增殖生长, 存活和血管生成。PTEN是具有磷酸酶活性的抑癌基因, PTEN的表达降低不能有效抑制PI3K-AKT-mTOR活化, 促进人类肿瘤发生。目前的研究发现伊马替尼耐药的C-Kit突变患者中存在AKT通路的激活, mTOR抑制剂对伊马替尼耐药性有所缓解[14]。mTOR抑制剂与血管内皮生长因子抑制剂贝伐单抗联合治疗对BRAF野生型患者效果良好, ORR为30%[15]。重组人血管内皮抑制素(Endostar)与达卡巴嗪联合治疗ORR为34.62%, DCR为76.92%, 不良反应率为34.62%, 而达卡巴嗪单药治疗ORR为15.38%, DCR为50.00%, 不良反应率为60.38%[16]。Endostar与达卡巴嗪联合治疗可有效缓解和控制黑色素瘤, 延长PFS和OS。转录因子FOXO1能抑制黑色素瘤细胞中相同的基因并抑制癌变, 这与b-连环蛋白和TLE家族成员间的平衡相关。同FOXO1相互作用时, 这些蛋白能将彼此转化为转录激活子或抑制子从而诱导或抑制CDH2基因表达,这个发现对开发黑色素瘤新型疗法有重要意义[17]。
4 讨论与展望在个体化癌症医学的时代, 用于预测靶向治疗的临床相关分子生物标志物的数量不断增加, 过去几年里, 新的靶向药物在恶性黑色素瘤, 结直肠癌和非小细胞肺癌中引入。准确的生物标志物检测有利于分子层面的治疗, 伴随诊断和靶向治疗的共同开发已经在临床中得到了很好的体现, 但仍面临很多挑战。
1) 全球范围内上市的针对黑色素瘤的分子靶向药物已经有八种, 而我国仅上市了威罗菲尼, 虽标志着中国黑色素瘤治疗迈入靶向时代, 但仍存在患者用药选择上的限制。我国黑色素瘤患者突变及病理类型与国外存在差异, 需要更多研究为我国患者的治疗提供可靠依据。
2) 多种黑色素瘤靶向抑制剂已在临床试验中显示了较高的效率, 但这些药物在体内产生的效果短暂且具有毒副作用, 大多数患者一年内就会产生耐药性。所以延缓耐药性和降低靶向药物的毒副作用将继续是研究的重点, 药物的联合治疗可能是黑色素瘤治疗的突破口。
3) 针对孤儿疾病的基因分析显示, 携带不可能成为靶点或罕见驱动基因突变的癌症, 很可能越来越常见, 甚至会出现多重驱动基因。因此要提出抗癌研究的新思路及药物的审批, 例如免疫治疗、化疗与靶向治疗进行协同治疗。
4) 个性化医学的关键是测量生物标志物的伴随诊断, 比如蛋白表达, 基因扩增或特异性突变。生物标志物的存在与否与小分子激酶抑制剂或抗体的特定靶向治疗的反应率直接相关。个性化医学的核心是伴随诊断装置能准确的分析患者对特定疗法收益的可能性, 所以临床试验的分析精度对治疗效果的影响还需进一步确认。
| [1] |
FLAHERTY K T, PUZANOV IKIM K B, RIBAS A, et al. Inhibition of mutated, activated BRAF in metastatic melanoma[J]. New England Journal of Medicine, 2010, 363(9): 809. DOI:10.1056/NEJMoa1002011 |
| [2] |
KOVACH, LANGLAND, SCHILLING, et al. CO18. The analytic performance of the cobasR 4800 BRAF V600 Mutation Test in the detection of V600E mutations in malignant melanoma:, assay reproducibility and effects of melanin[J]. Melanoma Research, 2011, 21(3): 11. |
| [3] |
CZIRBESZ K, GORKA E, BALATONI T, et al. Efficacy of Vemurafenib treatment in 43 metastatic melanoma patients with BRAF mutation. single-Institute retrospective analysis, early real-Life survival data[J]. Pathology & Oncology Research, 2017(10): 1-6. |
| [4] |
CHAPMAN P B, HAUSCHILD A, ROBERT C, et al. Improved survival with vemurafenib in melanoma with BRAF V600E mutation[J]. The New England Journal of Medicine, 2011, 364(26): 2507-2516. DOI:10.1056/NEJMoa1103782 |
| [5] |
GORKA E, FABO D, GEZSI A, et al. Dabrafenib therapy in 30 patients with melanoma metastatic to the brain:a single-centre controlled retrospective study in hungary[J]. Pathology & Oncology Research, 2017, 6(01): 1-6. |
| [6] |
HAUSCHILD A, GROB JJ, DEMIDOV LV, et al. Dabrafenib in BRAF -mutated metastatic melanoma:a multicentre, open-label, phase 3 randomised controlled trial[J]. Lancet, 2012, 380(9839): 358-365. DOI:10.1016/S0140-6736(12)60868-X |
| [7] |
KIRKWOOD J M, LONG G V, TREFZER U, et al. BREAK-MB:A phase Ⅱ study assessing overall intracranial response rate (OIRR) to dabrafenib (GSK2118436) in patients (pts) with BRAF V600E/k mutation-positive melanoma with brain metastases (mets)[J]. Journal of Clinical Oncology, 2012, 30(15): 8501. |
| [8] |
FLAHERTY K T M.D, ROBERT C, et al. Improved survival with MEK inhibition in BRAF-Mutated melanoma[J]. New England Journal of Medicine, 2012, 367(2): 107-114. DOI:10.1056/NEJMoa1203421 |
| [9] |
LUKE J J, OTT P A. New developments in the treatment of metastatic melanoma-role of dabrafenib-trametinib combination therapy[J]. Drug Healthcare & Patient Safety, 2014(6): 77-88. |
| [10] |
LARKIN J, ASCIERTO P A, DRENO B, et al. Combined vemurafenib and cobimetinib in BRAF-mutated melanoma[J]. New England Journal of Medicine, 2014, 371(20): 1867. DOI:10.1056/NEJMoa1408868 |
| [11] |
Quality-of-life (QOL)assessment in patients (pts)with metastaticmelanoma receiving Vemurafenib (v)and Cobimetinib (C). 2015 ASCO Annual Meeting, Abstracts, Meeting library. http://meetinglibrary.asco.org/content/143353-156.
|
| [12] |
毛丽丽, 于思帆, 陈含笑, 等. 伊马替尼治疗78例KIT变异的晚期黑色素瘤的疗效和安全性[J]. 中国肿瘤生物治疗杂志, 2017, 24(3): 259-263. DOI:10.3872/j.issn.1007-385X.2017.03.008 |
| [13] |
GUO J, CARVAIAL R D, DUMMER R, et al. Efficacy and safety of nilotinib in patients with KIT-mutated metastatic or inoperable melanoma:final results from the global, single-arm, phase Ⅱ TEAM trial:[J]. Annals of Oncology, 2017, 28(6): 1380-1387. DOI:10.1093/annonc/mdx079 |
| [14] |
SI L, XU X, KONG Y, et al. Major response to everolimus in melanoma with acquired imatinib resistance[J]. Journal of Clinical Oncology Official Journal of the American Society of Clinical Oncology, 2012, 30(4): 37-40. DOI:10.1200/JCO.2011.37.9644 |
| [15] |
PEYTON J D, SPIGEL D R, BURRIS H A, et al. Phase Ⅱ trial of bevacizumab and everolimus in the treatment of patients with metastatic melanoma:Preliminary results[J]. Journal of Clinical Oncology, 2009, 27(15): 9027. |
| [16] |
罗毅, 陈佳, 李先安, 等. 重组人血管内皮抑制素(恩度)联合达卡巴嗪治疗晚期黑色素瘤的临床研究[J]. 肿瘤药学, 2017, 7(3): 341-344. |
| [17] |
BAGATI A, BIANCHISMIRAGLIA A, MOPARTHY S, et al. Melanoma suppressor functions of the carcinoma oncogene FOXQ1[J]. Cell Reports, 2017, 20(12): 2820. DOI:10.1016/j.celrep.2017.08.057 |
 2017, Vol. 31
2017, Vol. 31


