| 谷氨酰胺转胺酶对发丝烫、染和梳理损伤修复的研究 |
谷氨酰胺转氨酶(Glutamine transaminase, TG酶), 它在植物、动物和微生物的体内普遍存在, 其可以催化赖氨酸残基上的ε-氨基和谷氨酸残基的上y-羟酰胺基结合, 从而使蛋白质(或多肽)之间发生共价交联的一种酶制剂。TG酶是一种具有极高商业价值的酶制剂, 由于其绿色、环保、无污染等优点, 已经在食品加工产业中得到了普及, 如海鲜制品, 肉制品, 面制品, 豆制品, 乳制品, 米制品等, 近些年来, 将TG酶应用在羊毛等织物修复上也越来越普遍。国内外研究发现, 羊毛与头发的都是由角蛋白构成的动物纤维, 两者在角蛋白组成上高度相近, 含有一定量的赖氨酸与谷氨酸, 这说明头发修复具有可行性。
目前, 头发洗护产品大多使用表面活性剂, 仅能清洁表面油污, 并且配方中的化学成分对头发无益, 达不到人们期待的养护效果;还有的产品仅仅添加少量的氨基酸, 虽然有一定修复作用, 实际修复程度有限, 原因是氨基酸等小分子流失。据报道, 最早在1985年, 日本住友化学公司就成功研发出用于护发的“可溶性胶原蛋白的水解产物”, 该产品的分子量均匀并且具有较高纯度, 可以作为各种护发产品的原料, 这也是生物护发的始端[1];在1988年倪永全等[2]利用Croquat WKP季按化水解角蛋白护发, 它在烫发前、后粘附性好, 且不易被香波洗去。以上报道的角蛋白护发方法主要是通过物理粘附, 使发丝断裂的二硫键发生重组, 改变头发性能, 这种修复虽然有提升发丝强韧性、保湿和防紫外等优点, 但仍存在一些不足:头发容易吸水膨胀;重组二硫键有一定随机性, 而且仅增加二硫键, 键能有限;多利用浓度较高的角蛋白成膜原理, 头发表面粘附蛋白剥离后产生“头屑”等[3-5]。与传统方法相比, TG酶具有高效催化的特性, 在外加蛋白形成更多的二硫键基础上, 可以定向(酶的专一性)催化角蛋白发生更多共价交联:TG酶不但可以使毛发纤维内部断裂分子链间或链内发生交联反应, 而且可以使外加蛋白分子与毛发纤维内分子链间发生交联反应, 修饰作用更加显著, 而且这种修复是一种“类永久”性的修复[6-8]。
本文将TG酶应用于受损头发的修复, 获得改性蛋白纤维, 对其修复效果进行测试, 研究表明:TG酶修复效果最明显的是烫发损伤, 修复后碱溶度由16.54%减小到9.92%, 断裂应力由0.932 N提高到1.468 N, 断裂应变由8.51 mm提高到10.47 mm, 吸水膨胀率由18.34%降低到12.34%。本文为酶法护发提供了理论基础, 为生物护发提供了新的思路, 在各类蛋白基材料应用上有着巨大的潜力。
1 材料与方法 1.1 材料来源选取云南20岁健康女性的发质作为实验原样, 采集的发样没有烫染史, 长度在30 cm左右, 黑色有光泽。
TG酶由山东隆科特酶制剂有限公司提供, 酶活4 700 U/g;角蛋白购买于上海麦克林生化科技有限公司, 分子量为800~1 200 Da。
1.2 损伤模型的建立 1.2.1 烫发损伤烫发试剂选取市售普通药水(含有巯基乙醇、氨水), 将发样分为直径0.5 cm为一束, 按说明书操作, 每次加入烫发药水50 mL, 分别制备3组发样, 去离子水洗净晾干备用。
1.2.2 染发损伤染发试剂选取普通市售染发膏(含有苯二胺), 将发样分为直径0.5 cm为一束, 加入染发剂(A剂、B剂), 按说明书操作, 分别制备3组发样, 去离子水洗净晾干, 以备后用。
1.2.3 梳理损伤将发样分为直径0.5 cm为一束, 右手拿取发束根部, 左手拿密齿发梳(长23 cm、宽2.7 cm), 按照顺梳3次、逆梳2次的顺序, 梳理500次左右, 分别制备3组发样备用。
1.3 TG酶修复发样的制备先将受损发样浸泡到100 mL水解角蛋白修复溶液中(A液), 置于40 ℃的烘箱中浸泡30 min(T1)后取出, 反应结束后将受损发样取出用去离子水清洗3~5次, 然后精确的称取0.1 g TG酶粉(酶活4 700 U/g), 将其溶解于100 mL去离子水中, 将角蛋白修复的受损发样放入已配好的TG酶液(B液)中, 置于温度40 ℃的恒温培养箱中浸泡90 min(T2), 待反应结束, 取出用去离子水清洗3~5次, 自然晾干后备用。
1.4 发样的性能测定 1.4.1 碱溶度测定精确称取一定量的烘干恒重的发样, 用0.2 mol/L氢氧化钠溶液100 mL于65 ℃处理1 h, 过滤, 再用蒸馏水和10 mL的稀醋酸洗涤至中性, 于65 ℃烘干至恒重。碱溶度的计算公式:
| $ \alpha = \frac{{X\left( {1 - G} \right) - W}}{{X\left( {1 - G} \right)}} \times 100\% $ | (1) |
式(1)中:X为碱溶前的发样质量, g;G为含水率(约等于0), %;W为碱处理后残留试样的质量, g。
1.4.2 断裂应力、应变测定使用电子纤维强力测试机进行测试(参照FZ/T 01030-1993标准)。每个发样随机选50个平行样进行测试, 在得到的数据中, 各去掉10个最大值和最小值, 取剩下30个数据的平均值作为该组发样的断裂应力和断裂应变。1.4.3吸水性能测定
将发样固定于载玻片上, 使用KH-7700型数字三维视频显微镜(HIROX, 日本)进行动态观测。将水滴滴在头发表面, 每隔30 s拍照保存, 共拍摄30 min。图片用Image-Pro Plus 6.0软件分析。每张图片读取三个直径数据并计算平均值作为此刻发样的直径。
吸水膨胀率E由公式(2)计算得到:
| $ E = \left( {{d_1} - {d_0}} \right)/{d_0} \times 100\% $ | (2) |
式中d1为吸水膨胀后发样直径, d0为初始直径。
1.5 发样的结构表征发样的化学结构由傅里叶红外光谱仪(AVATAR 5700 Nicolet, 美国)表征。将干态下的头发样品分别理成一束, 压于晶体表面, 用表面衰减全反射(ATR)模式进行测定, 在分辨率4 cm-1下扫描64次得到光谱。
2 结果与讨论 2.1 发样性能分析三种发样的碱溶度、断裂应力、断裂应变和吸水膨胀率测试结果如表 1、表 2和表 3所示, TG酶对烫发、染发和梳理等三种损伤发样均有不同程度的修复效果。表 1是烫发损伤及修复发样的性能测试结果, 通过分析发现:烫发修复效果最明显, 修复后碱溶度由16.54%减小到9.92%, 断裂应力由0.932 N提高到1.468 N, 断裂应变由8.51 mm提高到10.47 mm, 吸水膨胀率由18.34%降低到12.34%。烫发损伤主要是烫发剂中含有的巯基乙醇破坏了发丝中的化学键如二硫键等, 添加TG酶会促进蛋白间的交联重组, 对烫发这种化学损伤有较大改善。
| 表 1 烫发损伤及修复发样的性能测试结果 |
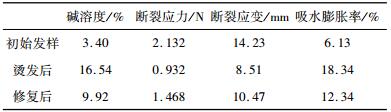 |
| 表 2 染发损伤、修复发样的性能测试结果 |
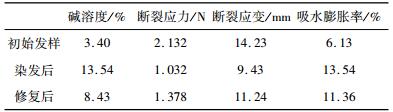 |
| 表 3 梳理损伤、修复发样的性能测试结果 |
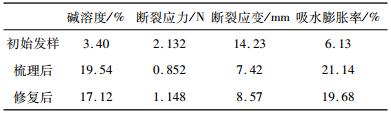 |
表 2是染发损伤及修复发样的性能测试结果, 通过分析发现:染发修复后效果比较明显, 修复后碱溶度由13.54%减小到8.43%, 断裂应力由1.032 N提高到1.378 N, 断裂应变由9.43 mm提高到11.24 mm, 吸水膨胀率由13.54%降低到11.36%。染发损伤与烫发损伤的作用机理基本一致, 主要是药剂中含有的化学成分破坏了发丝中的化学键, 添加TG酶会对其产生交联修复作用, 其本身对发丝破坏要小于烫发, 所以改善效果相较与烫发不明显。
表 3是梳理损伤及修复发样的性能测试结果, 通过分析发现:梳理损伤最不明显, 修复后碱溶度由19.54%减小到17.12%, 断裂应力由0.852 N提高到1.148 N, 断裂应变由7.42 mm提高到8.57 mm, 吸水膨胀率由23.14%降低到19.68%。梳理损伤属于物理损伤, 对化学键键的破坏较小, TG酶修复效果相较与前两种不明显, 但梳理对头发的损伤却最为严重。
通过对三种发样损伤、修复结果进行分析, 相比单独使用蛋白进行护发, 其效果仅能略微提高发丝抗碱性(碱溶度降低2%左右), 对发丝物化性能提高不大, 而添加TG酶护发能够使头发的物化性能提高更加明显, 修复效果更加显著。修复发样主要是利用TG酶的催化作用使头发纤维内部分子链间或链内发生交联反应来达到修复效果(DEFU S, XIANGYANG L, 2010)[9], 角蛋白渗入头发皮层, 能与受损发质中暴露出的亲水基团交联成键(WOJCIECHOWSKA E, A WLOCHOWICZ, 1999)[10], TG酶的催化作用不但可以使头发损伤样纤维内部断裂分子链间或链内发生交联反应, 而且可以使外加角蛋白分子与发内纤维分子链间发生交联反应, 使得参与交联反应的角蛋白和断裂纤维分子链更多, 能够更大程度的提升损伤头发的力学性能, 降低碱溶度[10-13]。
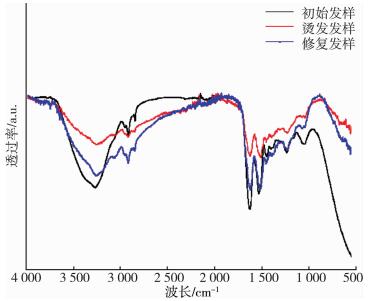
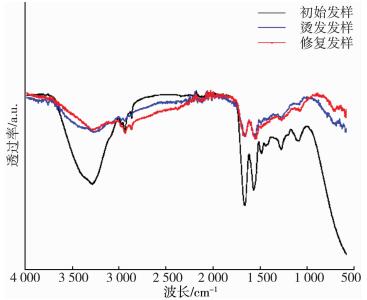
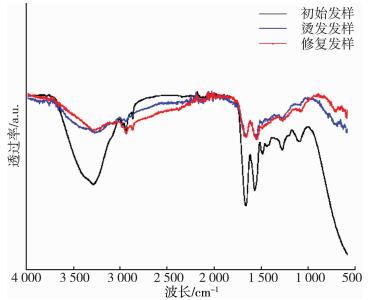
2.2 结构表征三种修复发样的的红外光谱图是图 1、图 2和图 3, 其中位于3 100 cm-1处的特征峰是酰胺基(-CONH-), 在1 689 cm-1处的是酰胺I带, 在1 531 cm-1处的是酰胺Ⅱ带, 在1 290 cm-1处的是酰胺Ⅲ带[14-17], 可以看到三张图均出现了对应的特征峰。
 |
| 图 1 烫发损伤及修复发样红外光谱图 |
 |
| 图 2 染发损伤及修复发样红外光谱图 |
 |
| 图 3 梳理损伤及修复发样红外光谱图 |
图 1是烫发损伤及修复发样的红外光谱图。烫发经过TG酶修复处理后的酰胺键增多明显, 且几种发样峰位并未发生偏移, 但各峰面积有明显差异, 说明TG酶催化修复在改善损伤发样物化性能的同时并不会影响头发蛋白的精细结构, 但酰胺键增多, 说明外加蛋白可以为TG酶提供更多修复位点, TG酶通过交联作用会形成致密的空间网络结构, 增加头发强韧性和抗逆性(CHUN-LI D, GUO-QUAN Z, 2013)[18-20]。
图 2是染发损伤及修复发样的红外光谱图。染发损伤的形成原因与烫发损伤相似, 都是由于药剂中的化学成分对纤维化学键造成了破坏, 染发药剂中的苯二胺是头发上色的主要成分, 对头发化学键有一定破坏, 还具有致癌作用[20-22]。经过TG酶修复后的酰胺键略有增多, 且峰位并未发生偏移, 但各峰面积有明显差异, 说明TG酶催化修复在改善损伤发样物化性能的同时并不会影响头发蛋白的精细结构, 但酰胺键增多, 说明外TG酶对发丝损伤部位进行了修复, TG酶通过交联作用形成致密的空间网络结构, 增加头发强韧性和抗逆性。
梳理损伤属于物理损伤, 对化学键破坏较小, 但对毛鳞片破坏较大, 会导致发丝蛋白暴露, 梳理损伤经过修复后酰胺键变化不明显, 峰位并未发生偏移(图 3), 说明TG酶没有影响到发丝的精细结构, 对梳理损伤效果不明显, 这也与上述的性能测试结果吻合[23]。进一步体现了TG酶的共价交联修复机理, 而非简单的吸附固定。
通过红外测试单独使用蛋白进行护发的传统方法, 很难在发丝受损部位形成新的酰胺键, 仅依靠随机“挂靠”形成的二硫键, 键能十分有限。与传统方法相比, TG酶可以在外加蛋白形成更多的二硫键基础上, 定向(酶的专一性)催化产生大量的酰胺键, 使发丝内部断裂分子链间或链内发生交联反应, 而且可以使外加蛋白分子与毛发纤维内分子链间发生交联反应, 修饰作用更加显著。
3 结论本文通过对比TG酶对烫、染和梳理三种损伤的修复效果, 利用蛋白间重组及TG酶交联作用来修复蛋白纤维, 得到质量更好的改性蛋白纤维, 研究发现:与损伤样相比, TG酶效果最明显的是烫发损伤, 修复后碱溶度由16.54%减小到9.92%, 断裂应力由0.932 N提高到1.468 N, 断裂应变由8.51 mm提高到10.47 mm, 吸水膨胀率由18.34%降低到12.34%。此法不仅能够改善人为烫染损伤的发质及自然损伤, 提高人发的抗损伤性、光泽及韧性, 预防发质干枯毛躁, 而且开辟了一个绿色、环保、高效的生物护理新方向, 在各类蛋白基材料的应用上有着巨大潜力。
| [1] |
张睿, 张毅, 张昊, 等. 兔毛角蛋白护发素的制备及其护发效果研究[J]. 纺织科学与工程学报, 2018, 35(01): 140-144. |
| [2] |
安原原.头发损伤对其性能影响及水分在损伤过程中的作用研究[D].杭州: 浙江理工大学, 2015.
|
| [3] |
王生, 张瑞萍, 申晓萍, 等. TG酶对羊毛针织物损伤的预防和修复[J]. 毛纺科技, 2010, 38(07): 19-24. |
| [4] |
张瑞萍, 蔡再生. TG酶在修复羊毛损伤中的应用[J]. 纺织学报, 2009, 30(01): 68-71. |
| [5] |
林珍.脆弱羊毛织物的mTG酶催化加固研究[D].杭州: 浙江理工大学, 2016.
|
| [6] |
唐传核. 微生物转谷氨酞胺酶(MTGase)的蛋白质底物催化特性及其催化机理研究(I)MTGase催化单底物蛋白质的聚合特性[J]. 食品科学, 2003(5): 19-24. |
| [7] |
MONTAZER M, PAKDEL E, MOGHADAM M B. Nano titanium dioxide on wool keratin as uv absorber stabilized by butane tetra carboxylic acid (btca):A statistical prospect[J]. Fibers and Polymers, 2010, 11(7): 967-975. DOI:10.1007/s12221-010-0967-y |
| [8] |
DRACK M, WIMMER R. Woolrock-a material for technical use consisting of keratin[J]. Journal of Materials Science, 2007, 42(15): 6183-6187. DOI:10.1007/s10853-006-1156-7 |
| [9] |
MHASKAR S, KALGHAT B, CHAVAN M, et al. Hair breakage index:An alternative tool for damage assessment of human hair[J]. Journal of Cosmetic Ence, 2011, 62(2): 203. |
| [10] |
ESPARZA YUSSEF, BANDARA NANDIKA, ULLAHAMAN, et al. Hydrogels from feather keratin show higher viscoelastic properties and cell proliferation than those from hair and wool keratins[J]. Materials Science & Engineering.C, Materials for Biological Applications, 2018, 90(1): 446-453. |
| [11] |
MEINERT K, SPRINGOB C, SCHMIDT C U, et al. Influence of antioxidants on the sun protection properties of hair care products[J]. International Journal of CosmeticEnce, 2010, 27(2): 138. |
| [12] |
PUGLIA D, CECCOLINI R, FORTUNATI E, et al. Effect of processing techniques on the 3D microstructure of poly (l-lactic acid) scaffolds reinforced with wool keratin from different sources[J]. Journal of Applied Polymer Ence, 2015, 132(48): 18-27. |
| [13] |
DAYIOGLU H, KUT D, MERDAN N. Theeffect of dyeing properties of fixing agent and plasma treatmenton silk fabric dyed with natural dye extract obtained from sambucus ebulus L.plant[J]. Procedia - Social and Behavioral Sciences, 2015, 195: 1609-1617. DOI:10.1016/j.sbspro.2015.06.201 |
| [14] |
REDDY N, YANG Y. Structure and properties of chicken feather barbs as natural protein fibers[J]. Journal of Polymers and the Environment, 2007, 15(2): 81-87. DOI:10.1007/s10924-007-0054-7 |
| [15] |
LEWALLEN R, FRANCIS S, FISHER B, et al. Hair care practices and structural evaluation of scalp and hair shaft parameters inafrican american and caucasian women[J]. J Cosmet Dermatol, 2015, 14(3): 216-223. DOI:10.1111/jocd.12157 |
| [16] |
TONIN C, ALUIGI A, VINEIS C, et al. Thermal and structural characterization of poly(ethylene-oxide)/keratin blend films[J]. Journal of Thermal Analysis and Calorimetry, 2007, 89(2): 601-608. DOI:10.1007/s10973-006-7557-7 |
| [17] |
CHUN-LI D, GUO-QUAN Z. Effects of transglutaminase treatment on the quality of buckwheat protein[J]. Food Research and Development, 2013, 12(1): 34-41. |
| [18] |
MYERS S L, YANG C Z, BITTNER G D, et al. Estrogenic and anti-estrogenic activity of off-the-shelf hair and skin care products[J]. Journal of ExposureEnce & Environmental Epidemiology, 2015, 25(3): 271. |
| [19] |
MOLINA R, P JOVANCIC, COMELLES F, et al. Shrink-resistance and wetting properties of keratin fibres treated by glow discharge[J]. Journal of Adhesion Science and Technology, 2012, 16(11): 1469-1485. |
| [20] |
KOVARSKⅡ A L, KASPAROV V V, A V KRIVANDIN. Epr spectroscopic and x-ray diffraction studies of carbon fibers with different mechanical properties[J]. Russian Journal of Physical Chemistry B, 2017, 11(2): 233-241. |
| [21] |
TATIANA NIKIFOROVA, VLADIMIR KOZLOV.MIKHAIL ISLYAIKIN. Sorption of d-metal cations by keratin from aqueous solutions[J]. Journal of Environmental Chemical Engineering, 2019, 7(5): 1-8. |
| [22] |
HAGENS R, WIERSBINSKI T, BECKER M E, et al. Qualification of an automated device to objectively assess the effect of hair care products on hair shine[J]. Journal of Cosmetic Ence, 2012, 62(5): 453-467. |
| [23] |
FERNANDEZ-DARLAS BORJA. Tough and functional cross-linked bioplastics from sheep wool keratin[J]. Scientific Reports, 2019, 9(1): 1-12. DOI:10.1038/s41598-018-37186-2 |
 2020, Vol. 34
2020, Vol. 34


