2. 中国科学院科技政策与管理科学研究所
干细胞研究是当今生命科学中关注度较高的前沿领域之一,在美国《科学》杂志每年公布的世界十大科技成果中于1999、2000、2003、2004、2007、2008、2009、2010、2012年多次入选。干细胞研究被广泛认为在细胞生物学、发育生物学、再生医学、动植物品种改良及其生物反应器研发、新药研发与评价等方面将扮演十分重要的角色。
干细胞研究不仅成为衡量一个国家生命科学发展水平的重要指标,并且在未来具有十分重大的社会效益和经济效益,引起各国政府、科技界和公众的高度关注。目前干细胞研究进展日新月异,新技术、新理论不断地涌现和突破,国际竞争空前激烈[1]。世界各国纷纷放宽政策限制,投入大量经费促进干细胞领域的发展。美国一直大力支持干细胞研究,2002-2011年,美国国立卫生院(NIH)共计投入80.68亿美元支持干细胞研究①。英国大力发展干细胞治疗方法和技术研究,并于2005年发布了干细胞计划,制定了一份对干细胞研究、治疗与相关技术发展的10年战略,计划每年投入4100万-1.04亿英磅②。日本将发展干细胞技术视作在生命科学和生物技术领域赶超美欧国家的绝好机遇,2007年12月,日本文部科学省在iPSc研究取得进展后决定,在未来5年内投入70亿日元发展干细胞领域。韩国政府亦大力发展干细胞研究,计划到2015年,将干细胞研究年度经费从3300万美元提高到9800万美元,建立至少5个世界级研究团队。我国政府和科学界自上世纪90年代后期以来一直高度关注干细胞研究,科技部973计划、国家重大科学研究计划、863计划、国家自然科学基金和重大专项等均给予干细胞研究大力支持。[1]
①数据来源:NIH Stem Cell Research Funding,FY2002-2011. http://stemcell.nih.gov/research/funding/Funding.htm
②数据来源:Departent of Henlth.Stem Cell Initiative:Report and Recommendatims,2005. http://dh.gov.uk/ab/UKSCI/index.htm.
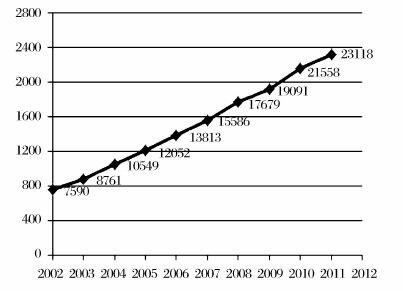
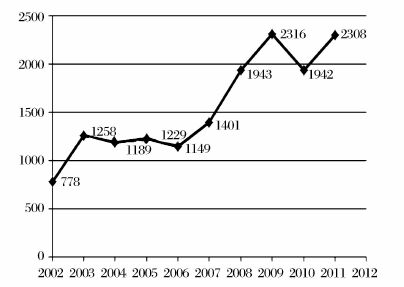
干细胞领域的基础研究和应用开发规模不断扩展,研究成果数量不断增加,这突出地表现在,世界范围内以干细胞为研究主题的SCI论文和专利数量逐年增长。采用ISI Web of Science数据库中的Science Citation Index Expanded(SCI2 EXPANDED)数据做分析,可以看出,从2002年到2011年,世界范围内以干细胞“stem cell”为主题词的SCI论文数量共计149797篇,且增长趋势十分明显(见图 1)。利用Derwent数据库分析2002年到2011年的专利数量,也可以发现,以干细胞为主题的专利数量,在2007年之后出现了强劲的增长(见图 2)。
|
图 1 2002—2011年以干细胞为研究主题发表的SCI论文数量 数据来源:Web of Science数据库 统计时间:2012年11月26日 |
|
图 2 2002—2011主要国家以干细胞为主题的专利数量 数据来源:Derwent数据库 统计时间:2012年11月26日 |
干细胞在产业化方面具有诱人前景,促使众多企业和社会资本纷纷进入该领域。据美国相关生物产业专家的预计,至2015年左右,全球干细胞医疗的潜在市场规模大约在800亿美元,如果将药物等有关的产业计算在内,2020年前后每年干细胞应用的全球市场规模可达4000亿美元,是21世纪重点战略性新兴产业之一①。
①干细胞医疗市场规模2015年将达800亿美元,http://health.sohu.com/20080311/n255641154.shtml[2008-3].
二、 干细胞研究和应用过程中的伦理、法律及社会问题(ELSI)1998年,美国科学家成功地从人类胚胎组织中分离出了胚胎干细胞,自此全世界开始了干细胞研究的热潮。但干细胞研究作为生命科学的热点领域,由于技术自身的风险以及不同国家、民族、宗教等文化差异以及不同利益群体之间的价值冲突等原因,其在发展过程中不时地面对诸多伦理问题,甚至与传统伦理发生激烈的碰撞。在干细胞研究的临床应用方面,由于临床监管机制的缺失,目前世界上有许多医疗机构声称能为患者提供有效的干细胞疗法,并形成了以寻找干细胞治疗手段为目的的跨国“干细胞旅游”,严重损害了医疗机构所在国的国际形象和患者的利益,在某种程度上造成了干细胞治疗的乱象。[3]
从干细胞研发的过程,即干细胞的来源、干细胞研究中的操作、以及干细胞临床转化等三个方面,梳理和总结出干细胞研究及应用领域中具体的伦理、法律和社会问题。
1. 干细胞的来源根据目前已知的情况,可以将干细胞来源分为人胚胎干细胞、诱导性多能干细胞、成体干细胞。人类胚胎干细胞研究领域伦理争议集中在人类胚胎的伦理地位和人胚胎干细胞的来源。这里涉及的问题包括人类胚胎的伦理地位、来源途径中捐献者的安全、捐献者知情同意权、捐献者的隐私权、人类胚胎与病人利益的冲突、安全性等方面。诱导性多能干细胞的问题主要指捐献者的知情同意、隐私权以及安全问题。成体干细胞涉及的主要问题包括:捐献者的知情同意权、捐献者的隐私权、脐带血存储的商业化、安全性以及用于生殖性克隆的可能等问题。
2. 干细胞研究中的操作干细胞研究中的操作主要包括实验室操作和临床前试验两个阶段。
实验室操作主要涉及以下问题:(1)实验室操作规范化问题,如没有合理节约的利用资源,没有合理的获取、储存、处理实验资源,没有合理处理实验垃圾,实验室人员经过在试验前和试验后未按要求进行卫生处理等等;(2)研究过程缺乏监管。目前相关的管理部门并没有对干细胞研究和应用过程施行有效的监管,多数研究机构的伦理委员会只是停留在对前期计划阶段进行伦理审查,大多数是出于“形式”上的需求,即保证本单位的研究计划、论文发表能够符合外部机构的各种形式上的要求;(3)用来规范干细胞实验室操作的伦理准则相对于技术进步来说显得较为滞后。
临床前试验主要是在对人体进行临床试验和应用之前的研究,即开展动物实验。在干细胞研究中,动物实验是干细胞研究不可缺少的手段和方法,保证动物福利,不仅是动物自身的需要,也是保证实验结果科学、可靠、准确、可信的基本要求。临床前试验主要涉及以下问题:尊重试验对象生命、保证研究的科学性和安全性、合理利用试验对象、饲养已引入人类干细胞的动物和将人类胚胎移植到非人类子宫中研究的可能等等。
3. 干细胞临床转化干细胞临床转化主要是指干细胞的临床试验(人体受试)及干细胞的应用。主要涉及到的问题是遵守临床试验的程序、病人的知情同意权和隐私权、病人的健康安全、病人的利益保护、病人的公平和商业利益驱动等问题。
三、 干细胞科学共同体的责任“科学家社会责任”问题最初是在20世纪30年代由以贝尔纳为首的英国科学家提出的,之后的第二次世界大战使科学共同体对责任问题有了深刻地了解并产生了较大的反响,面对原子弹爆炸的惨剧,使得许多科学家开始反思科学的社会后果和科学家应尽的社会责任,随后发生在上世纪50 年代的世界和平运动是科学共同体对其社会责任的认识达到新的高度。上世纪70年代的DNA基因重组争论是科学共同体履行责任的典型表现,为防止可能出现的危害,自动控制和放弃某些类型的实验,从而对科学自觉地实行控制,这在科学史上是前所未有的。1999 年联合国教科文组织和世界科学联盟并在匈牙利布达佩斯召开了“科学为世界21世纪服务:一项新任务”会议,明确了新世纪科学工作面临的挑战和根本任务以及科学的价值、科学的精神、科学的责任等内容,并形成两个核心文件,即《科学和利用科学知识宣言》和《科学议程—行动框架》[4]。
从以上“科学家的社会责任”问题的发展历程看,早期“科学家的社会责任”在于科学家有责任防范利益集团对科技成果的非理性利用。但是,随着新的科学技术革命的到来,科学技术本身成为了现代社会的重要风险源,科研工作本身出现了许多新变化和新情况,关于科学家社会责任的思考,不只出现于技术形成和应用之后,更体现在技术发生之初或之前 [5]。
结合上文所述,干细胞研究和应用过程中所产生的伦理冲突以及干细胞治疗乱象严重制约了干细胞领域的发展,如何治理这些问题,需要政府、科学共同体和公众等多方面协同合作。由于科学家在干细胞领域的研究开发、审批决策、风险管理、科技传播等事务中掌握着重要的话语权,以及在干细胞的社会应用问题上承担的积极角色,因此,干细胞科学共同体应当积极主动地承担自身的责任,应对干细胞研究领域的伦理问题,开展负责任的干细胞研究。概况地讲,干细胞领域的科学家应尽的首要责任是要理解并遵守国家相关部门制定的相关准则和条例,尊重和遵守国际公认的生命伦理准则和国际交往中对方国家的相关规定。其次,在研究开发过程中积极严格的自我规范,在审批决策过程中审慎负责的咨询行为,在风险管理过程中公正理性的评估立场,在科技传播过程中诚实坦率的沟通态度,都已经成为干细胞科研人员义不容辞的责任。
下面按照干细胞研发过程,我们将干细胞科学共同的责任分解为研究阶段和技术发展阶段的责任,其中研究过程中的责任包括材料的取得、细胞处理与加工、临床前研究和临床研究等几个阶段中的责任,技术发展阶段责任包括服务国家战略、从事科技咨询和开展科技传播等责任。同时结合上文所述研发阶段中所出现的伦理、法律和社会问题,对科学家所承担的责任进行总结。
1. 获取材料过程中的责任科研人员在取得与干细胞研究相关的原材料的时候,必须确保生物材料的取得符合国际公认的研究伦理标准,充分尊重和保障实验参与者的自主权、知情权和隐私权,以审慎的态度保证研究的公益性和非盈利性。当捐赠者同意捐赠时,应该告知捐赠者用于细胞系(株)可能来源于其捐赠的组织,其可能被存储和与其他人共享,也可能对其进行基因操作以及用于商业产品开发。在可能的情况下,用于细胞培养或保存的源于动物的材料,应该用人类的材料或用化学方法合成的材料来代替,以减少把有害的化学或生物材料或病原体意外传染给病人的风险 [6, 7] 。
2. 细胞处理与加工过程中的责任科研人员在对干细胞的处理与加工过程中,推进细胞培养期间相关参考标准的建立,以保证细胞治疗的有效性、安全性和可比性。积极开展国际间的合作与交流,参与国际标准制定,为干细胞的捐献、采集、检验、编码、制备、细胞潜能的保持、细胞的储存及运输等环节制定合适的质量管理体系[6, 7] 。
3. 临床前研究中的责任科研人员在开展临床前研究的过程中,要严格规范研究过程,自觉接受独立同行审评及管理监督,保证临床研究能满足在科研和治疗上的要求和条件。加强应用于临床试验细胞的安全性评价,保存完整的原始实验数据。针对临床转化研究中的安全问题,加强与临床研究者之间的交流和沟通。遵循减少数量、完善方案、取代动物实验等原则,开展负责任的动物研究 [7, 8] 。
4. 临床研究中的责任遵守相应的职业道德和操守,积极开展严格规程指导下的临床疗效研究及评价,坚决杜绝以营利为目地的、不负责任的技术滥用。对诊疗病例数、适应症、临床应用效果、并发症、合并症、不良反应及随访情况等严格按照国家临床试验的规范进行,自觉接受临床试验的监管 [7] 。
5. 服务国家战略的责任我国是一个发展中的人口大国,加强干细胞和再生医学研究,事关民生大计,对构建我国国民健康体系至关重要。2009年温家宝总理在中科院成立60周年纪念活动及与首都科技界大会上的重要讲话中指出:“目前,世界主要发达国家的干细胞研究发展势头强劲。干细胞研究促进了再生医学的发展,这是继药物治疗、手术治疗之后的又一场医疗革命。我们要力争在干细胞研究的更多领域取得领先地位”①。这就要求我们从事干细胞研究的科研人员主动承担起服务国家战略的责任,其首要任务是增强我国在干细胞研究上的原始创新能力,针对干细胞与再生医学研究领域亟待解决的问题,力争在干细胞多能性维持与重编程的分子机制、干细胞与微环境的相互作用、干细胞的可控性增殖、干细胞定向分化与转分化、干细胞应用转化研究与关键性技术等方面取得突破,获得重大成果。
①中科院60年发展道路:科技领域崛起“中国力量”, http://www.gov.cn/jrzg/2009-10/30/content_1452907.htm[2009-10].
作为掌握专业性、权威性知识的干细胞科学共同体,提供的咨询意见在科技政策的制定中起着重要的作用。具体到干细胞领域的科技咨询是指从事干细胞基础研究、临床研究等的专家通过不同行政部门的咨询机制,依据其干细胞领域专业知识提供政策意见。包括结合干细胞研究领域的最新进展、重大成果和发展态势,围绕我国干细胞与再生医学领域未来的发展战略规划、部署、对策和相关建议,干细胞和再生医学领域的关键核心科学问题、相关政策法规、发展模式、科研布局、优势发展领域、人才团队、平台建设等主题,积极建言献策。
6. 推动科技传播的责任目前我国公众对干细胞领域的整体认知不高,存在着巨大的知识鸿沟。这类知识鸿沟的存在,有碍于公众共享干细胞科技发展的成果,同时也不利于干细胞科技的推广与应用。因此,干细胞科学共同体需要肩负起推动干细胞知识传播的责任。积极推广和普及干细胞领域的知识和科技成果,在科技风险问题上与社会公众充分沟通,使之认识到干细胞研究和应用的探索性与风险性,提升公众科学意识和鉴别能力。
2. Institution of Policy and Management, CAS
| [1] | 裴钢. 中国干细胞研究大有希望. 生命科学, 2009(5). |
| [2] | 傅俊英. 干细胞领域研究、开发及市场的全球态势分析. 中国生物工程, 2011(9). |
| [3] | 邱仁宗, 翟晓梅. 关于干细胞研究及其临床应用伦理管治的回顾与展望. 中国医学伦理学, 2009, 22(5): 3-9. |
| [4] | 莫少群. "科学家的社会责任"问题的由来与发展. 自然辩证法研究, 2003, 19(6): 50-53. |
| [5] | 杜鹏. 关于科学的社会责任. 科学与社会, 2011, 1(1): 114-122. |
| [6] | International Society for Stem Cell Research (ISSCR): Guidelines for the Conduct of Human Embryonic Stem Cell Research, Version 1,2006. |
| [7] | International Society for Stem Cell Research (ISSCR):Guidelines for the Clinical Translation of Stem Cells, 2009. |
| [8] | Indian Council of Medical Research Department of Health research & Department of Biotechnology: Guidelines for Stem Cell Research (Draft), 2012. |
 2013, Vol. 3
2013, Vol. 3
