自上世纪中叶以来,生命科学发展日新月异。继分子生物学、基因组学为代表的两次生命科学革命之后,数学、物理、化学、计算科学、工程科学与生命科学的深度融合,正在促使生命科学从观测性、描述性、经验性的科学,跃升为可定量、可预测、工程性的科学。以定量化、模型化和工程化为特征的新生命科学,为生物学研究提供了崭新的研究思想,正在催生一次新的科学文化革命和技术产业革命。[1]合成生物学是多学科技术和方法的交叉科学学科,利用工程学的模块化概念和系统设计理论,依赖于化学合成的DNA,通过标准化和自动化的过程,改造和优化现有自然生物体系,甚至从头合成创建具有特定功能的人工生物体系,从而突破自然进化的限制,在深入理解生命本质的同时,实现合成生物体系在能源、材料、食品、医药、化工、环境和农业等领域的广泛应用(图 1)。[2]通过设计、构建、调试优化的工程学循环得以合成实现的人工生物体系结构日益复杂、功能日益强大、性能日益优化。可以预见,不久的将来,以合成生物学为代表的新生命科学将证明自己不仅可用以揭示生命本质和探索生命过程基本规律,而且将革新生物技术,实现对复杂途径与系统在人工设计指导下的定量可控表达与生产,由此为人类面临的资源、能源和环境等重大问题提供全新的解决方案,从根本上变革人类的生产和生活方式。
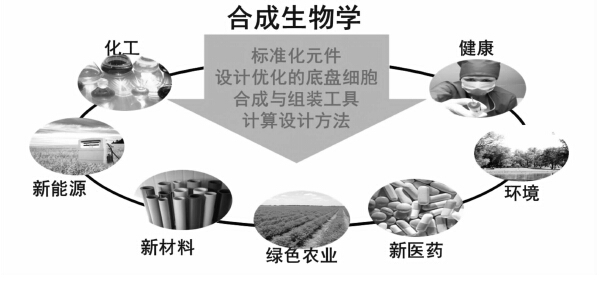
|
图 1 合成生物学及其应用领域 |
合成生物学作为一门新兴的学科,过去十年在概念理论、技术方法和功能应用等都取得了显著的进展,三方面相辅相成,极大地促进了该学科的发展和成熟。[3]
1. 基因线路作为合成生物学基础理论研究,奠定了学科发展的坚实基础合成生物学的思想起源于对电子线路概念的借鉴,试图利用已知的基因功能和相互调控关系,通过合成可设计、可组装、可替换的基因元件,构建具有特定功能和逻辑关系的基因线路,用以加深对基因表达和调控的认识。美国波士顿大学的James Collins设计的双稳态开关与加州理工学院Michael Elowitz设计的自激振荡环并称为合成生物学的发端之作,奠定了合成生物学理论的基础。[4, 5]在此基础上,基因线路的构建逐步扩展到更为复杂的基因网络水平。James Collins“由下而上”地构建基因网络;Michael Elowitz提出用各种人工基因网络模型来模拟实际生物网络;麻省理工学院的Ron Weiss则通过构建不同层次的基因网络,提出了合成生物网络的工程化设计原则。然而基因网络并非电器元件的连接和叠加,植入细胞内的基因网络受到基因元件和线路间相互作用及宿主自身的影响,难以按照设计和模拟的结果实现预期功能。随着网络规模和复杂程度的增加,其噪声也显著增强。人工生物网络的噪声、稳定性、鲁棒性和可调性分析,进一步完善了合成生物学的基本概念和理论,并有利于合成生物学基因网络的功能实现。[6]
2. 基因合成、删减和编辑技术进步为合成生物学从理论到应用提供了强力支持合成生物学研究方法可分为自上而下法(top-down approach)和自下而上法(bottom-up approach)。自上而下法是人们利用合成生物学对现有生物或基因序列进行重新设计,以去掉不必要的零件,或取代或添加特定的零件。自下而上法是人们利用非生命组分作为原材料来构建生命系统。两种方法可以在某种程度上互相交叉,都有共同目标:工程化特定的生物功能,使其具有可预测性及可靠性。以Craig Venter为首的研究团队通过多年的努力,从合成噬菌体开始,逐步实现了具有生命特征的蕈状支原体基因组合成与移植,从而创造了一个仅由合成染色体控制的新的蕈状支原体细胞,是合成生物学发展史的里程碑式进步。[7]2006年Science杂志首次发表了大规模大肠杆菌基因组删减的研究,对基因组精确删除15%以上,结果导致菌种电转化效率提高、稳定性增强。[8]随后日本协和发酵公司构建了基因组敲除约25%的大肠杆菌;日本花王公司则获得了基因组删除20%的枯草芽胞杆菌。近几年来,作为支撑合成生物学发展的重要技术之一,DNA合成技术发展很快,成本越来越低。研究人员利用取自高保真微阵列DNA库的选择性扩增,进行可扩展的基因合成,使合成一个核苷酸的成本低于1美分。[9]优化的底盘生物除了需要维持生命的必需功能外,还要能够保证合成的复杂基因网络在其中有效发挥功能,这就需要全基因组水平上的大规模代谢流微调。包括Multiplex Automated Genome Engineering (MAGE)方法的开发,以及ZFN、TALEN、和Crispr-Cas9等基因组编辑技术的发展,可以在细胞内实现同时进行对多个关键基因的改造与调控,极大地提高了对人工细胞的改造能力。[10]
3. 基于合成生物学的生物制造奠定了在医药、能源和化工等领域的应用基础合成生物学本质上具有工程学的特性,利用已有生物系统的全部或部分代谢网络,引入新的功能基因模块并使之适应基因网络,最终使生物实现前所未有的新功能,是合成生物学的重要目标。这方面以美国加州大学伯克利分校Jay Keasling、麻省理工学院Gregory Stephanopoulos和加州大学洛杉矶分校James Liao等为主要代表人物,分别在涉及医药、能源和化学品的青蒿素、紫杉醇、丁醇衍生物的生产方面有杰出的工作。[11, 12, 13]他们研究表明人们能够象有机合成化学一样,根据需要设计、重组并优化新的生物合成途径,产生自然界来源受限的包括复杂天然产物类药物在内的各类药物、能源和材料化学品,一批原来不能生物合成,或生物合成效率很低的化学品,通过人工生物体逐步实现了生物合成。
合成生物学已经引起全球科技界与社会各层面的高度关注。英国于2012年7月13日发布了《合成生物学路线图》,规划了英国在发展世界领先的合成生物学方面的宏大目标。[14]2006年,美国国家科学基金会资助由加州大学伯克利分校、哈佛大学、麻省理工学院、加州大学旧金山分校等4家单位共同建立“合成生物学工程研究中心”,该中心计划运行10年,已经与50多家公司形成了伙伴关系,努力在推动国家工程生物学计划(National Initiative in Engineering Biology)。美国国防部高级研究计划署(DARPA)启动了Living Foundries项目进军合成生物学领域,希望通过改造细胞的代谢和遗传机制使其高效生产有用的生物基产品。与此同时,在各国政府政策和计划的鼓励和刺激下,英国石油公司(BP)、壳牌(Shell)、巴斯夫(BASF)、拜尔(Bayer)、杜邦(Dupont)、道化学(Dow Chemical)等大型跨国石油和化工集团斥巨资投入生物化工产业,发展面向生物制造的合成生物学与工业应用技术。我国政府也高度重视合成生物学研究。自2009年起,中科院大力推动设立合成生物学与先进生物制造的研究计划的努力,客观上推动了科技部973计划、863计划对合成生物学的重视。2010年以来,我国973计划设置了合成生物学专项,包括“人工合成细胞工厂”等9个项目陆续启动(表 1)。科技部于2012年组织启动了863计划重大项目“合成生物技术”,主要以酵母为模型,研究基因组的合成和生物技术利用。这些项目的设立大大加快了我国合成生物学的发展进程。
| 表 1 我国已批准立项和启动的973计划合成生物学项目 |
建立人工生物设计模式,提高生物制造能力,打通更多化学品的生化合成通道,是目前合成生物学的重要任务,通过全世界相关研究人员的辛勤工作,基于合成生物学的生物制造已经在多个方面取得了革命性进展,为改变经济增长的轨迹和革新产业奠定了坚实的基础。
1. 从农业种植到工业发酵——天然产物生物合成目前全球使用天然药物的人数约40亿,占世界总人口的80%。天然药物销售额约占全球医药销售总额的30%,并且每年还以15%的速度增长。面对如此巨大而又快速增长的市场,传统的种植业已经满足不了社会的需求。近年来,采用基因组学技术发掘天然产物代谢途径、合成生物学手段在微生物中重构天然产物合成途径已经成了药用植物研究的热点。例如,加州大学伯克利分校Jay Keasling小组致力于青蒿素的微生物合成十多年,2013年把青蒿素前体的产量提到了一个前所未有的高度(25g/L),为青蒿素的生产从农业种植到工业发酵的变革扫平了道路。[15]2010 年,Gregory Stephanopoulos 小组利用大肠杆菌代谢工程技术合成了抗癌药物紫杉醇的前体物紫杉二烯,并使其产量达到了1000 mg/L,与原来的菌株相比,产量提高了15000 倍。[16]我国科学家也在这个领域取得了一系列进展。2013年赵宗保和黄璐琦研究小组结合转录组分析和合成生物学技术发现了丹参酮合成途径中的一个关键基因。[17]2014年张学礼小组利用代谢工程技术构建了第一代的“人参酵母”,其中人参皂苷前体产量达到了1120 mg/L。[18]代谢工程与合成生物学的结合,促使一批天然化合物实现人工生物合成,催生了一批以细胞工厂为技术核心的崭新科技,实现了天然产物从农业种植到工业发酵的跨越式发展,为破解经济发展的资源环境瓶颈制约带来了新的希望。
2. 从化石原料到生物原料——平台化学品合成生物制造由于化石资源不可再生,而且是造成温室效应的主因,近年来世界各主要国家都积极推动和鼓励可再生的生物基材料替代不可再生的化石材料,扩大生物基材料在生产和生活领域的应用。2011年全球生物基材料产能已达3010万吨,占所有聚合物材料产能(3.66亿吨)的8.2%。近些年生物基材料的成本持续下降、性能不断提高,对传统石化材料的竞争力不断增强。基于合成生物学的多种平台化学品的生物制造已经或即将取得对石油路线的竞争优势。在对微生物代谢网络进行系统分析的基础上,通过合理设计、改造的代谢途径及性能系统优化,可以合成出各种高效的人工细胞,将生物质资源高效、快速地转化为各种平台化学品。[19, 20, 21]如生物基1,3-丙二醇的工业化生产(Dupont和Genencor公司),3-羟基丙酸的生物制造新路线(Cargill公司) ,大肠杆菌中异丁醇的合成(Dupont公司、加州大学洛杉矶分校和Gevo公司)、1,4-丁二醇的生物合成(Genomatica)、异戊二烯合成(Genencor公司和Goodyear公司)、己二酸生物合成(Verdezyne公司和Genomatica公司)等。通过几年的努力,我们的973重大科学问题导向项目“人工合成细胞工厂”也取得了重要进展,利用DNA组装和和精确表达调控技术,[22]创建和优化了从葡萄糖到丁二酸、戊二胺、己二酸、5-氨基乙酰丙酸等途径,达到预期原子经济性,其中5-氨基乙酰丙酸产量达到50g/L,比国际水平高5倍,丁二酸产量达到125g/L,产物对底物葡萄糖的转化率为105%(可部分固定二氧化碳),[23]技术指标处于国际领先水平。国内外这些研究的快速发展为建立从生物质原料到聚合物材料的产业链,实施规模化应用,对替代化石原料、解决环境污染、加快石油化工材料产业结构调整,形成新的绿色经济增长点等具有重大作用。
3. 从有机原料到无机气体——二氧化碳转化利用二氧化碳是主要的温室气体,同时也是一种取之不尽、用之不竭的廉价碳氧资源。减少二氧化碳排放甚至降低其在大气中的浓度已成为各国共同面对的重大挑战。利用二氧化碳代替石化资源等有机原料来合成大宗基础化学品、燃料和高分子材料,将帮助人类摆脱因过量使用石化资源所造成的能源、资源和环境的多重困境,这一领域也因此成为科学界和产业界共同关注的焦点。2013年,我国二氧化碳排放总量达100亿吨,居全球首位,如能利用好这些碳资源,将为我国解决碳排放的同时,提高丰富的碳资源。随着合成生物学的发展,设计人工生物体来进行二氧化碳的固定和利用逐渐取得了重要的进展。[24]2009年,James Liao研究小组通过设计合成蓝细菌首次实现了光合合成异丁醛。[25]2010年,美国麻省大学Derek Lovley研究小组构建反转微生物燃料电池利用产乙酸微生物将电能和二氧化碳生产有机产品。[26]2012年,还是James Liao研究小组同时利用电能和二氧化碳生产异丁醇,打开二氧化碳电力驱动的生物转化到商业化学品的可能性。[27]2013年,美国佐治亚大学Michael Adams研究小组改造微生物从二氧化碳和氢气可以产生有用的产物,比如,3-羟基丙酸甲酯。[28]2013年,德国研究人员利用氢依赖性二氧化碳还原酶由二氧化碳和氢气生产甲酸。[29]我们的“人工合成细胞工厂”项目也在光合二氧化碳的固定利用方面取得重要进展。在对光合蓝细菌底盘细胞的生理调控机制进行系统研究和形成较为完整的理解和认识的基础上,构建了一系列获得抗逆性能提高的光合蓝细菌底盘细胞,[30]通过光合模块、二氧化碳固定和生物合成模块的重构和优化,实现了从二氧化碳生物合成酮、醇、酸等典型化学品,为发展和利用新的碳资源提供了可能,其中丙酮、D-乳酸,3-羟基丁酸均为国际上首次报道。[31, 32]二氧化碳资源的高效综合利用,实现碳收集、转化、消费和排放的循环经济将是未来世界经济可持续发展的重要保障。
三、 合成生物学发展分析目前,大规模的传统医药、化工、能源、材料等工业发展已经不适应经济社会发展方式的需求。而合成生物学正在对现代工业产生革命性影响。人类赖以生存的化学品(包括材料、能源和天然化合物)制造,正面临着原料路线从化石资源向可再生生物资源、加工路线从化学制造向生物制造转移两个不可避免的变革。对于资源对外依存度不断加深、节能减排压力巨大的我国,这两个变革尤其重要。
以合成生物学为指导,设计有机化学品的高效合成路线和人工生物体系,逐渐从天然生物的轻度修饰向全人工合成的生物或生命过度,不仅可能高效利用原来不能利用的生物质资源,也有可能高效合成原来不能生物合成、或者原来生物合成效率很低的产品(图 2)。这将为突破自然生物体合成功能与范围的局限,打通传统化学品的生物合成通道,为发展先进生物制造技术、促进可持续经济体系形成与发展,提供重大机遇。
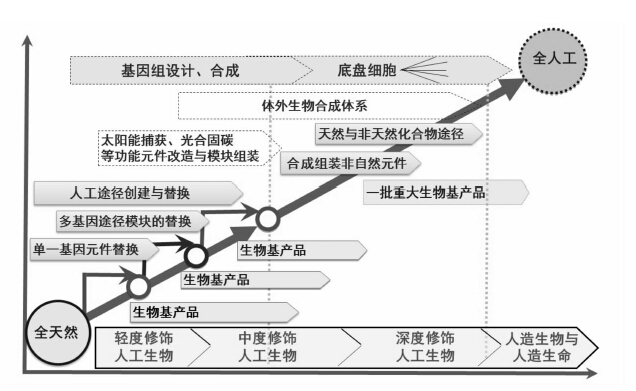
|
图 2 面向生物制造的合成生物学发展路线图 |
然而,合成生物学从理论基础到研究方法策略,从使能技术到工程化操作平台,尚处于初创阶段,有待发展和完善。而且生物系统是高度动态、灵活调控、非线性、且不可预测的。对于经过亿万年自然选择压力下进化形成的复杂天然生物,如何以工程化的设计,获得具有特定功能的人工生物,是合成生物学面临的核心挑战。解决这一挑战,不仅需要对人工生物(生命)设计与构建的科学原理进行研究,丰富、发展和创新合成生物学理论,更需要一系列方法和技术创新的支撑。
1. 生命的精确化与再造原理自然界存在大量不同功能的多样性元件及模块并由此组装成能适应不断变化的有生命体,是有机体通过平衡体内基因变异和修正变异以适应环境的短期变化和长期选择压力的进化的结果。在系统生物学思想和工程化设计原理指导下,将不同来源的、各种生物学功能和代谢途径元件化、模块化,组合成相应的生物器件,并在一定的底盘细胞上进行组装,将能够大大提高构建复杂代谢途径和生物网络的效率,为人造生物功能组合合成的工程化奠定基础,并且提高人类对于生物网络组织原则与功能关系的理解,深化对于生物分子结构、功能与互作关系的认识。然而,目前人们对这些元件、回路、途径的的生物学认识水平和工程学设计能力仍很不完善;知识不完整、影响体系的因素太多使问题过于复杂等等因素导致人工生物设计结果具有极大的不确定性,远不能满足定向创建人工生物的需要。
针对这个问题,我们需要建立生物元器件的定量生物学研究方法及其相应仪器装备,综合“湿”实验和“干”计算知识,提升对生命过程与功能模块的数学建模能力。在系统分析生命活动和功能规律的基础上,通过计算机设计模拟与实验验证结合,大规模删除非必需基因和功能模块,构建基因组不断简化、能够自我复制和生长的底盘生物,提升对于生命活动的本质及其物质基础的认识。我们需要进行基本生命活动与代谢功能模块的解析、解耦、抽提,通过将部分基因组模块化的实验手段,探索模块化基因组的设计原则。在高通量筛选的基础上,结合功能模块(特别是结构功能模块)在底盘细胞中的稳定性研究,开发设计正交模块技术体系;建立可供计算建模的虚拟细胞,实现对人工细胞代谢与调控的模拟仿真能力和预测设计能力。通过计算模拟导入的生物功能模块与底盘细胞网络的相互作用,指导底盘生物基因组的简化,重新设计其生化网络,指导构建能够对不同环境进行适应性响应的生物。随着对复杂生物系统认识的逐步提高,不断地提升对元件、回路、途径甚至生物体系的设计能力。
2. 生命性状与功能的人工控制合成生物学的目标是组装一系列具有特定代谢功能的分子模块,并赋予其整体功能。然而,人们对活细胞工作原理的了解还远远没有达到对电子机械设备工作原理所了解的程度,直接对自然界的器件进行组装常常不能按预期模式互相耦合,导致生物功能模块不能正确地行使功能。同时,导入外源的生物功能模块往往会对底盘生物造成很大的影响,甚至会抑制其生长,也使得功能模块不能有效地工作。元件与元件之间、元件与模块之间、功能模块之间、以及功能模块与底盘生物之间的适配程度,决定了生物功能模块的整体效率。此外,功能模块的工作环境是高度动态的,人工生物生长条件的变化、以及随机发生的遗传突变都会严重影响功能模块的工作效率,甚至造成其无法正常工作。
针对这一问题,我们需要发掘自然代谢的多样性,识别经过长期进化产生的、适于模块化和标准化的优异分子模块,包括蛋白质分子开关和相互作用结构域、核酸序列单元如核酸开关和核酶等,特别注意发掘结构上相对独立,具备重要和普适的功能(如信号感受、相互作用、物质转运与生理调控等)的元件,对它们进行改造和优化,构建通用型的功能模块,我们要分析各种生物功能元件与模块的结构、功能、调控以及分子进化特征,在现有生物学和基因组知识的指导下人工设计合成具有特定功能的元件与模块,对它们进行定量的工程性的功能表征。同时,建立高通量的元件组合和模块集成的适配性检测,实现in silico、in vitro和in vivo进化优化技术的统一。通过计算模拟的干法和组学分析的湿法相结合,研究人工细胞对遗传、生理与环境因子的应答机制,揭示人工生物功能进化的遗传机理,从DNA、RNA、蛋白质(酶)、代谢物及代谢流量、细胞等不同层次上实现对细胞网络的调控,进行高通量的基因组编辑和改造,实现在底盘生物上模块之间的优化磨合对接,极大地提升合成人工生物的能动性和精确度。
四、 合成生物学风险管理合成生物学是集生物科学、化学、工程学和信息科学的交叉学科,其目的是创造有基础研究或应用价值的新型生物体,这就随之带来了生物安全的问题,从而引起了社会各界对其在生物安全和伦理道德方面的关注。2010年,美国总统奥巴马指示总统生物伦理问题研究委员会对合成生物学进行评估,并制定伦理指南,意在使风险最小化的同时实现公共利益最大化。[33]基于基因重组技术和其他现代生物技术的合成生物学可能带来人类及其生活环境的巨大变革,同时也应该意识到这种力量的潜在威胁。这些威胁包括研究合成生物体的未知安全性和环境意外泄露、利用合成生物学技术制造生物武器威胁社会、甚至于针对某个种族特异靶点的人造种族基因武器等。因此,需要从以下四个方面保障合成生物学的健康发展:
1. 起草和健全合成生物学管理文件与法规。参考转基因生物安全评价的相关文件,在国家级甚至全球层面上制定合成生物安全管理文件和法规,围绕有关合成来源DNA和生物,建立和健全一致性的规范描述语言,明确哪些合成DNA和生物受到管制,召集专家讨论和起草指导意见并向全社会发布。
2. 建立和规范实验室合成生物工作的备案制度。建议有关部门组织开发限制合成的基因序列和生物物种的数据库,建议基因合成公司根据数据库对合成的DNA和生物进行筛选、对订购信息进行备案。对于能自行合成DNA和生物的研究单位,需要向有关部门备案,并且在国际范围内进行沟通和协调,推广备案和监管制度。
3. 加强对专业人员的合成生物安全教育培训。针对合成生物学领域不同背景和专业人员,进行生物安全的培训和相关管理文件的宣传,增强其了解相关权利和义务,提高研究人员关于合成生物学科研安全的意识和道德修养,制定相应生物安全操作规范,敦促研究人员按照操作手册进行相关试验,并及时做好风险评估。
4. 建立生物安全的科普宣传平台,合理引导公众舆论。设立专门的合成生物学网站和其他科普平台,介绍合成生物学的研发、生物安全、风险评价和风险管理情况;加强政府、新闻媒体和公众之间的沟通与交流,严格监督和约束科学家的职业道德,避免误导公众。
合成生物学作为新技术、先进科技,是一面双刃剑,带来巨大的社会效益同时也产生了巨大风险,为了有效地降低其潜在威胁,只有从制度、法规和公众舆论引导等方面逐渐形成系统性的风险管控措施,才能保证并促进合成生物学技术健康快速地发展,为人类文明的进步做出贡献。
| [1] | Committe eon a New Biology for the 21st Century of National Research Council. A New Biology for the 21st Century: Ensuring the United States Leads the Coming Biology Revolution. Washington DC: The National Academics Press, 2009. |
| [2] | Cheng AA, Lu TK. Synthetic biology: an emerging engineering discipline. Annu Rev Biomed Eng, 2012, 14: 155-78. DOI: 10.1146/annurev-bioeng-071811-150118. |
| [3] | Way JC, Collins JJ, Keasling JD, Silver PA. Integrating biological redesign: where synthetic biology came from and where it needs to go. Cell, 2014, 157(1): 151-61. DOI: 10.1016/j.cell.2014.02.039. |
| [4] | Lu TK, Khalil AS, Collins JJ. Next-generation synthetic gene networks. Nat Biotechnol, 2009, 27(12): 1139-50. DOI: 10.1038/nbt.1591. |
| [5] | Levine JH, Lin Y, Elowitz MB. Functional roles of pulsing in genetic circuits. Science, 2013, 342(6163): 1193-200. DOI: 10.1126/science.1239999. |
| [6] | Slusarczyk AL, Lin A, Weiss R. Foundations for the design and implementation of synthetic genetic circuits. Nat Rev Genet, 2012, 13(6): 406-20. DOI: 10.1038/nrg3227. |
| [7] | Gibson DG, Glass JI, Lartigue C, Noskov VN, Chuang RY, Algire MA, Benders GA, Montague MG, Ma L, Moodie MM, Merryman C, Vashee S, Krishnakumar R, Assad-Garcia N, Andrews-Pfannkoch C, Denisova EA, Young L, Qi ZQ, Segall-Shapiro TH, Calvey CH, Parmar PP, Hutchison CA 3rd, Smith HO, Venter JC. Creation of a bacterial cell controlled by a chemically synthesized genome. Science, 2010, 329(5987): 52-6. DOI: 10.1126/science.1190719. |
| [8] | Leprince A, van Passel MW, dos Santos VA. Streamlining genomes: toward the generation of simplified and stabilized microbial systems. CurrOpinBiotechnol, 2012, 23(5): 651-8. |
| [9] | Kosuri S, Church GM. Large-scale de novo DNA synthesis: technologies and applications. Nat Methods, 2014, 11(5): 499-507. DOI: 10.1038/nmeth.2918. |
| [10] | Cheng JK, Alper HS. The genome editing toolbox: a spectrum of approaches for targeted modification. CurrOpinBiotechnol, 2014 Dec;30C:87-94 |
| [11] | Keasling JD. Manufacturing molecules through metabolic engineering. Science, 2010, 330(6009): 1355-8. DOI: 10.1126/science.1193990. |
| [12] | Yadav VG, De Mey M, Lim CG, Ajikumar PK, Stephanopoulos G. The future of metabolic engineering and synthetic biology: towards a systematic practice. Metab Eng, 2012, 14(3): 233-41. DOI: 10.1016/j.ymben.2012.02.001. |
| [13] | Felnagle EA, Chaubey A, Noey EL, Houk KN, Liao JC. Engineering synthetic recursive pathways to generate non-natural small molecules. Nat Chem Biol, 2012, 8(6): 518-26. DOI: 10.1038/nchembio.959. |
| [14] | UK synthetic biology roadmap coordination group. A synthetic biology roadmap for UK. London, 2012. |
| [15] | Paddon CJ, Westfall PJ, Pitera DJ, Benjamin K, Fisher K, McPhee D, Leavell MD, Tai A, Main A, Eng D, Polichuk DR, Teoh KH, Reed DW, Treynor T, Lenihan J, Fleck M, Bajad S, Dang G, Dengrove D, Diola D, Dorin G, Ellens KW, Fickes S, Galazzo J, Gaucher SP, Geistlinger T, Henry R, Hepp M, Horning T, Iqbal T, Jiang H, Kizer L, Lieu B, Melis D, Moss N, Regentin R, Secrest S, Tsuruta H, Vazquez R, Westblade LF, Xu L, Yu M, Zhang Y, Zhao L, Lievense J, Covello PS, Keasling JD, Reiling KK, Renninger NS, Newman JD. High-level semi-synthetic production of the potent antimalarial artemisinin. Nature, 2013, 496(7446): 528-32. DOI: 10.1038/nature12051. |
| [16] | Ajikumar PK, Xiao WH, Tyo KE, Wang Y, Simeon F, Leonard E, Mucha O, Phon TH, Pfeifer B, Stephanopoulos G. Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli. Science, 2010, 330(6000): 70-4. DOI: 10.1126/science.1191652. |
| [17] | Guo J, Zhou YJ, Hillwig ML, Shen Y, Yang L, Wang Y, Zhang X, Liu W, Peters RJ, Chen X, Zhao ZK, Huang L. CYP76AH1 catalyzes turnover of miltiradiene in tanshinones biosynthesis and enables heterologous production of ferruginol in yeasts. ProcNatlAcadSci U S A, 2013, 110(29): 12108-13. DOI: 10.1073/pnas.1218061110. |
| [18] | Dai Z, Liu Y, Zhang X, Shi M, Wang B, Wang D, Huang L, Zhang X. Metabolic engineering of Saccharomyces cerevisiae for production of ginsenosides. Metab Eng, 2013, 20: 146-56. DOI: 10.1016/j.ymben.2013.10.004. |
| [19] | Cho C, Choi SY, Luo ZW, Lee SY. Recent advances in microbial production of fuels and chemicals using tools and strategies of systems metabolic engineering. Biotechnol Adv. 2014, DOI: 10.1016/j.biotechadv,2014.11.006 |
| [20] | Nielsen J, Fussenegger M, Keasling J, Lee SY, Liao JC, Prather K, PalssonB. Engineering synergy in biotechnology. Nat Chem Biol, 2014, 10(5): 319-22. DOI: 10.1038/nchembio.1519. |
| [21] | Lee JW, Na D, Park JM, Lee J, Choi S, Lee SY. Systems metabolic engineering of microorganisms for natural and non-natural chemicals. Nat Chem Biol, 2012, 8(6): 536-46. DOI: 10.1038/nchembio.970. |
| [22] | Yu X, Liu T, Zhu F, KhoslaC. In vitro reconstitution and steady-state analysis of the fatty acid synthase from Escherichia coli. ProcNatlAcadSci U S A, 2011, 108(46): 18643-8. DOI: 10.1073/pnas.1110852108. |
| [23] | Zhu X, Tan Z, Xu H, Chen J, Tang J, Zhang X. Metabolic evolution of two reducing equivalent-conserving pathways for high-yield succinate production in Escherichia coli. Metabolic Engineering, 2014, 24: 87-96. DOI: 10.1016/j.ymben.2014.05.003. |
| [24] | Desai SH, Atsumi S. Photosynthetic approaches to chemical biotechnology. CurrOpinBiotechnol, 2013, 24(6): 1031-6. |
| [25] | Atsumi S, Higashide W, Liao JC. Direct photosynthetic recycling of carbon dioxide to isobutyraldehyde. Nat Biotechnol, 2009, 27(12): 1177-80. DOI: 10.1038/nbt.1586. |
| [26] | Nevin KP, Woodard TL, Franks AE, Summers ZM, Lovley DR. Microbial electrosynthesis: feeding microbes electricity to convert carbon dioxide and water to multicarbon extracellular organic compounds. MBio, 2010, 1(2). |
| [27] | Li H, Opgenorth PH, Wernick DG, Rogers S, Wu TY, Higashide W, Malati P, HuoYX, Cho KM, Liao JC. Integrated electromicrobial conversion of CO2 to higher alcohols. Science, 2012, 335(6076): 1596. DOI: 10.1126/science.1217643. |
| [28] | Keller MW, Schut GJ, Lipscomb GL, Menon AL, Iwuchukwu IJ, Leuko TT, Thorgersen MP, Nixon WJ, Hawkins AS, Kelly RM, Adams MW. Exploiting microbial hyperthermophilicity to produce an industrial chemical, using hydrogen and carbon dioxide. ProcNatlAcadSci U S A, 2013, 110(15): 5840-5. DOI: 10.1073/pnas.1222607110. |
| [29] | Schuchmann K, Müller V. Direct and reversible hydrogenation of CO2 to formate by a bacterial carbon dioxide reductase. Science, 2013, 342(6164): 1382-5. DOI: 10.1126/science.1244758. |
| [30] | Jin H, Chen L, Wang J, and Zhang W. Engineering biofuel tolerance in non-native producing microorganisms. Biotechnology Advances, 2014, 32(2): 541-548. DOI: 10.1016/j.biotechadv.2014.02.001. |
| [31] | Zhou J, Zhang H, Zhang Y, Li Y, Ma Y. Designing and creating a modularized synthetic pathway in cyanobacteriumSynechocystis enables production of acetone from carbon dioxide. Metabolic Engineering, 2012, 14(4): 394-400. DOI: 10.1016/j.ymben.2012.03.005. |
| [32] | Wang B, Pugh S, Nielsen DR, Zhang W, Meldrum DR. Engineering cyanobacteria for photosynthetic production of 3-hydroxybutyrate directly from CO2. Metabolic Engineering, 2013, 16: 68-77. DOI: 10.1016/j.ymben.2013.01.001. |
| [33] | Presidential Commission for the Study of Bioethical Issues. NEW DIRECTIONS: The Ethics of Synthetic Biology and Emerging Technologies. Washington DC, 2010. |
 2014, Vol. 4
2014, Vol. 4
