| 苯甲羟肟酸铅金属有机配合物在氧化矿浮选中的作用机理及其应用 |
在矿物浮选领域中,金属离子活化作用机理成为近年来研究的一个热点[1]。铅离子是氧化矿浮选中最常用的活化剂[2-6]。例如,在白钨矿[4-6]和锡石[7-9]浮选体系中,溶液中铅离子及羟基配合物吸附在矿物表面上,为矿浆中捕收剂(油酸、苯甲羟肟酸(BHA)等)在矿物表面吸附提供活性位点,从而实现对目的矿物的捕收[9]。事实上,金属离子在溶液是以水合金属离子形式存在,金属离子在矿物表面的吸附会导致矿物表面水化层结构的变化,从而影响捕收剂的吸附;另一方面,溶液体系中水合金属离子与捕收剂会不可避免地会发生作用,形成一定的配合物,这些配合物在浮选过程中的作用往往被忽略。因此,经典的活化浮选理论是一个简化的吸附模型,对金属离子及捕收剂的吸附过程的解释并不完善,有待进一步拓展。
20世纪60年代,M.C. Fuerstenau[10]指出:在脂肪酸浮选石英过程中,金属离子对石英具有较强的活化作用,但是真正起捕收作用的成分极有可能是Ca(OH)(RCOO)(aq)配合物。那么可以推测在金属离子活化浮选过程中,金属离子与捕收剂形成的配合物也可能是起捕收作用的重要组分。因此,通过金属离子配位调控分子组装设计新型捕收剂具有很大的可行性。目前在高分子材料领域,金属离子配位调控分子组装已得到广泛应用,并取得一系列的进展[11-14]。基于金属离子配位调控分子组装的理念,中南大学首次将Pb-BHA金属有机配合物作为一种新型捕收剂应用于湖南柿竹园黑钨矿和白钨矿混合浮选。试验结果表明[15-18]:相对于在矿浆中顺序加入硝酸铅活化剂和BHA捕收剂,在相同药剂用量的条件下,Pb-BHA金属有机配合物在白钨矿(锡石)与方解石浮选分离中具有更强的捕收能力和选择性。
本文基于溶液化学[19-21]对Pb-BHA金属有机配合物的结构进行计算推导,综合考虑溶液体系和固液界面的水化层结构,提出金属离子活化浮选过程中金属离子配位调控分子组装模型,对经典的金属离子活化浮选理论进行补充或扩展。
1 试验 1.1 试验样品及试剂试验所用白钨矿和锡石单矿物均取自湖南柿竹园有色金属有限责任公司,单矿物块状矿样经破碎、人工挑拣、陶瓷球磨机磨矿,取-74 μm粒级供试验使用。其矿物纯度经X射线衍射分析均在97%以上,符合单矿物试验纯度要求。
试验所用硝酸铅、BHA、氢氧化钠和盐酸为分析纯。pH值由NaOH和HCl溶液调节。Pb-BHA金属有机配合物由硝酸铅和BHA混合制备,硝酸铅和BHA两种药剂添加顺序没有要求。所有试验用水均为去离子水。
1.2 单矿物浮选试验方法单矿物浮选试验在吉林探矿XFG挂槽式浮选机中进行,浮选机叶轮转速1 600 r/min,浮选槽容积40 mL,矿浆温度为25 ℃。每次称取2 g矿样放入浮选槽中,加入适量去离子水,搅拌2 min,此后按照要求依次加入相应的药剂,并搅拌一定的时间,浮选6 min。浮选药剂的添加分为两种方式:(1)硝酸铅和BHA依次加入矿浆中,搅拌时间分别为3 min和5 min; (2)相同用量的硝酸铅和BHA混合形成Pb-BHA金属有机配合物作为一种新型捕收剂加入矿浆中,搅拌时间为5 min。浮选前用PHS-3C精密pH计测量并记录pH值。试验后将所得泡沫产品和槽底产品烘干、称重,计算实际回收率。2结果与讨论
2.1 Pb2+和BHA的溶液化学研究Pb2+在水溶液发生水解反应,生成各种羟基配合物,矿浆pH决定了金属离子各水解组分的含量,溶液中铅离子各羟基配合物和Pb2+之间的关系如式(1)~式(3)所示,β1,β2和β3是累积平衡常数[22]。铅离子及其各羟基配合物在溶液中分布如式(4)~式(7)所示。
图 1(a)为铅离子在溶液中的组分分布(未考虑其水合作用)。事实上,铅离子组分在溶液中通常以水合结构存在[23, 24],在pH为6~8范围内,铅主要以Pb(H2O)62+形式存在;在pH为8~10范围内,铅主要以Pb(OH)(H2O)5+形式存在。
| $ \begin{array}{l} {\rm{Pb}}_{{\rm{(aq)}}}^{2 + }{\rm{ + OH}}_{{\rm{(aq)}}}^ - \leftrightarrow {\rm{Pb}}\left( {{\rm{OH}}} \right)_{{\rm{(aq)}}}^ + \\ {\beta _1} = \frac{{{c_{{\rm{Pb}}\left( {{\rm{OH}}} \right)_{{\rm{(aq)}}}^ + }}}}{{{c_{Pb_{{\rm{(aq)}}}^{2 + }}} + {c_{OH_{{\rm{(aq)}}}^ - }}}} = {10^{6.3}} \end{array} $ | (1) |
| $ \begin{array}{l} {\rm{Pb}}_{{\rm{(aq)}}}^{{\rm{2 + }}}{\rm{ + 2OH}}_{{\rm{(aq)}}}^{\rm{ - }} \leftrightarrow {\rm{Pb}}{\left( {{\rm{OH}}} \right)_{{\rm{2(aq)}}}}\\ {\beta _2} = \frac{{{c_{{\rm{Pb}}{{\left( {{\rm{OH}}} \right)}_{{\rm{2(aq)}}}}}}}}{{{c_{{\rm{Pb}}_{{\rm{(aq)}}}^{{\rm{2 + }}}}} + c_{_{OH_{{\rm{(aq)}}}^{\rm{ - }}}}^2}} = {10^{10.9}} \end{array} $ | (2) |
| $ \begin{array}{l} {\rm{Pb}}_{{\rm{(aq)}}}^{{\rm{2 + }}}{\rm{ + 3OH}}_{{\rm{(aq)}}}^{\rm{ - }} \leftrightarrow {\rm{Pb}}\left( {{\rm{OH}}} \right)_{{\rm{3(aq)}}}^{\rm{ - }}\\ {\beta _3} = \frac{{{c_{{\rm{Pb}}\left( {{\rm{OH}}} \right)_{{\rm{3(aq)}}}^{\rm{ - }}}}}}{{{c_{Pb_{{\rm{(aq)}}}^{{\rm{2 + }}}}} + c_{OH_{{\rm{(aq)}}}^{\rm{ - }}}^3}} = {10^{13.9}} \end{array} $ | (3) |
| $ {\phi _{{\rm{[Pb}}_{{\rm{(aq)}}}^{{\rm{2 + }}}]}} = \frac{1}{{1 + {\beta _1}\left[{{\rm{OH}}} \right] + {\beta _2}{{\left[{{\rm{OH}}} \right]}^2} + {\beta _3}{{\left[{{\rm{OH}}} \right]}^3}}} $ | (4) |
| $ {\phi _{{\rm{[Pb}}\left( {{\rm{OH}}} \right)_{{\rm{(aq)}}}^{\rm{ + }}{\rm{)]}}}} = \frac{1}{{1 + {\beta _1}\left[{{\rm{OH}}} \right] + {\beta _2}{{\left[{{\rm{OH}}} \right]}^2} + {\beta _3}{{\left[{{\rm{OH}}} \right]}^3}}} $ | (5) |
| $ {\phi _{{\rm{[Pb}}\left( {{\rm{OH}}} \right){\rm{2(aq)]}}}} = \frac{1}{{1 + {\beta _1}\left[{{\rm{OH}}} \right] + {\beta _2}{{\left[{{\rm{OH}}} \right]}^2} + {\beta _3}{{\left[{{\rm{OH}}} \right]}^3}}} $ | (6) |
| $ {\phi _{{\rm{[Pb}}\left( {{\rm{OH}}} \right)_{{\rm{3(aq)}}}^-{\rm{]}}}} = \frac{1}{{1 + {\beta _1}\left[{{\rm{OH}}} \right] + {\beta _2}{{\left[{{\rm{OH}}} \right]}^2} + {\beta _3}{{\left[{{\rm{OH}}} \right]}^3}}} $ | (7) |
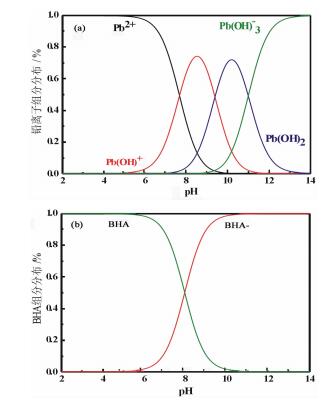 |
| 图 1 铅离子(a)和BHA(b)在溶液中的形态分布 Fig.1 The distribution of lead and BHA species in aqueous solution |
BHA为弱酸, 在水溶液中存在解离平衡, 在水溶液中, 未解离的分子(BHA)与解离的离子(BHA-)间的比例, 取决于溶液的pH值。BHA解离平衡常数pKα为8.1, 在水溶液中各组分关系如式(8)所示(式中,HB代表BHA,B-代表BHA-)。未解离的分子(BHA)与解离的离子(BHA-)在溶液中分布如式(9~10)所示。
溶液中BHA形态分布如图 1(b)所示,在pH为6~8范围内,BHA主要以未解离的分子(BHA)形式存在; 在pH为8~10范围内,BHA主要以解离的离子(BHA-)形式存在。
| $ \left[{{\rm{HB}}} \right] \leftrightarrow {\rm{[}}{{\rm{H}}^{\rm{ + }}}\left] {\rm{ + }} \right[{{\rm{B}}^{\rm{-}}}{\rm{]}}{K_{\rm{ \mathsf{ α} }}} = \frac{{{\rm{[}}{{\rm{H}}^{\rm{ + }}}{\rm{][}}{{\rm{B}}^{\rm{-}}}{\rm{]}}}}{{\left[{{\rm{HB}}} \right]}} = {10^{ - 8.1}} $ | (8) |
| $ {\phi _{{\rm{[}}{{\rm{B}}^{\rm{-}}}{\rm{]}}}} = \frac{1}{{1 + [1/{K_{\rm{ \mathsf{ α} }}}][{{\rm{H}}^ + }]}} $ | (9) |
| $ {\phi _{{\rm{[HB]}}}} = \frac{{[1/{K_{\rm{ \mathsf{ α} }}}][{{\rm{H}}^ + }]}}{{1 + {\rm{[}}1/{K_{\rm{ \mathsf{ α} }}}]{\rm{[}}{{\rm{H}}^ + }]}} $ | (10) |
根据上述Pb2+和BHA溶液化学计算结果,可以推断出Pb-BHA金属有机配合物在不同pH值下的主要活性组分。田孟杰等[7, 16]通过电化学方法和紫外分光光度法对Pb-BHA金属有机配合物的的溶液化学结构进行了研究,认为:在pH为6~8范围内,未解离的分子(BHA)与Pb2+相互作用形成主要活性物质(Pb-BHA)2+;在pH为8~10范围内,解离的离子(BHA-)与Pb(OH)+相互作用形成主要活性物质HO-Pb-BHA。因此,Pb2+-OHm-(m=0, 1)、-BHAn(n=1, 2)、-BHA2-n-很可能会在Pb2+和BHA溶液反应中生成,并在浮选过程中发挥一定的作用。但是,由于苯环的空间位阻效应,Pb2+-OHm-(m=0, 1)、-BHAx-BHAy-(x+y≥3)难以在溶液中稳定存在。
红外光谱和量子化学计算结果表明,BHA能与金属离子形成五元环的配合物[25-28]。BHA存在两种形式,氧肟酸和羟肟酸,前者比后者总能量更低、稳定性更高。所以,Pb-BHA配合物中主要活性物质结构简式可以推断出如图 2所示(不考虑金属有机配合物之间的缔合)。
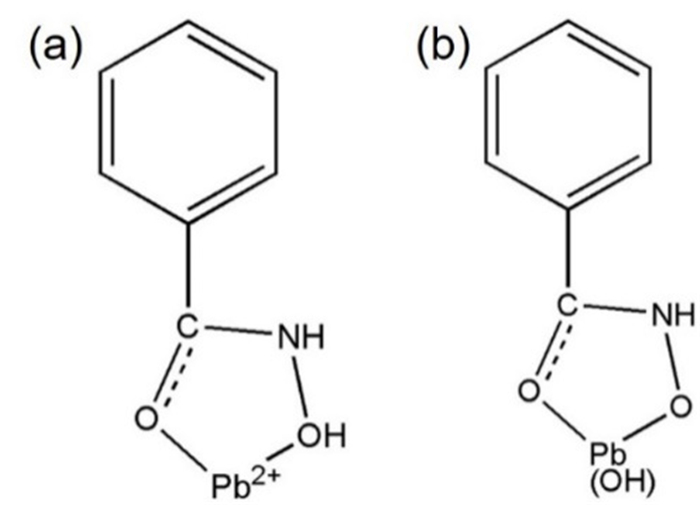 |
| 图 2 在pH为6~8(a)和8~10(b)条件下Pb-BHA配合物在溶液中主要的活性成分结构简式(不考虑配合物间的缔合) Fig.2 The molecular structures of Pb-BHA complexes in aqueous solution without the consideration of the assembly of different complexes |
2.2 金属有机配合物对白钨矿和锡石浮选行为的影响
基于上述溶液化学计算分析,通过浮选试验对上述假设进行进一步验证。图 3(a)是白钨矿和锡石回收率与浮选pH值关系图。由图 3(a)可知,在不添加硝酸铅活化剂的条件下,白钨矿回收率在pH为9时达到最大8.41%,锡石回收率在pH为7时达到最大35.37%,表明BHA对白钨矿和锡石的捕收能力较弱。当硝酸铅活化剂和BHA捕收剂顺序加入矿浆时,白钨矿和锡石浮选回收率先随着pH值增加而逐渐增加,然后逐渐下降。白钨矿回收率在pH为9时达到最大值72.3%,锡石回收率在pH为8~9范围内达到最大(约为78%),表明铅离子对氧化矿物浮选具有明显活化作用。当Pb-BHA金属有机配合物作为一种新型捕收剂加入到矿浆中,白钨矿回收率在pH为9时达到最大85.9%,锡石回收率在pH为9时达到最大87.7%。由图 3(a)可知,在相同浮选药剂用量的条件下,添加Pb-BHA配合物药剂时,白钨矿和锡石回收率明显高于顺序加药。这说明BHA体系中铅离子的活化作用并非单纯的是铅离子吸附在矿物表面上作为活性质点,铅离子与BHA反应生成的Pb-BHA配合物在浮选过程中可能发挥了重要作用。
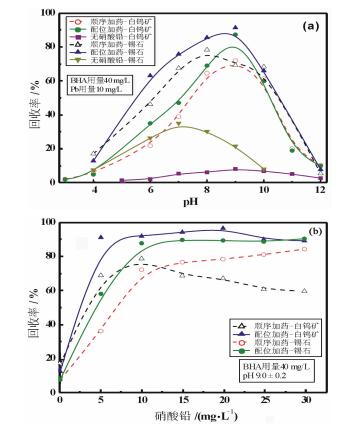 |
| 图 3 矿物回收率与pH(a)和硝酸铅用量(b)关系图 Fig.3 The effect of pH and Pb/BHA ration on the flotation behavior of scheelite and cassiterite |
图 3(b)是白钨矿和锡石回收率与硝酸铅用量(硝酸铅与BHA配比)关系图。当硝酸铅活化剂和BHA捕收剂顺序加入矿浆时,白钨矿浮选回收率先随着硝酸铅用量增加而逐渐增加后趋于稳定,在硝酸铅用量范围为20~30 mg/L时,白钨矿回收率达到稳定,约为80%;锡石浮选回收率先随着硝酸铅用量增加而逐渐增加后逐渐降低,在硝酸铅用量为10 mg/L时,锡石回收率达到最大78.8%。当Pb-BHA配合物作为一种新型捕收剂加入到矿浆中,白钨矿回收率先随着硝酸铅用量增加而逐渐增加后趋于稳定,在硝酸铅用量范围为20~30 mg/L时,白钨矿回收率达到稳定,约为90%;锡石回收率先随着硝酸铅用量增加而逐渐增加,后趋于稳定,当硝酸铅用量范围为10~30 mg/L时,锡石回收率达到90%。由图 3可知,在相同浮选药剂用量的条件下,配位加药时白钨矿和锡石回收率明显高于顺序加药,并且前者白钨矿浮选回收率随着铅离子用量变化波动不大。
2.3 Pb-BHA配合物在矿物表面吸附模型传统的金属离子活化浮选模型没有考虑金属离子在溶液中的水化作用。事实上,Pb2+应该以Pb(H2O)62+形式存在,考虑到金属离子水化作用的经典金属离子活化浮选模型如图 4所示。
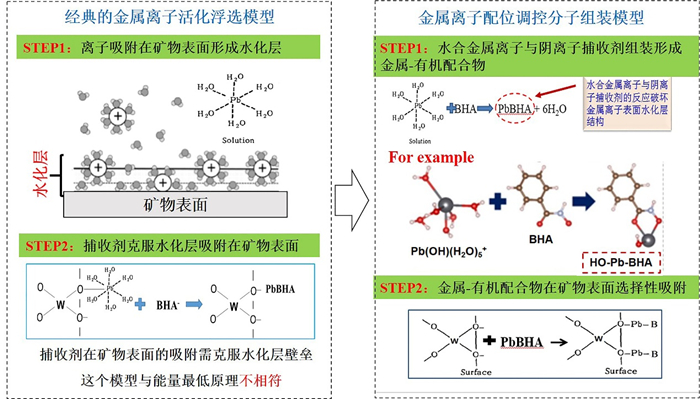 |
| 图 4 经典的金属离子活化浮选模型和金属离子配位调控分子组装模型 Fig.4 The models of classical metal ion activation mechanism and molecular assembly using metal ions |
在该模型中,Pb(H2O)62+或PbOH(H2O)5+优先吸附在矿物表面上,解离的苯甲羟肟酸离子(BHA-)克服铅离子组分的水化层,并与矿物表面铅质点作用。然而,Pb2+离子水化层在一定程度上阻碍了苯甲羟肟酸捕收剂的吸附,降低了苯甲羟肟酸捕收剂在矿物表面上的吸附效率。在金属离子配位调控分子组装模型中,Pb(H2O)62+或PbOH(H2O)5+在溶液中首先与苯甲羟肟酸离子(BHA-)反应生成Pb-BHA配合物,破坏了水合铅离子组分的水化层结构,有利于捕收剂在矿物表面的吸附。金属离子配位调控分子组装模型为新型捕收剂的设计、开发提供了新的思路。与传统阴离子捕收剂相比,金属有机配合物捕收剂以金属基为主要官能团,在捕收性能和选择性等方面具备一定的优势。
2.4 基于金属有机配合物的钨锡混合浮选新工艺柿竹园钨矿是世界最大钨矿之一,但是矿石钨品位低、矿物成分及组成复杂、分选难度大、资源综合利用困难,是典型的复杂低品位钨钼多金属黑白钨伴生资源,柿竹园资源及其选矿工艺是目前我国钨矿山的典型代表[29, 30]。经过多年开发,原Ⅲ矿带富矿段资源利用已经接近尾声,占大部分资源储量的低品位矿石成为以后开发的主体。该部分矿石具有更加复杂的赋存特征,例如:钨、钼、铋品位降低,含钙脉石矿物含量越来越高,矿物组成更加复杂,共生关系复杂、嵌布粒度更细等。该矿体选别难度进一步加大,资源综合利用更加困难,这对钨的选矿工艺提出了更高的要求[31]。苯甲羟肟酸铅配合物对黑钨矿、白钨矿和锡石的选择性捕收能力为选钨新工艺的开发提供了新的契机。图 5为基于Pb-BHA金属有机配合物的柿竹园黑白钨混合浮选新工艺200 t/d工业试验流程(2014年),试验结果见图 6。。
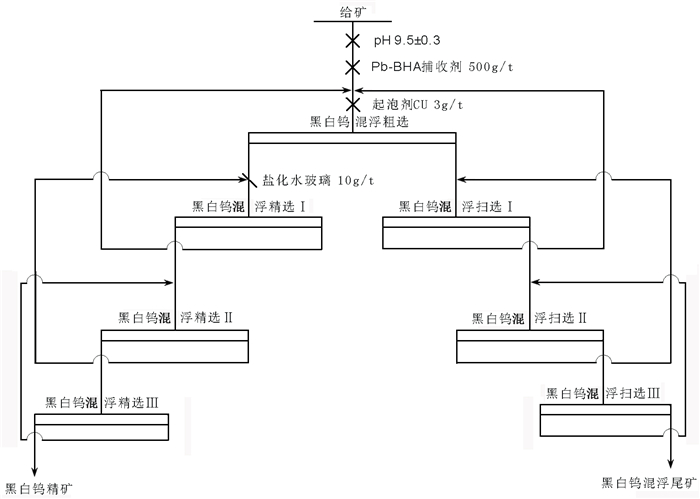 |
| 图 5 黑白钨混合浮选新工艺工业试验流程 Fig.5 Flotation flowsheet of pilot scale test of tungsten ore flotation |
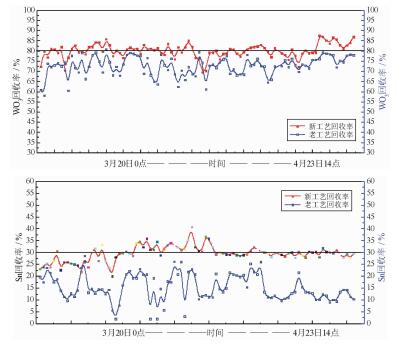 |
| 图 6 黑白钨混合浮选新工艺WO3、Sn回收率曲线 Fig.6 The recovery of WO3 and Sn in the pilot scale test of tungsten mineral flotation |
200 t/d工业试验采用生产现场分流,工艺流程配置参考“GY”法现场生产工艺粗选作业,两个系列进行平行对比。工业试验结果表明:相较于“GY”法现场生产工艺,该流程特点为硝酸铅与苯甲羟肟酸混合使用、无水玻璃、无脂肪酸,钨精矿WO3品位大幅提高,回收率平均提高10%以上,锡石富集于钨精矿中,锡石回收率高达30%,黑白钨混合浮选新工艺在提高WO3及Sn回收率方面体现了很大的优势。目前,基于金属有机配合物捕收剂的浮选新工艺在柿竹园多金属选厂和东波多金属选厂进行工业化推广应用,钨综合回收率整体提高8%以上[15, 18]。在生产实践中证明了金属有机配合物捕收剂对白钨矿、黑钨矿和锡石表现出很强的选择性捕收能力。
3 结论浮选试验结果表明,Pb-BHA金属有机捕收剂相比于传统活化浮选体系下的顺序加药表现出对钨矿物、锡石更强的捕收能力。溶液化学计算分析发现,在pH为6~8范围内,(Pb-BHA)2+是Pb-BHA金属有机捕收剂在溶液中的主要活性物质;在pH为8~10范围内,解离的离子(BHA-)与Pb(OH)+相互作用形成主要活性物质HO-Pb-BHA(不考虑配合物之间的缔合)。基于这一认识,本文首次提出了浮选过程中金属离子配位调控分子组装模型。经典金属离子活化浮选模型充分考虑到Pb2+离子水化层结构和溶液体系苯甲羟肟酸离子(BHA-)与Pb2+离子相互作用;而在金属离子配位调控分子组装模型中,Pb(H2O)62+或PbOH(H2O)5+在溶液中首先与苯甲羟肟酸离子(BHA-)反应破坏了Pb2+离子水化层结构,生成Pb-BHA配合物,进而提高了苯甲羟肟酸捕收剂在矿物表面的吸附效率。相比于传统阴离子捕收剂,金属有机配合物捕收剂以金属基为主要官能团,在捕收性能和选择性等方面体现出一定的优势。金属离子配位调控分子组装模型为新型捕收剂的设计、开发提供了新的思路。
| [1] |
高跃升, 高志勇, 孙伟. 金属离子对矿物浮选行为的影响及机理研究进展[J]. 中国有色金属学报, 2017, 27(4): 859-868. |
| [2] |
贺智明, 董雍赓, 孙笈. 铅离子对水杨氧肟酸浮选金红石的活化作用研究[J]. 有色金属工程, 1994(4): 43-48. |
| [3] |
高玉德, 钟传刚, 邱显扬, 等. 苯甲羟肟酸浮选黑钨矿体系中铅离子的活化作用机理[J]. 中国有色金属学报, 2016, 26(9): 1999-2006. |
| [4] |
王纪镇, 印万忠, 李振, 等. 铁离子和铅离子对白钨矿与石英浮选的影响及机理研究[J]. 矿产保护与利用, 2017(2): 35-38. |
| [5] |
张烨, 韩海生, 孙伟, 等. 基于新型配位捕收剂的黑白钨常温精选新工艺[J]. 中国钨业, 2016, 31(3): 19-26. |
| [6] |
卫召, 韩海生, 胡岳华, 等. Pb-BHA配位捕收剂的黑白钨混合常温浮选研究[J]. 有色金属工程, 2017, 7(6): 70-75. |
| [7] |
Tian M, Hu Y, Sun W, et al. Study on the mechanism and application of a novel collector-complexes in cassiterite flotation[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 2017, 522: 635-641. |
| [8] |
宫贵臣, 刘杰, 韩跃新. 金属离子对微细粒锡石浮选行为的影响[J]. 矿产综合利用, 2016(4): 43-47. |
| [9] |
张周位. 锡石浮选体系中金属离子作用机理及其应用[D]. 长沙: 中南大学, 2013.
|
| [10] |
Miller J D, Pray R E. Metal ion activation in xanthate flotation of quartz[J]. Trans. Am. Inst. Min. Eng, 1965(235): 359-365. |
| [11] |
王子川, 刘东涛, 崔冬梅. 稀土金属有机配合物催化共轭双烯烃高选择性聚合[J]. 高分子学报, 2015(9): 989-1009. DOI:10.11777/j.issn1000-3304.2015.15056 |
| [12] |
杨丽. 金属有机配合物及高聚物发光材料的理论研究[D]. 长春: 吉林大学, 2006.
|
| [13] |
于俊婷. D-A型环金属铂/铱配合物近红外发光材料合成及性能研究[D]. 湘潭: 湘潭大学, 2014.
|
| [14] |
王强. 蛋氨酸类希夫碱配合物的合成、表征与生物活性研究[D]. 青岛: 中国海洋大学, 2011.
|
| [15] |
Han H S, Liu W L, Hu Y H, et al. A novel flotation scheme:selective flotation of tungsten minerals from calcium minerals using Pb-BHA complexes in Shizhuyuan[J]. Rare Metal, 2017, 36(6): 1-8. |
| [16] |
Yue T, Han H, Hu Y, et al. New Insights into the Role of Pb-BHA Complexes in the Flotation of Tungsten Minerals[J]. JOM, 2017, 69(11): 2345-2351. DOI:10.1007/s11837-017-2531-3 |
| [17] |
Han H, Hu Y, Sun W, et al. Novel catalysis mechanisms of benzohydroxamic acid adsorption by lead ions and changes in the surface of scheelite particles[J]. Minerals Engineering, 2018, 119: 11-22. DOI:10.1016/j.mineng.2018.01.005 |
| [18] |
Han H, Hu Y, Sun W, et al. Fatty acid flotation versus BHA flotation of tungsten minerals and their performance in flotation practice[J]. International Journal of Mineral Processing, 2017, 159: 22-29. DOI:10.1016/j.minpro.2016.12.006 |
| [19] |
孙伟, 唐鸿鹄, 陈臣. 萤石-白钨矿浮选分离体系中硅酸钠的溶液化学行为[J]. 中国有色金属学报, 2013(8): 2274-2283. |
| [20] |
孙伟, 陈臣, 唐鸿鹄. 碳酸根对方解石浮选速率的影响及机理研究[J]. 中国矿业大学学报, 2012, 41(1): 48-51. |
| [21] |
王建军, 高志勇, 孙伟, 等. 白钨矿常温浮选基础研究[J]. 金属矿山, 2016, 45(2): 66-71. |
| [22] |
王淀佐, 胡岳华. 浮选溶液化学[M]. 长沙: 湖南科学技术出版社, 1988.
|
| [23] |
Wander M C F, Clark A E. Hydration properties of aqueous Pb(Ⅱ) ion[J]. Inorganic Chemistry, 2008, 47(18): 8233. DOI:10.1021/ic800750g |
| [24] |
Bhattacharjee A, Hofer T S, Pribil A B, et al. Revisiting the hydration of Pb(Ⅱ):a QMCF MD approach[J]. Journal of Physical Chemistry B, 2009, 113(39): 13007-13013. DOI:10.1021/jp905848x |
| [25] |
Zhao G, Wang S, Zhong H. Study on the activation of scheelite and wolframite by lead nitrate[J]. Minerals, 2015, 5(2): 247-258. |
| [26] |
Deng L, Zhao G, Zhong H, et al. Investigation on the selectivity of N -((hydroxyamino)-alkyl) alkylamide surfactants for scheelite/calcite flotation separation[J]. Journal of Industrial & Engineering Chemistry, 2016, 33: 131-141. |
| [27] |
Farkas E, Bátka D, Csapó E, et al. Synthesis and characterization of Cu2+, Ni2+ and Zn2+ binding capability of some amino-and imidazole hydroxamic acids:Effects of substitution of side chain amino-N for imidazole-N or hydroxamic-N-H for -N-CH3 on metal complexation[J]. Polyhedron, 2007, 26(3): 543-554. DOI:10.1016/j.poly.2006.08.019 |
| [28] |
Qiu X Y, Cheng D M, Wang D Z. Reaction mechanism between benzoylhydroxamic acid and scheelite[J]. Mining & Metallurgical Engineering, 2001, 21: 39-42. |
| [29] |
毛景文. 超大型钨多金属矿床成矿特殊性——以湖南柿竹园矿床为例[J]. 地质科学, 1997(3): 351-363. |
| [30] |
於崇文, 岑况, 龚庆杰, 等. 湖南郴州柿竹园超大型钨-多金属矿床的成矿复杂性研究[J]. 地学前缘, 2003, 10(3): 15-39. |
| [31] |
宋振国, 孙传尧, 王中明, 等. 中国钨矿选矿工艺现状及展望[J]. 矿冶, 2011, 20(1): 1-7. |
 2018
2018 


