| 碳化法去除硫酸锰浸出液中钴、镍的研究 |
2. 贵州省冶金工程与过程节能重点实验室,贵州 贵阳 550025;
3. 贵州省电池用锰材料工程技术研究中心,贵州 铜仁 554300
2. Guizhou Provincial Key Laboratory of Metallurgical Engineering and Energy Saving, Guiyang 550025, China;
3. Research Technology Center of Manganese Materials for Battery of Guizhou Province, Tongren 554300, China
硫酸锰为锰系锂电池正极中最基础、最重要的锰源材料[1]。若硫酸锰材料中钴、镍重金属杂质的含量过高,将直接降低电池的比容量以及充放电次数等关键性能[2],因此在获取高纯硫酸锰溶液时,除杂是其中的重要工艺。
基于我国锰矿贫矿多、富矿多,矿石中的杂质含量高等特点,在净化硫酸锰溶液时普遍存在钴、镍等重金属杂质含量过高、除杂工艺复杂、溶液很难达标等问题。目前除Co、Ni的方法主要有共沉淀法、物理吸附法、硫化物沉淀法等[3, 4],共沉淀法是利用Fe(OH)3或Al(OH)3胶体的吸附性能实现对Co、Ni的去除,但此方法在生产过程中存在,Fe、Al离子超标的风险;物理吸附法利用活性炭吸附能力虽强,但存在价格高、用量大等问题,因此只能用作辅助手段除杂[5];硫化物沉淀法[6]可以利用溶度积的差异实现Ni、Co等重金属与Mn的分离,但此方法存在投量大、废渣产率大、锰损失高等缺点,且会引入S杂质及产生H2S等有毒气体。因此,需寻求一种简单、经济、高效的方法去除硫酸锰体系中钴、镍的方法。
本文以纯度为99.995%的CO2为碳化剂,采用碳化沉锰,反溶净化溶液的方法去除钴、镍杂质,此方法较传统的共沉淀法、物理吸附法、硫化物沉淀法等相比,不会引入新的杂质,除杂更彻底,且安全无污染。
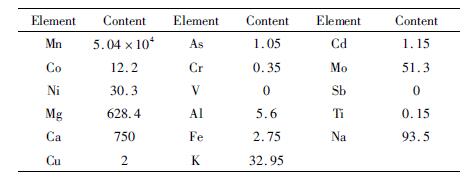
1 实验 1.1 实验原料实验原料为贵州铜仁某电解锰企业经初级净化除杂后的硫酸锰溶液,利用ICP-MS测定溶液成分,结果见表 1。
|
表 1 样品元素分析结果 |
|
表 1结果表明,溶液主要成分为硫酸锰,其中Co、Ni等重金属含量较高,分别为12.2 mg/L、30.3 mg/L。
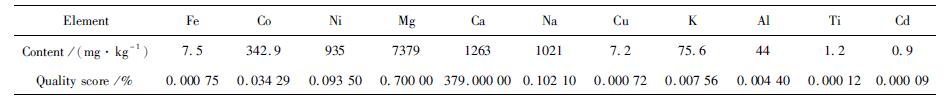
粗除杂后的硫酸锰结晶产品,经ICP分析结果如表 2所示。
| 表 2 硫酸锰结晶杂质ICP成分分析 Table 2 ICP analysis of manganese sulfate crystal impurity |
|
由表 2结果表明,此硫酸锰溶液在一次结晶之后的产品中,Co、Ni、Ca、Mg、Na含量较高,分别为342.9 mg/kg、935 mg/kg、1 263 mg/kg、7 379 mg/kg、1 021 mg/kg,其中Co、Ni含量分别为0.034 2%和0.093 5%。
1.2 实验原理碳化过程中Mn2+、Co2+、Ni2+存在的行为:
| $ {\rm M{n^{2 + }} + C{O_3}^{2 - } = MnC{O_3} \downarrow } $ | (1) |
| $ {\rm C{o^{2 + }} + C{O_3}^{2 - } = CoC{O_3}} $ | (2) |
| $ {\rm N{i^{2 + }} + C{O_3}^{2 - } = NiC{O_3}} $ | (3) |
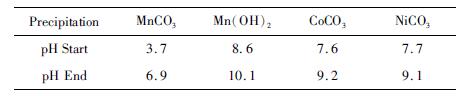
MnCO3、CoCO3、NiCO3在硫酸锰溶液中25 ℃时的理论沉淀pH如表 3所示[7-8]。
| 表 3 25 ℃理论沉淀pH Table 3 Theoretical precipitate pH at 35 ℃ |
|
由式(1)、(2)、(3)可知,在碳化反应的过程中,Mn2+、CO2+、Ni2+会生成MnCO3、CoCO3、NiCO3。经查阅文献[9]可知,CoCO3、NiCO3在酸性条件下具有较好的可溶解性。由表 3可知,开始生成碳酸钴和碳酸镍沉淀是的pH在7.6以上,而碳酸锰在pH为6.9时就会完全沉淀。因此在碳化沉锰的过程中,通过合理控制pH,使CoCO3、NiCO3继续留在溶液中,仅使碳酸锰从原溶液中沉淀出来,再将沉淀产品进行反溶,从而达到除杂的目的。
1.3 实验方法CO2碳化实验装置主要包括CO2气瓶、恒温水浴锅、释放器、温度计和pH计。实验过程:取定量的样品注入反应器中,打开高纯CO2气瓶阀门,向其中通入一定流量的CO2气体,由于气流具有搅拌的作用,故只通过恒温水浴锅控制温度。同时为控制pH保持恒定,向反应器中缓慢滴加pH调节剂A。搅拌反应一段时间后,停止加入调节剂A并停止通入CO2,随后继续搅拌一段时间。反应后的溶液经过滤和多次洗涤后,将获得的碳酸锰沉淀用硫酸返溶得到硫酸锰溶液。实验装置如图 1所示。
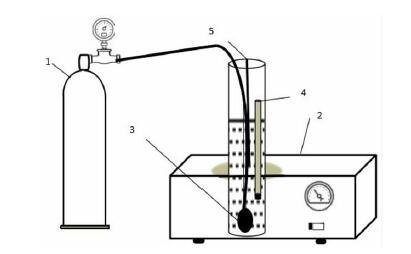 |
| 图 1 CO2碳化硫酸锰溶液实验装置:1—CO2 gas cylinder;2—Constant temperature water bath;3—Gas release part;4—thermometer;5—pH meter Fig.1 Experimental device of CO2 carbonized manganese sulfate solution |
1.4 分析方法
本次实验的实验原料和产物中Mn、Co、Ni的含量均采用ICP -MS质谱仪进行测定,ICP -MS质谱仪可以针对无机元素进行定性分析、无机元素定量、半定量分析并具有智能摄谱功能,能较好地实现对实验原料和产物中Mn、Co、Ni含量的测定;碳化产物的物相组成采用XRD分析。
检测仪器如表 4所示。
| 表 4 检测仪器 Table 4 Testing equipment |

|
2 结果和讨论 2.1 CO2流量的影响
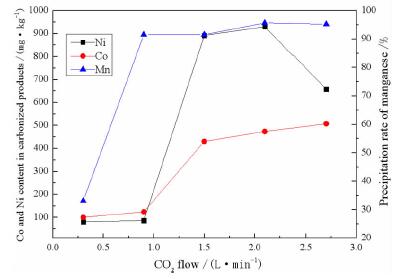
常温下取锰含量为50 g/L的硫酸锰溶液1 L,控制反应温度35 ℃,反应时间35 min,pH=7.0不变,研究CO2流量对MnSO4中钴、镍净化效果及锰沉淀率的影响如图 2所示。
 |
| 图 2 CO2流量对去除效果及锰沉淀率的影响 Fig.2 Effect of CO2 flow rate on the removal effect and the manganese precipitation rate |
由图 3可知,随着二氧化碳流量的增加,锰的沉淀率一直升高,CO2流量为2.7 L/min时锰的沉淀率达到最高为95.21%。碳化产物中钴、镍杂质的含量随着二氧化碳流量的增加而增加,在CO2流量为0.9 L/min之后钴含量迅速增加,镍含量也增加较快,继续增加CO2流量,杂质含量会增多。综合锰的沉淀率和碳化产物中钴、镍杂质的含量考虑,取最适宜的CO2流量为0.9 L/min。
 |
| 图 3 pH对去除效果及锰沉淀率的影响 Fig.3 Effect of pH on the removal effect and the precipitation rate of manganese |
热力学角度分析可知,增加二氧化碳流量,溶液中碳酸根离子浓度高,则溶液中碳酸根离子的过饱和度越高,愈有利于碳化反应晶核的生成[10],随着CO2流量的增加,碳酸根的浓度增高,碳酸锰沉淀过快,将Co、Ni离子包裹进沉淀中,使沉淀中的Co、Ni杂质含量升高。
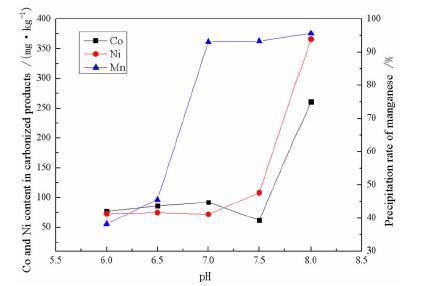
2.2 pH值的影响常温下取锰含量为50 g/L的硫酸锰溶液1 L,控制反应温度25 ℃,反应时间35 min,CO2流量0.9 L/min不变,研究pH值对MnSO4中钴、镍净化效果及锰沉淀率的影响如图 3所示。
由图 3可知,随着pH值的不断提升,锰的沉淀率先迅速升高,在pH达到6.9时,锰的沉淀率趋于平缓。碳化产物中钴、镍杂质的含量在pH6~7.5之间变化平缓,在pH达到7.5之后,钴、镍杂质在碳化产物中的含量迅速上升。
由表 3可知,碳酸锰在pH为6.9时达到沉淀平衡,继续增大pH,锰的沉淀率几乎不再变化,因此锰的沉淀率在pH为7左右时才达到最佳值附近。当溶液的pH升高到7.6、7.7时,溶液碱性增强,CoCO3、NiCO3分别开始生成沉淀,随着pH的升高,CoCO3、NiCO3进入沉淀的量增多,因此杂质含量会迅速升高。
综合锰的沉淀率和碳化产物中钴、镍杂质的含量考虑,取最适宜的pH为7.5。
2.3 反应温度的影响常温下取锰含量为50 g/L的硫酸锰溶液1 L,控制反应pH=7.5,反应时间35 min,CO2流量0.9 L/min不变,研究反应温度对MnSO4中钴、镍净化效果及锰沉淀率的影响如图 4所示。
 |
| 图 4 反应温度对净化效果的影响 Fig.4 Effect of the reaction temperature on the purification effect |
由图 4可知,随着反应温度的升高,锰的回收率增加,当温度为45 ℃时,锰的沉淀率最高达到97.79%。钴、镍杂质在碳化产物中的含量呈上升趋势。
从动力学角度分析,随着温度的升高,液体黏度减小,粒子布朗运动加快[11],接触碰撞动能增加,晶体合并凝聚长大的趋势上升[12],MnCO3、CoCO3、NiCO3的沉淀量均会增加,因此锰的沉淀率及沉淀中杂质的含量均会增加。在温度为25 ℃时杂质的含量最低,综合考虑选择最适宜反应温度为25 ℃。
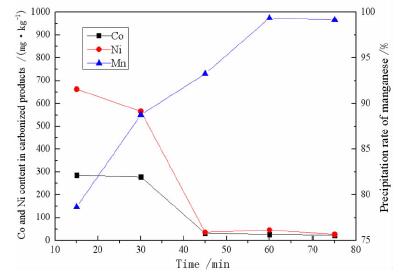
2.4 反应时间的影响常温下取锰含量为50 g/L的硫酸锰溶液1 L,控制反应pH=7.5,反应温度为25 ℃,CO2流量0.9 L/min不变,研究反应时间对MnSO4中钴、镍净化效果及锰沉淀率的影响如图 5所示。
 |
| 图 5 反应时间对去除效果及锰沉淀率的影响 Fig.5 Effect of reaction time on the removal effect and the manganese precipitation rate |
由图 5所知,随着反应时间的增加,锰的沉淀率升高,但在反应时间在60 min之后略微下降。碳化产物中钴、镍杂质的含量随着反应时间的增加呈现先下降的趋势,在45 min之后含量趋于平缓。且60 min时锰的沉淀率最高,故选择60 min为最适宜反应时间。
综合以上实验的最佳条件为应温度25 ℃,溶液pH为7.5,二氧化碳流量0.9 L/min,反应时间60 min,此条件下锰的回收率为99.36%,碳化产物中Co、Ni的含量分别为26 mg/kg和46 mg/kg。
3 碳化产物分析在最适宜工艺条件下获得的碳化产物的XRD图如图 6所示。
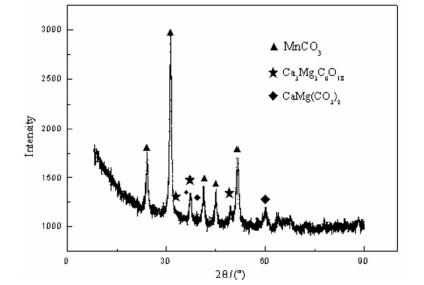 |
| 图 6 碳化产物XRD图 Fig.6 XRD pattern of carbonized products |
如图 6所示,图中MnCO3表现为强峰,说明产物中的Mn主要以MnCO3的形式存在[13],结晶度较好。还存在少量的Ca、Mg等杂质,且杂质主要以碳酸盐和硅酸铁钙的形式存在。
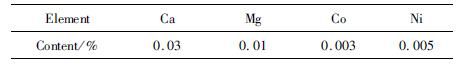
将碳化产物中的Co、Ni、Ca、Mg元素含量经ICP测定结果如表 5所示。
| 表 5 产物元素含量 Table 5 Product element content |
|
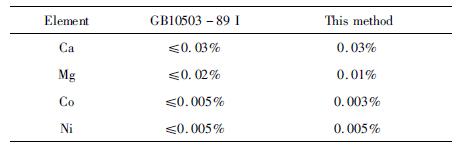
国家高纯碳酸锰GB10503-89I型标准中钴、镍含量的要求如表 6所示。
| 表 6 高纯碳酸锰质量指标 Table 6 High purity manganese carbonate quality index |
|
由表 5、表 6可知,在最适宜的工艺条件下所得的碳化产品中,Co、Ni含量仅为0.003%和0.005%,比硫酸锰一次结晶产物分别降低了0.031 29%和0.088 5%,符合高纯硫酸锰GB10503-89 I型品的标准。
4 结论(1) 实验确定了碳化法去除硫酸锰浸出液中Co、Ni的最适宜工艺条件为:反应温度25 ℃,溶液pH为7.5,二氧化碳流量0.9 L/min,反应时间60 min。
(2) 碳酸锰完全沉淀时的理论pH值为6.9,而Co、Ni杂质在pH大与7.5时会迅速增加,因此合理控制溶液反应的最终pH是此方法的关键。
(3) 在最适宜的工艺条件下获得的产品中主要成分为碳酸锰,其中Co、Ni含量分别为0.003%和0.005%,符合碳酸锰GB10503-89 I型品的标准,后续可将碳酸锰产品反溶成硫酸锰。较共沉淀法、物理吸附法、硫化物沉淀法等比,此方法获得的碳酸锰产品中不会引入新的杂质,除杂更彻底、锰的沉淀率高且安全无污染。
| [1] |
郁先哲, 李能学, 宋金奎, 等. 电解锰工业生产中硫酸锰的净化处理研究[J]. 无机盐工业, 2017, 49(6): 50-52. |
| [2] |
黄学杰. 锂离子电池及相关材料进展[J]. 中国材料进展, 2010, 29(8): 46-52, 36. |
| [3] |
岳林.高磷菱锰矿焙烧特性及焙烧—氨浸工艺研究[D].重庆: 重庆大学, 2016.
|
| [4] |
陈丽鹃, 刘大为, 彭天剑, 等. 硫酸锰溶液净化工艺研究[J]. 企业技术开发, 2012, 31(Z1): 128-129. |
| [5] |
刘京, 武佳, 冯江涛, 等. 硫酸锰制备及净化研究进展[J]. 中国锰业, 2017, 35(5): 114-118. |
| [6] |
陈飞宇, 吴烽. 高纯硫酸锰制备中除重金属新工艺的研究[J]. 中国锰业, 2012, 30(2): 26-28. |
| [7] |
宋玄, 李裕. 碳酸镍的生产方法[J]. 无机盐工业, 2014, 46(1): 55. |
| [8] |
张志华, 赵海涛. 碳酸钠沉淀法合成高纯碱式碳酸镍的热力学分析[J]. 金属材料与冶金工程, 2013, 41(2): 22-25. |
| [9] |
韩笑, 朱继俊, 孟凡兵, 刘玉珠.一种含锰废液制取高纯硫酸锰的方法: CN104445424A[P].2015-03-25.
|
| [10] |
李昌新, 李秋月, 喻源, 钟宏, 王帅. 以高硫锰矿制备电池用硫酸锰的净化除杂工艺研究[J]. 无机盐工业, 2018, 50(7): 27-32. |
| [11] |
ALLEN RW. An improved method of removing dissolved ferric iron from iron-bearing solution: Australian Patent424, 095[P]. 1970-05-15.
|
| [12] |
AHMAD B J, CHENG WH, LOW W M, et al. Study on the removal of iron and manganese in groundwater by granular activated carbon[J]. Desalination, 2005, 182(1): 347-353. |
| [13] |
高昭伟.二氧化锰深度净化硫酸锰溶液中钼的行为及机理研究[D].贵阳: 贵州大学, 2019.
|
 2020
2020



