| 冶金模式微生物Acidithiobacillus ferrooxidans表面质子吸附特性的研究 |
2. 中南大学 生命科学学院,湖南 长沙 410013
2. School of Life Science, Central South University, Changsha 410013, Hunan, China
A. ferrooxidans是一种革兰氏阴性、嗜酸、自养型细菌,能够利用氧作为电子受体,将亚铁氧化为三价铁,或将单质硫/还原性无机硫化合物氧化为硫酸盐而获得生长所需的能量[1]。这种特殊的代谢特征使其成为酸性矿山废水(Acid mine drainage)形成和金属硫化矿生物浸出生产中的关键微生物之一[1],被作为生物冶金模式微生物[2, 3]。A. ferrooxidans细胞表面的酸碱性质在其与金属硫化矿的黏附、对金属硫化矿的氧化以及对酸性矿山废水中重金属离子的吸附方面起着至关重要的作用。
近年来,通过细胞在矿物表面的吸附行为研究对A. ferrooxidans细胞的表面性质有了一定了解[4-6],如Zhu等人研究发现S0、Fe2+或CuFeS2培养的A. ferrooxidans表面疏水性、净电荷及与黄铜矿间的吸附力不同,从而对黄铜矿中铜的浸出效率也不同[5],Li等人研究发现细胞表面的胞外多聚物(EPS)决定着细胞的表面性质,从而决定了A. ferrooxidans细胞在黄铜矿表面的吸附行为[6]。找出不同培养条件及离子强度如何影响A. ferrooxidans细胞的表面特性,将有助于阐明A. ferrooxidans细胞对酸性矿山废水中重金属吸附和迁移的影响,并通过改变细胞表面性质提高A. ferrooxidans对金属硫化矿的浸出效率,然而目前相关研究仍然缺乏。
模拟细菌细胞壁表面的质子模型,对理解细菌表面发生的反应和物质传输有重要作用[8]。目前已有许多针对细菌细胞壁质子化反应的电位滴定研究,但是基于这些电位滴定试验结果的建模方法又不尽相同。例如,Plette[9]等整合了3个位点的Langmuir-freundlich模型和gibbs-donnan shell模型,来模拟Rhodococcus erythropolis A177的酸碱滴定结果。Fein[10]等对Bacillus subtilis进行了电位滴定,并且把细胞壁分为三个独立功能组,然后利用恒定电容模型模拟三组的电位变化,Cox[11]等做了相似的试验,但是用了一种不同的建模方法,即非静电线性编程方法,利用5个独立的结合位点模拟滴定结果。而Martinez[12]等利用Gibbs-donnan shell模型并兼顾一系列均衡分布的pKa值模拟了Bacillus subtilis和Escherichia coli的滴定结果,并且找到了证据支持可以把细菌表面分为四个功能区。尽管已有大量工作研究其它微生物的表面化学特性[9-14],以完善表面络合模型,用于解释和预测微生物在各种条件下的质子/重金属吸附行为,目前还没有研究系统地报道过极端嗜酸菌A. ferrooxidans的表面质子吸附/解吸附规律。细菌表面官能团种类繁多,位点复杂,研究表明细菌表面上最常见的有机酸官能团是羧基、羟基和磷酰基,氨基和巯基的含量较小,整合太少位点的表面络合模型不能很好地进行拟合[15]。Borrok等人将四位点、无静电吸附的表面络合模型作为通用模型对超过35个菌种/细菌群落的225个滴定数据集进行了拟合,之后,Turner和Fein发现尽管四位点的无静电吸附模型可以合理地描述滴定数据,但获得的菌的缓冲值“峰值”比预期要宽[16]。相对于四位点的无静电吸附模型,三位点的固定电容模型比较适合对细菌表面质子化拟合[13, 16]。He等的研究也发现对于嗜酸菌Acidianus manzaensis的表面质子化拟合,三位点的Donnan壳模型适用,两位点模型不能够提供很好的拟合,四位点模型也没有提升拟合度[17]。该研究中即采用三位点模型,使用被很多研究采用的能够优化表面质子化模型的ProtoFit[16]来进行酸碱滴定数据拟合,对A. ferrooxidans进行表面质子化模拟。ProtoFit作为一种质子化模型的工具,它可以用表面离散模型(DLM)、固定电容模型(CCM)、Donnan壳模型(DSM)和无静电吸附模型(NEM)四种表面络合模型中的一种来对1-4种表面功能基团位点进行优化拟合从而得出该位点的pKa和位点浓度[18]。
该研究中,考察了pH值、离子强度和培养能源(S0、Fe2+、FeS2)对A. ferrooxidans细胞的表面酸碱性质的影响。先后进行了酸碱滴定和ProtoFit质子模拟,并通过电泳迁移率测量和傅里叶变换衰减全反射红外光谱法(ATR-FTIR)评估细胞壁上的电荷密度和官能团分布。
1 试验部分 1.1 仪器与试剂试验用到的主要仪器设备有雷磁ZDJ-5自动电位滴定仪(上海精密仪器仪表有限公司)、Avanti J-E离心机(Beckman Coulter, Inc.)、PHS-3C pH计(上海康仪仪器有限公司)、Nicolet Model Nexus 670傅里叶红外光谱仪(美国尼高力公司)、YXQ-LS-SII立式压力蒸汽灭菌器(上海博迅实业有限公司医疗设备厂)、XMTE-7000数控恒温浴锅(余姚市长江温度仪表厂)。
试验菌株为Acidithiobacillus ferrooxidans A9,采用改进的9K基础培养基培养。培养基配方为:(NH4)2SO4 3 g,KCl 0.1 g,K2HPO4 0.5 g,MgSO4·7H2O 0.5 g,Ca(NO3)2 0.01 g,加蒸馏水1 000 mL。培养基的初始pH值用H2SO4调节至2.0,分装于锥形瓶中,120 ℃灭菌20 min。添加S0(10 g/L)、FeSO4·7H2O(44.7 g/L)或者黄铁矿(2%)作为生长的能源物质,S0和FeSO4·7H2O等药品均为分析纯(AR),由北京鼎国昌盛生物技术有限责任公司生产。将接种了A. ferrooxidans的锥形瓶置于30 ℃、180~200 r/min的恒温摇床培养。
试验用黄铁矿(FeS2)由生物冶金教育部重点实验室提供,粒度≤0.074 mm。经测定,黄铁矿矿样中元素Fe的质量百分比为44.46%,S为47.78%。X射线衍射物相分析(结果见图 1)结果表明矿样可作为纯矿物使用,杂质为石英。
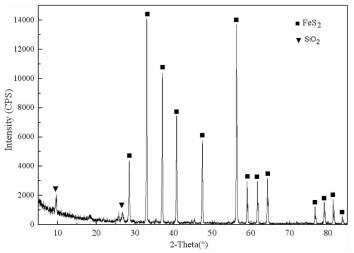 |
| 图 1 黄铁矿X射线衍射图 Fig.1 X-ray diffraction pattern of pyrite |
1.2 试验方法
当细菌长到稳定期时,10 000 r/min离心15 min收集菌体。收集的菌体悬浮于0.001 mol/L、0.01 mol/L或0.1 mol/L的背景电解质NaNO3溶液中,在25 ℃进行电位滴定试验。滴定前,用纯度大于99.99%的氮气涤荡0.5 h以赶走溶液中的二氧化碳,使pH值保持在4~5之间。电位滴定试验按照文献报道的方法[15]进行,菌悬液先用0.1 mol/L HNO3溶液调整pH值至2.0,然后用0.01 mol/L NaOH在电位漂移率≤5 mV/min(0.1 mV/Sec)时持续加入碱,滴定至pH值为10。为了检测可逆性和质子化行为进行了逆向滴定,即在到达滴定终点(pH值为10)后,用0.1 mol/L HNO3溶液迅速滴定到pH值为2,记录过程中所用HNO3溶液的体积。整个滴定过程保持较低压力的氮气缓慢地通入菌悬液。滴定结束后,对酸碱滴定结果进行拟合。利用ProtoFit软件将原始滴定数据进行优化处理,得到最优化模拟数据,根据最优数据模拟出质子模型,并与原始滴定数据作比较以检验将质子模型应用于极端嗜酸微生物A. ferrooxidans表面酸碱性质研究的适用性。
为了进行电泳迁移率测量,菌体离心收集、洗涤后重悬于0.001 mol/L、0.01 mol/L或0.1 mol/L的NaNO3溶液中,保存在冰上。将三个不同离子浓度的NaNO3溶液的等分试样(10 mL)通过分别添加1 mol/L HNO3溶液或1 mol/L NaOH溶液,调整为不同的pH值(2~10)。在电泳迁移率测量之前,将这些样品和相应离子强度的细菌悬浮液混合,并测定最终pH值。使用Zeta电位和粒度分析仪(Delsa 440SX)在25 ℃下测量电泳迁移率。所有试验均设置三个平行。
FTIR分析:配制不同pH值的0.01 mol/L的NaNO3溶液制备细菌悬液,利用FTIR分光光度计测定吸光值[18]。每一个pH值条件下,在4 000 cm-1~950 cm-1波长范围内,以4 cm-1的分辨率进行100次测定。
2 试验结果 2.1 不同能源培养的A. ferrooxidans不同离子强度酸碱滴定曲线电位滴定曲线见图 2(a-c),结果表明,三种不同能源培养的A. ferrooxidans在pH值2~4间均有很强的缓冲能力。一些研究发现去质子化过程就是细菌表面的酸性位点对溶液中不断加入的碱性溶液的一种缓冲现象[17, 19],在该研究中得到了相同的结论。滴定过程中滴定仪实时显示的滴定曲线表明细菌悬浮液的第一次pH值升高和第二次pH值降低的滴定之间具有极好的一致性(图片未展示),表明在滴定试验的时间范围内(约2 h),质子吸附和解吸是完全可逆的。每种离子强度下,质子在细菌上的吸附程度随pH值的增加而降低。滴定数据还表明,培养能源对细菌的缓冲能力有很大的影响。整体上,以S0为能源培养的A. ferrooxidans具有最强的缓冲能力,以Fe2+为能源的次之,而FeS2培养的最弱。在Li等人的研究中,在0.01 M NaCl溶液作为背景电解质的离子强度下,Fe2+为能源培养的A. ferrooxidans的缓冲能力也低于以S0为能源的,但以CuFeS2为能源的缓冲能力最强[6]。离子强度对不同能源培养的A. ferrooxidans细胞的缓冲能力表现出不同的影响。S0培养的A. ferrooxidans在0.1 mol/L的NaNO3溶液中缓冲能力最好,当0.01 mol/L NaOH用量为110 mL时,滴定曲线才基本平衡。FeS2为能源培养的A. ferrooxidans在0.001 mol/L的NaNO3溶液中缓冲能力最好,NaOH用量为42 mL时滴定趋于平衡。而A. ferrooxidans以Fe2+为能源培养后对0.01 mol/L NaNO3溶液缓冲能力好,NaOH用量在53 mL左右时去质子化基本达到平衡。
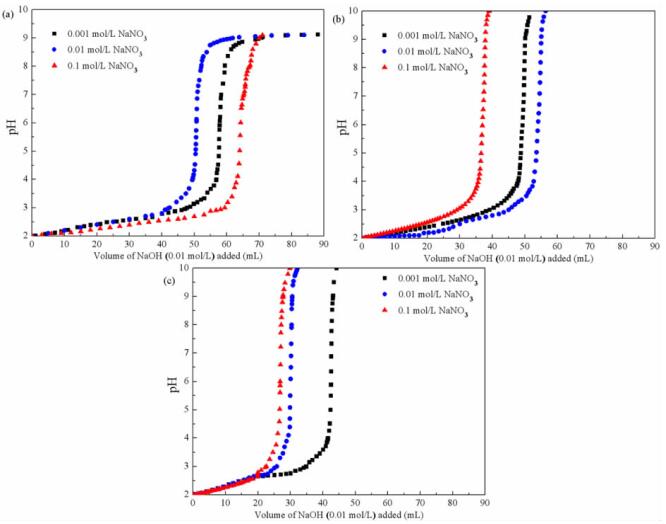 |
| 图 2 S0(a)、Fe2+(b)、FeS2(c)培养的A. ferrooxidans不同离子强度酸碱滴定曲线 Fig.2 Potentiometric titration data of A. ferrooxidans cultured with S0 (a), Fe2+ (b) and FeS2 (c) at different ionic strengths |
测量的pH值(x轴)与在滴定过程中消耗或释放的质子(y轴)相对于离子强度的归一化结果如图 3所示,便于直观比较不同离子强度下的结果。纵坐标数据根据公式(1)进行计算:
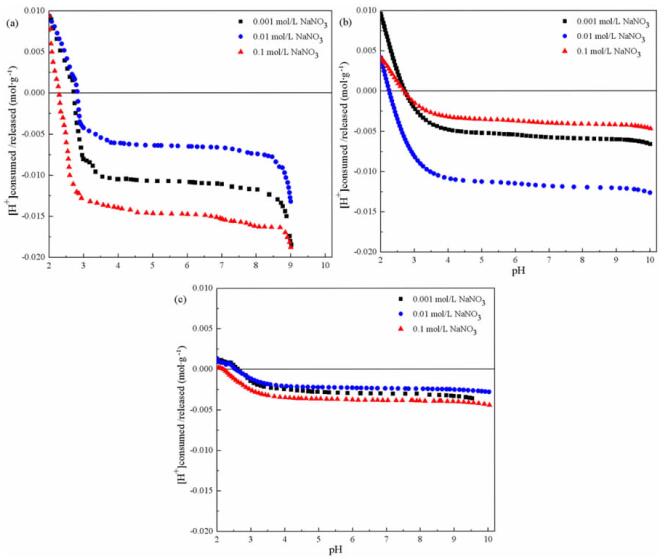 |
| 图 3 S0(a)、Fe2+(b)、FeS2(c)培养的A. ferrooxidans不同离子强度质子吸附/解吸附结果 Fig.3 Protonation and deprotonation for A. ferrooxidans cultured with S0 (a), Fe2+ (b) and FeS2 (c) at different ionic strengths |
| $ {\left[ {{{\rm{H}}^{\rm{ + }}}} \right]_{{\rm{consumed}}/{\rm{releaesd}}}} = \left( {{{\rm{C}}_{\rm{a}}} - {{\rm{C}}_{\rm{b}}} - \left[ {{{\rm{H}}^{\rm{ + }}}} \right] + \left[ {{\rm{O}}{{\rm{H}}^{\rm{ - }}}} \right]} \right)/{\rm{mb}} $ | (1) |
其中Ca和Cb是滴定过程添加的酸和碱的浓度,单位为mol/L,mb是细菌的湿重悬浮液浓度(g/L)。
质子吸附/解吸附曲线表明不同能源培养的A. ferrooxidans细胞的表面存在pKa值相近的官能团,且在所研究的整个pH值范围内发生了大量的质子吸附/解吸附。在三种不同的离子强度溶液中,三种不同能源培养的细胞呈现出明显不同的位点浓度。在0.01 mol/L电解质溶液中,以Fe2+为能源培养的A. ferrooxidans细胞的位点浓度是以S0为能源条件下的两倍,是FeS2为能源条件下五倍。对于以S0为能源培养的A. ferrooxidans,在0.01 mol/L电解质溶液中的总位点浓度明显低于在另外两个研究的离子强度下的,而以Fe2+为能源的在0.01 mol/L离子强度的电解质溶液中总位点浓度最高。以FeS2为能源培养的A. ferrooxidans细胞在三种离子强度下总位点浓度无显著差异。
之前的研究报道表明[17],嗜酸嗜热古菌A. manzaensis在0.01 mol/L的NaNO3溶液中能缓冲大量的NaOH,在滴定达到平衡的时候NaOH的用量达到50 mL;在0.001 mol/L的NaNO3溶液中NaOH用量为47 mL;而在0.1 mol/L NaNO3溶液中其缓冲能力最差,只消耗35 mL 0.01 mol/L的NaOH溶液即基本达到平衡。Tourney等[20]研究了革兰氏阳性嗜热菌Bacillus licheniformis S-86的电位滴定,发现在所研究的范围内,离子强度对去质子化常数或位点浓度没有显著影响。而Burnett等[18]得出结论,随着离子强度的增加,Anoxybacillus flavithermus的缓冲能力增加。Johnson[21]的研究表明,革兰氏阴性细菌Shewanella putrefaciens在好氧和厌氧条件下表现出完全不同的酸碱性质,这些差异远大于不同培养基配方或菌龄引起的差异。但是,该研究中生长能源(S0、Fe2+、FeS2)显著影响了A. ferrooxidans的表面特性,导致离子强度对不同能源培养的A. ferrooxidans细胞表面缓冲能力的影响也不同。
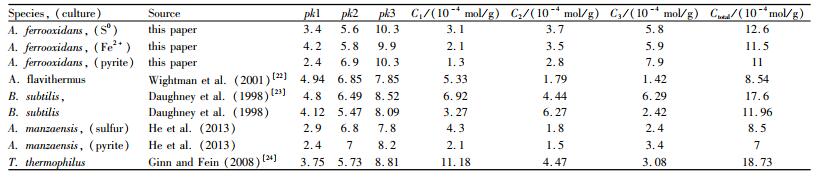
2.2 ProtoFit模拟该研究采用DSM(Donnan壳的静电模型)来模拟不同离子强度条件的滴定,利用每组滴定数据计算出不同能源培养的A. ferrooxidans细胞表面位点的logK值和位点浓度(表 1)。
| 表 1 不同能源培养的A. ferrooxidans及一些生物表面的表面特性 Table 1 Surface characteristics of A. ferrooxidans and some biological surfaces |
|
根据文献[11, 12, 25],羧基的解离常数为2~6,磷酸盐基团的解离常数一般为5.6~7.2,伯胺的解离常数大于10,氨基的解离常数为7~9,羟基的解离常数为8.6~9。该研究中,根据ProtoFit软件模拟得到的去质子化常数可以推测A. ferrooxidans细胞表面存在羧基、磷酸盐基团和伯胺。
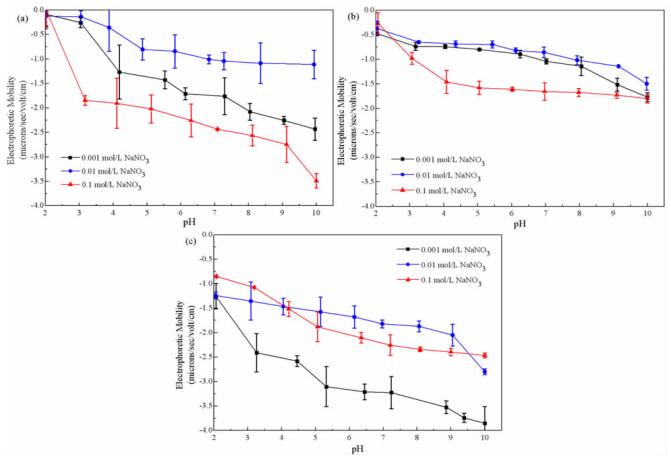 |
| 图 4 S0(a)、Fe2+(b)、FeS2(c)培养的A. ferrooxidans不同离子强度电泳迁移率 Fig.4 Electrophoretic mobility data for A. ferrooxidans cultured with S0 (a), Fe2+ (b) and FeS2 (c) at different ionic strengths |
2.3 电泳迁移率分析
电泳迁移率可以估算出整个细菌表面电荷及其等电点,图 3为不同能源培养的A. ferrooxidans在不同离子强度下的电泳迁移率。数据表明,A. ferrooxidans在pH值范围内(2~10)均呈负电性。随着pH值的升高,A. ferrooxidans表面的负电荷增加,符合微生物表面带电的一般特性[26]。有研究报道电泳迁移率随离子强度的增加而降低[27],但该研究的结果并不支持这一结论。目前关于离子强度对细菌质子化参数影响的研究尚未达成共识[20]。该研究中观察到细胞的电泳迁移率取决于许多因素,例如pH值、离子强度和培养能源,并且发现培养能源极大地影响了细菌的电泳迁移率。对于以S0或Fe2+为能源培养的A. ferrooxidans细胞,pH值对电泳迁移率的影响随离子强度的增加而增加(斜率变陡),而对于以FeS2为能源培养的A. ferrooxidans细胞,该研究中得到了相反的结论。结果还表明,培养能源显著影响A. ferrooxidans细胞的等电点。以S0为能源培养的A. ferrooxidans的等电点(IEP)约为2.0,并且不受溶液离子强度的影响。对于以Fe2+或FeS2为能源培养的A. ferrooxidans,即使在研究的最低pH值下也未观察到IEP。
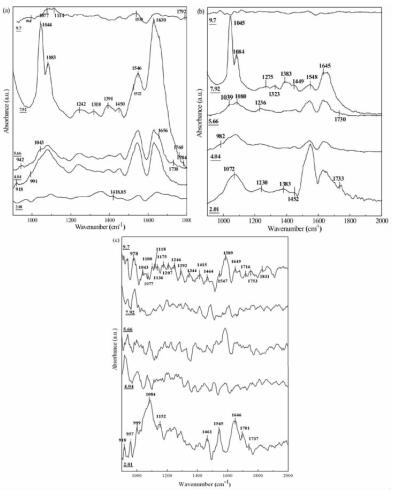
2.4 A. ferrooxidans的ATR-FTIR图谱分析进一步采用ATR-FTIR分析在不同的pH值条件下,不同能源培养的A. ferrooxidans表面官能团的分布规律。图 5是以S0、Fe2+或FeS2为能源培养的A. ferrooxidans在pH值为2.02、4.04、5.66、7.97和9.7条件下的ATR-FTIR图谱。表 2总结了在不同pH值下以S0、Fe2+或FeS2为能源培养的A. ferrooxidans的主要官能团的特征峰的比较。结果表明,A. ferrooxidans的红外图谱显示出较大的差异,与培养能源和pH值相关。
 |
| 图 5 S0(a)、Fe2+(b)和FeS2(c)培养的A. ferrooxidans在不同pH值的ATR-FTIR图谱 Fig.5 ATR-FTIR spectra of A. ferrooxidans cultured with S0 (a), Fe2+ (b) and FeS2 (c) at different pH values |
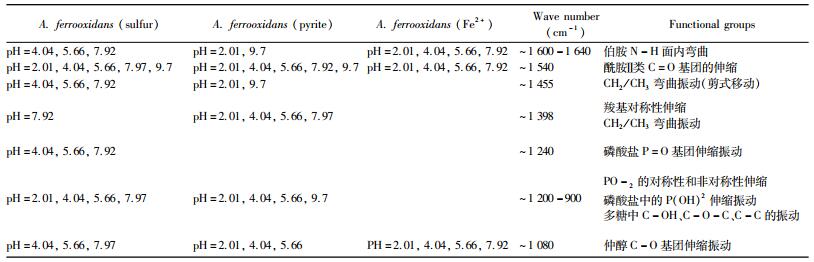
| 表 2 不同pH值下以S0、Fe2+或FeS2为能源培养的A. ferrooxidans表面主要官能团的比较 Table 2 Comparison on the main functional groups of A. ferrooxidans cultured with S0, Fe2+ or FeS2 at different pH values |
|
以S0为能源培养的A. ferrooxidans,pH值为4.04、5.66和7.92时的吸收峰较多,主要分布在1 000 cm-1~1 200 cm-1和1 500 cm-1~1 700 cm-1范围内,pH值为2.01和pH值为9.7时的图谱没有明显的吸收峰。1 044 cm-1处的吸收峰在pH值为2.01时比较弱,与1 083 cm-1处的吸收峰强度几乎一样。之后随着溶液碱性增加,1 044 cm-1处的吸收慢慢增强,在pH值为7.92时的谱带中达到最大,是1 083 cm-1处的吸收峰的5倍以上。但是,在pH值为9.7时的谱带中没有这两个吸收峰。1 500 cm-1~1 600 cm-1范围内各pH值条件下的谱带也有明显区别:在pH值为2.01时的谱带中,这个范围的吸收峰较弱;在pH值为4.04和5.66的谱带中,这个范围的吸收峰宽度和强度都很相似。pH值为7.92的谱带中,1 630 cm-1处的吸收峰变得很强,主要是由氨基与蛋白连接的C=O基团的伸缩引起的特征吸收峰。酰胺Ⅱ类和酰胺Ⅰ类的吸收峰分别出现在1 538 cm-1、1 546 cm-1和1 630 cm-1处,酰胺Ⅱ类与酰胺Ⅰ类的比值随着pH值的上升而增大,但是在pH值为9.7时两个吸收峰不明显。
以Fe2+为能源培养的A. ferrooxidans的ATR-FTIR图谱见图 5 (b)。仲醇C-O基团的吸收峰随着pH值的上升位置有所偏移,从pH值为2.01的1 072 cm-1,到pH值为5.66时的1 080 cm-1,到pH值为7.92时的1 084 cm-1;而且在pH值≥4.04时,逐渐分出伯醇C=O基团的吸收峰,在pH值为7.92时仲醇C-O基团和伯醇C=O基团的吸收峰最强。1 650 cm-1~1 550 cm-1为酰胺Ⅰ类和酰胺Ⅱ类的吸收峰。酰胺Ⅱ类的吸收随pH值的上升而减弱,酰胺Ⅰ类的吸收随pH值的上升而增强。酰胺Ⅰ类与酰胺Ⅱ类在pH值为9.7时吸收峰不明显。
图 5(c)是以FeS2为能源培养的A. ferrooxidans的ATR-FTIR谱图。吸收峰主要集中在1 260 cm-1~1 000 cm-1和1 640 cm-1~1 600 cm-1两个波段。1 260 cm-1~1 000 cm-1被复杂的叠加振动所控制,主要为C-O-C和C-O-P的伸缩振动,这些基团涉及复杂的多糖群体。pH值为4.04和7.92的谱带中没有较强的吸收峰。1 084 cm-1的吸收峰随pH值的上升其吸收减弱,而且吸收波段有所迁移,pH值为9.7时在1 077 cm-1。酰胺Ⅱ类和酰胺Ⅰ类的吸收峰分别出现在1 547 cm-1、1 545 cm-1和1 646 cm-1处。酰胺Ⅱ类与酰胺Ⅰ类的比值随着pH值的上升而减弱,但是在pH值为9.7时酰胺Ⅱ类吸收峰明显。相对以S0或Fe2+为能源培养的A. ferrooxidans的谱图,以FeS2为能源培养的A. ferrooxidans的谱图吸收峰较多,没有像以S0或Fe2+为能源培养的A. ferrooxidans的谱图一样出现明显的特征吸收峰。
这些有酸碱活性的羧基、酰胺基和磷酸基等官能团在电位滴定过程中起到重要的作用,不同能源培养的A. ferrooxidans表面官能团分布的差异影响了其质子吸附/解吸附规律。
3 结论该研究将酸碱电位滴定结合表面络合理论用于极端嗜酸菌A. ferrooxidans的酸碱缓冲能力的解析。结果表明,A. ferrooxidans的表面性质受到能源、离子强度和pH值的影响。随着pH值的升高,缓冲容量也增加,导致表面负电荷增加。ProtoFit拟合结果表明以S0为能源培养的A. ferrooxidans表面的总位点浓度高于以Fe2+或FeS2为能源培养的A. ferrooxidans。根据选择的DSM模型,可以通过调用三种不同类型的细胞壁官能团来表征A. ferrooxidans细胞壁的酸碱性质:羧基、磷酸基和酰胺基,并通过ATR-FTIR得到了验证。与S0为能源培养的A. ferrooxidans相比,以FeS2为能源培养的A. ferrooxidans的表面官能团具有更高的多样性。该研究将表面络合理论扩展到冶金模式微生物A. ferrooxidans,结果同样适用,该研究可以为A. ferrooxidans及其它嗜酸微生物的表面性质的研究提供重要参考。
| [1] |
DEVASIA P, NATARAJAN KA. Adhesion of Acidithiobacillus ferrooxidans to mineral surfaces[J]. International Journal of Mineral Processing, 2010, 94(3-4): 135-139. DOI:10.1016/j.minpro.2010.02.003 |
| [2] |
BONNEFOY V, HOLMES DS. Genomic insights into microbial iron oxidation and iron uptake strategies in extremely acidic environments[J]. Environmental Microbiology, 2012, 14(7): 1597-1611. DOI:10.1111/j.1462-2920.2011.02626.x |
| [3] |
WANG W, XIAO S, CHAO J, et al. Regulation of CO2 fixation gene expression in Acidithiobacillus ferrooxidans ATCC 23270 by Lix984n shock[J]. J Microbiol Biotechnol, 2008, 18(11): 1747-1754. |
| [4] |
DONG Y, LIN H, XU X, et al. Bioleaching of different copper sulfides by Acidithiobacillus ferrooxidans and its adsorption on minerals[J]. Hydrometallurgy, 2013, 140: 42-47. DOI:10.1016/j.hydromet.2013.05.009 |
| [5] |
ZHU J, WANG Q, ZHOU S, et al. Insights into the relation between adhesion force and chalcopyrite-bioleaching by Acidithiobacillus ferrooxidans[J]. Colloids Surf B Biointerfaces, 2015, 126: 351-357. DOI:10.1016/j.colsurfb.2014.11.036 |
| [6] |
LI Q, WANG Q, ZHU J, et al. Effect of Extracellular Polymeric Substances on Surface Properties and Attachment Behavior of Acidithiobacillus ferrooxidans[J]. Minerals, 2016, 6(4): 100-111. DOI:10.3390/min6040100 |
| [7] |
HE ZG, YANG YP, ZHOU S, et al. Effect of pyrite, elemental sulfur and ferrous ions on EPS production by metal sulfide bioleaching microbes[J]. Transactions of Nonferrous Metals Society of China, 2014, 24(4): 1171-1178. DOI:10.1016/S1003-6326(14)63176-9 |
| [8] |
MISHRA B, BOYANOV M, BUNKER BA, et al. High- and low-affinity binding sites for Cd on the bacterial cell walls of Bacillus subtilis and Shewanella oneidensis[J]. Geochimica Et Cosmochimica Acta, 2010, 74(15): 4219-4233. DOI:10.1016/j.gca.2010.02.019 |
| [9] |
PLETTE ACC, VAN RIEMSDIJK WH, BENEDETTI MF, et al. pH dependent charging behavior of isolated cell walls of a gram-positive soil bacterium[J]. Journal of Colloid and Interface Science, 1995, 173(2): 354-363. DOI:10.1006/jcis.1995.1335 |
| [10] |
FEIN JB, BOILY JF, YEE N, et al. Potentiometric titrations of Bacillus subtilis cells to low pH and a comparison of modeling approaches[J]. Geochimica Et Cosmochimica Acta, 2005, 69(5): 1123-1132. DOI:10.1016/j.gca.2004.07.033 |
| [11] |
COX JS, SMITH DS, WARREN LA, et al. Characterizing heterogeneous bacterial surface functional groups using discrete affinity spectra for proton binding[J]. Environmental Science & Technology, 1999, 33(24): 4514-4521. |
| [12] |
MARTINEZ RE, SMITH DS, KULCZYCKI E, et al. Determination of intrinsic bacterial surface acidity constants using a donnan shell model and a continuous pKa distribution method[J]. Journal of Colloid and Interface Science, 2002, 253(1): 130-139. DOI:10.1006/jcis.2002.8541 |
| [13] |
HAAS JR, DICHRISTINA TJ, WADE R. Thermodynamics of U(Ⅵ) sorption onto Shewanella putrefaciens[J]. Chemical Geology, 2001, 180(1-4): 33-54. DOI:10.1016/S0009-2541(01)00304-7 |
| [14] |
KENNEY JPL, FEIN JB. Cell wall reactivity of acidophilic and alkaliphilic bacteria determined by potentiometric titrations and Cd adsorption experiments[J]. Environmental Ence & Technology, 2011, 45(10): 4446-4452. |
| [15] |
FEIN JB, YU Q, NAM J, et al. Bacterial cell envelope and extracellular sulfhydryl binding sites:Their roles in metal binding and bioavailability[J]. Chemical Geology, 2019, 521: 28-38. DOI:10.1016/j.chemgeo.2019.04.026 |
| [16] |
TURNER BF, FEIN JB. Protofit:a program for determining surface protonation constants from titration data[J]. Computers & Geosciences, 2006, 32(9): 1344-1356. |
| [17] |
HE ZG, YANG YP, ZHOU S, et al. The effect of culture condition and ionic strength on proton adsorption at the surface of the extreme thermophile Acidianus manzaensis[J]. Colloids and Surfaces B-Biointerfaces, 2013, 102: 667-673. DOI:10.1016/j.colsurfb.2012.09.028 |
| [18] |
BURNETT P-G, HEINRICH H, PEAK D, et al. The effect of pH and ionic strength on proton adsorption by the thermophilic bacterium Anoxybacillus flavithermus[J]. Geochimica Et Cosmochimica Acta, 2006, 70(8): 1914-1927. DOI:10.1016/j.gca.2006.01.009 |
| [19] |
LI MK, HUANG YJ, YANG YP, et al. Heavy metal ions removed from imitating acid mine drainages with a thermoacidophilic archaea:Acidianus manzaensis YN25[J]. Ecotoxicology and Environmental Safety, 2020, 190. DOI:10.1016/j.eurpolymj.2014.11.024 |
| [20] |
TOURNEY J, NGWENYA BT. The effect of ionic strength on the electrophoretic mobility and protonation constants of an EPS-producing bacterial strain[J]. J Colloid Interface Sci, 2010, 348(2): 348-354. DOI:10.1016/j.jcis.2010.04.082 |
| [21] |
HAAS JR. Effects of cultivation conditions on acid-base titration properties of Shewanella putrefaciens[J]. Chemical Geology, 2004, 209(1-2): 67-81. DOI:10.1016/j.chemgeo.2004.04.022 |
| [22] |
WIGHTMAN PG, FEIN JB, WESOLOWSKI DJ, et al. Measurement of bacterial surface protonation constants for two species at elevated temperatures[J]. Geochimica Et Cosmochimica Acta, 2001, 65(21): 3657-3669. DOI:10.1016/S0016-7037(01)00763-3 |
| [23] |
DAUGHNEY CJ, FEIN JB. The Effect of Ionic Strength on the Adsorption of H+, Cd2+, Pb2+, and Cu2+ by Bacillus subtilis and Bacillus licheniformis:A Surface Complexation Model[J]. Journal of Colloid And Interface Science, 1998, 198(1): 53-77. DOI:10.1006/jcis.1997.5266 |
| [24] |
GINN BR, FEIN JB. The effect of species diversity on metal adsorption onto bacteria[J]. Geochimica Et Cosmochimica Acta, 2008, 72(16): 3939-3948. DOI:10.1016/j.gca.2008.05.063 |
| [25] |
и.C.拉甫罗夫. 胶体化学实验[M]. 高等教育出版社, 1992.
|
| [26] |
SCHWARZ M, KLOSS S, STOCKEL S, et al. Pioneering particle-based strategy for isolating viable bacteria from multipart soil samples compatible with Raman spectroscopy[J]. Anal Bioanal Chem, 2017, 409(15): 3779-3788. DOI:10.1007/s00216-017-0320-z |
| [27] |
ADOUT A, KANG S, ASATEKIN A, et al. Ultrafiltration membranes incorporating amphiphilic comb copolymer additives prevent irreversible adhesion of bacteria[J]. Environmental Science & Technology, 2010, 44(7): 2406-2411. |
 2020
2020



