| 改性磁铁矿对矿区土壤中镉的吸附性能及机理 |
工矿业活动引发的矿区及周边土壤重金属污染已成为严重的环境问题之一[1]。据2014年环境保护部和国土资源部联合发布的《全国土壤污染状况调查公报》,我国矿区土壤超标点位占33.4%,主要污染物镉排在首位。镉及其化合物是一类极危险的重金属污染物,具有生物富集性、持久性和不可逆等毒性特征[2]。特别是土壤中有效态镉,通过水和食物链进入生态系统从而对人和生物造成严重伤害[3]。因此开展矿区土壤中镉污染的修复或去除具有重要的实际意义。
矿物材料作为一种资源受到了人们的普遍重视,但它的环境属性却长期以来被忽视。多数天然矿物的比表面积大、离子交换容量高、吸附性能佳,且制备工艺简单、成本低廉、环境相容性好[4]。近年来,研究者发现一些矿物材料在重金属废水处理方面有一定的功效,如凹凸棒土[5]、蛭石[6]、蒙脱石[7]、沸石[8]、高岭土[9]等均已开展了大量的应用探索。磁铁矿(主成分Fe3O4)除满足上述矿物的优点外,还具有很强的磁性,能被磁铁所吸附,易于回收再利用。但是磁铁矿对重金属离子的吸附主要是在水溶液体系中进行[10-14],相反,在固-液体系中捕获重金属离子尚未广泛开展研究。本文以磁铁矿为吸附材料,并通过简单的酸浸、灼烧法对其进行改性处理,比较了磁铁矿和改性磁铁矿对矿区土壤中水溶性镉的吸附效果,重点研究了改性磁铁矿对镉离子的吸附特性及机理,为在固-液体系中处理无磁性重金属提供一种解决方案。
1 试验部分 1.1 仪器与材料扫描电镜(S-4800,日本日立高新技术公司);X射线光电子能谱仪(250xi,美国赛默飞世尔科技公司);X射线衍射仪(Ultima IV,日本理学公司);电感耦合等离子体质谱仪(NexIon 350X,美国珀金埃尔默仪器有限公司);原子吸收分光光度计(ice3500,美国赛默飞世尔科技公司);振荡器(HY-8A,金坛天竞实验仪器厂);pH计(PHS-3,上海佑科仪器有限公司)。
试验用磁铁矿粉购自上海肴弋合金材料有限公司,比表面积为35 m2/g。具体改性方法为0.5 mol/L盐酸浸泡48 h、150 ℃灼烧10 min[11],冷却备用。试验土壤采自川西某矿区冶炼厂附近,经自然风干后,过2 mm筛去除杂物,保存备用;其pH值为6.85,有机质含量为21.37 g/kg,总镉含量为3.77 mg/kg。试验用化学试剂盐酸、硝酸、氨水、硫脲等均为分析纯,购自西陇化工股份有限公司。试验用水为蒸馏水。
1.2 吸附试验土壤样品20 g,加入1 mL 5 μg/mL Cd2+溶液和60 mL蒸馏水,搅拌30 min成悬浮液。先用磁铁除去悬浮液中的磁性物质,然后加入改性磁铁矿粉0.5 g(如酸性土壤需调节pH为6.5以上),振荡转速设为150 r/min,间歇振荡70 min,静置20 min后磁铁分离。采用电感耦合等离子质谱内标法或原子吸收法测定。
1.3 脱附试验将吸附Cd2+的磁铁矿粉用蒸馏水清洗,沥干后投入到5 mL 0.5% HCl -0.5%硫脲热溶液中,水浴15 min,然后用磁铁将磁铁矿粉回收,经水洗酸处理后再利用。洗脱液冷却后定容至10 mL,上仪器测定镉的浓度。
1.4 样品分析土壤样品按照HJ/T 166—2004规程进行采集和制备;总镉含量采用GB/T 17141—1997法测定;土壤pH值采用NY/T 1121—2006法;采用国家标准物质GBW 07411以及加标回收试验进行质量监控。按照公式(1)计算土壤中镉的去除率:
| $ R = \left( {\omega 1 - \omega 2} \right)/\omega 1 \times 100\% $ | (1) |
式中,ω1为原土壤中镉的量(10-6);ω2为吸附后土壤中镉的量(10-6)。
2 结果与讨论 2.1 磁铁矿改性前后结构表征图 1所示为磁铁矿(a)和改性磁铁矿(b)的扫描电镜(SEM)图。从图 1可以看出,在磁铁矿(a)中磁铁颗粒几乎是团聚在一起的,而改性后磁铁矿(b)中颗粒较为分散,团聚体基本消失。说明通过改性提高了磁铁矿颗粒间的分散性,增大了磁铁矿颗粒的比表面积,从而更有利于在固-液体系中与Cd2+相接触。
 |
| 图 1 磁铁矿(a)与改性磁铁矿(b)SEM图 Fig.1 SEM images of the magnetite and modified magnetite |
图 2所示为磁铁矿与改性磁铁矿的X射线衍射(XRD)分析图。从图 2可以看出,改性磁铁矿XRD图谱中出现了一定量的细小衍射峰,说明改性后磁铁矿的表面或内部结构出现了变化。推测可能是盐酸浸泡磁铁矿导致表面产生了一定量的低分子类铁盐,经灼烧低分子铁盐与磁铁矿表面紧密结合,从而改变了磁铁矿比表面或内部结构,强化了磁铁矿的吸附能力[11]。
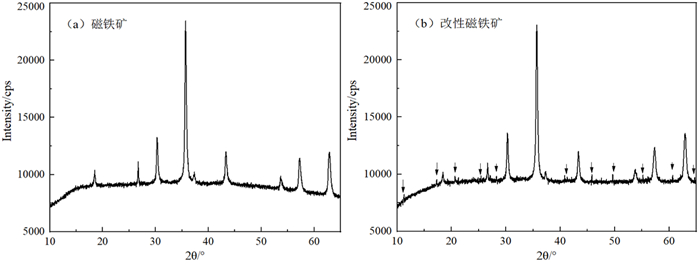 |
| 图 2 磁铁矿与改性磁铁矿XRD图 Fig.2 XRD images of the magnetite and modified magnetite |
2.2 pH对磁铁矿去除镉的影响
称取土壤样品各10份,按1.2节试验方法制备悬浮液,采用HNO3和氨水调成不同初始pH值,于室温下分别加入磁铁矿和改性磁铁矿0.5 g,间歇搅拌70 min,考察磁铁矿和改性磁铁矿在不同初始pH值时对镉去除的影响,结果如图 3。
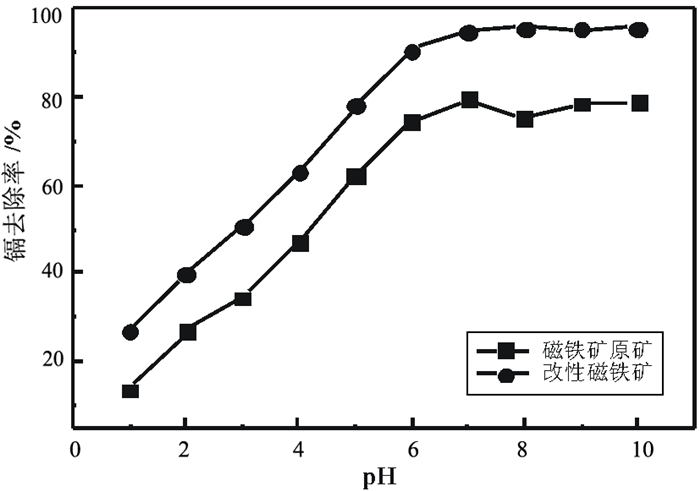 |
| 图 3 pH值对镉去除率的影响 Fig.3 Removal rate of the cadmium at different pH |
由图 3可见,磁铁矿和改性磁铁矿对镉的去除率均随pH值的增大而增加,但是改性磁铁矿的去除率明显高于磁铁矿。当pH达到6.5以上时,即在中性和碱性条件下,镉的去除率达到最高并处于平衡状态。推测可能是在酸性环境中H+浓度相对较大,H+与Cd2+在磁铁矿表面形成了竞争吸附,从而导致镉的去除率偏低;而随着酸度的下降,体系中H+浓度逐渐降低,使得H+和Cd2+在磁铁矿表面的竞争效应逐级减弱;同时体系中OH-浓度升高,使得磁铁矿表面的负电荷增多,从而更有利于Cd2+在磁铁矿表面的吸附[13]。本试验最终选择改性磁铁矿作为吸附材料,吸附初始pH值为7。
2.3 改性磁铁矿用量对去除镉的影响称取土壤样品10份,按1.2节试验方法制备悬浮液,调节pH为7,于室温下间歇搅拌70 min,考察改性磁铁矿用量对镉去除率的影响,结果如图 4。由图 4可见,镉的去除率在开始阶段随着改性磁铁矿用量的增加而升高,当改性磁铁矿用量为0.5 g时,镉的去除率达到最高,随后增加改性磁铁矿用量对镉的去除率基本无影响。推测可能是起始阶段改性磁铁矿用量增加时,客观上增加了Cd2+的吸附位点,从而提高了Cd2+的吸附效率。但是体系中可被吸附的Cd2+量是一定的,因此当继续增加改性磁铁矿用量时,去除率变化不大,且逐渐趋于平衡[15]。本试验选择改性磁铁矿用量为0.5 g。
 |
| 图 4 改性磁铁矿用量对镉去除率的影响 Fig.4 Removal rate of the cadmium at different modified magnetite dosage |
2.4 吸附时间
称取土壤样品12份,按1.2节试验方法制备悬浮液,调节pH为7,于室温下加入改性磁铁矿0.5 g,考察吸附时间对镉去除率的影响,结果如图 5。由图 5可见,整个吸附过程中镉去除率的变化分为两个阶段。前70 min为快速反应阶段,随着时间延长镉的去除率逐渐上升,70 min以后达到最高并逐渐趋于稳定。推测可能是由于前70 min内,改性磁铁矿表面含有大量的吸附位点,且土壤中Cd2+浓度相对较高,使得Cd2+浓度和改性磁铁矿表面形成浓度差,提高了传质推动力,加快了去除速度的进行[12]。而随着反应的进行,改性磁铁矿表面吸附的Cd2+量逐渐达到饱和,并最终达到平衡。本试验最终选择的最佳吸附时间为70 min。
 |
| 图 5 吸附时间对镉去除率的影响 Fig.5 Removal rate of the cadmium at different adsorption time |
2.5 吸附温度
称取土壤样品5份,按1.2节试验方法制备悬浮液,调节pH为7,加入改性磁铁矿0.5 g,间歇搅拌70 min,考察不同温度下磁铁矿对土壤中镉的去除率,结果如图 6。由图 6可见,温度的提高对提升改性磁铁矿去除镉的效果并不明显,说明温度不是影响Cd2+吸附效果的主要因素,同时也证实了Cd2+的吸附与反应能量变化无直接关系。本试验直接选择室温(25 ℃)为反应温度。
 |
| 图 6 吸附温度对镉去除率的影响 Fig.6 Removal rate of the cadmium at different adsorption temperature |
2.6 洗脱剂用量
根据磁铁矿吸附Cd2+的pH范围,在酸性条件下,Cd2+易于被洗脱下来。同时,硫脲能与Cd2+形成稳定的化合物,因而试验选择盐酸和硫脲的混合溶液作为Cd2+的洗脱剂。选用L9(34)正交试验法来考察盐酸、硫脲、洗脱体积三个因子对洗脱效果的影响,每个因子选择三个水平,以确定最佳洗脱条件,结果如表 1。由表 1可见,当盐酸浓度为0.5%,硫脲浓度在0.5%以上,洗脱体积在5 mL以上时,镉可获得满意的回收率。本试验最终选择5 mL 0.5%盐酸-0.5%硫脲为最佳洗脱用量。
| 表 1 正交试验结果 Table 1 The results of the orthogonal test |
 |
2.7 改性磁铁矿吸附Cd2+机理
矿物表面反应主要包括吸附、沉淀和吸收等几种反应类型[15],根据镉与铁原子的结构特征,改性磁铁矿表面和Cd2+发生沉淀和吸收的可能性很小,因此吸附是主要反应模式[10]。吸附的发生是由于固体在界面分子的力场不饱和,即存在一种能从外界吸附分子、原子或离子的固体表面力,并在吸附表面上形成多分子层或单分子层的现象。改性磁铁矿在土壤悬浮液中对Cd2+的吸附行为实质上仍是磁铁矿-水界面之间的作用,因此可采用吸附等温线来描述这种相互作用。Langmuir和Freundlich等温吸附模型是常用描述吸附过程的等温线方程[13]。将Cd2+在改性磁铁矿上的吸附等温曲线分别进行Langmuir和Freundlich模型拟合,结果如下:Langmuir拟合方程为y=0.033 1x+0.189,Freundlich拟合方程为y=0.086 1x+0.175。由表 2可见,两个等温方程均具有良好的线性关系,且改性磁铁矿饱和吸附容量达到了18.93 mg/g,明显高于改性前。结果表明,改性磁铁矿对Cd2+的吸附既有单分子层吸附,也有多分子层吸附,是多种吸附共同作用的结果,这一结论和前人的研究[10]相吻合。
| 表 2 磁铁矿吸附等温线拟合参数 Table 2 Parameters of the fitting of adsorption isotherms on magnetite |
 |
矿区环境中存在大量电解质离子,它们会影响到矿物表面的双电层,并与矿物表面的吸附位点进行竞争反应,从而抑制金属离子吸附[16]。本文考察了NaCl离子浓度对改性磁铁矿吸附Cd2+的影响,结果如图 7。
 |
| 图 7 NaCl浓度对镉去除率的影响 Fig.7 Removal rate of the cadmium at different NaCl concentration |
由图 7可见,NaCl浓度改变对镉去除率的影响不明显,说明电解质的引入未影响到改性磁铁矿表面的吸附位点。相关研究[14, 16]认为,这种现象表明在吸附过程中Cd2+与改性磁铁矿表面有新化学键生成,而静电引力和氢键的作用相对较少。
图 8所示为改性磁铁矿吸附Cd2+前后的X射线光电子能谱(XPS)图。
 |
| 图 8 改性磁铁矿吸附Cd2+前后的XPS全谱图 Fig.8 XPS of the modified magnetite before and after absorbed with Cd2+ |
由图 8可见,吸附Cd2+之前在结合能406.88 eV处没有Cd 3d轨道特征峰,而在吸附Cd2+之后在结合能406.88 eV处出现了Cd 3d轨道特征峰,表明改性磁铁矿表面有一定量的镉元素存在。同时,Cl 2p轨道的结合能由吸附前的198.78 eV变为吸附后的198.28 eV,可以认为是改性磁铁矿表面的羟基氧化铁[Fe8O8(OH)8Cl1.35]中Cl与Cd发生了离子交换反应[17]。O1s轨道结合能分别由吸附前的532.48 eV降到吸附后的530.48 eV,说明羟基氧化铁中氧的外层电子密度增加了,化学价态发生了变化,因此吸附过程也发生了氧化还原反应。
2.8 改性磁铁矿与相关非金属矿物的吸附性能比较目前,利用矿物材料吸附镉的相关报道比较多,各种材料对镉的吸附容量不尽相同。表 3是改性磁铁矿与几种常用非金属矿物对镉吸附性能的比较,可以看出改性磁铁矿对镉的吸附容量是比较高的,尽管比凹凸棒土要低一些,但是其改性条件要比凹凸棒土简单温和,且能采用磁铁分离,省时省力,再生能力强,因此是一种有较好应用前景的重金属吸附材料。
| 表 3 不同矿物材料对镉的吸附容量比较 Table 3 Comparison of the adsorption capacity of cadmium with various mineral |
 |
3 结论
(1) 改性磁铁矿对矿区土壤中水溶性Cd2+的吸附效果显著优于磁铁矿。对于20 g矿区土壤样品,当改性磁铁矿用量为0.5 g、pH为7、吸附时间70 min时,镉的去除率达到95%以上。
(2) Cd2+的吸附等温线符合Langmuir和Freundlich等温线吸附模型,饱和吸附容量为18.93 mg/g,且吸附行为不受离子强度影响,XPS测试结果证实吸附过程主要为离子交换和氧化还原反应。
(3) 采用改性磁铁矿吸附非磁性重金属元素,常温下直接在固-液体系中富集、分离,方法简便快速,成本低,为处理矿区土壤中镉污染提供一种解决方案。
致谢:
中国地质科学院矿产综合利用研究所程蓉博士为本试验提供了矿区土壤样品,赖杨工程师提供了XRD测试数据,特此致谢。
| [1] |
黄占斌, 孙朋成. 矿区重金属污染土壤的修复[J]. 科学, 2013, 65(6): 38-42. |
| [2] |
李婧, 周艳文, 陈森, 等. 我国土壤镉污染现状、危害及其治理方法综述[J]. 安徽农学通报, 2015, 21(24): 104-107. DOI:10.3969/j.issn.1007-7731.2015.24.044 |
| [3] |
Chojnacka K., Chojnacki A., Gorecka H., et al. Bioavailability of heavy metals from polluted soils to plants[J]. Science of the total environment, 2006, 337(1): 175-182. |
| [4] |
聂果, 王永杰, 李军. 环境矿物材料吸附重金属的有机改性研究[J]. 环境科技, 2015, 28(2): 76-80. DOI:10.3969/j.issn.1674-4829.2015.02.018 |
| [5] |
徐婉珍, 吴向阳, 李春香, 等. 凹凸棒土对镉(Ⅱ)和镍(Ⅱ)吸附行为的研究及分析应用[J]. 冶金分析, 2010, 30(7): 52-57. DOI:10.3969/j.issn.1000-7571.2010.07.012 |
| [6] |
朱小燕, 姜丽娜, 尚建疆, 等. 重金属离子在改性蛭石表面的竞争吸附及其动力学研究[J]. 矿产保护与利用, 2018(2): 111-117. |
| [7] |
魏凤, 徐怀洲, 向春晓, 等. 不同前处理方式下钠基蒙脱石对重金属镉的吸附研究[J]. 农业环境科学学报, 2018, 37(3): 456-463. |
| [8] |
赵兴杰, 侯鹏程, 韩旭平, 等. 膨润土和沸石对污染土壤有效镉的动态影响[J]. 山西农业科学, 2014, 42(9): 981-983. DOI:10.3969/j.issn.1002-2481.2014.09.14 |
| [9] |
王莫茜. 高岭土去除镉离子与对硝基苯酚二元污染物的研究[J]. 资源节约与环保, 2015(8): 73-76. DOI:10.3969/j.issn.1673-2251.2015.08.065 |
| [10] |
赵谨.天然磁铁矿与褐铁矿处理含Hg(Ⅱ)、Cd(Ⅱ)、Cr(Ⅱ)废水实验研究[D].北京: 中国地质大学(北京), 2002.
|
| [11] |
吴昆明, 郭华明, 魏朝俊. 天然磁铁矿化学改性及其在水体除砷中的应用[J]. 岩矿测试, 2017, 36(1): 32-39. |
| [12] |
Alexandre T. Paulino, Laurence A. Belfiore, Lauro T. Kubota, et al. Effect of magnetite on the adsorption behavior of Pb(Ⅱ), Cd(Ⅱ), and Cu(Ⅱ) in chitosan-based hydrogels[J]. Desalination, 2011, 275(1-3): 187-196. DOI:10.1016/j.desal.2011.02.056 |
| [13] |
姜彬慧, 丽丽, 赵研, 等. pH值对天然磁铁矿吸附水中Pb2+的影响及吸附机制研究[J]. 功能材料, 2013, 44(23): 3392-3396. DOI:10.3969/j.issn.1001-9731.2013.23.007 |
| [14] |
谭服鼎, 何宏平, 梁晓亮, 等. 类质同像置换对磁铁矿吸附Pb(Ⅱ)性能的影响[J]. 矿物学报, 2018, 38(1): 64-73. |
| [15] |
Zeng G M, Liu Y Y, Tang L, et al. Enhancement of Cd(Ⅱ) adsorption by polyacrylic acid modified magnetic mesoporous carbon[J]. Chemical engineering journal, 2015, 259: 153-160. DOI:10.1016/j.cej.2014.07.115 |
| [16] |
Hu X J, Liu Y G, Zeng G M, et al. Effects of background electrolytes and ionic strength on enrichment of Cd(Ⅱ) ions with magnetic graphene oxide-supported sulfanilic acid[J]. Journal of colloid and interface science, 2014, 435: 138-144. DOI:10.1016/j.jcis.2014.08.054 |
| [17] |
Kamimura T, Nasu S, Segi T, et al. Corrosion behavior of steel under wet and dry cycles containing Cr3+ ion[J]. Corrosion science, 2003, 45(8): 1863-1879. DOI:10.1016/S0010-938X(03)00023-4 |
 2019
2019


