| 热分解法制备三水碳酸镁晶须及其结晶动力学研究 |
2. 矿物加工科学与技术国家重点实验,北京 100160;
3. 东北大学 资源与土木工程学院,辽宁 沈阳 110819
2. State Key Laboratory of Mineral Processing, Beijing 100160, China;
3. School of Resources & Civil Engineering, Northeastern University, Shenyang 110819, China
三水碳酸镁晶须(MgCO3·3H2O)是微米级碳酸镁单晶体,其性价比高,是一种新型多功能精细无机材料,具有重要的工业应用前景和巨大的经济潜力,在新材料领域倍受关注。由于纯度极高,热分解温度低,MgCO3·3H2O晶须可用作制备硝酸镁、硫酸镁、氢氧化镁和氧化镁等精细镁盐产品的前驱物[1]。由于良好的介稳性能,MgCO3·3H2O晶须还主要作为合成介孔二氧化钛、二氧化硅和氧化镍等分级结构材料的软模板[2, 3]。因极佳的物化性质及优异的机械性能,棒状MgCO3·3H2O晶须被广泛用作医药、化妆品、塑料、涂料、橡胶、玻璃、陶瓷及印刷等行业的增强填料[4, 5]。
目前国内外众研究者主要采用共沉淀法合成MgCO3·3H2O晶体。Mitsuhashi[6]等利用Mg(OH)2水溶液与CO2反应生成针状MgCO3·3H2O晶体。Kovacheva等[7]以卤水和碳酸盐为原料制备了亚稳态的棒状MgCO3·3H2O晶体和稳态的碱式碳酸镁晶体,并对相转变过程进行研究。G. Jauffret等[8]在MgO-CO2-H2O多相系统中合成了针状MgCO3·3H2O晶体,并对MgCO3·3H2O的热分解过程进行了研究。王勇等[9]以MgCl2和(NH4)2CO3作为反应物料,制备了直径约为5 μm的针状三水碳酸镁,研究发现,控制反应温度、平衡时间、搅拌速度等条件可以控制晶体形貌。邵明浩等[10]在MgCl2-Na2CO3-NaHCO3溶液中制备出了直径为10~20 μm的棒状MgCO3·3H2O晶体,并分析了pH值对晶须生长的影响。杨晨等[11, 12]以氯化镁和纯碱作为反应原料,SDS为添加剂,制备了高长径比棒状MgCO3·3H2O晶体,并从晶体成核和生长角度初步研究了三水碳酸镁结晶生长过程。Du等[13]以MgSO4和(NH4)2CO3为原料,采用共沉淀法制备了针状MgCO3·3H2O晶体以及片状4MgCO3·Mg(OH)2·4H2O晶体,主要研究了三水碳酸镁相转移过程。为达到形貌调控目的,众研究者将添加剂应用于三水碳酸镁晶体的可控合成。闫平科等[14-16]以MgCl2·6H2O或MgSO4·7H2O和NH4HCO3为原料,不同种类表面活性剂为晶形控制剂,分别制备了棒状、放射状、束状和鱼翅状MgCO3·3H2O晶体,并研究了晶体稳定性和形貌调控过程。吴丹等[17]以MgCl2·6H2O和NH4HCO3为原料制备了棒状MgCO3·3H2O晶须,该试验条件适用于卤水资源体系。王素平[18]等以工业氢氧化镁、CO2为原料,柠檬酸钠为添加剂,制备了高长径比的三水碳酸镁晶须。
综上所述,研究者以可溶性镁盐和碳酸盐或碳酸氢盐为原料,采用一种原料滴入另一种原料的沉淀方法,可以合成MgCO3·3H2O晶须,该工艺存在制备成本较高、副产物易引发环境污染等问题;此外上述报道未对MgCO3·3H2O晶体形貌的形成机理进行详尽研究。
我国具有含镁矿产资源储量丰富且品质优良的资源优势,利用菱镁矿、白云石、水镁石、盐湖卤水等作为镁源制备三水碳酸镁晶须具有原料廉价易得、来源广泛的优点。陈敏等[19]以菱镁矿为原料利用水化碳酸化法合成出直径大约为5 μm、长径比为10~20的碳酸镁晶体。刘家祥等[20]以轻烧白云石为原料,通过水化碳化法制备重镁水溶液,调控温度和时间,获得了长度为40~80 μm的MgCO3·3H2O晶须。
在前期研究基础上[21-23],本研究以天然菱镁矿为原料制备重镁水溶液,并以此为前驱溶液,利用热分解法制备MgCO3·3H2O晶须,主要考察热分解时间、重镁水溶液浓度和搅拌速率对晶体组成和形貌的影响,并分析了MgCO3·3H2O结晶动力学过程。
1 试验 1.1 试验原料试验原料为产自辽宁宽甸的天然菱镁矿,其主要化学组成为:MgO(47.61%)、CaO(0.50%)、SiO2(0.66%),纯度约为99.58%。将菱镁矿于750 ℃的马弗炉中煅烧3.0 h后获得轻烧氧化镁,其MgO含量为96.89%。
1.2 三水碳酸镁晶须制备研磨轻烧氧化镁并过筛,称取粒径为﹤74 μm的氧化镁按照m(MgO) : m(H2O)为1 : 40的比例与热水混合,在60 ℃水浴中以500 r/min的速率搅拌一段时间后冷却至室温,并筛分除杂得水化溶液。往上述水化溶液中通入CO2,自制冰水水浴下搅拌,当溶液pH值为7.5(或更低)时,停止通气和搅拌,过滤得重镁水溶液。采用去离子水调节重镁水溶液的浓度,将不同浓度的重镁水溶液置于50 ℃水浴中,以不同的速率搅拌热解一定时间后过滤,滤饼经去离子水洗涤、过滤,随后置入60 ℃电热鼓风干燥箱中干燥6.0 h,得到白色粉末。
1.3 检测与表征采用荷兰帕纳科公司的X-Pert型X射线衍射仪(XRD)表征产物的物相组成,辐射源为铜靶K,λ=0.154 1 nm,镍滤波片,超能探测器,X光管工作电压40 kV,管流45 mA,扫描速率4°·min-1,扫描范围2θ=5°~90°;采用JEOL公司JSM-6360LV型扫描电子显微镜(SEM)观察产物的形貌,加速电压为20.0 kV。
2 结果与讨论 2.1 热解时间的影响图 1为50 ℃时重镁水溶液经不同时间热解后所得产物的XRD图,图 2是不同热解时间所得产物的SEM图像。
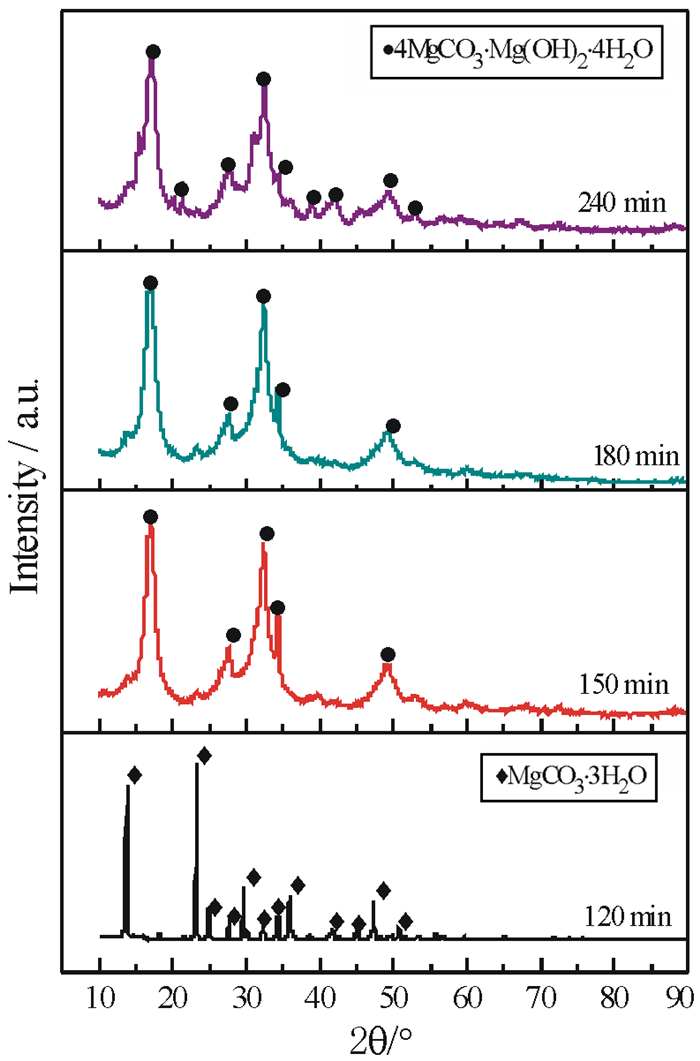 |
| 图 1 不同热解时间制备所得产物的XRD图谱 Fig.1 XRD patterns of products prepared at different times |
 |
|
图 2 不同热解时间所得产物的SEM图 Fig.2 SEM of products prepared at different reactive times
(a)5 min;(b)30 min;(c)60 min;(d)90 min;(e)120 min; (f)150 min;(g)150 min产物局部放大;(h)180 min;(i)240 min |
由图 1可知,120 min时所得产物的全部衍射峰与单斜晶系的三水碳酸镁(MgCO3·3H2O)的XRD标准图谱(JCPDS 00-020-0669)相符合,其空间群为P121/n1(14),晶格常数为a=12.11 Å,b=5.365 Å,c=7.697 Å,β=90.42°。衍射峰形尖锐,强度较高,未发现杂质峰,说明此时所制备的MgCO3·3H2O结晶良好,无其他物质存在。150~180 min时,产物中MgCO3·3H2O的特征峰消失,衍射峰位置全部与碱式碳酸镁(4MgCO3·Mg(OH)2·4H2O)的XRD标准图谱(JCPDS 00-025-0513)一致,其晶格常数为a=10.11 Å,b=8.95 Å,c=8.38 Å,β=114.44°。与120 min时MgCO3·3H2O的特征峰相比,4MgCO3·Mg(OH)2·3H2O的衍射峰宽,强度低,且基底不平滑,说明在该段时间内MgCO3·3H2O晶体消失,而得到尺寸小,结晶度较差的4MgCO3·Mg(OH)2·3H2O。240 min时产物衍射峰数量增多,且位置与4MgCO3·Mg(OH)2·3H2O一致,峰窄且基底平滑,说明此时所得4MgCO3·Mg(OH)2·3H2O结晶良好。XRD检测结果表明,保持其他条件不变,120 min时制备所得产物为结晶良好的MgCO3·3H2O,当热解时间继续延长,MgCO3·3H2O逐渐转变为4MgCO3·Mg(OH)2·3H2O。
由图 2可见,5 min时溶液中为产物为无定形颗粒(图 2a),30~120 min无定形颗粒逐渐转变为光滑针状晶体或棒状晶须,随着热解时间的延长,棒状晶须长度不断增加,长径比增大,粒径均匀性变好(图 2b~2d)。120 min时棒状MgCO3·3H2O晶须表面非常光滑,其平均直径为6.0 μm,平均长度为100 μm(图 2e)。150 min时,所得产物仍为长径比较大的棒状晶须,但从放大图(图 2g)中可以看出,棒状晶须表面变粗糙,明显长着片状颗粒。180 min时,表面不光滑的棒状晶体长度变短,并且产物中还夹杂部分短粗柱状晶体(图 2h),240 min时,光滑棒状晶体消失,产物全部为表面由多孔结构组成的棒状4MgCO3·Mg(OH)2·3H2O晶体,多孔结构由纳米片交叉重叠构成,叶片成弯曲状,叶片的厚度仅为几纳米(图 2i)。
结合前期研究结果以及上述分析可知[24],低温(≤50 ℃)热分解重镁水,首先生成亚稳相MgCO3·3H2O晶体,随着时间延长,MgCO3·3H2O逐渐转变为4MgCO3·Mg(OH)2·3H2O,因此选择热解时间为120 min。
2.2 重镁水溶液质量浓度的影响图 3为热解不同质量浓度(简称浓度)重镁水溶液所得产物的XRD图,图 4为热解不同浓度Mg(HCO3)2溶液所得产物的SEM图。
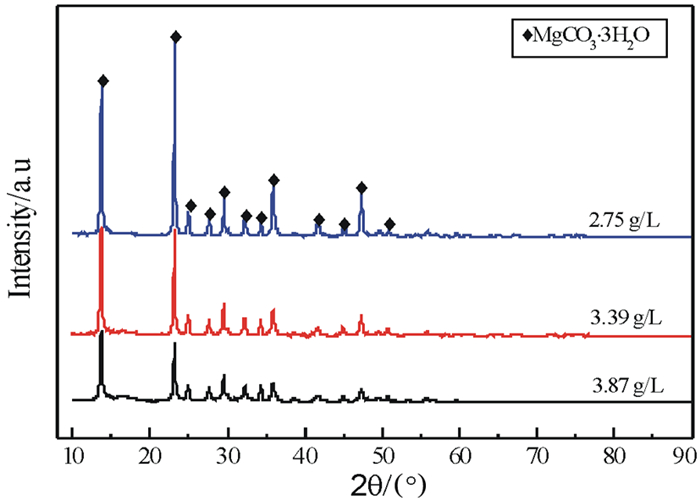 |
| 图 3 热解不同浓度重镁水溶液所得产物的XRD图谱 Fig.3 XRD patterns of products prepared at different concentrations of Mg(HCO3)2 solution |
 |
| 图 4 热解不同浓度重镁水溶液所得产物的SEM图 Fig.4 SEM of products prepared at different concentrations of Mg(HCO3)2 solution (a)3.87 g/L; (b)3.39 g/L; (c)2.75 g/L |
由图 3的XRD谱图可知,50 ℃时,热解不同浓度重镁水溶液所得产物均为MgCO3·3H2O,其衍射峰基底平滑,无其他杂峰,表明不同浓度下所得MgCO3·3H2O晶体结晶良好,相对纯度较高;但较低浓度所得MgCO3·3H2O晶体衍射峰强度远远大于较高浓度下所得产物的峰强,说明较低浓度下所得MgCO3·3H2O晶体结晶度优于较高浓度下所得晶体。
观察图 4发现,重镁水溶液浓度较高时,所得产物均为表面长着颗粒状碎末的MgCO3·3H2O晶体,其粒径均匀性变差,长径比较小(图 4a)。当浓度降低至3.39 g/L时,产物中同时存在表面不光滑、长着碎末状颗粒以及表面非常光滑的棒状MgCO3·3H2O晶须,其平均直径2.6 μm,平均长度40 μm(图 4b)。Mg(HCO3)2溶液浓度进一步降低至2.75 g/L时,产物全部为表面非常光滑、粒径均匀、平均直径2.5 μm、平均长度30 μm的棒状MgCO3·3H2O晶须(图 4c)。由结晶热力学理论可知,溶液过饱和度愈大,临界晶核的尺寸愈小,转为二次结晶中心的粒子数愈多。因此较高浓度下所得MgCO3·3H2O棒状晶体表面不光滑并附着许多无定形碎末是已生成的MgCO3·3H2O发生溶解所致。
为了得到纯度高、结晶良好、表面光滑的三水碳酸镁晶须,控制重镁水溶液浓度在2.75~3.39 g/L之间。
2.3 搅拌速率的影响重镁水溶液是一种极不稳定的溶液,搅拌强度对溶液的稳定性影响较大,提高搅拌强度能加速重镁水溶液的分解,因此考察了搅拌速率对产物组成和形貌的影响,结果如图 5和图 6所示。
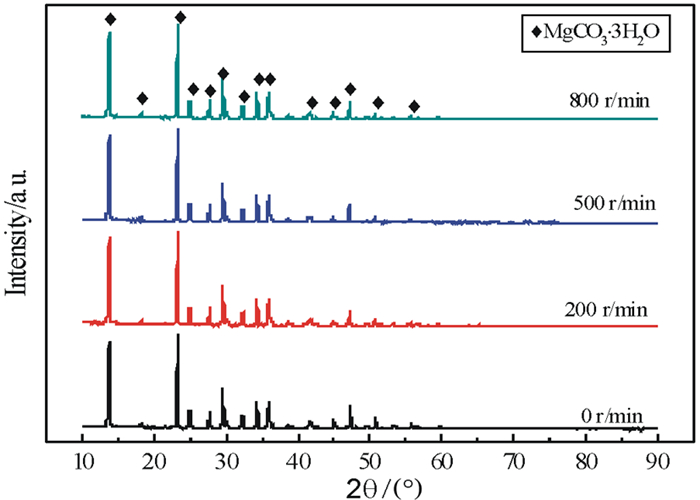 |
| 图 5 不同搅拌速率下所得产物的XRD图谱 Fig.5 XRD curves of products prepared at different stirring speeds |
 |
|
图 6 不同搅拌速率下所得产物的SEM图 Fig.6 SEM of products prepared at different stirring speeds
(a)0 r/min; (b)200 r/min; (c)400 r/min; (d)500 r/min; (e)600 r/min; (f)800 r/min |
结合产物的XRD图谱(图 5)和SEM图像(图 6)可知,低温热分解重镁水过程中,搅拌速率对产物的物相组成和形貌均无显著影响。不同搅拌速率下均得到光滑棒状MgCO3·3H2O晶须,但在低转速下,产物的产率较低,结晶速度慢,而高转速下,已生成的棒状晶体容易被搅拌桨搅断,会使晶体长度变短,长径比下降。试验过程中还发现无搅拌时,晶体的产率较低,搅拌时,所生成的晶体品质和产率均较高[24]。这是由于当溶液处于无搅拌作用(即处于平衡状态)时,溶液中自发产生的第一批沉淀物在溶液中混合不均匀,传质较为困难,所产生的结晶中心数目有限,从而对后续结晶过程中的成核产生消极的影响。当搅拌溶液时,在接近溶液变为不稳态的一瞬间,首先自发产生的沉淀物进入溶液,搅拌作用加速了其从溶液本体向表面的扩散进程,减小了表面层溶液的厚度,从而使得溶液中出现浓度的波动,产生局部高过饱和区。在这些局部高过饱和区,溶液过饱和度增大,晶体成核和生长速率均相应增大。此外,搅拌作用使晶体之间的互碰频率增大,而互碰又会使晶体破碎,最终使得表面积增大。
综上所述,考虑到需要获得产率较高和长径比较大的晶须,因此选择适宜的搅拌速率为500 r/min。
3 机理分析 3.1 三水碳酸镁晶体生长基元根据MgCO3·3H2O XRD表征结果中的晶胞参数,采用Diamond软件模拟绘制MgCO3·3H2O沿b轴[010]方向的晶体结构图,如图 7所示。
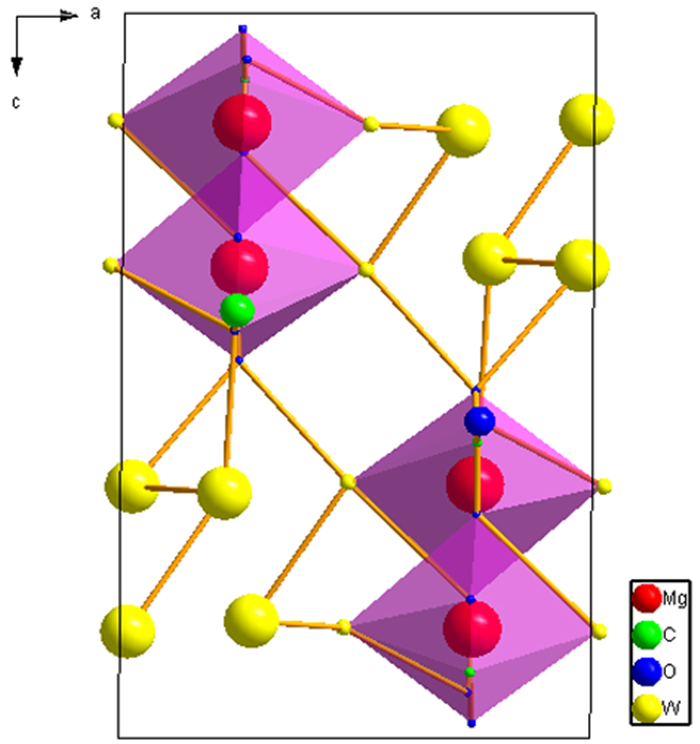 |
| 图 7 沿a轴[010]方向的三水碳酸镁的晶体结构图 Fig.7 Crystal structure of nesquehonite in projection parallel to a [010] |
由图 7可知,结晶过程发生前形成的较强的O-H和C-O键相互作用分别形成了MgCO3·3H2O晶体结构中的H2O和CO32-,而结晶过程中形成的较弱的Mg-O键则沿着[010]方向构成扭曲的[MgO6]正八面体。MgCO3·3H2O的生长基元为[MgO6],晶体结构中,每个CO32-连接三个[MgO6]正八面体,其中两个正面体以共顶点方式连接,另一个以共棱的方式连接。MgCO3·3H2O通过Mg-O键以共顶点的方式紧密相连,沿化学键作用力较强的[010]方向无限连接形成长链。
3.2 MgCO3·3H2O结晶动力学分析低温热分解重镁水溶液制备MgCO3·3H2O晶须是一个复杂的多相结晶过程。由前述结果讨论可知,重镁水浓度对三水碳酸镁的形貌和组成具有重要的影响。由前述结果可知,MgCO3·3H2O晶体是在间歇结晶过程中产生的,在开始的某段时间内,溶液浓度实际上保持不变,这段时间称为诱导期tind,其为结晶过程的主要动力学特征之一。诱导期时间很大程度上依赖于过饱和度和温度等因素[25]。因浓度随时间的变化在一定程度上反映了结晶动力学,因此用以判断结晶进程的主要指标之一是溶液中物质的浓度。按照相生成的热力学理论,诱导期时间的计算公式为[25]:
| $ \lg {t_{{\rm{ind}}}} = {k_{{\rm{ind}}}} - {n_{\rm{N}}}\lg \left( {c/{c_{{\rm{eq}}}}} \right) = {k_{{\rm{ind}}}} - {n_N}\lg s $ | (1) |
式中:kind=lg[Δc/mNkNceqnN)];mN和kN为常数;nN表示过程阶数。当s>1时,上述关系式是正确的。
通常,采用绝对过饱和度Δc、相对过饱和度δ与过饱和系数s来表示过饱和度,这三者的计算公式分别为:
| $ \mathit{\Delta c = c - }{\mathit{c}_{{\rm{eq}}}} $ | (2) |
| $ \delta = \left( {c - {c_{{\rm{eq}}}}} \right)/{c_{{\rm{eq}}}} $ | (3) |
| $ s = c/{c_{{\rm{eq}}}} $ | (4) |
在上述三个方程式中,c表示溶液的初始浓度,g·(100 mL)-1 H2O或g·(100 g)-1 H2O;ceq表示平衡时MgCO3·3H2O的浓度即溶解度,g·(100 mL)-1 H2O。由于MgCO3·3H2O是亚稳相晶体,其溶解度随着温度的增大而减小,19 ℃时溶解度达最大值,为0.151 8 g·(100 mL)-1 H2O,为了计算方便,将50 ℃时MgCO3·3H2O的溶解度约等于0.151 8 g·(100 mL)-1 H2O。
试验过程中测定了浓度为c1~c9时所对应的三水碳酸镁结晶过程中诱导期时间tind1~tind9,并根据公式(1)~(4)计算得到其对应的Δc、δ和s,结果如表 1所示。
| 表 1 50 ℃时,结晶过程中溶液的过饱和度和诱导期时间 Table 1 The supersaturation and induction time of solution during the crystallization for 50 ℃ |
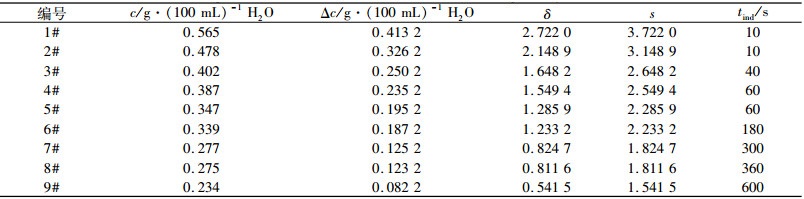 |
根据表 1中的数据,并按照公式(1)对lgtind与lgs进行线性拟合计算,可得到两者的关系式,结果如图 8所示。
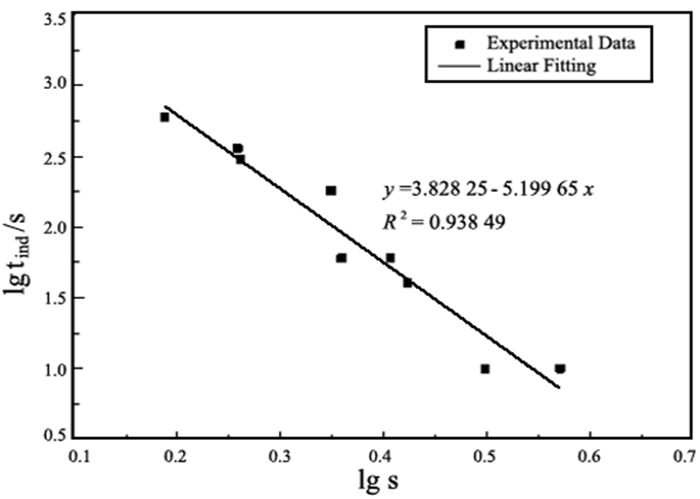 |
| 图 8 lgtind与lgs的关系 Fig.8 Relationship between lgtind and lgs |
由图 8可知,lgtind与f(lgs)呈线性关系y=3.828 25-5.199 65x,决定系数R2=0.983 49,说明该模型拟合程度较高。即便将直线外推至lgtind→0的过饱和度,也可求得与很小的lgtind值相应的lgs值,不会因为数据的波动和布点数的变化而显著改变。热分解重镁水溶液生成MgCO3·3H2O的反应是吸热反应,提高热解温度有利于反应向右进行。温度和其他条件相同时,tind的延续时间随重镁水浓度的降低而大大延长,随着溶液浓度的增大而缩短,模型拟合结果与试验所测数据良好吻合。诱导期结束即结晶刚开始发生的这一瞬间,HCO3-离子浓度变化趋于迅速减小,CO32-离子浓度变化则趋于迅速增加,MgCO3·3H2O过饱和溶液形成。由于分子间的向心力,范德华力以及氢键具有选择性和方向性,它们通过加和和协调作用促使结晶中心大量形成,从而使得重镁水溶液热解速度明显加快。由经典结晶理论可知,当Mg2+、CO32-、OH-、Mg2+与CO32-或Mg2+与OH-缔合离子对迁移到晶体表面时,并不是立即进入晶格,而是失去一个自由度,在晶体表面自由移动,从而在晶体表面(晶体相)与溶液(亚稳相)交界面形成一个吸附层,这个吸附层与重镁水溶液间建立动力学平衡。由晶体生长动力学可知,离子或离子对总是容易或优先与晶格吸引力最大的位置相连,因此最终得到多孔棒状4MgCO3·Mg(OH)2·3H2O,其生长示意图如图 9所示。
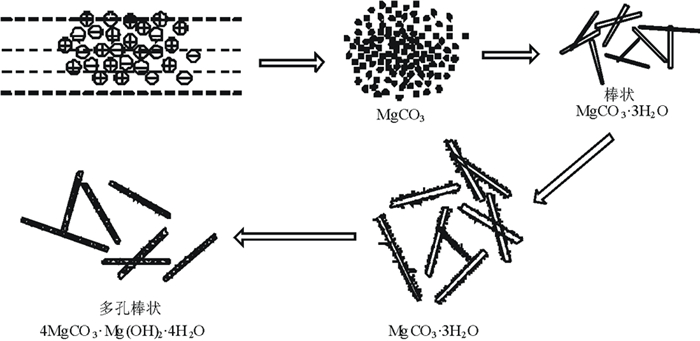 |
| 图 9 热解重镁水溶液过程中三水碳酸镁的生长示意图 Fig.9 The schematic diagram of nesquehonite crystals during pyrolysis |
由图 9可知,热分解重镁水溶液过程中,无定形物首先转化成亚稳态的棒状MgCO3·3H2O晶体,溶液浓度或热解时间等条件发生改变时,棒状MgCO3·3H2O晶体表面或整个棒状结构会发生溶解重新形成无定形颗粒,最终形成多孔棒状4MgCO3·Mg(OH)2·3H2O。
4 结论(1) 热分解温度50 ℃,热解时间120 min时,热分解重镁水溶液制备得到表面光滑,平均直径为6.0 μm、平均长度为100 μm的棒状MgCO3·3H2O晶须。时间继续延长,MgCO3·3H2O逐渐转变为多孔棒状4MgCO3·Mg(OH)2·4H2O。
(2) 重镁水浓度对MgCO3·3H2O的结晶度和表面光洁度有影响,浓度越低,MgCO3·3H2O结晶度越高,表面越光滑。搅拌速率对MgCO3·3H2O的组成和形貌无显著影响,但影响晶体的产率,适宜的搅拌速率为500 r/min。
(3) MgCO3·3H2O的生长基元为[MgO6]正八面体,其通过Mg-O键以共顶点的方式紧密相连,沿化学键作用力较强的[010]方向无限连接形成长链。采用线性拟合计算得lgtind与f(lgs)的关系为y=3.828 25-5.199 65x,决定系数R2=0.983 49,拟合结果与试验结果良好吻合,重镁水溶液浓度增大,诱导期时间缩短。
(4)热分解重镁水溶液过程中,无定形物首先转化成亚稳态的棒状MgCO3·3H2O晶体,溶液浓度或热解时间等条件发生改变时,棒状MgCO3·3H2O晶体表面或整个棒状结构会发生溶解重新形成无定形颗粒,最终形成多孔棒状4MgCO3·Mg(OH)2·3H2O。
| [1] |
Freitag F, Kleinebudde P. How roll compaction and dry granulation affect the tableting behaviour of inorganic materials:Comparison of four magnesium carbonates[J]. Eur. J. pharm. sci, 2003, 19: 281-289. DOI:10.1016/S0928-0987(03)00133-7 |
| [2] |
庞洪昌.水镁石的诱导转晶制备含镁微纳米材料及应用性能研究[D].大连: 大连理工大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10141-1012271828.htm
|
| [3] |
田朋.碳酸镁模板化制备复杂微纳米结构及性能表征[D].大连: 大连理工大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10141-1013197919.htm
|
| [4] |
Ding Wenjin, Ouyang Jing, Yang Huaming. Synthesis and characterization of nesquehonite (MgCO3 center dot 3H2O) powders from natural talc[J]. Powder technology, 2016, 292(3): 169-175. |
| [5] |
闫平科, 田海山, 高玉娟, 等. 高长径比三水碳酸镁晶须的合成研究[J]. 人工晶体学报, 2012, 41(1): 158-164. DOI:10.3969/j.issn.1000-985X.2012.01.032 |
| [6] |
Mitsuhashi K, Tagami N, Tanabe K. Synthesis of microtubes with a surface of "house of cards" structure via needlelike particles and control of their pore size[J]. Langmuir, 2005, 21: 3659-3663. DOI:10.1021/la047580o |
| [7] |
Kovacheva A, Rabadjieva D, Tepavitcharova St. Simulation of stable and metastable sea-type carbonate systems for optimization of MgCO3 center dot 3H2O precipitation from waste sea brines[J]. Desalination, 2014, 348(9): 66-73. |
| [8] |
Jauffret G, Morrison J, Glasser F P. On the thermal decomposition of nesquehonite[J]. J. therm. anal. calorim, 2015, 122: 601-609. DOI:10.1007/s10973-015-4756-0 |
| [9] |
Wang Y, Li Z B. Demopoulos GR controlled precipitation of nesquehonite (MgCO3·3H2O) by the reaction of MgCl2 with (NH4)2CO3[J]. Journal of crystal growth, 2008, 310(6): 1220-1227. DOI:10.1016/j.jcrysgro.2008.01.002 |
| [10] |
邵明浩, 史永刚, 胡泽善. 碳酸镁晶须的制备、表征与分析方法[J]. 后勤工程学院学报, 2008, 24(1): 37-40. DOI:10.3969/j.issn.1672-7843.2008.01.010 |
| [11] |
杨晨.多晶相水合碳酸镁结晶生长过程调控研究[D].上海: 华东理工大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10251-1013211507.htm
|
| [12] |
Yang Chen, Song Xingfu, Sun Shuying, et al. Effects of sodium dodecyl sulfnate on the oriented growth of nesquehonite whiskers[J]. Advanced powder technology, 2013, 24: 585-592. DOI:10.1016/j.apt.2012.10.005 |
| [13] |
Du Juan, Chen Zhen, Wu Yu-Long, et al. Study on crystal transformation process of magnesium carbonate hydrate based on salt lake magnesium resources utilization[J]. Turkish journal of chemistry, 2013, 37(2): 228-238. |
| [14] |
闫平科, 卢智强, 高玉娟, 等. 束状三水碳酸镁晶体合成及动力学研究[J]. 人工晶体学报, 2015, 44(12): 3606-3611. DOI:10.3969/j.issn.1000-985X.2015.12.044 |
| [15] |
闫平科, 程书林, 卢智强, 等. 油酸钠对三水碳酸镁晶须稳定性的研究[J]. 硅酸盐通报, 2016, 35(3): 732-735. |
| [16] |
闫平科, 薛国梁, 高玉娟, 等. 表面活性剂对三水碳酸镁晶须形貌的影响研究[J]. 硅酸盐通报, 2013, 32(9): 1729-1740. |
| [17] |
吴丹, 王玉琪, 武海虹, 等. 三水碳酸镁合成与形貌演变过程研究[J]. 人工晶体学报, 2014, 43(3): 606-613. DOI:10.3969/j.issn.1000-985X.2014.03.024 |
| [18] |
王素平, 肖殷, 王世荣, 等. 高镁转化率三水碳酸镁晶须生长条件的研究[J]. 功能材料, 2016, 47(2): 2116-2129. DOI:10.3969/j.issn.1001-9731.2016.02.024 |
| [19] |
陈敏, 李月圆, 王健东, 等. 利用菱镁矿制备碳酸镁晶须[J]. 硅酸盐学报, 2009, 37(10): 1649-1653. DOI:10.3321/j.issn:0454-5648.2009.10.011 |
| [20] |
欧龙, 刘家祥. 重镁水中通入空气制备三水碳酸镁晶须[J]. 硅酸盐学报, 2016, 44(1): 104-111. |
| [21] |
王余莲, 印万忠, 钟文兴, 等. 微纳米三水碳酸镁晶须的制备及性能[J]. 中南大学学报(自然科学版), 2014, 45(3): 708-713. |
| [22] |
王余莲, 印万忠, 姚金, 等. 菱镁矿法合成微纳米三水碳酸镁晶须的研究[J]. 东北大学学报(自然科学版), 2014, 35(9): 1335-1339. DOI:10.3969/j.issn.1005-3026.2014.09.027 |
| [23] |
王余莲, 印万忠, 张夏翔, 等. 大长径比三水碳酸镁晶须的制备及晶体生长机理[J]. 硅酸盐学报, 2018, 46(7): 944-951. |
| [24] |
王余莲.微/纳米水合碳酸镁的制备及应用研究[D].沈阳: 东北大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10145-1016009242.htm
|
| [25] |
叶铁林. 化工结晶过程原理及应用[M]. 北京: 北京工业大学出版社, 2006.
|
 2018
2018 
