| 铜渣改性制备多孔硅酸盐负载微纳米零价铁及其去除废水中的Cr(VI) |
铜渣是铜精矿火法冶炼过程中产生的废渣,含有多种有价金属,其中含有30%~40%的铁、0.5%~2.1%的铜,具有重要的回收价值[1]。铜渣中的铜矿物一般通过浮选回收,浮选后产生90%以上的尾渣[2]。铜渣中的铁主要以铁橄榄石和超细磁铁矿形式存在,难以通过物理选矿技术进行回收。除少量用于生产水泥外,铜渣以堆存为主。中国目前已经堆存了数亿吨铜渣,且以每年近2 000万t的速度增长。大量的铜渣堆存不仅浪费了宝贵的金属资源,而且其中的重金属进入水和土壤中将会引起严重的环境问题。因此,亟需研发新工艺实现铜渣的综合利用。
零价铁水处理技术是利用金属铁的腐蚀电化学原理的废水处理工艺,能够高效去除废水中的有机污染物、重金属离子、硝酸盐、砷酸盐等多种污染物[3-5]。其作用机理主要为:(1)金属铁及其氧化后产生的Fe2+还原污染物;(2)金属铁氧化产生的Fe(OH)2、Fe(OH)3、Fe2O3、Fe3O4对污染物的吸附、絮凝和沉淀作用;(3)电极反应产生的活性氢还原破坏污染物。粒度是影响零价铁活性的关键因素之一,减小粒度、增加比表面积,可提其降解染物的效率[6]。因此,许多学者将纳米零价铁用于废水处理,结果表明纳米零价铁能够快速降解废水中的污染物[7-8]。但是纳米零价铁反应后生成磁铁矿,在水体中容易聚集,导致反应活性降低。为了解决这个问题,很多学者将纳米零价铁负载在黏土矿物、活性炭、壳聚糖、聚合高分子等多孔材料表面,避免纳米铁聚集,以提高污染物的去除效率[9]。目前负载型纳米铁的制备方法主要有:(1)多孔载体与铁盐水溶液混合后在液相中经NaHB4或KBH4还原,或干燥后在高温下用还原性气体还原;(2)多孔碳材料和铁盐水溶液混合后,在高温下进行还原焙烧。但是这些制备方法的成本很高,从而限制了负载型纳米铁在水处理中的应用。因此研发低成本高性能的微细粒铁材料是零价铁水处理技术的重点研究方向。
铜渣中铁含量丰富,很多学者研究采用碳热还原焙烧法处理铜渣,将铜渣中的铁矿物还原为金属铁,并促进金属铁颗粒长大,然后通过磨矿—磁选回收高品位的直接还原铁粉[10-12]。受此启发,本研究提出采用碳热还原焙烧技术处理铜渣,制备多孔硅酸盐镶嵌微纳米铁,并将其用于去除废水中的Cr(VI),考察了微纳米铁制备条件和废水降解条件对去除废水中Cr(VI)的影响,并探讨相关反应机理。
1 试验原料和试验方法 1.1 试验原料本研究采用的铜渣样品为江西某铜冶炼厂的铜渣浮选尾矿(以下简称铜渣),其粒度为-0.074 mm占94.80%,其化学分析结果见表 1,XRD物相分析和SEM-EDS分析结果分别见图 1和图 2。
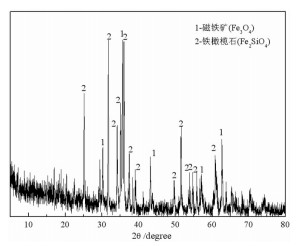 |
| 图 1 铜渣的XRD图谱 Fig.1 XRD pattern of copper slag |
 |
| 图 2 铜渣的SEM图 Fig.2 SEM image of copper slag |
|
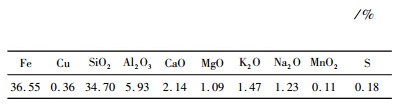
表 1 铜渣XRF分析结果 |
|
由表 1可知,铜渣含Fe 36.55%,含Cu 0.36%,主要脉石组分为SiO2和Al2O3,含量分别为34.70%和5.93%。XRD分析表明,铜渣中的主要矿物为铁橄榄石和磁铁矿。SEM分析结果表明,铁橄榄石、磁铁矿和硅酸盐玻璃相的嵌布关系复杂。此外,铜渣中发现了少量超细粒铜硫。试验所用还原剂为无烟煤,其工业分析结果表明其含有0.80%水分、81.11%固定碳、10.91%灰分和7.18%挥发分。将无烟煤粉碎至-0.1 mm后备用。
1.2 试验方法(1) 微纳米铁的制备方法:将30 g铜渣、无烟煤(10%~30%)、羧甲基纤维素钠(0.5%)和水(25%)混合均匀后,制备成直径约10 mm的球团。将湿球在105 ℃的烘箱中干燥2 h后置于石墨坩埚中,待马弗炉内温度达到设定温度后,将坩埚放入炉膛中焙烧一定时间,焙烧结束后将坩埚取出并在空气中冷却。球团冷却后取出一部分研磨至-0.1 mm使用。
(2) 废水处理:用分析纯重铬酸钾试剂配置Cr(VI)模拟废水,在500 mL的烧杯中装入400 mL废水,烧杯放入水浴锅中控制废水温度,用H2SO4和NaOH溶液调节废水的初始pH,加入一定量的微纳米铁,并用机械搅拌器搅拌(转速为400 r/min)。反应一定时间后,分析水样分析残余的Cr(VI)浓度,计算污染物去除率。采用二苯碳酰二肼分光光度法测水中Cr(VI)。
2 结果与讨论 2.1 焙烧条件对微纳米铁去除Cr(VI)的影响铁矿物的还原焙烧转化为零价铁的过程受焙烧温度、焙烧时间和煤用量影响很大,为了获得最佳性能的微纳米铁,研究焙烧条件对微纳米铁去除Cr(VI)的影响。微纳米铁用量设为1 g/L,Cr(VI)浓度为10 mg/L,废水初始pH为4。
2.1.1 焙烧温度对微纳米铁去除Cr(VI)的影响在焙烧时间40 min、煤用量25%的条件下,研究焙烧温度对微纳米铁去除Cr(VI)的影响,结果见图 3。
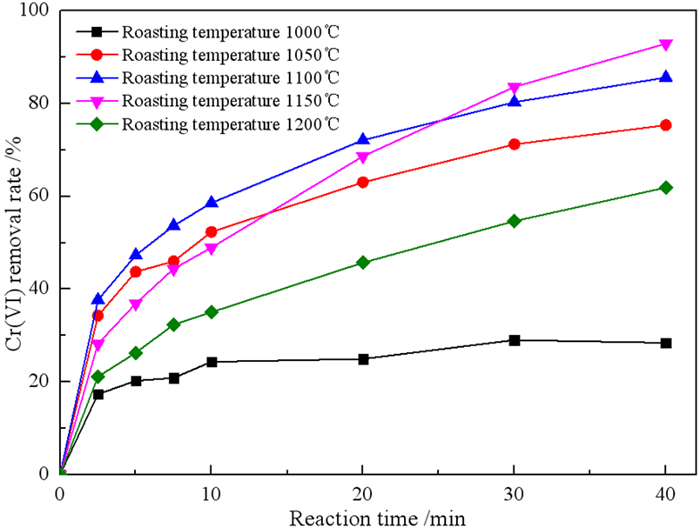 |
| 图 3 焙烧温度对微纳米铁去除Cr(VI)的影响 Fig.3 Effect of calcination temperature on removal of Cr(VI) by micro-nano-iron |
由图 3可知,当焙烧温度为1 000 ℃时,反应40 min后Cr(VI)去除率仅为28.43%,而当焙烧温度为1 150 ℃时,反应40 min Cr(VI)的去除率增加到92.95%。而当焙烧温度进一步升高到1 200 ℃时,反应40 min后的去除率下降为61.90%。这可能是由于焙烧温度影响零价铁的形成和聚集,在一定范围内提高焙烧温度会促进零价铁的形成,从而有利于去除Cr(VI)。进一步提高焙烧温度不会产生更多的零价铁,但会促进零价铁颗粒聚集,从到导致与Cr(VI)接触的机会减少,使Cr(VI)的去除率下降。所以确定最佳焙烧温度为1 150 ℃。
2.1.2 焙烧时间对微纳米铁去除Cr(VI)的影响在焙烧温度1 150 ℃、煤用量25%的条件下,研究焙烧时间对微纳米铁去除Cr(VI)的影响,结果见图 4。
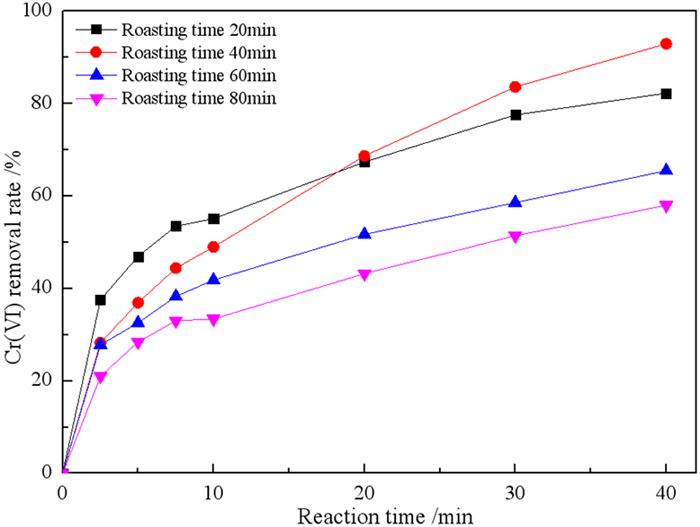 |
| 图 4 焙烧时间对微纳米铁去除Cr(VI)的影响 Fig.4 Effect of calcination time on the removal of Cr(VI) by micro-nano iron |
如图 4可知,当焙烧时间从20 min增加到40 min时,反应40 min后Cr(VI)的去除率从82.24%增加到92.95%。当焙烧时间增加到60 min和80 min时,反应40 min后Cr(VI)的去除率分别降低到65.48%和58.00%。焙烧时间超过60 min后,微纳米铁性能的下降可能也是由于零价铁颗粒的聚集造成的。所以确定最佳焙烧时间为40 min。
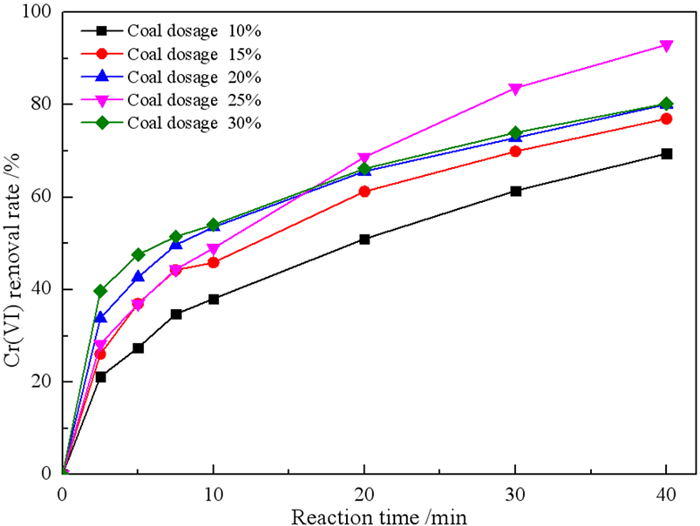
2.1.3 煤用量对微纳米铁去除Cr(VI)的影响在焙烧温度1 150 ℃、焙烧时间40 min的条件下,研究煤用量对微纳米铁去除Cr(VI)的影响,结果见图 5。
 |
| 图 5 煤用量对微纳米铁去除Cr(VI)的影响 Fig.5 Effect of coal dosage on the removal of Cr(VI) by micro-nano iron |
由图 5可知,当煤用量分别为10%、15%、20%和25%时,在40 min内的Cr(VI)去除率分别为69.41%、76.97%、80.08%和92.95%。但是,当煤用量增加到30%时,反应40 min内Cr(VI)去除率下降到80.23%。这是因为在煤量不足的情况下,铁矿物无法完全转化为零价铁,但是煤用量过高时,焙烧产品中残余碳含量会增多,导致相同质量的微纳米铁中零价铁含量下降,从而不利于Cr(VI)的去除。所以确定最佳煤用量为25%。
根据以上试验结果,确定微纳米铁的最佳制备条件为焙烧温度1 150 ℃,焙烧时间40 min,煤用量25%。
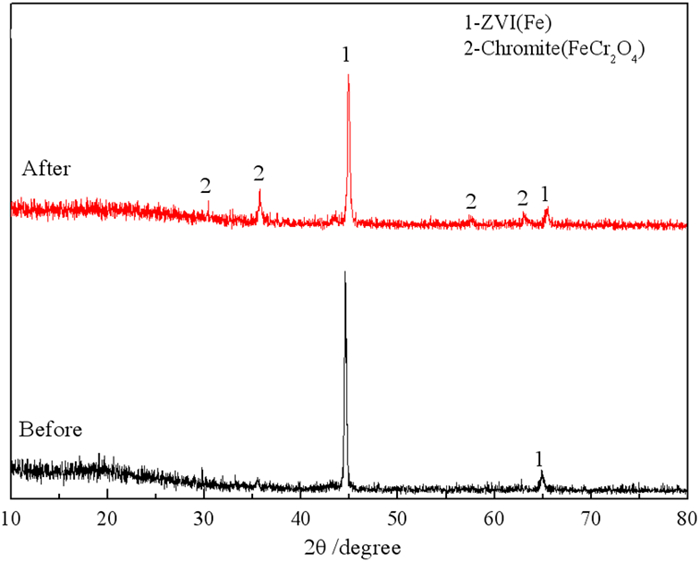
2.2 微纳米铁的表征最佳条件下制备的微纳米铁的XRD分析结果如图 11所示。反应前的微纳米铁中仅观察到零价铁的衍射峰,这说明在还原焙烧过程中铁矿物被还原为金属铁,而其他组分在高温下以熔态存在,在冷却过程中来不及结晶形成玻璃相。
 |
| 图 11 与Cr(VI)废水反应前后微纳米铁的XRD图谱 Fig.11 XRD pattern of micro-nano iron before and after reaction with Cr(VI) |
最佳条件下制备的微纳米铁的SEM和EDS分析结果如图 6所示。从图中可以看出,焙烧产物中形成了许多100 μm左右的孔洞,大量纳米级和微米级零价铁颗粒镶嵌在硅酸盐孔洞表面。这种结构有利于零价铁和废水接触,从而提高Cr(VI)的去除效率。EDS分析表明,零价铁含有0.46%的Cu,这说明含铜矿物被还原为金属铜并熔入零价铁。很多报道表明,引入铜可以提零价铁去除污染物的性能,因为铁和铜之间的还原电位差(0.78 V)可加快零价铁的腐蚀[13]。
 |
| 图 6 最佳条件下制备的微纳米铁的SEM图像和EDS结果 Fig.6 SEM images and EDS results of micro-nano iron prepared under optimal conditions |
2.3 反应参数对Cr(VI)去除的影响
零价铁降解废水过程除了受铁材料性质影响外,还受铁材料用量、废水pH、废水温度和污染物浓度等工艺参数影响,因此采用最佳条件下制备的微纳米铁进行试验,研究这些参数对Cr(VI)去除率的影响。
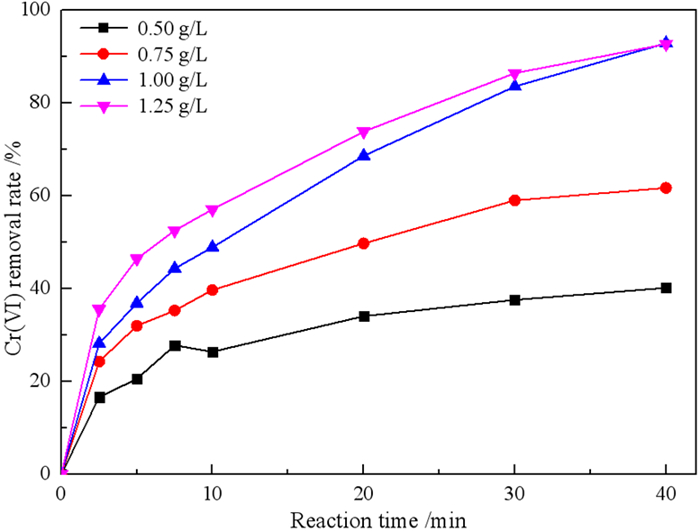
2.3.1 微纳米铁用量对Cr(VI)去除率的影响在废水Cr(VI)浓度为10 mg/L、初始pH为4、温度为27 ℃的条件下,研究微纳米铁用量对Cr(VI)去除率的影响,结果见图 7。
 |
| 图 7 微纳米铁用量对Cr(VI)去除率的影响 Fig.7 Effect of micro-nano iron dosage on the removal rate of Cr(VI) |
由图 7可知,Cr(VI)的去除率随微纳米铁用量的增加而提高。当微纳米铁用量分别为0.5、0.75、1.0和1.25 g/L时,在40 min内Cr(VI)的去除率分别为40.20%、61.78%、92.95%和92.76%。这是因为增加微纳米铁用量为反应提供了更多的活性位点,加速了反应过程。
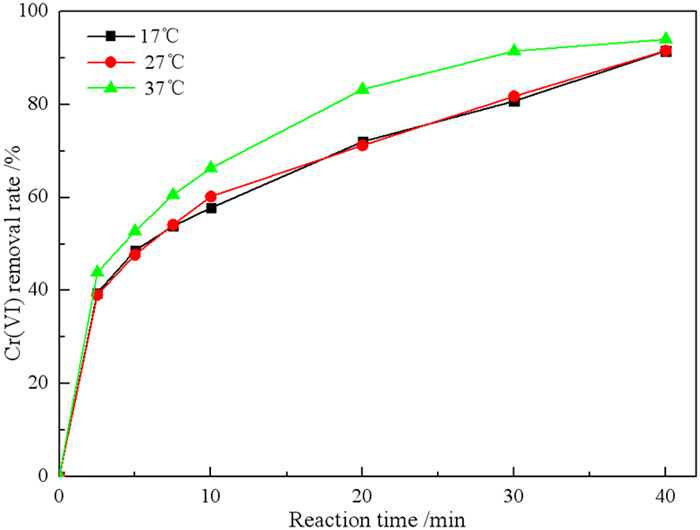
2.3.2 废水温度对Cr(VI)去除率的影响在废水Cr(VI)浓度为10 mg/L、微纳米铁用量1 g/L、废水初始pH为4的条件下,研究废水温度对微纳米铁去除Cr(VI)的影响,结果见图 8。
 |
| 图 8 废水温度对Cr(VI)去除率的影响 Fig.8 The effect of wastewater temperature on the removal rate of Cr(VI) |
由图 8可知,Cr(VI)的去除率随着废水温度的升高而增加。17 ℃下的Cr(VI)去除率略低于27 ℃。当废水温度升至37 ℃时,Cr(VI)的去除率明显提高。由此说明,微纳米铁可以在较宽的废水温度范围内去除Cr(VI)。
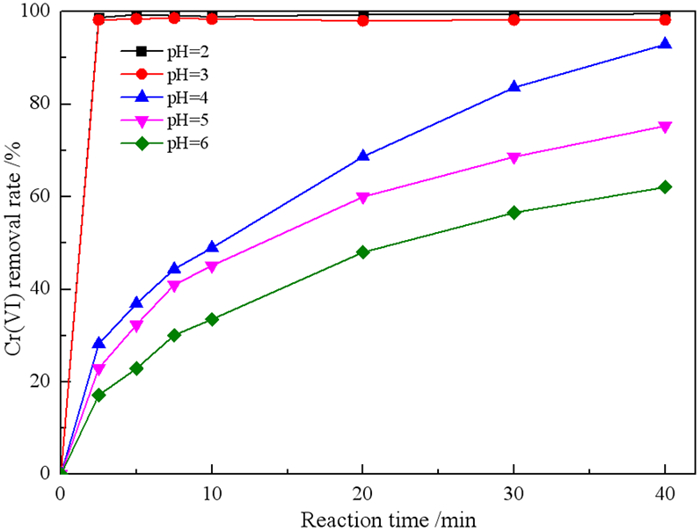
2.3.3 废水初始pH对Cr(VI)去除率的影响在废水Cr(VI)浓度为10 mg/L、微纳米铁用量1 g/L、废水温度为27 ℃的条件下,研究废水初始pH对微纳米铁去除Cr(VI)的影响,结果见图 9。
 |
| 图 9 废水初始pH对Cr(VI)去除率的影响 Fig.9 The effect of the initial pH of wastewater on the removal rate of Cr(VI) |
如图 9可知,当pH值为2和3时,反应2.5 min后几乎除去了100%的Cr(VI)。当pH值为4、5和6时,反应40 min后Cr(VI)的去除率分别为92.95%、75.29%和62.10%。这表明Cr(VI)去除速率随pH降低而增加,这是因为在较低的pH值下,零价铁的腐蚀加速,产生更多的Fe(Ⅱ)可以还原Cr(VI)。并且在较低pH值下,Cr和Fe的氢氧化物在零价铁表面上的沉淀过程将被抑制,有从而利于零价铁持续与Cr(VI)反应[14]。
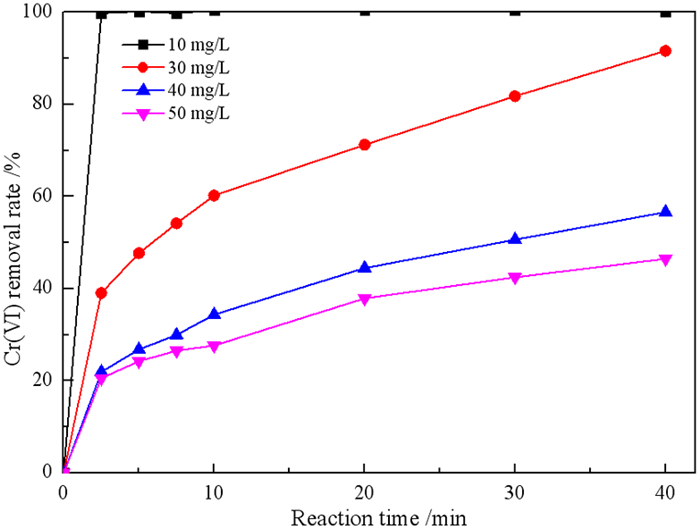
2.3.4 Cr(VI)浓度对Cr(VI)去除率的影响在微纳米铁用量1 g/L、废水初始pH为3、废水温度为27 ℃的条件下,研究Cr(VI)浓度对微纳米铁去除Cr(VI)的影响,结果见图 10。
 |
| 图 10 Cr(VI)浓度对Cr(VI)去除率的影响 Fig.10 The effect of Cr(VI) concentration on the removal rate of Cr(VI) |
如图 10可知,Cr(VI)的去除率随初始Cr(VI)浓度的增加而降低。当Cr(VI)初始浓度分别为10 mg/L、30 mg/L、40 mg/L和50 mg/L时,反应40 min后Cr(VI)的去除率分别为100%、91.64%、56.62%和52.25%。但是微纳米铁对Cr(VI)的绝对去除量分别为10 mg/g、27.49 mg/g、22.65 mg/g和26.13 mg/g,当Cr(VI)初始浓度为20 mg/L,微纳米铁对Cr(VI)的绝对去除量最高。
2.5 微纳米铁去除Cr(VI)的机理为了查明微纳米铁对Cr(VI)的去除机理,对反应后的微纳米铁进行XRD和SEM-EDS分析,结果分别如图 11和12所示。由图 11可知,反应后的微纳米铁中检测到零价铁和铬铁矿的衍射峰。图 12的SEM和EDS结果也显示,材料表面形成了铬铁矿。这说明微纳米铁不仅将高毒性的Cr(VI)还原为毒性较小的Cr(Ⅲ),而且Cr(Ⅲ)被矿化为铬铁矿。Cr(VI)(< 1 g/L)在pH为1~6的水溶液中主要以的形式存在,在pH大于6的水溶液中主要以存在[15]。在本试验中,零价铁与Cr(VI)之间可能发生的反应见反应(1)~(6)[16-17]。Fe0及其氧化后产生的Fe2+将Cr6+还原为Cr3+后,Fe3+与Cr3+共沉淀形成CrxFe1-x(OH)3,CrxFe1-x(OH)3再转化为铬铁矿和磁铁矿。
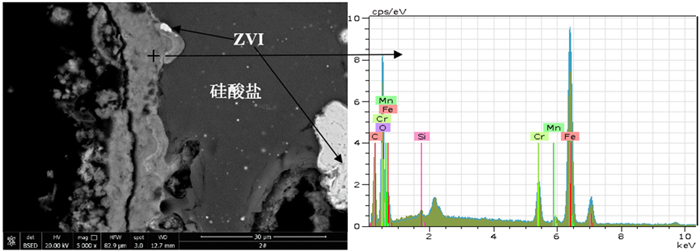 |
| 图 12 与Cr(VI)废水反应后微纳米铁的SEM图和EDS分析结果 Fig.12 SEM image and EDS analysis result of micro-nano iron after reaction with Cr(VI) |
| $ {2{\rm{HCrO}}_4^ - + 3{\rm{F}}{{\rm{e}}^0} + 14{{\rm{H}}^ + } \to 3{\rm{F}}{{\rm{e}}^{2 + }} + 2{\rm{C}}{{\rm{r}}^{3 + }} + 8{{\rm{H}}_2}{\rm{O}}} $ | (1) |
| $ {2{\rm{CrO}}_4^{2 - } + 3{\rm{F}}{{\rm{e}}^0} + 16{{\rm{H}}^ + } \to 3{\rm{F}}{{\rm{e}}^{2 + }} + 2{\rm{C}}{{\rm{r}}^{3 + }} + 8{{\rm{H}}_2}{\rm{O}}} $ | (2) |
| $ {{\rm{HCrO}}_4^ - + 3{\rm{F}}{{\rm{e}}^{3 + }} + 7{{\rm{H}}^ + } \to 3{\rm{F}}{{\rm{e}}^{3 + }} + 2{\rm{C}}{{\rm{r}}^{3 + }} + 4{{\rm{H}}_2}{\rm{O}}} $ | (3) |
| $ {{\rm{CrO}}_4^ - + 3{\rm{F}}{{\rm{e}}^{2 + }} + 8{{\rm{H}}^ + } \to 3{\rm{F}}{{\rm{e}}^{3 + }} + 2{\rm{C}}{{\rm{r}}^{3 + }} + 4{{\rm{H}}_2}{\rm{O}}} $ | (4) |
| $ {\left( {1 - x} \right){\rm{F}}{{\rm{e}}^{3 + }} + x{\rm{C}}{{\rm{r}}^{3 + }} + 3{{\rm{H}}_2}{\rm{O}} \to {\rm{C}}{{\rm{r}}_x}{\rm{F}}{{\rm{e}}_{1 - x}}{{({\rm{OH}})}_3} + 3{{\rm{H}}^ + }} $ | (5) |
(1) 在一定范围内提高焙烧温度、焙烧时间和煤用量有利于微纳米铁去除Cr(VI),微纳米铁的最佳制备条件为:焙烧温度为1 150 ℃,煤用量为25%,焙烧时间为40 min。
(2) 提高微纳米铁用量和废水温度,降低废水初始pH,均可提高Cr(VI)的去除率。在微纳米铁用量为1 g/L、废水温度为27 ℃、初始pH为3、Cr(VI)浓度为10 mg/L的条件下,反应2.5 min后即可去除100%的Cr(VI)。
(3) 最佳条件下制备的微纳米铁呈多孔结构,大量纳米级至微米级的零价铁颗粒分布在硅酸盐孔洞表面。与Cr(VI)反应后,将Cr(VI)还原为Cr(Ⅲ),并形成铬铁矿。
| [1] |
GORAI B, JANA R K, PREMCHAND. Characteristics and utilisation of copper slag-a review[J]. Resources, Conservation and Recycling, 2003, 39(4): 299-313. |
| [2] |
翟启林, 刘润清, 王琛, 等. 保温缓冷对铜渣结晶性能及铜浮选的影响[J]. 矿产保护与利用, 2019, 39(3): 75-80. |
| [3] |
KIM M S, PIGGOTT E, ZRINYI N, et al. Reduction of chlorendic acid by zero-valent iron:Kinetics, products, and pathways[J]. Journal of Hazardous Materials, 2020, 384: 121269. |
| [4] |
CHENG R, LI G, SHI L, et al. The mechanism for bacteriophage f2 removal by nanoscale zero-valent iron[J]. Water Research, 2016, 105: 429-435. |
| [5] |
XIE P, ZHANG L, CHEN J, et al. Enhanced degradation of organic contaminants by zero-valent iron/sulfite process under simulated sunlight irradiation[J]. Water Research, 2019, 149: 169-178. |
| [6] |
SUN Y, LI J, HUANG T, et al. The influences of iron characteristics, operating conditions and solution chemistry on contaminants removal by zero-valent iron:A review[J]. Water Research, 2016, 100: 277-295. |
| [7] |
LIU Z, DONG S, ZOU D, et al. Electrochemically mediated nitrate reduction on nanoconfined zerovalent iron:Properties and mechanism[J]. Water Research, 2020, 173: 115596. |
| [8] |
RONAVARI A, BALAZS M, TOLMACSOV P, et al. Impact of the morphology and reactivity of nanoscale zero-valent iron (NZVI) on dechlorinating bacteria[J]. Water research, 2016, 95: 165-173. |
| [9] |
ZOU Y, WANG X, KHAN A, et al. Environmental remediation and application of nanoscale zero-valent iron and its composites for the removal of heavy metal ions:a review[J]. Environmental Science & Technology, 2016, 50(14): 7290-7304. |
| [10] |
许冬, 春铁军, 陈锦安. 铜渣高温快速还原焙烧-磁选回收铁的研究[J]. 矿冶工程, 2017, 37(1): 89-91. |
| [11] |
曹志成, 孙体昌, 薛逊, 等. 铜渣转底炉直接还原磁选与熔分工艺比较[J]. 中南大学学报(自然科学版), 2017, 48(10): 2565-2571. |
| [12] |
张汉泉, 高王杰, 胡超杰, 等. 铜渣煤基直接还原过程中的铁物相转变[J]. 钢铁研究学报, 2020, 32(4): 311-321. |
| [13] |
LAI B, ZHANG Y, CHEN Z, et al. Removal of p-nitrophenol (PNP) in aqueous solution by the micron-scale iron-copper (Fe/Cu) bimetallic particles[J]. Applied Catalysis B:Environmental, 2014, 144: 816-830. |
| [14] |
PETALA E, DIMOS K, DOUVALIS A, et al. Nanoscale zero-valent iron supported on mesoporous silica:Characterization and reactivity for Cr(VI) removal from aqueous solution[J]. Journal of Hazardous Materials, 2013, 261: 295-306. |
| [15] |
MOHAN D, PITTMAN C U. Activated carbons and low cost adsorbents for remediation of tri- and hexavalent chromium from water[J]. Journal of Hazardous Materials, 2006, 137(2): 762-811. |
| [16] |
LV X, XU J, JIANG G, et al. Removal of chromium(VI) from wastewater by nanoscale zero-valent iron particles supported on multiwalled carbon nanotubes[J]. Chemosphere, 2011, 85(7): 1204-1209. |
| [17] |
ZHAO M, ZHANG C, YANG X, et al. Preparation of highly-conductive pyrogenic carbon-supported zero-valent iron for enhanced Cr(VI) reduction[J]. Journal of Hazardous Materials, 2020, 396: 122712. |
 2020
2020



