| 含钴二次资源综合回收技术研究进展 |
钴具有优良的物理化学性能,是生产耐热合金、硬质合金、防腐合金、磁性合金和各种钴盐的重要原料[1-2],被广泛用于高新技术和军工、航空航天等重要领域[3-4]。近年来随着新能源电池材料的广泛研究及技术推广,钴在电池领域的突出地位日益凸显,消费占比超过80%。鉴于钴日益突出的重要地位,欧盟、美国最近先后发布了包含钴矿物、钴金属及氧化物在内的关键矿物、原材料清单,将其列为重要“战略物资”,并制定了限制其进出口贸易的安全供应战略和政策[5-6]。我国已于2016年将金属钴列入战略性矿产目录[7]。
中国作为全球第一大钴消费国,国内钴资源相对贫乏,仅占全球储量的1.13%,且开采难度高,所以需大量进口,才能满足国内对钴消费的需求。电池材料是我国钴消费的最大领域,近年来,随着智能手机、笔记本电脑和新能源汽车的广泛使用,对二次电池的需求急剧增长,钴消费量日益增大,此外,我国材料行业的用钴量也快速增长,钴的供需矛盾日益突出。钴已成为我国对外依存度最高的有色金属之一,其中超过90%以上的钴初级产品来自非洲,而非洲地区政局动荡、局部冲突多发,存在诸多不确定因素。在资源短缺加进口不稳定性双重压力下,我国钴资源供应存在巨大安全隐患,难以为钴原料的安全供应提供有效的保障。
随着我国钴需求量的不断增加,我国钴资源不足的现状将长期存在,探索新的钴生产来源迫在眉睫。表 1列出了不同类型的钴资源。我国庞大的钴消费基数成为我国解决钴资源储量不足的潜在优势,报废含钴产品及含钴矿物冶炼产生的大量二次资源拥有很高的利用价值。因此,近年来,从二次资源中综合回收钴得到了更多的关注。基于此,本论文对钴二次资源的来源、种类和钴的分离回收方法进行了分析总结。
| 表 1 钴资源分类[1] Table 1 Classification of cobalt resources |

|
1 钴矿资源现状 1.1 世界钴矿产资源现状
钴在地球上分布广泛,但分布高度集中且含量很低,其地壳丰度仅为25×10-6,远远低于铝铁等常见金属资源[8]。据美国地质调查局(USGS)2021年的统计[9],全球钴储量(金属量)为710万t,中国储量仅为8万t(金属量),占世界总储量的1.13%。全球陆地钴储量及分布如图 1所示,陆地钴矿资源主要集中在刚果(金)、澳大利亚、古巴、菲律宾、马达加斯加、加拿大和俄罗斯等国。此外还有大量的钴资源分布在大洋深海地壳及海山等富钴结壳内[10-13]。根据钴原料的地质或矿物学来源,钴的矿产资源可分为以下五类:镍(铜钴)硫化物、镍(钴)红土、铜(钴)硫化物、钴(砷)硫化物和次生资源[14]。自然界中超过90%的钴是从钴铜矿和钴镍矿中提取的。唯一正在运营的以钴为主要产品的矿山是摩洛哥的BouAzzer矿,其主要矿物是砷钴矿[15]。
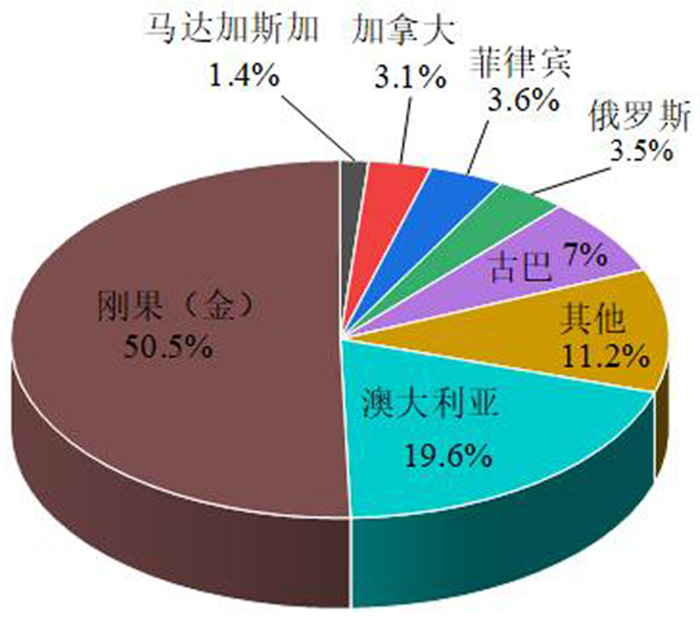 |
| 图 1 全球陆地钴资源储量分布 Fig.1 Distribution map of global terrestrial cobalt reserves |
1.2 中国钴矿产资源现状
我国钴矿资源不多,独立钴矿床尤少,主要伴生于铁、镍、铜等矿产中,开发难度较大,钴矿产地有150余处,分布于24个省(区),如图 2所示,主要分布在甘肃、山东、云南、河北、青海、山西等6省,以甘肃省储量最多,约占全国的30%。钴矿开发利用较好的矿区有金川、盘石铜镍矿、铜录山、中条山、凤凰山、武山铜矿、大冶、金岭、莱芜铁矿等。但这些矿床钴品位仅0.02%~0.18%,因而在生产的过程中存在回收率低、工艺复杂、生产成本高等不易开发的因素。
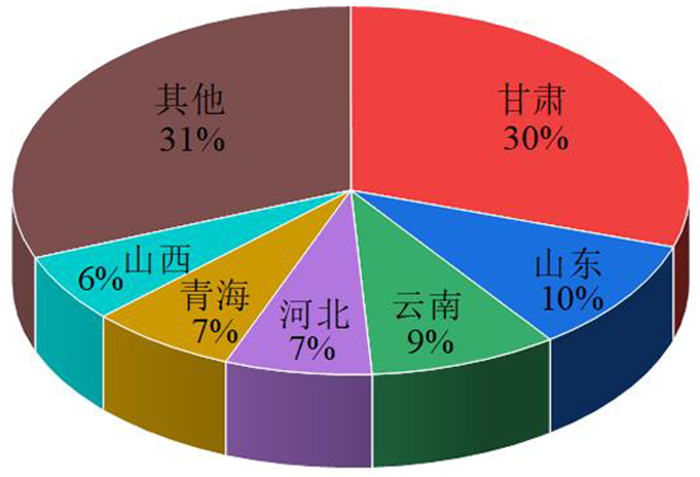 |
| 图 2 中国钴资源储量分布 Fig.2 Distribution map of cobalt reserves in China |
2 钴二次资源来源及种类
全球与我国钴的消费结构如图 3和图 4所示,其中电池领域是钴最大的应用领域。
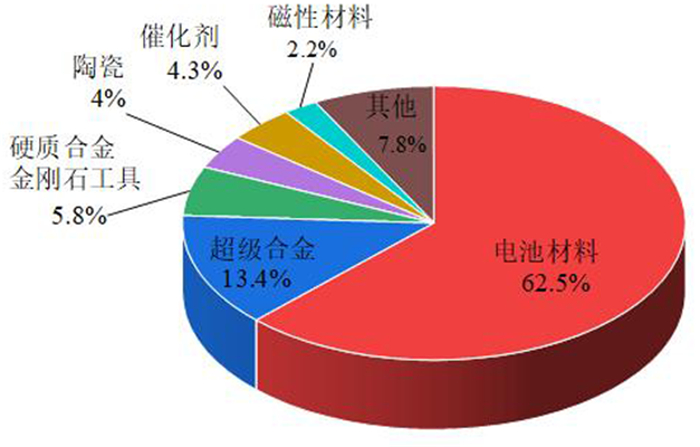 |
| 图 3 2019年全球钴消费结构 Fig.3 Global cobalt consumption structure in 2019 |
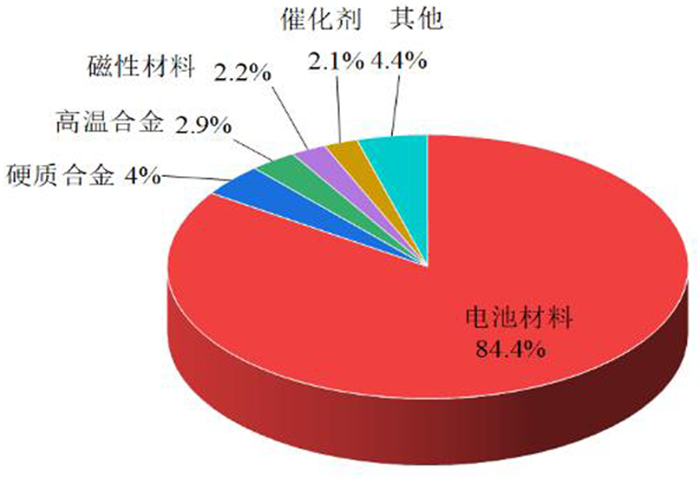 |
| 图 4 2020年中国钴消费结构 Fig.4 Cobalt consumption structure in China in 2020 |
含钴二次资源的种类繁多,主要有冶金渣、废合金、废催化剂和废二次电池材料等[4, 16-19]。
在湿法冶炼过程中,会产生大量含钴废渣,如电解锰厂产生的锰钴渣、湿法冶锌工艺净化除钴工序产生的锌钴渣,以及铜、镍等冶炼产生的冶金渣等。这些含钴冶金渣含有丰富的锌、镉、铜、钴、锰等金属元素,其中钴的含量在0.08%~6%之间,通常高于原始矿物中钴的含量。鉴于冶金渣的规模和含钴量,从含钴冶金渣回收钴具有很高的经济价值和保障钴安全供应的战略意义[20]。
废旧锂离子电池中也存在大量的含钴废料。锂离子电池一般采用碳、Li-Al合金或石墨作负极材料,采用LiCoO2、LiCoxOy或LiCoxMnyNizO2作为正极材料,结构示意图如图 5所示。一般而言,废旧锂离子电池正极材料的主要成分有钴、镍、锰、铝、锂等金属,与原生矿和含钴冶金渣相比,从废旧锂离子电池中提取钴更有价值[21-22]。将废旧锂离子电池中的钴资源回收,不仅能够使钴资源有效地得到利用,同时,还能够有效地降低废旧电池对环境的污染。
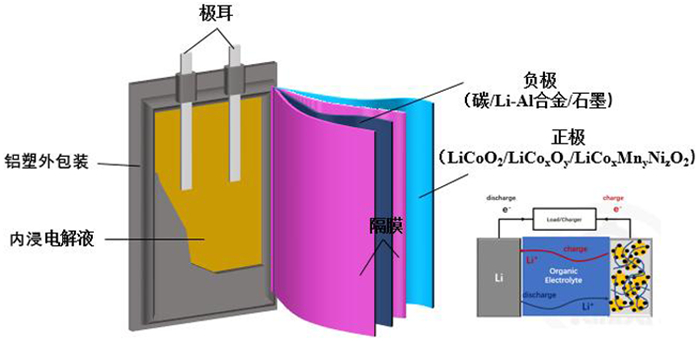 |
| 图 5 锂离子电池结构 Fig.5 Structure diagram of lithium-ion battery |
含钴合金废料主要包括高温合金、硬质合金和磁性合金。其中钴基高温合金主要成分以Co为主,含有Ni、Cr及其他元素。硬质合金主要成分为碳化钨和钴。磁性合金中钴一般作为提高磁饱和强度的添加剂。从这些合金废料中提取有价元素钴,既可实现资源的再生,又能获得可观的经济效益[23-24]。
我国工业的快速发展导致对催化剂的需求不断增加。催化剂的作用对于石油炼制工业中的燃料生产是必不可少的。目前炼油工艺广泛应用的含钴催化剂包括加氢脱硫催化剂、加氢精制催化剂和Mo-Co-Ni催化剂[25-26]。这些催化剂通常由负载在氧化铝载体上的钼(Mo)和助剂如钴(Co)或镍(Ni)组成,它们通过促进加氢处理过程中的加氢脱硫(HDS)、加氢脱氮(HDN)和加氢脱金属(HDM)反应来提高原料中存在的硫、氮和金属(V和Ni)等不良杂质的脱除。随着催化剂失活,每年产生大量的废催化剂[27]。这些废催化剂富含钼(Mo)、镍(Ni)、钴(Co)、钒(V)和铝(Al)等战略金属。其中钴主要以单质和氧化物的形式存在,其含量为0.5%~30%[28]。与从矿石中提炼钴相比,这在技术上也是可行和经济的。
3 钴二次资源回收技术现状钴的二次资源种类繁多,化学成分复杂多变,近年来,我国研究工作者在含钴二次资源回收方面做了大量工作,提出了许多回收工艺流程。这些工艺流程以湿法工艺为主,一般包括浸出、化学预除杂、钴与其他金属离子分离等工艺过程,如图 6所示。
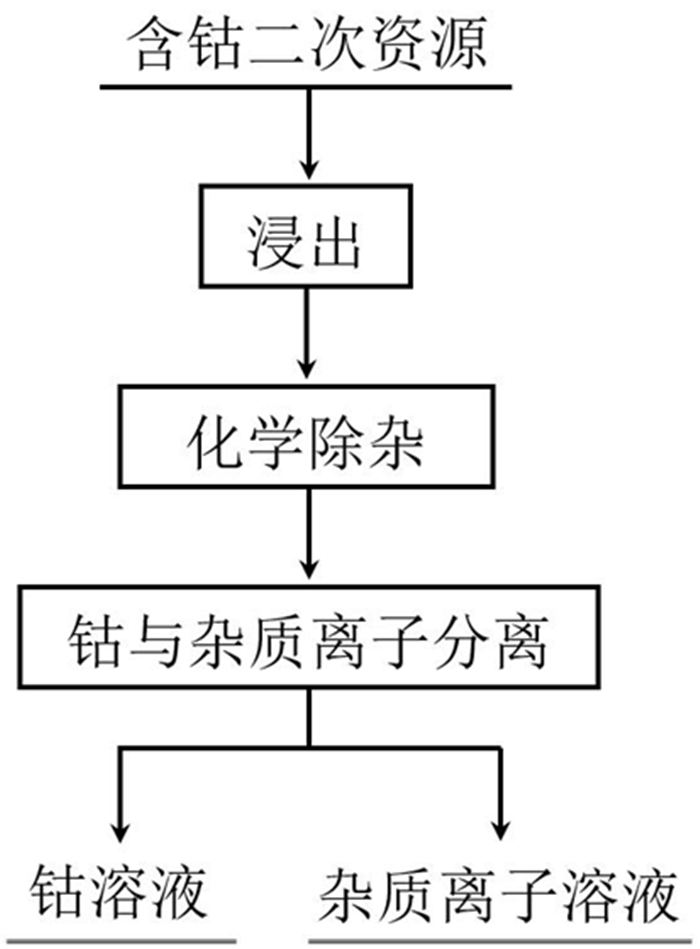 |
| 图 6 含钴二次资源回收过程 Fig.6 Recovery process of secondary resources containing cobalt |
3.1 含钴二次资源的预处理
预处理步骤因含钴二次资源种类而异。锌冶炼净化钴渣需要酸洗除去大部分锌,形成一种富钴渣;当含钴冶金渣含有有机物时还需进行焙烧除去有机物。处理含钴合金废料时,通常需碱洗去除表面上的油污和杂质,或氧化焙烧将其转化为氧化物。对于废旧锂离子电池,在湿法冶金方法中,使用物理过程作为预处理步骤,首先需要采用放电、粉碎、筛分、磁选、细碎和分级一系列的机械工艺来得到富含钴的正极材料,然后进行浸出[29]。含钴废催化剂在浸出之前需进行脱油、脱焦和粉碎处理。在一些加氢脱硫催化剂中,金属以硫化物的形式存在,首先高温焙烧以脱除催化剂中的焦炭和硫。
3.2 含钴二次资源的浸出预处理后的含钴二次资源可采用酸浸、碱浸和两段浸出的方法进行溶解。酸浸一般使用无机酸进行,如H2SO4[30]、HCl[31]、HNO3[32]。近年来,有机酸得到了更多关注,如甘氨酸、柠檬酸、草酸、天冬氨酸等。碱浸出可作为含钴二次资源的替代浸出工艺,如NaOH、Na2CO3、NaHCO3和铵盐。然而,钴在碱性溶液中的溶解度低。因此,在这种情况下,两阶段浸出将是一个更好的选择,常用于废旧锂离子电池和含钴废催化剂的浸出过程,首先进行碱浸以溶解三氧化钼和氧化铝,然后对先前浸出的固体残渣进行酸浸以溶解钴。
3.2.1 无机酸浸出法目前采用H2SO4进行溶解浸出的含钴二次资源包括含钴冶金渣、废锂离子电池、废催化剂。李强[33]、Davood[34]等人,研究了H2SO4对酸洗后的锌冶金净化钴渣的浸出过程,最佳条件下钴的浸出率达到95%以上。刘红斌等人[35]以H2SO4为浸出剂处理铜转炉渣,铜、钴、铁等金属元素生成相应的金属硫酸盐进入溶液,硅形成硅化合物留在渣中,最终,铜、钴、铁回收率达95%以上。王文辉等人[36]采用H2SO4直接对含钴转炉渣进行两次循环浸出,钴浸出率可达95%以上。
Kojima等人[37]比较了HCl、H2SO4和HNO3在相同条件下硬质合金废料中钴的浸出性能。结果表明,用HCl溶解钴的效果最好,其次是H2SO4和HNO3。当WC-Co合金废料在110 ℃用6 mol/L HCl浸取24 h后,钴粘结剂相被完全去除。Sinha等人[38]对比了HNO3、H2SO4和HCl溶解焙烧后的SmCo磁性合金废料,发现HCl是最好的浸出剂。谭世雄等人[24]使用热酸浸溶法处理废高温合金,在5 mol/L HCl沸腾条件下,将合金中的钴转入溶液,对于大块难以破碎、难以酸溶的合金类废料,须用电化学的方法进行强化溶出。电解过程一般是以合金为阳极,铜片为阴极,在HCl体系中进行能得到较好的效果[23]。柳松[39]、魏国侠[40]等人均采用电解对废料的回收进行了研究,可以使钴以氯化物形式进入溶液中且钴浸出效率高。
根据处理废旧锂离子电池的不同浸出方式,浸出时常用的无机酸浸出剂有H2SO4[41]、HCl[42]、HNO3[43]。在相似条件下,发现正极材料钴酸锂在H2SO4和HCl溶液中钴和锂的浸出效果最好。为了提高钴的浸出率,通常添加还原剂,这类试剂通过削弱正极材料中的Co-O键将Co3+转化为Co2+,通常使用的还原剂包括H2O2、Na2SO3、Na2S2O3、抗坏血酸等。H2O2是目前使用最广泛的还原剂。
Valverde等人[44]用高浓度的H2SO4处理预处理过的Co-Mo废催化剂时,钴具有高浸出率。Banda等人[45]用HCl浸取含铝、钴、钼和镍的废加氢脱硫(HDS)催化剂,当HCl浓度为3 mol/L、温度为90 ℃、粒径为250 μm、固液比为5%(质量体积比)、反应时间为60 min时,钼和钴的浸出率分别为97%和94%。根据Hamza等人[46]的报道,在H2SO4、HCl、HNO3这三种无机酸中,H2SO4是处理废催化剂最有效的浸出剂。
Lee等人[47]为提高反应效率,以王水为浸出剂,同时促进其与硬质合金中的WC和Co的反应,生成钨酸和氯化钴,实现了钨和钴的分离。该方法与传统酸浸法相比工艺流程更短,反应效率高,但该方法中使用了王水,危险性大。岳松[48]用H2SO4、HCl和HNO3溶解废高磁合金钢。Rabah等人[49]将浓H2SO4和HNO3的混合物(体积比为3:1)用于从废加氢脱硫(HDS)催化剂中浸出钴和钼。据称,该工艺的回收率为96%。
针对不同的含钴二次资源,需选用合适的无机酸浸出剂,如含钴冶金渣、废旧锂离子电池和废催化剂在H2SO4溶液中,钴浸出率最高;而废旧合金在HCl溶液中钴的浸出率最高。
3.2.2 有机酸浸出法无机酸虽浸出能力较强,但高浓度的无机酸会危害环境,释放有毒气体(Cl2、SO3、NOx),产生高酸度废水,污染土壤和水,以及腐蚀设备。相比之下有机酸浸出剂被认为是环保的,有机酸浸出剂产生的二次污染小,可生物降解,可回收利用,并且对操作员的健康提供了更大的安全性。常用于溶解含钴二次资源的有机酸浸出剂包括甘氨酸、天冬氨酸、草酸、柠檬酸、抗坏血酸和酒石酸等[16, 50-52]。这些酸在广泛的pH条件下很容易为水体系贡献质子,是金属阳离子的有效配体,因此这些试剂的浸出效率与HCl和H2SO4相似。有机酸浸出原理是通过酸解和络合溶解机制在金属溶解中发挥着作用。在酸解中,氢离子与金属反应并将它们浸出到溶液中,在络合分解中,有机酸通过络合/螯合反应与金属离子形成稳定络合/螯合物。
Yukun等人[53]提出了一种用碱性甘氨酸溶液为浸出剂分离锌和钴的新方法,如图 7所示。这种方法选择性地从锌冶金渣中高产率地溶解锌和镉,将大部分钴和锰留在残渣中。在最佳条件下(pH=10,45 ℃,甘氨酸质量浓度100 g/L,液固比40:1,反应时间180 min),锌和镉的浸出率分别为93.81%和87.64%。相比之下,钴和锰的溶出率几乎可以忽略不计。王俊杰等人[54]研究了用柠檬酸从锌冶金渣中回收有价金属的工艺方法。结果表明,在柠檬酸浓度0.8 mol/L、浸出温度60 ℃、浸出时间90 min条件下, 钴的浸出率高达97.64%。
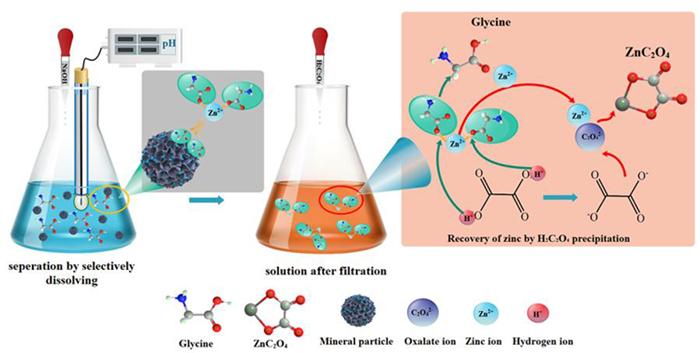 |
| 图 7 碱性甘氨酸溶液选择性络合浸出分离锌钴技术 Fig.7 The separation of zinc and cobalt by the selective complexation leaching with alkaline glycine solution |
抗坏血酸(C6H8O6)可以同时作为浸出剂和还原剂,Li等人[55]采用抗坏血酸从废锂离子电池的正极材料中浸出锂和钴,浸出过程中,LiCoO2首先用抗坏血酸溶解生成C6H6O6Li2,而不溶性Co(Ⅲ)化合物还原为可溶性Co(II),促进了钴的提取,钴的浸出率高达94.8%。酒石酸(C4H6O6)是一种主要存在于植物中的天然有机酸,在葡萄中尤为丰富。Lipo等人[51]以酒石酸为浸出剂、H2O2为还原剂,从正极材料LiCoO2和LiNi0.5Co0.2Mn0.3O2中回收钴、镍、锰和锂。在无H2O2存在的情况下,钴的浸出率仅为15%,镍、锰和锂的浸出率为30%,但当H2O2的浓度从0增加到4%时,这些金属的浸出率约为99%。发酵过程中产生的柠檬酸(C6H8O7)在酸性介质中很容易生成金属络合物,是一种强络合剂。Xiangping等人[56]以柠檬酸为浸出剂和H2O2为还原剂浸出废旧锂离子的中的钴和锂,在优化条件下钴和锂的浸出率达到98%、99%。Nayaka等人[57]评估了柠檬酸辅助抗坏血酸还原浸出LiCoO2。柠檬酸起着络合剂的作用,从正极材料中溶解钴和锂;柠檬酸质量浓度从0.1 mol/L增加到0.4 mol/L(T=80 ℃,S/L=2 g/L,[抗坏血酸]=0.02 mol/L),锂的浸出率从90%增加到100%,钴的浸出率从70%增加到95%。草酸(H2C2O4)与钴和镍形成不溶的草酸盐沉淀而草酸锂和草酸铝是可溶的。因此在回收钴步骤中经常用草酸来分离钴、锂并回收钴。根据上述事实,草酸可以作为浸出剂和沉淀剂直接回收钴。Liang等人[52]研究了草酸作为浸取剂从废旧锂离子电池中回收钴和锂的效果。XRD分析结果表明,钴以CoC2O4形式析出,而大部分锂以LiHC2O4的形式被浸出。曾宪来等人[58]用草酸,在95 ℃、150 min、15 g/L的固液比和400 r/min的转速下,直接浸出及沉淀废锂离子电池中的钴和锂,研究结果表明,废旧锂离子电池中钴和锂的回收率可达到约98%和97%。
Beuther和Flinn[59]比较了草酸、乳酸、柠檬酸、乙醇酸、邻苯二甲酸、丙二酸、琥珀酸、水杨酸和酒石酸等多种有机酸从废加氢处理催化剂中浸出金属(钒、钼、镍和钴)的效率。本研究在常温常压下使用相同浓度的酸水溶液,草酸对所有四种金属的浸出效率最高,用1%草酸溶液浸出47%钒、59%钼、60%钴和56%镍。
虽然有机酸浸出剂产生的二次污染小,可生物降解,可回收利用,但其价格较高难以大规模用于工业上。而且有机酸体系中的有价金属的分离比较困难,从而对有价金属的分离和回收造成一定的影响。
3.2.3 碱浸/酸碱两段浸出法在碱性溶液中浸出废旧锂离子电池正极材料,虽然不常见,但已经显示出潜在的效果。Caibin等人[60]报道了利用氨作为浸出试剂、碳酸氢铵作为pH缓冲液、亚硫酸铵作为还原剂,氨浸对锂、镍和钴具有较高的选择性,因为它们能形成稳定的金属氨络合物。在最佳工艺条件(氨水1.5 mol/L,亚硫酸铵1 mol/L,碳酸氢铵1 mol/L,固液比为20:1(g/L),t=3 h,T=60 ℃)下,锂和钴的浸出率分别为60.53%和80.99%。Marcantonio等人[61]使用氨、铵盐和H2O2的水溶液从废加氢处理催化剂中提取金属(钒、钼、镍和钴)。在适合的试剂浓度下,废催化剂中93%的钼、88%的钒、80%的镍和78%的钴被浸出。虽然氨和铵盐的水溶液能抑制铝的浸出,但其钴浸出率较低,不适用于钴的回收。Liang等人[62]开发了一种从废旧锂离子电池中回收草酸钴的工艺,该工艺采用酸碱两段浸出,正极材料粉末用NaOH溶液浸取除铝,残渣用4 mol/L H2SO4浸取,加入10% H2O2(V/V)。在矿浆质量浓度100 g/L、浸出时间120 min、浸出温度85 ℃的最佳条件下,钴的浸出率为95%,锂的浸出率为96%。Angelids等人[63]用NaOH和H2SO4从废HDS催化剂中浸出钴、钼、镍,这一过程是基于MoO3和CoO、NiO在酸性和碱性介质中溶解度的差异,在第一段碱浸过程中钼的最大浸出率为97%;第二阶段钴、镍的浸出率分别为90%、93%。
3.3 浸出液的净化除杂浸出液净化过程根据废料来源、种类和浸出工艺不同,可采用中和水解、溶剂萃取、离子交换等方法进行[17]。一般较常见的杂质元素为Cu、Cr、Fe、Al、Mo、W等。铁离子去除方法的选择通常取决于浸出液中铁的含量,当含铁量高时,通常使用黄铁矾法和针铁矿法,当含铁量较低时可通过溶剂萃取进行处理[64]。铜、铝和镉离子经常采用中和水解法和置换法除去。
叶有明等人[65]使用碳酸钙调节浸出液pH至4,使Fe3+形成Fe(OH)3沉淀去除,P204在一定pH条件下优先萃取锰。Weisheng等人[41]应用三阶段选择性沉淀法处理了一种废旧锂离子电池的浸出液。首先加入NaOH在95 ℃下达到pH=3反应2 h以黄钾铁矾的形式除去铁,然后在70 ℃下调节pH=4,加入10%(NH4)2S2O8溶液以除去锰,添加NaOH调节pH值至5.5以除去铜。结果表明,铁、锰的去除率为99%,铜的去除率为98.5%,钴的损失小于2%。陈亮等人[66]对硫酸浸出液中的杂质采用黄钠铁矾法除去溶液中的铁,除铁率为99.9%;以N902为萃取剂,H2SO4为反萃剂回收溶液中的铜,铜回收率可达到99.9%;然后采用水解沉淀法除铝。Valverde等人[44]使用溶剂萃取法、沉淀法和离子交换法回收硫酸浸出(Co-Mo和Ni-Mo/Al2O3)催化剂中的铝、钼、镍、钴。在室温、溶液pH=1.8、A/O相比为1(V/V)的条件下,用丙胺304(煤油中体积分数为5%)萃取钼(99.5%)效果较好。用稀氨水反萃取,浓缩后得七钼酸铵[(NH4)6Mo7O24·4H2O]。萃余液用草酸铵处理,使Ni/Co沉淀成草酸盐。用酸性溶液在室温低流速(3 mL/min)下通过阴离子交换柱除去可溶性磷,用氢氧化钠中和洗脱液分离铝。
3.4 浸出液中金属离子的分离经化学除杂后的溶液一般仅含Co2+、Ni2+、Zn2+,这时通常使用溶剂萃取法和化学沉淀法分离钴和镍、锌。溶液中锌钴分离和钴镍分离是根据锌、镍、钴的含量来选择合适的方法。当锌含量高时常采用化学沉淀法,锌含量低时常使用溶剂萃取回收钴。对镍高钴低的溶液可用氧化水解沉淀除钴,对镍低钴高的溶液可用硫化沉淀除去镍,对于镍钴浓度大致相当的溶液不太适合用沉淀法[67]。
3.4.1 化学沉淀法分离回收化学沉淀可以选择性地沉淀金属。可以根据每种金属在特定pH值下的氢氧化物、硫化物和草酸化合物的溶解度,使用NaOH、Na2S和(NH4)2C2O4进行沉淀。此外,还可以添加特定的沉钴试剂,如β-萘酚。
孙明生等人[68]以含钴为0.2%~0.6%的锌冶金净化钴渣为原料,经过H2SO4浸出得到含钴浸出液,然后在温度为50 ℃~60 ℃、pH值为3~4、反应时间为30 min~40 min的条件下加入α-亚硝基-β-萘酚溶液沉钴,沉钴率达到98%,实现钴与锌的分离。Shaole等人[69]以H2SO4为浸出剂处理锌冶金净化渣,经净化除杂后,采用乙基黄原酸钠作为沉淀剂,K2MnO4为氧化剂,从锌冶金净化含钴渣滤液中分离回收锌和钴,在最佳条件下,钴的沉淀率接近100%,锌钴分离效果好。工艺流程如图 8所示。在整个分离提纯过程中,钴的回收率为88%,锌的回收率为98%。
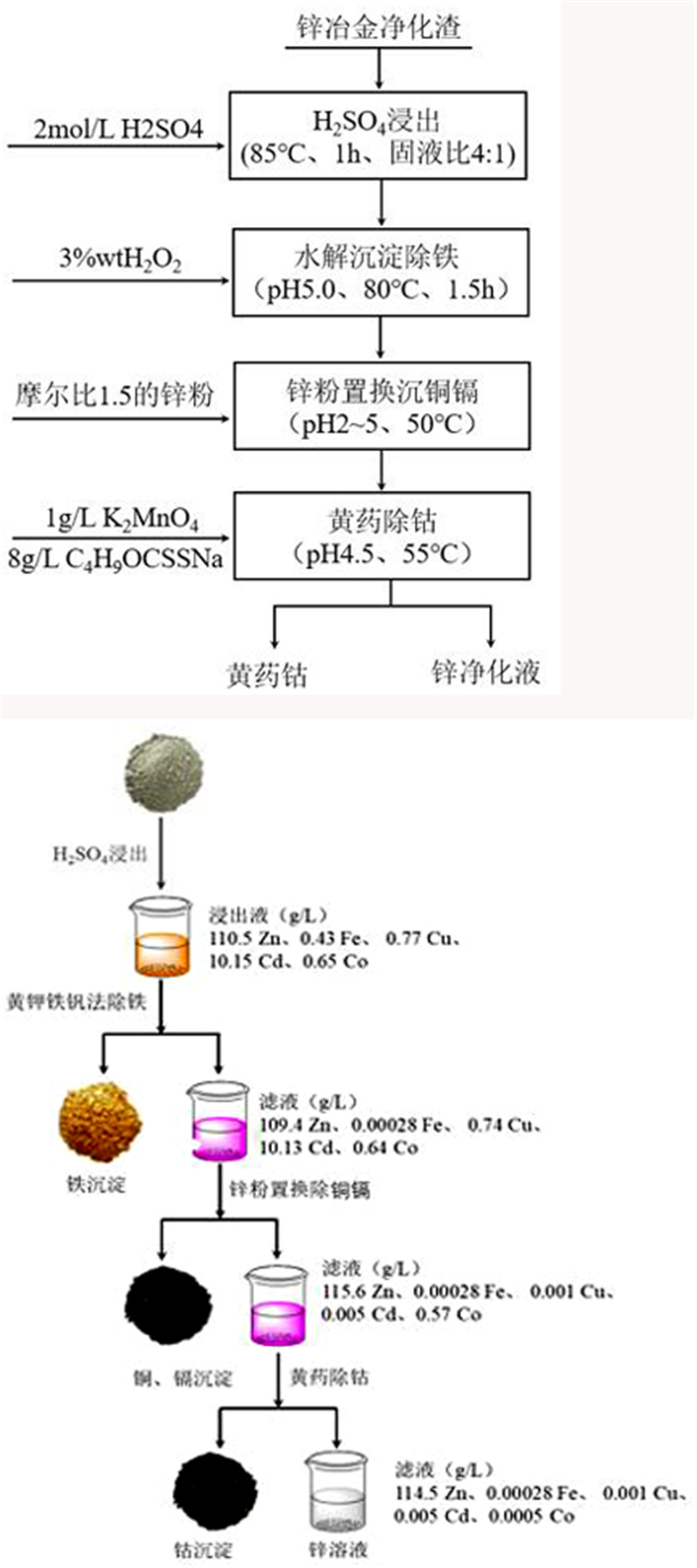 |
| 图 8 [69]回收钴、锌的工艺流程 Fig.8 Technological process for recovery of cobalt and zinc |
柳松等人[39]对于镍钴比为14:1的废高温合金首先进行电化学溶解,再采用中和沉淀法分离铬,最后选择性氧化沉淀分离钴、镍。除铬后的镍钴氯化溶液中通入氯气,氯气溶于水,生成的次氯酸将Co2+氧化为Co3+,通过对pH值的控制,得到Co(OH)3沉淀,再向溶液中加入Na2CO3以形成NiCO3沉淀,从而实现钴、镍的分离回收。Yue等人[70]用高锰酸钾通过氧化还原反应从浸出液中选择性回收锰,然后用丁二酮肟选择性回收镍。最后添加NaOH将滤液的pH提高到11,可以选择性分离钴和锂。郭丽萍等人[71]以Na2S2O3为还原剂,H2SO4为浸出剂,浸出废旧锂离子电池正极材料中的钴。先调节溶液pH=5除去铝和铁,而后调节溶液pH值至9.5~10沉淀钴,钴回收率达到93%。
3.4.2 溶剂萃取法分离回收广泛应用于钴、锌、镍分离的萃取剂有磷酸类、有机酸类和胺类萃取剂。对于复杂的溶液,有时还需要协同萃取系统[67, 72-73]。使用上述萃取剂处理含锌钴溶液时,提取Zn2+比Co2+更容易,可以控制某些条件从溶液中只萃取Zn2+,或者同时将Zn2+和Co2+萃取到有机相中,再通过反萃分离[24]。溶剂萃取可有效地应用于低锌高钴溶液中的钴锌分离。然而,当溶液中含有大量锌时,萃取剂用量过大,溶剂萃取不经济。目前锌钴和镍钴的萃取分离主要是在氯化物、硫酸盐溶液中进行。
在硫酸体系中,经常采用磷酸类萃取剂(P204、P507、Cyanex272)分离钴、镍、锌。李强等人[33]对P204萃取分离锌钴进行了研究,在体积分数10%P204、相比1:1、萃取水相pH为3~4、萃取级数为4级等条件下进行萃取分离,锌、镉、铁的萃取率均超过95%,而钴的萃取率不足5%,其余95%的钴进入到萃余液中且杂质金属离子含量较低,可以作为制备钴产品的原料。Banz等人[74]用D2EPHA萃取分离溶液中的钴和锌,钴的萃取率达96%以上。
蔡传算等人[75]对P204萃取分离镍钴进行了研究。最佳条件下,经十二级逆流萃取,HCl反萃,负载有机相四级逆流洗镍后,可获得符合要求的产品。陈奇志等人[76]利用体积分数25%P507萃取剂分离净化液中的钴镍,钴优先进入到有机相而镍留在水相中,负载钴的有机相通过5 mol/L H2SO4反萃后形成硫酸钴溶液。周炳珍[77]采用H2SO4溶解预先焙烧的钐钴粉,除杂后用15%P204+85%汽油体积分数萃取Cu2+、Mn4+、Zn2+,最后用25%P507+75%汽油体积分数萃取分离钴镍,3 mol/L HCl反萃提取钴,经5级反萃后,钴回收率大于90%。刘富强等人[78]使用P507回收废钴镍催化剂中的钴,结果表明,在pH=3.0~4.0、相比1:5的条件下,通过3级逆流萃取、洗涤,可以实现钴与铜、锌、镍的高效萃取分离,再经过3%的硫酸溶液3级反萃取和洗涤,得到CoSO4,最终钴的回收率达98.5%。以上结果表明,P507比P204具有更优良的分离镍钴的性能而且以P204为萃取剂分离钴镍时,萃取级数较多。
张阳等人[79]对锂电池正极材料硫酸浸出液中的Co2+、Ni2+、Li+进行萃取分离及回收钴,采用的有机相为25%P507+5%TBP+70%稀释剂,萃取剂皂化率为70%,在水相料液pH=3.5、室温条件下,经3级逆流萃取,钴萃取率达99.5%,共萃的锂和镍仅为4.9%和3.1%,可实现钴与锂、镍的分离且分离效果较好,然后负载钴的有机相通过草酸溶液反萃取得到草酸钴产品。Jingu等人[80]研究了用Cyannex272从废锂离子电池中萃取分离回收钴。在硫酸浸出液中控制溶液pH为5.5~6.0时,钴萃取率可达95%~98%,而共萃的镍仅为1%左右,分离效果好。用2 mol/L的H2SO4反萃负载的有机相得到96 g/L的钴溶液。Granata等人[81]比较了Cyanex 272和D2EHPA,从废锂离子电池的实际浸出液中分离钴和镍。在pH=6、O/A=4时,Cyanex 272对Co的选择性明显优于D2EHPA。Banda等人[45]分别用磷酸三丁酯(TBP)和三异辛胺(丙胺308)溶剂萃取用盐酸处理过的废加氢脱硫(HDS)催化剂浸出液中的钼和钴。首先用TBP溶剂萃取法回收钼,用稀盐酸溶液从负载的TBP中反萃取钼。用丙胺308对无钼抽余液进行三级逆流萃取回收钴,用酸化蒸馏水定量反萃钴。这两种金属的回收率均在99%以上,纯度较高。
在氯化物体系中,主要使用胺类萃取剂(N235、TNOA、TBP和P350)进行镍、钴的萃取分离。其原理是在氯化液体系中,Co2+能够与Cl-形成相对稳定的阴离子络合物(CoCl4)2-,其稳定性要比Ni2+与Cl-形成的络合物的稳定性高很多,萃取剂萃取钴络合物从而实现镍钴分离。谭世雄等人[24]使用热盐酸浸溶法处理废高温合金。经浸出和净化除杂后,以N235为萃取剂分离钴镍,萃取分离并洗涤后再用HCl反萃回收钴,钴、镍的最终回收率可分别达到97.2%和91.8%。侯晓川等人[82]采用的苏打焙烧碱浸法使钼、铝进入溶液而钴、镍、铁、铜等元素不被碱浸出而留在渣中。氯气溶于水生成盐酸和次氯酸,与碱浸渣中的钴、镍反应,使它们转入溶液。使用N235萃取分离镍、钴,钴的萃取率和反萃率均大于99%,萃余液中残留钴低,而反萃液含镍低,镍、钴得到有效地分离[83]。
在钴与杂质离子分离时,氧化沉淀法选择性差,溶剂萃取法成本较高,特别是对于浸出液中锌含量高于钴的溶液;而采用有机试剂α-亚硝基-β-萘酚、黄药沉钴法通过煅烧方式提钴,致使沉钴试剂经过煅烧后无法循环利用,对资源造成严重浪费等。为了提高钴回收率,今后的研究重点应该是结合现有工艺,从安全、环保以及经济等角度考虑,开发出一种对物料适应性高、成本低且能有效回收钴的方法。
4 结论与展望钴的应用非常广泛,其来源除了矿物外,较大一部分是来自于其应用领域中产生的含钴二次资源,我国钴资源缺乏,但又因消耗量巨大,国内资源供给无法满足需求。因此,回收含钴二次资源并提取钴是未来研究重点。目前,已报道的回收钴湿法冶金工艺仍然需要改进,以确定试剂消耗、副产品、排放和产品收率等关键参数,建立整个工艺流程和质量平衡,并实现工艺商业化和经济性。例如,用无机酸浸取可能产生污染性气体,有机酸成本高,而且产生的副产物的收集和处理方法将对含钴二次资源的回收的经济性产生巨大影响。寻找经济环保的回收工艺迫在眉睫。为实现这些目标,可以从以下方向着手:(1)了解和控制将进入回收过程的杂质,以生产高纯度和高价值的产品。(2)寻找更经济的回收工艺,并从所有副产品中开发产品,以减少整个回收成本。(3)开发试剂再利用或再生的闭环循环工艺,最大限度地减少试剂消耗和排放,避免有毒气体和废液的产生。开发高效、绿色、低能耗的工艺技术回收二次资源的钴尤为重要。但由于含钴二次资源种类繁多、湿法过程相对不易控制等原因,距离钴湿法回收过程的完全工业化仍有很长的路要走。
| [1] |
SAFARZADEH M S, DHAWAN N, BIRINCI M, et al. Reductive leaching of cobalt from zinc plant purification residues[J]. Hydrometallurgy, 2011, 106(1/2): 51-57. |
| [2] |
SCHMIDT T, BUCHERT M, SCHEBEK L. Investigation of the primary production routes of nickel and cobalt products used for Li-ion batteries[J]. Resources Conservation and Recycling, 2016, 112: 107-122. DOI:10.1016/j.resconrec.2016.04.017 |
| [3] |
王海北, 蒋开喜, 林江顺, 等. 废旧锂离子电池钴综合回收技术研究[J]. 日用电器, 2010(9): 15-17. DOI:10.3969/j.issn.1673-6079.2010.09.002 |
| [4] |
WANG S. Cobalt - Its recovery, recycling, and application[J]. Jom, 2006, 58(10): 47-50. DOI:10.1007/s11837-006-0201-y |
| [5] |
U.S. Depertment Of Energy, Critical materials strategy summary 2010 [M]. U.S. Depertment Of, Energy, 2010.
|
| [6] |
U.S. Geological Survey, 2019, Mineral commodity summaries 2019 [M]. U.S. Geological Survey, 2019.
|
| [7] |
黄晓兵. 中国钴资源安全评估[D]. 北京: 中国地质大学(北京), 2018.
|
| [8] |
SMITH C G. Always the bridesmaid, never the bride: cobalt geology and resources[J]. Applied Earth Science, 2001, 110(2): 75-80. DOI:10.1179/aes.2001.110.2.75 |
| [9] |
U.S. Geological Survey. Mineral commodity summaries 2021 [M]. U.S. Geological Survey, 2021.
|
| [10] |
刘永刚, 何高文, 姚会强, 等. 世界海底富钴结壳资源分布特征[J]. 矿床地质, 2013, 32(6): 1275-1284. DOI:10.3969/j.issn.0258-7106.2013.06.013 |
| [11] |
张福良, 崔笛, 胡永达, 等. 钴矿资源形势分析及管理对策建议[J]. 中国矿业, 2014, 23(7): 6-10. DOI:10.3969/j.issn.1004-4051.2014.07.002 |
| [12] |
张富元, 章伟艳, 任向文, 等. 全球三大洋海山钴结壳资源量估算[J]. 海洋学报, 2015, 37(1): 88-105. DOI:10.3969/j.issn.0253-4193.2015.01.010 |
| [13] |
张伟波, 叶锦华, 陈秀法, 等. 全球钴矿资源分布与找矿潜力[J]. 资源与产业, 2018, 20(4): 56-61. |
| [14] |
KAPUSTA J P T. Cobalt production and markets: A brief overview[J]. Jom, 2006, 58(10): 33-36. DOI:10.1007/s11837-006-0198-2 |
| [15] |
HUANG Y, ZHANG Z, CAO Y, et al. Overview of cobalt resources and comprehensive analysis of cobalt recovery from zinc plant purification residue- a review[J]. Hydrometallurgy, 2020, 193: 105327. DOI:10.1016/j.hydromet.2020.105327 |
| [16] |
GOLMOHAMMADZADEH R, FARAJI F, RASHCHI F. Recovery of lithium and cobalt from spent lithium ion batteries (LIBs) using organic acids as leaching reagents: A review[J]. Resources Conservation and Recycling, 2018, 136: 418-435. DOI:10.1016/j.resconrec.2018.04.024 |
| [17] |
WANG Y, ZHOU C S. Hydrometallurgical process for recovery of cobalt from zinc plant residue[J]. Hydrometallurgy, 2002, 63(3): 225-234. DOI:10.1016/S0304-386X(01)00213-4 |
| [18] |
刘晓剑. 镍钴二次资源回收过程溶液深度净化及材料制备研究[D]. 长沙: 中南大学, 2007.
|
| [19] |
唐娜娜, 马少健. 废弃物料中钴、镍的回收[J]. 有色矿冶, 2005(S1): 113-114. |
| [20] |
张建军, 陈为亮, 李照刚. 从钴渣中回收钴的研究进展[J]. 矿产综合利用, 2017(4): 11-15. DOI:10.3969/j.issn.1000-6532.2017.04.003 |
| [21] |
FAN X, TAN C, LI Y, et al. A green, efficient, closed-loop direct regeneration technology for reconstructing of the LiNi0.5CoO.2MnO.3O2 cathode material from spent lithium-ion batteries[J]. Hazard Mater, 2021, 410: 124610. DOI:10.1016/j.jhazmat.2020.124610 |
| [22] |
JUNG J CY, SUI PC, ZHANG J. A review of recycling spent lithium-ion battery cathode materials using hydrometallurgical treatments[J]. Journal of Energy Storage, 2021, 35: 102217. DOI:10.1016/j.est.2020.102217 |
| [23] |
孟晗琪, 马光, 吴贤, 等. 镍钴高温合金废料湿法冶金回收[J]. 广州化工, 2012, 40(17): 29-30+43. DOI:10.3969/j.issn.1001-9677.2012.17.012 |
| [24] |
谭世雄, 申勇峰. 从废高温合金中回收镍钴的工艺[J]. 化工冶金, 2000(3): 294-297. DOI:10.3321/j.issn:1009-606X.2000.03.014 |
| [25] |
RABAH M A, HEWAIDY I F, FARGHALY F E. Recovery of molybdenum and cobalt powders from spent hydrogenation catalyst[J]. Powder Metallurgy, 1997, 40(4): 283-288. DOI:10.1179/pom.1997.40.4.283 |
| [26] |
GHOLAMI R M, BORGHEI S M, MOUSAVI S M. Bacterial leaching of a spent Mo-Co-Ni refinery catalyst using acidithiobacillus ferrooxidans and acidithiobacillus thiooxidans[J]. Hydrometallurgy, 2011, 106(1/2): 26-31. |
| [27] |
MARAFI M, STANISLAUS A. Spent hydroprocessing catalyst management: A review Part Ⅱ.Advances in metal recovery and safe disposal methods[J]. Resources Conservation and Recycling, 2008, 53(1/2): 1-26. |
| [28] |
LE M N, LEE M S. A review on hydrometallurgical processes for the recovery of valuable metals from spent catalysts and life cycle analysis perspective[J]. Mineral Processing and Extractive Metallurgy Review, 2020, 42(5): 335-354. |
| [29] |
MESHRAM P, MISHRA A, ABHILASH, et al. Environmental impact of spent lithium ion batteries and green recycling perspectives by organic acids - A review[J]. Chemosphere, 2020, 242: 12591. |
| [30] |
李平, 邓攀, 刘宜强, 等. 从硬质合金磨削废料中综合回收钴试验研究[J]. 湿法冶金, 2017, 36(4): 271-274. |
| [31] |
黄炳光, 谢克难, 解然, 等. 盐酸法处理硬质合金粉双回收Co和WC新工艺研究[J]. 四川有色金属, 2009(2): 30-33. DOI:10.3969/j.issn.1006-4079.2009.02.007 |
| [32] |
汤青云, 段冬平. 硝酸法处理废硬质合金回收金属钴和碳化钨[J]. 城市学刊, 1996(6): 64-70. |
| [33] |
李强, 李奇勇, 徐叶, 等. 湿法炼锌净化钴渣选择性浸出回收锌与钴[J]. 有色金属(冶炼部分), 2019(4): 6-10. DOI:10.3969/j.issn.1007-7545.2019.04.002 |
| [34] |
MORADKHANI D, SEDAGHAT B, KHODAKARAMI M, et al. Recovery of valuable metals from zinc plant residue through separation between manganese and cobalt with n-n reagent[J]. Physicochemical Problems of Mineral Processing, 2014, 50(2): 735-746. |
| [35] |
刘红斌, 蒋伟, 蒋训雄, 等. 铜转炉渣湿法回收钴[J]. 有色金属(冶炼部分), 2012(2): 19-22. DOI:10.3969/j.issn.1007-7545.2012.02.005 |
| [36] |
喻正军. 从镍转炉渣中回收钴镍铜的理论与技术研究[D]. 长沙: 中南大学, 2006.
|
| [37] |
KOJIMA T, SHIMIZU T, SASAI R, et al. Recycling process of WC-Co cermets by hydrothermal treatment[J]. Journal of Materials Science, 2005, 40(19): 5167-5172. DOI:10.1007/s10853-005-4407-0 |
| [38] |
SINHA M K, PRAMANIK S, KUMARI A, et al. Recovery of value added products of Sm and Co from waste SmCo magnet by hydrometallurgical route[J]. Sep Purif Technol, 2017, 179: 1-12. DOI:10.1016/j.seppur.2017.01.056 |
| [39] |
柳松, 古国榜. 镍基高温合金废料的回收[J]. 无机盐工业, 1997(2): 38-39. |
| [40] |
魏国侠, 孙挺. 电解法回收废镍基高温合金的研究[C]//中国工程院化工、冶金与材料工学部第七届学术会议论文集. 北京: 2009.
|
| [41] |
CHEN W S, HO H J. Leaching behavior analysis of valuable metals from lithium-ion batteries cathode material[J]. Key Engineering Materials, 2018, 775: 419-426. DOI:10.4028/www.scientific.net/KEM.775.419 |
| [42] |
GUZOLU J S, GHARABAGHI M, MOBIN M, et al. Extraction of Li and Co from Li-ion Batteries by Chemical Methods[J]. Journal of The Institution of Engineers (India): Series D, 2017, 98(1): 43-48. DOI:10.1007/s40033-016-0114-z |
| [43] |
LEE C K, RHEE K I. Reductive leaching of cathodic active materials from lithium ion battery wastes[J]. Hydrometallurgy, 2003, 68(1-3): 5-10. DOI:10.1016/S0304-386X(02)00167-6 |
| [44] |
VALVERDE I M, Jr., PAULINO J F, AFONSO J C. Hydrometallurgical route to recover molybdenum, nickel, cobalt and aluminum from spent hydrotreating catalysts in sulphuric acid medium[J]. J Hazard Mater, 2008, 160(2/3): 310-317. |
| [45] |
BANDA R, NGUYEN T H, SOHN S H, et al. Recovery of valuable metals and regeneration of acid from the leaching solution of spent HDS catalysts by solvent extraction[J]. Hydrometallurgy, 2013, 133: 161-167. DOI:10.1016/j.hydromet.2013.01.006 |
| [46] |
HAMZA M F, ROUX JC, GUIBAL E. Metal valorization from the waste produced in the manufacturing of Co/Mo catalysts: leaching and selective precipitation[J]. Journal of Material Cycles and Waste Management, 2019, 21(3): 525-538. DOI:10.1007/s10163-018-0811-9 |
| [47] |
LEE J C, KIM E Y, KIM J H, et al. Recycling of WC-Co hardmetal sludge by a new hydrometallurgical route[J]. International Journal of Refractory Metals & amp; Hard Materials, 2011, 29(3): 365-371. |
| [48] |
岳松. 废高磁合金钢中钴、镍的分离和利用[J]. 四川环境, 2000, 19(4): 29-31. DOI:10.3969/j.issn.1001-3644.2000.04.009 |
| [49] |
A.R M. Recovery of molybdenum and cobalt powders from spent catalysts[J]. Metal Powder Report, 1998, 53(11): 37. |
| [50] |
LI L, GE J, WU F, et al. Recovery of cobalt and lithium from spent lithium ion batteries using organic citric acid as leachant[J]. J Hazard Mater, 2010, 176(1): 288-293. |
| [51] |
HE LP, SUN SY, MU YY, et al. Recovery of lithium, nickel, cobalt, and manganese from spent lithium-ion batteries using l-tartaric acid as a leachant[J]. ACS Sustainable Chemistry & amp; Engineering, 2017, 5(1): 714-721. |
| [52] |
SUN L, QIU K. Organic oxalate as leachant and precipitant for the recovery of valuable metals from spent lithium-ion batteries[J]. Waste Management, 2012, 32(8): 1575-1582. DOI:10.1016/j.wasman.2012.03.027 |
| [53] |
HUANG Y, GUO H, ZHANG C, et al. A novel method for the separation of zinc and cobalt from hazardous zinc & amp; ndash; cobalt slag via an alkaline glycine solution[J]. Sep Purif Technol, 2021, 273: 119009. DOI:10.1016/j.seppur.2021.119009 |
| [54] |
王俊杰, 谈定生, 丁家杰, 等. 湿法炼锌渣柠檬酸浸出回收钴、锌和镍[J]. 矿产保护与利用, 2021, 41(2): 137-143. |
| [55] |
LI L, LU J, REN Y, et al. Ascorbic-acid-assisted recovery of cobalt and lithium from spent Li-ion batteries[J]. Journal of Power Sources, 2012, 218: 21-27. DOI:10.1016/j.jpowsour.2012.06.068 |
| [56] |
CHEN X P, LUO C B, ZHANG J X, et al. Sustainable recovery of metals from spent lithium-ion batteries: a green process[J]. Acs Sustainable Chemistry & amp; Engineering, 2015, 3(12): 3104-3113. |
| [57] |
NAYAKA G P, MANJANNA J, PAI K V, et al. Recovery of valuable metal ions from the spent lithium-ion battery using aqueous mixture of mild organic acids as alternative to mineral acids[J]. Hydrometallurgy, 2015, 151: 73-77. DOI:10.1016/j.hydromet.2014.11.006 |
| [58] |
ZENG X, LI J, SHEN B. Novel approach to recover cobalt and lithium from spent lithium-ion battery using oxalic acid[J]. J Hazard Mater, 2015, 295: 112-118. DOI:10.1016/j.jhazmat.2015.02.064 |
| [59] |
BEUTHER H, FLINN R A. Technique for removing metal contaminants from catalysts[J]. I & amp; EC Product Research and Development, 1963, 2(1): 53-57. |
| [60] |
WU C, LI B, YUAN C, et al. Recycling valuable metals from spent lithium-ion batteries by ammonium sulfite-reduction ammonia leaching[J]. Waste Management, 2019, 93: 153-161. DOI:10.1016/j.wasman.2019.04.039 |
| [61] |
MARCANTONIO P J. Leaching cobalt from metal-containing particles, Google Patents [P]. 1991
|
| [62] |
CHEN L, TANG X, ZHANG Y, et al. Process for the recovery of cobalt oxalate from spent lithium-ion batteries[J]. Hydrometallurgy, 2011, 108(1): 80-86. |
| [63] |
ANGELIDIS T N, TOURASANIDIS E, MARINOU E, et al. Selective dissolution of critical metals from diesel and naptha spent hydrodesulphurization catalysts[J]. Resources, Conservation and Recycling, 1995, 13(3/4): 269-282. |
| [64] |
PRANOLO Y, ZHANG W, CHENG C Y. Recovery of metals from spent lithium-ion battery leach solutions with a mixed solvent extractant system[J]. Hydrometallurgy, 2010, 102(1/2/3/4): 37-42. |
| [65] |
叶有明, 谢雪珍, 农永萍. 用常压酸浸—溶剂萃取法从硫锰废渣中回收锰钴镍试验研究[J]. 湿法冶金, 2020, 39(4): 298-303. |
| [66] |
陈亮, 唐新村, 张阳, 等. 从废旧锂离子电池中分离回收钴镍锰[J]. 中国有色金属学报, 2011, 21(5): 1192-1198. |
| [67] |
刘三平, 王海北, 蒋开喜, 等. 钴提取分离技术分析与应用[J]. 有色金属, 2004(2): 73-76. DOI:10.3969/j.issn.2095-1744.2004.02.018 |
| [68] |
孙明生, 沙涛, 苏凤来. 湿法炼锌净化渣综合回收的生产实践[J]. 矿冶, 2010, 19(1): 73-76. |
| [69] |
SONG S L, SUN W, WANG L, et al. Recovery of cobalt and zinc from the leaching solution of zinc smelting slag[J]. J Environ Chem Eng, 2019, 7(1): 102777. DOI:10.1016/j.jece.2018.11.022 |
| [70] |
YANG Y, LEI S, SONG S, et al. Stepwise recycling of valuable metals from Ni-rich cathode material of spent lithium-ion batteries[J]. Waste Management, 2020, 102: 131-138. DOI:10.1016/j.wasman.2019.09.044 |
| [71] |
郭丽萍, 杜小弟, 方伟, 等. Na2S2O3还原溶解LiCoO2及钴、锂分离回收[J]. 应用化学, 2006(10): 1182-1184. DOI:10.3969/j.issn.1000-0518.2006.10.026 |
| [72] |
黎华玲, 陈永珍, 宋文吉, 等. 湿法回收退役三元锂离子电池有价金属的研究进展[J]. 化工进展, 2019, 38(2): 921-932. |
| [73] |
李冰洁, 廖亚龙, 胡亮, 等. 溶液中钴与镍的深度分离研究进展[J]. 化学工程, 2015, 43(8): 33-37. DOI:10.3969/j.issn.1005-9954.2015.08.008 |
| [74] |
BANZA A N, GOCK E, KONGOLO K. Base metals recovery from copper smelter slag by oxidising leaching and solvent extraction[J]. Hydrometallurgy, 2002, 67(1/2/3): 63-69. |
| [75] |
蔡传算, 刘荣义. 含钴高温合金废料的综合利用[J]. 中国有色金属学报, 1996, 6(1): 49-52. DOI:10.3321/j.issn:1004-0609.1996.01.011 |
| [76] |
陈奇志, 高锋, 史磊. 全湿法从锰钴镍渣中回收钴、镍的试验研究[J]. 企业技术开发(学术版), 2014(2): 20-22. |
| [77] |
周炳珍. 用P204和P507脱除含钴废料中的杂质生产高纯度氯化钴[J]. 有色金属(冶炼部分), 2002(6): 16-17+44. DOI:10.3969/j.issn.1007-7545.2002.06.005 |
| [78] |
刘富强, 朱兆华, 邓华利. 废镍催化剂中有价金属回收试验研究[J]. 三峡环境与生态, 2008(2): 21-23+62. DOI:10.3969/j.issn.1674-2842.2008.02.006 |
| [79] |
张阳, 满瑞林, 王辉, 等. 用P507萃取分离钴及草酸反萃制备草酸钴[J]. 中南大学学报(自然科学版), 2011, 42(2): 317-322. |
| [80] |
KANG J, SENANAYAKE G, SOHN J, et al. Recovery of cobalt sulfate from spent lithium ion batteries by reductive leaching and solvent extraction with Cyanex 272[J]. Hydrometallurgy, 2010, 100(3/4): 168-171. |
| [81] |
GRANATA G, MOSCARDINI E, PAGNANELLI F, et al. Product recovery from Li-ion battery wastes coming from an industrial pre-treatment plant: Lab scale tests and process simulations[J]. Journal of Power Sources, 2012, 206: 393-401. DOI:10.1016/j.jpowsour.2012.01.115 |
| [82] |
侯晓川, 肖连生, 高从堦, 等. 从废高温镍钴合金中浸出镍和钴的试验研究[J]. 湿法冶金, 2009, 28(3): 164-169. DOI:10.3969/j.issn.1009-2617.2009.03.008 |
| [83] |
侯晓川, 肖连生, 高从堦, 等. 废高温镍钴合金浸出液净化试验研究[J]. 有色金属(冶炼部分), 2010(4): 9-11, 21. DOI:10.3969/j.issn.1007-7545.2010.04.003 |
 2021
2021



