| 盐介质对磷石膏常压盐溶液法制备α半水石膏的影响研究 |
2. 贵州大学 矿业学院,贵州 贵阳 550025;
3. 贵州省非金属矿产资源综合利用重点实验室,贵州 贵阳 550025;
4. 喀斯特地区优势矿产资源高效利用国家地方联合工程实验室,贵州 贵阳 550025
2. Mining College, Guizhou University, Guiyang 550025, China;
3. National & Local Joint Laboratory of Engineering for Effective Utilization of Regional Mineral Resources from Karst Areas, Guizhou University, Guiyang 550025, China;
4. Guizhou Key Lab of Comprehensive Utilization of Non-metallic Mineral Resources, Guizhou University, Guiyang 550025, China
磷石膏是湿法磷酸生产过程中,用硫酸分解磷矿石萃取磷酸排放的固体废弃物。据统计,每生产1 t磷酸约产生5.0 t磷石膏[1];我国每年约排放7 000万t磷石膏,其利用率只有20%左右[2]。磷石膏的主要成分为二水石膏(CaSO4·2H2O),还含有少量的可溶磷、共晶磷、可溶氟和有机物等有害杂质[3]。磷石膏直接排放不仅会占用大量土地,还会对周边环境和地下水造成污染[4],需要合理处理和有效利用。
常压盐溶液法是近年来发展起来的新工艺,其制备原理与原则流程是二水石膏在盐溶液中溶解生成Ca2+与SO42-,达到过饱和度后形成α半水石膏晶核,并在转晶剂调控下生成短柱状α半水石膏产品。该工艺具有常压、合成温度和能耗低、生产效率高等优点。采用常压盐溶液法制备α半水石膏是磷石膏资源化与深加工的新途径。采用常压盐溶液法制备α半水石膏的研究目前主要集中在脱硫石膏和天然石膏等杂质含量低的石膏方面[5]。由于磷石膏中所含杂质种类多,对其使用性能影响大,对采用常压盐溶液法利用磷石膏制备α半水石膏的研究较少[6]。
盐介质的选择是常压盐溶液法制备α半水石膏的关键,其作用是提高α半水石膏的相对过饱和度,降低二水石膏向α半水石膏的转化温度[7]。常用的盐介质有NaCl、KCl、MgCl2、CaCl2和MgSO4等,也有采用复合盐溶液作介质[6]。在添加4 mol/L Ca(NO3)2和8.75 mmol/L K2SO4的条件下,利用脱硫石膏制备出纯度为98.23%的α半水石膏[8]。在25% CaCl2、2% MgCl2·6H2O和1% KCl的混合盐溶液中,温度为94 ℃,合成时间为5~6 h的条件下,利用脱硫石膏制备出纯度为95%的α半水石膏[9]。适宜的盐介质不仅能加快二水石膏转化为α半水石膏,还能使其晶体生长完整。本文系统考察了NaCl、NaNO3、MgCl2、CaCl2和Ca(NO3)2对磷石膏制备α半水石膏转化速率、物相组成和微观形貌的影响,为磷石膏常压盐溶液法制备高强石膏提供基础数据。
1 试验材料与方法 1.1 磷石膏性质分析磷石膏试样呈灰白色至灰色,粉末状,有结块,含游离水9.23%, 呈酸性,pH为2.71。磷石膏的化学成分如表 1所示,主要成分为二水硫酸钙,含量约为91.32%,此外还含有一定量的磷和氟等有害杂质。
| 表 1 磷石膏化学组成 Table 1 Chemical component of phosphogypsum |
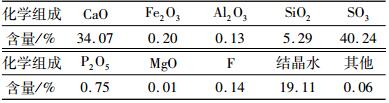 |
磷石膏XRD图谱如图 1所示。二水石膏(CaSO4·2H2O)的特征峰位于11.648°、20.758°、23.418°和29.148°,共晶磷(CaHPO4·2H2O)与二水石膏在11.648°和23.418°有重合的特征峰。由图 1可以看出,磷石膏的主要成分为二水石膏,还含有少量的共晶磷和石英,二水石膏XRD半定量计算结果为90%。
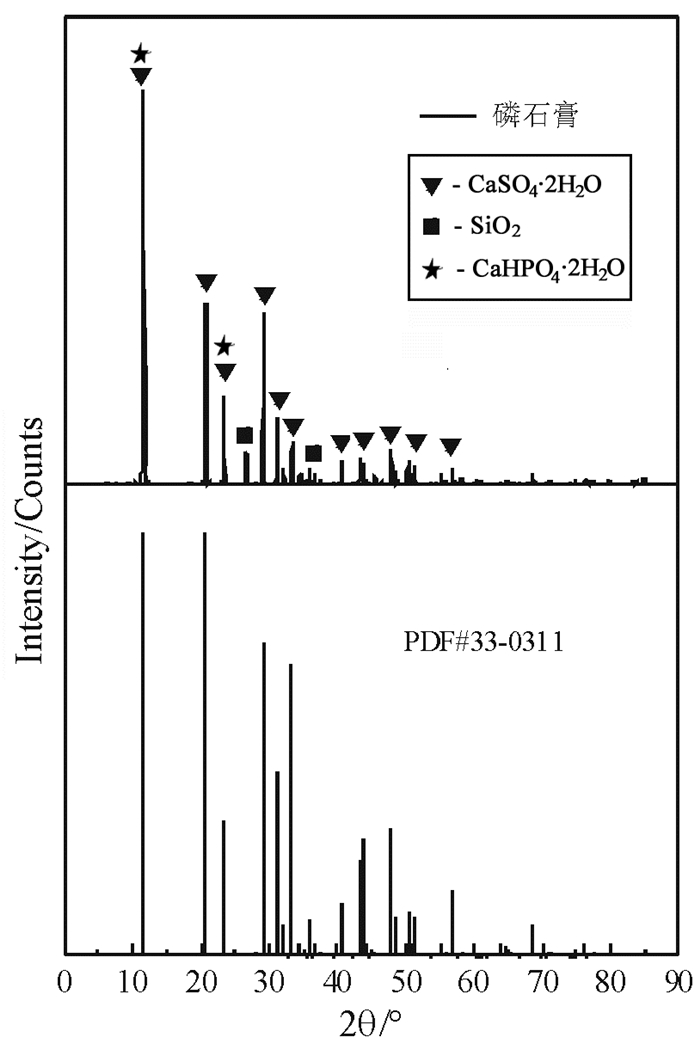 |
| 图 1 磷石膏XRD图谱 Fig.1 XRD pattern of phosphogypsum |
磷石膏的TG-DSC曲线如图 2所示。由图 2可以看出,磷石膏样品在160 ℃处有一个吸热峰,并伴有随有一个较大的失重,质量减少6.51%。这是由于二水石膏脱掉1.5个结晶水生成半水石膏所致。此外,在176.5 ℃处有一个吸热峰,这对应半水石膏脱水生成无水石膏。磷石膏在230 ℃受热失重19.23%,与所测的结晶水含量19.11%相近。
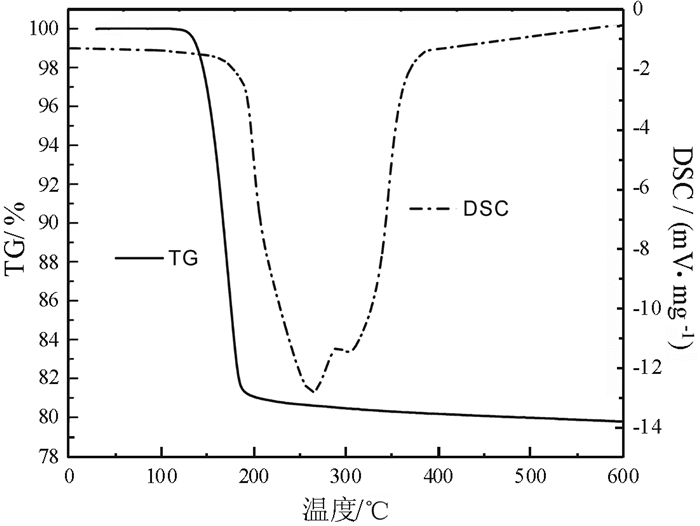 |
| 图 2 磷石膏TG-DSC曲线 Fig.2 TG-DSC curves of phosphogypsum |
1.2 试验方法 1.2.1 磷石膏制备α半水石膏的方法
以原状磷石膏为原料,采用常压盐法制备α半水石膏。先配制不同浓度(质量浓度,下同)的盐溶液,将溶液倒入500 mL三口烧瓶中并预先加热至95 ℃,按固液质量比为1 GA6FA 4加入磷石膏进行恒温动态反应,搅拌速度为200 r/min。每隔一定时间吸取料浆快速抽滤,滤饼经沸水洗涤,无水乙醇固定后,在40 ℃的鼓风干燥箱内烘至恒重,用于测定结晶水含量、X射线衍射分析和扫描电镜分析。
1.2.2 磷石膏脱水产物结晶水含量的测定试样经无水乙醇固定后,置于(40±1) ℃烘箱中干燥至恒重。参照GB/T 17669.2—1999《建筑石膏结晶水含量测定》测定磷石膏脱水产物结晶水含量。
1.2.3 α半水石膏的表征用X射线衍射仪(XRD,PANalytical)分析样品的物相组成,测定条件: Cu靶,电压40 kV,电流40 mA,扫描范围2θ从5°~90°;采用Jade 5软件对XRD图谱进行分析,根据ICDD晶体粉末衍射数据库(PDF2 2004)进行检索。采用ZEISS型扫描电子显微镜(SEM)观察样品的晶体形貌和尺寸,采用Image-Pro Plus图像分析软件手工测量至少100颗α半水石膏晶体的长度和直径,再计算平均长径比。
2 试验结果与讨论 2.1 NaCl对α半水石膏转化速率、物相组成和形貌的影响 2.1.1 NaCl溶液浓度对脱水速率的影响NaCl是常压盐溶液法制备α半水石膏常用的盐介质。NaCl溶液浓度对磷石膏脱水反应速率的影响如图 3所示。
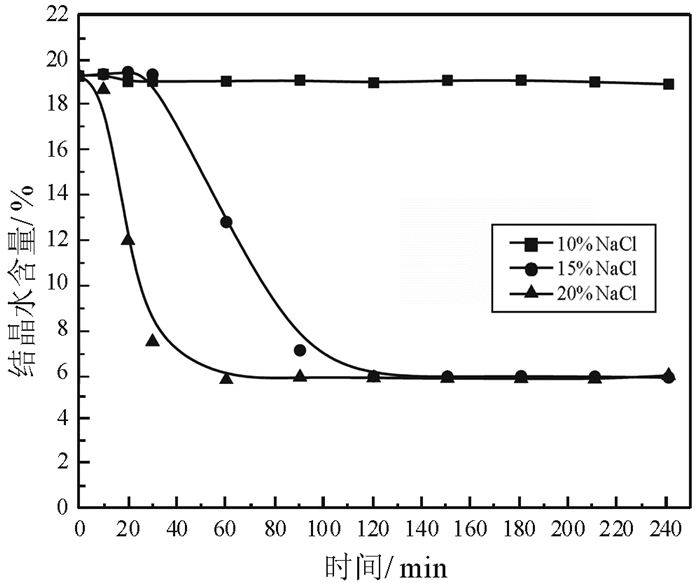 |
| 图 3 NaCl溶液浓度对脱水反应的影响 Fig.3 Effect of NaCl concentration on dehydration reaction |
由图 3可以看出,NaCl溶液浓度对磷石膏转化为α半水石膏的速率影响较大,NaCl浓度过低时,脱水反应无法进行;随着NaCl浓度的增大,脱水反应加快。当NaCl浓度为10%,反应时间达到240 min,磷石膏未发生转化;当NaCl浓度为15%时,完成脱水反应时间为120 min;当NaCl浓度增加至20%,转化完成时间缩短至60 min。
磷石膏在常压盐溶液条件下转化为α半水石膏的过程可划分为诱导阶段和晶体生长阶段。NaCl溶液浓度对α半水石膏结晶诱导时间和晶体生长时间的影响如图 4所示。由图 4可以看出,随着NaCl浓度的增加,诱导时间和晶体生长时间均缩短。NaCl浓度对诱导时间的影响比晶体生长时间的影响更显著。当NaCl浓度从15%增加至20%,诱导时间缩短25%,而晶体生长时间只缩短约60%,总的脱水时间缩短50%。
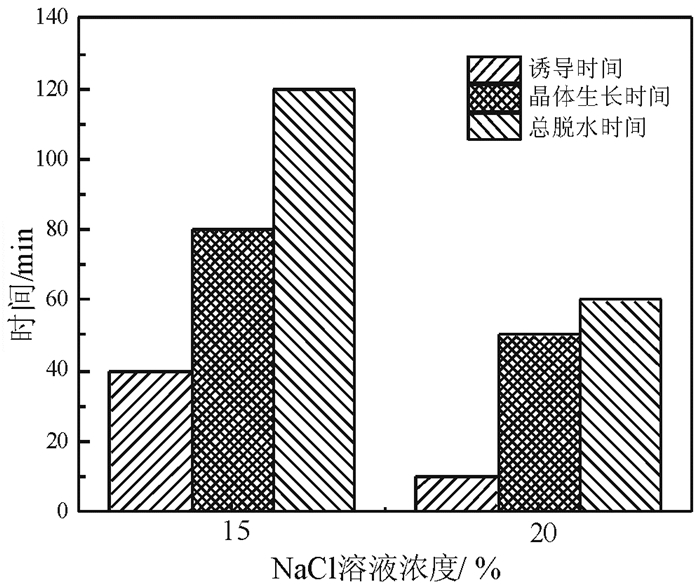 |
| 图 4 不同NaCl浓度下诱导时间和晶体生长时间 Fig.4 Induction period and crystal growth period in different NaCl concentrations |
2.1.2 NaCl浓度对产物物相组成的影响
磷石膏在不同NaCl浓度下反应240 min产物的XRD图谱如图 5所示。由图 5可以看出,在NaCl浓度为10%,反应产物仍为二水石膏;当NaCl浓度为10%和15%时,反应产物为α半水石膏。
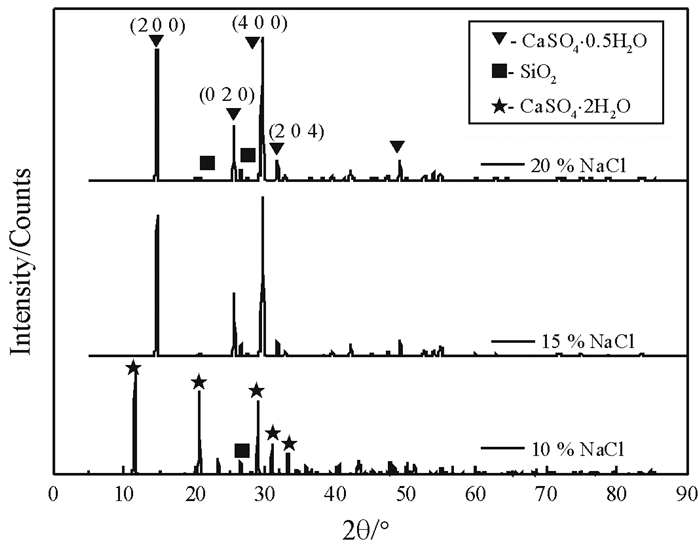 |
| 图 5 不同NaCl溶液浓度下反应产物XRD图谱 Fig.5 XRD patterns of reaction products in different NaCl concentrations |
不同NaCl浓度下,磷石膏制备α半水石膏反应产物结构相的半定量结果列于表 2中。由表 2中结果可以看出,当NaCl浓度为10%时,产物中二水石膏含量约为91%;当NaCl浓度分别为15%和20%时,反应产物中α半水石膏的含量分别约为96%和95%。
| 表 2 不同NaCl浓度下反应产物结构相的半定量检索结果 Table 2 Semi quantitative results of the phases of reaction products in different NaCl concentrations |
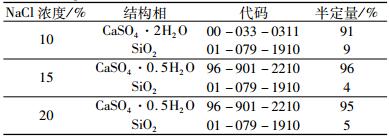 |
2.1.3 反应产物形貌分析
在NaCl浓度为15%、反应240 min产物的微观形貌如图 6所示。由图 6可以看出,在未添加晶形控制剂的条件下,反应产物α半水石膏的生长习性呈六方长柱状,颗粒的长度范围为35~230 μm,直径范围为2.2~15 μm,长径比平均为14 GA6FA 1。α半水石膏表面光滑,缺陷较少;端面清晰可见,呈现出多个锥面。
 |
| 图 6 反应产物α半水石膏SEM图 Fig.6 SEM images of α-hemihydrate gypsum (NaCl溶液浓度:15%;反应时间:240 min) (NaCl concentration: 15%; reaction time: 240 min) |
2.2 NaNO3对α半水石膏转化速率、物相组成和形貌的影响 2.2.1 NaNO3溶液浓度对脱水速率的影响
NaNO3溶液浓度对磷石膏脱水反应速率的影响如图 7所示。
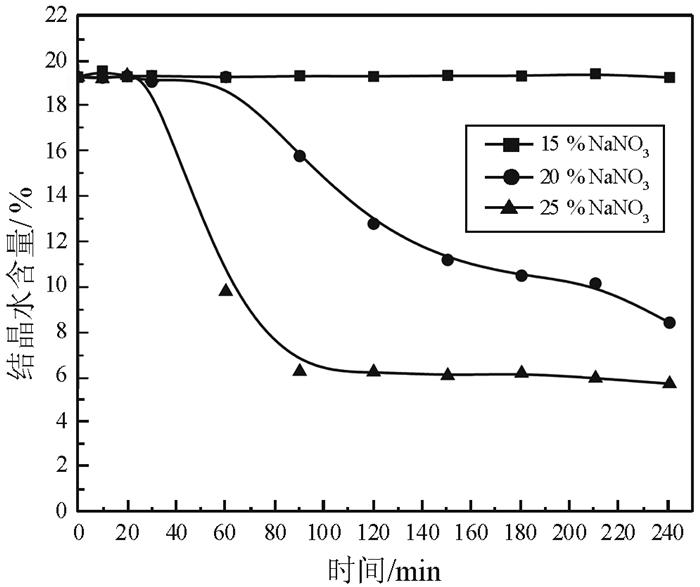 |
| 图 7 NaNO3溶液浓度对脱水反应的影响 Fig.7 Effect of NaNO3 concentration on dehydration reaction |
由图 7可以看出,当NaNO3浓度为15%,反应时间达到240 min时磷石膏未发生转变;当NaNO3浓度为20%,反应时间为240 min时磷石膏的转化率为90.4%;当NaNO3浓度增加至25%,磷石膏完全转化为α半水石膏,且反应时间缩短至90 min。在相同的盐浓度下,NaNO3的转化效果低于NaCl。
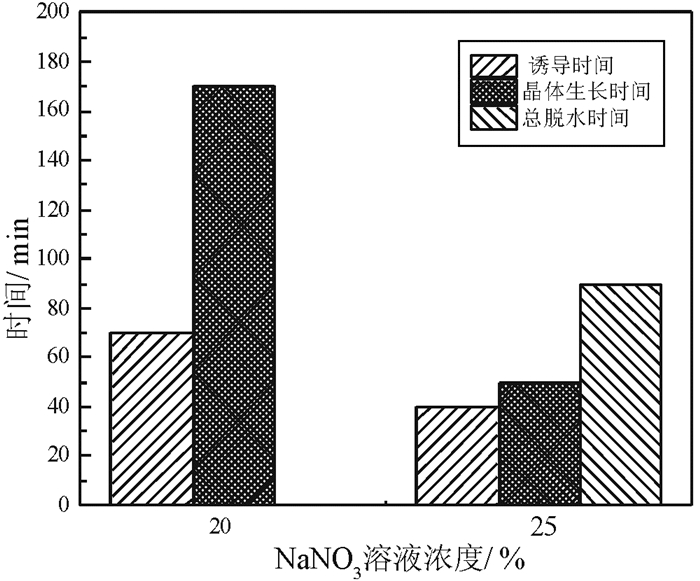
NaNO3溶液浓度对磷石膏制备α半水石膏结晶诱导时间和晶体生长时间的影响如图 8所示。
 |
| 图 8 不同NaNO3浓度下诱导时间和晶体生长时间 Fig.8 Induction period and crystal growth period in different NaNO3 concentrations |
由图 8可以看出,随着NaNO3浓度的增加,诱导时间和晶体生长时间均缩短。NaNO3浓度对晶体生长时间的影响比诱导时间显著。当NaNO3浓度从20%增加至25%,诱导时间从70 min缩短至40 min。在NaNO3浓度为20%时,晶体生长时间超过170 min;当NaNO3浓度为25%时,晶体生长缩短为50 min。
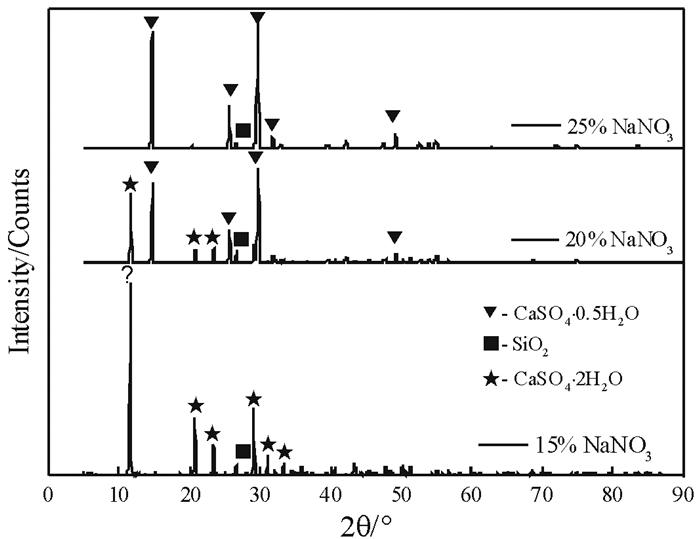
2.2.2 NaNO3浓度对产物物相组成的影响磷石膏在不同NaNO3溶液浓度下反应240 min产物的XRD图谱如图 9所示。
 |
| 图 9 不同NaNO3溶液浓度下反应产物XRD图谱 Fig.9 XRD patterns of reaction products in different NaNO3 concentrations |
由图 9可以看出,在NaNO3溶液浓度为15%时,反应产物仍为二水石膏,当NaNO3溶液浓度增加至20%时,部分磷石膏转化为α半水石膏,产物为α半水石膏与二水石膏的混合物;当NaNO3溶液浓度为25%时,反应产物全部转化为α半水石膏。
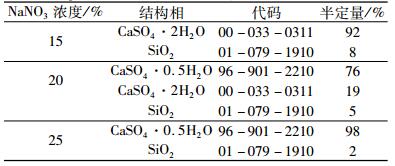
不同NaNO3浓度下,磷石膏制备α半水石膏反应产物结构相的半定量结果列于表 3中。由表 3可以看出,当NaNO3浓度为15%,二水石膏含量约为92%;当NaNO3浓度为20%时,反应产物中二水石膏和α半水石膏的含量分别约占76%和19%;当NaNO3浓度为25%时,α半水石膏的纯度约为98%。
| 表 3 不同NaNO3浓度下反应产物结构相的半定量检索结果 Table 3 Semi quantitative results of the phases of reaction products in different NaNO3 concentrations |
 |
2.2.3 反应产物形貌分析
在NaNO3溶液浓度为25%、反应240 min产物的微观形貌如图 10所示。
 |
| 图 10 反应产物α半水石膏SEM图 Fig.10 SEM images of α-hemihydrate gypsum (NaNO3溶液浓度:25%;反应时间:240 min) (NaNO3 concentration: 25%; reaction time: 240 min) |
由图 10可以看出,在未添加晶形控制剂的条件下,反应产物α半水石膏的形貌与15% NaCl溶液中α半水石膏的形貌与粒度组成相似,晶体呈六方长柱状,长度范围为23~207 μm,直径范围为1.6~17 μm,平均长径比为14.4 GA6FA 1。α半水石膏晶体表面光滑,部分α半水石膏穿插生长,端面清晰可见,呈现出多个锥面。
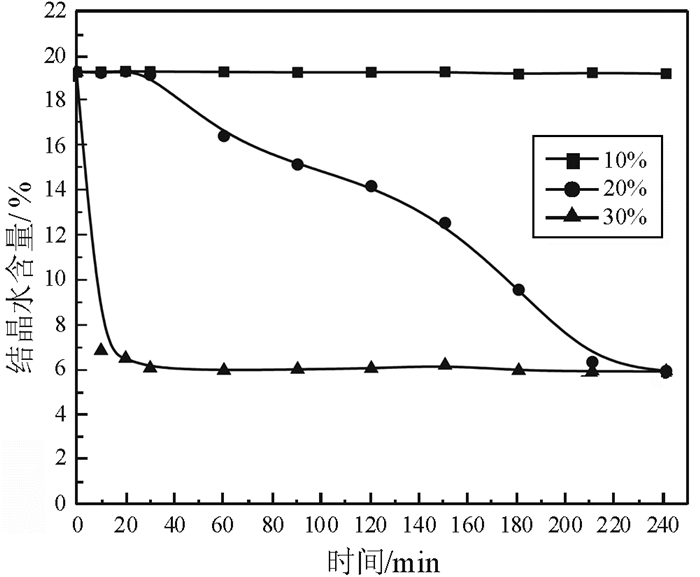
2.3 MgCl2对α半水石膏转化速率、物相组成和形貌的影响 2.3.1 MgCl2溶液浓度对脱水速率的影响MgCl2溶液浓度对磷石膏转化为α半水石膏脱水速率的影响如图 11所示。
 |
| 图 11 MgCl2溶液浓度对脱水反应的影响 Fig.11 Effect of MgCl2 concentration on dehydration reaction |
由图 11可以看出,磷石膏脱水反应速率受MgCl2浓度的影响较大,当MgCl2浓度为10%,反应时间达到240 min,磷石膏仍未发生转变;当MgCl2浓度为20%时,反应产物的结晶水含量随反应时间呈直线下降,在反应时间为210 min时,磷石膏基本上转化为α半水石膏;当MgCl2浓度增加至30%时,反应速率急剧增加,在反应时间为30 min时,磷石膏已全部转化为α半水石膏。
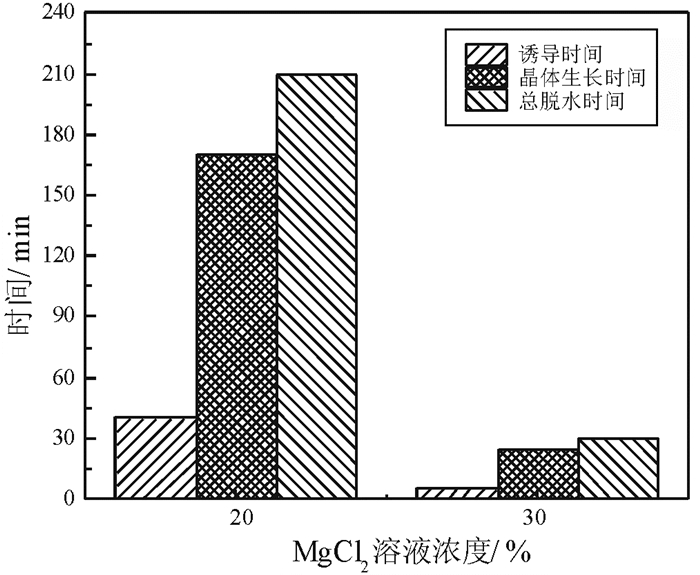
MgCl2溶液浓度对磷石膏制备α半水石膏结晶诱导时间和晶体生长时间的影响如图 12所示。
 |
| 图 12 不同MgCl2浓度下诱导时间和晶体生长时间 Fig.12 Induction period and crystal growth period in different MgCl2 concentrations |
由图 12可以看出,随着MgCl2浓度的增加,诱导时间和晶体生长时间明显缩短。当MgCl2浓度从20%增加至30%,诱导时间缩短12%,晶体生长时间缩短约15%,总的脱水时间缩短14%。
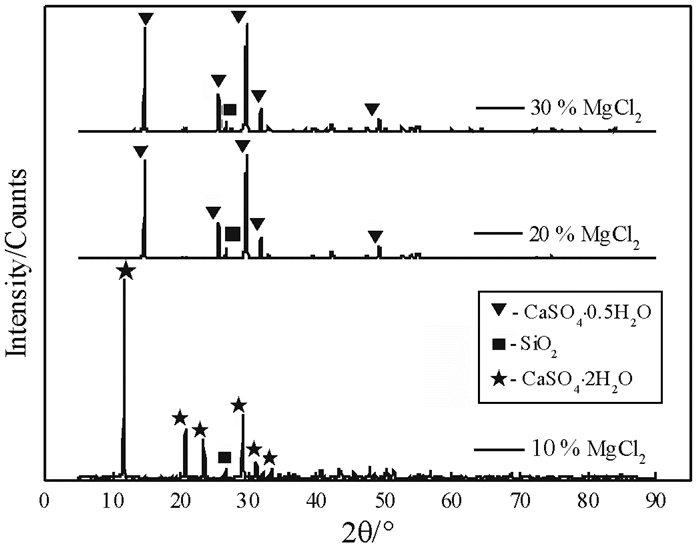
2.3.2 MgCl2浓度对产物物相组成的影响磷石膏在不同MgCl2浓度下反应240 min产物的XRD图谱如图 13所示。
 |
| 图 13 不同MgCl2溶液浓度下反应产物XRD图谱 Fig.13 XRD patterns of reaction products in different MgCl2 concentrations |
由图 13可以看出,在MgCl2浓度为10%,反应产物为二水石膏;当MgCl2浓度为20%和30%时,磷石膏全部转化为α半水石膏。
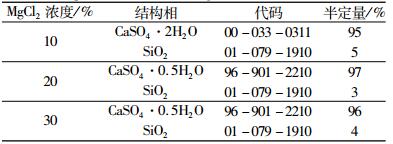
不同MgCl2浓度下,磷石膏制备α半水石膏反应产物结构相的半定量结果列于表 4中。由表 4可以看出,当MgCl2浓度为10%,二水石膏含量约为95%;当MgCl2浓度分别为20%和30%时,反应产物中α半水石膏的含量分别约为97%和96%。
| 表 4 不同MgCl2浓度下反应产物结构相的半定量检索结果 Table 4 Semi quantitative results of the phases of reaction products in different MgCl2 concentrations |
 |
2.3.3 反应产物形貌分析
在MgCl2浓度为20%、反应240 min产物的微观形貌如图 14所示。
 |
| 图 14 反应产物α半水石膏SEM图 Fig.14 SEM images of α-hemihydrate gypsum (MgCl2溶液浓度:20%;反应时间:240 min) (MgCl2 concentration: 20%; reaction time: 240 min) |
由图 14可以看出,在未添加晶形控制剂的条件下,反应产物α半水石膏的形貌呈六方长柱状,颗粒的长度范围为61~415 μm,直径范围为10~33 μm,平均长径比为11 GA6FA 1。α半水石膏晶体表面存在细小孔洞,端面呈空心层状包裹,晶体缺陷较大;相对于NaCl和NaNO3溶液,MgCl2溶液中制备的α半水石膏粒度更均匀,颗粒的长度和直径显著增大,长径比降低。
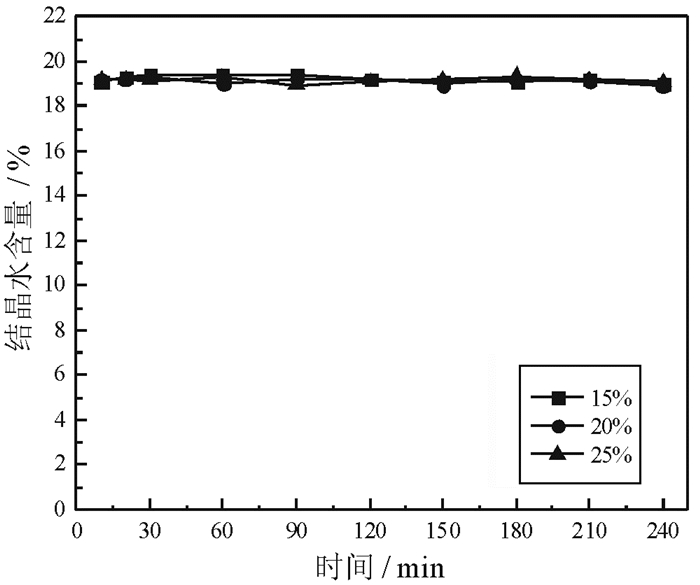
2.4 CaCl2和Ca(NO3)2对磷石膏制备α半水石膏的影响分别以CaCl2和Ca(NO3)2作盐介质,考察其浓度对磷石膏转化为α半水石膏的影响,结果分别如图 15和图 16所示。
 |
| 图 15 CaCl2溶液浓度对脱水反应的影响 Fig.15 Effect of CaCl2 concentration on dehydration reaction |
 |
| 图 16 Ca(NO3)2溶液浓度对脱水反应的影响 Fig.16 Effect of Ca(NO3)2 concentration on dehydration reaction |
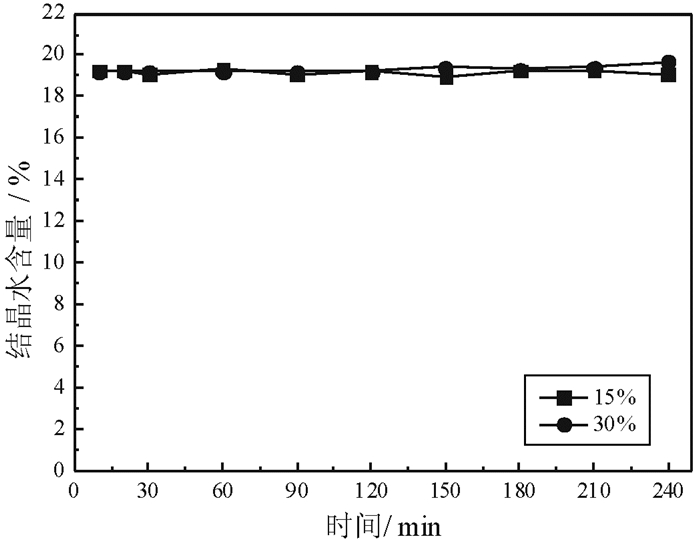
由图 15和图 16可以看出,当CaCl2浓度从15%增加至25%,Ca(NO3)2浓度从15%增加至30%,随着反应时间的延长,磷石膏未发生转变,结晶水含量保持在19%左右。原因是由于同离子效应的影响,磷石膏在CaCl2和Ca(NO3)2溶液中的溶解度相对较低,没有形成过饱和溶液,进而导致无法形成α半水石膏晶核。由此可见,CaCl2和Ca(NO3)2不宜作为磷石膏常压盐溶液制备α半水石膏的介质。
3 结论(1) 一定浓度的NaCl、NaNO3和MgCl2溶液均能使磷石膏转化为α半水石膏。随着盐溶液浓度的增加,磷石膏转化为α半水石膏的速率加快,结晶诱导时间和晶体生长时间缩短;反应产物中α半水石膏的含量在95%以上。
(2) 在不同盐介质中,反应产物α半水石膏晶体均呈六方长柱状,但端面形貌不相同。在NaCl和NaNO3溶液中,α半水石膏存在多个锥面且晶面完整,长径比约为14 GA6FA 1;在MgCl2溶液中端面呈空心层状包裹,长径比为11 GA6FA 1,粒度均匀,但晶体缺陷较大。
(3) 在CaCl2和Ca(NO3)2溶液中,磷石膏未发生相变,故CaCl2和Ca(NO3)2不宜作为磷石膏常压盐溶液制备α半水石膏的盐介质。
| [1] |
Tayibi H, Choura M, López F A, et al. Environmental impact and management of phosphogypsum[J]. Journal of Environmental Management, 2009, 90(8): 2377-2386. DOI:10.1016/j.jenvman.2009.03.007 |
| [2] |
侯婷婷, 郑传阳, 江晓敏. 固体废弃物磷石膏的净化处理及石膏晶须的研究[J]. 安徽化工, 2015, 41(5): 46-49. |
| [3] |
Shen Y, Qian J, Chai J, et al. Calcium sulphoaluminate cements made with phosphogypsum: production issues and material properties[J]. Cement and Concrete Composites, 2014, 48(4): 67-74. |
| [4] |
桂明生, 王鹏飞, 董俊. 脱色磷石膏制备硫酸钙晶须的研究[J]. 贵州大学学报(自然科学版), 2014, 31(3): 59-61. |
| [5] |
Guan B, Yang L, Wu Z, et al. Preparation of α-calcium sulfate hemihydrate from FGD gypsum in K, Mg-containing concentrated CaCl2 solution under mild conditions[J]. Fuel, 2009, 88(7): 1286-1293. DOI:10.1016/j.fuel.2009.01.004 |
| [6] |
茹晓红. 磷石膏基胶凝材料的制备理论及应用技术研究[D]. 武汉: 武汉理工大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10497-1013297455.htm
|
| [7] |
刘红霞. 常压盐溶液法α-半水脱硫石膏的制备及晶形调控研究[D]. 重庆: 重庆大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10611-2010215874.htm
|
| [8] |
Jiang G, Wang H, Chen Q, et al. Preparation of alpha-calcium sulfate hemihydrate from FGD gypsum in chloride-free Ca(NO3)2 solution under mild conditions[J]. Fuel, 2016, 174: 235-241. DOI:10.1016/j.fuel.2016.01.073 |
| [9] |
Guan B, Kong B, Fu H, et al. Pilot scale preparation of alpha-calcium sulfate hemihydrate from FGD gypsum in Ca-K-Mg aqueous solution under atmospheric pressure[J]. Fuel, 2012, 98: 48-54. DOI:10.1016/j.fuel.2012.03.032 |
 2017
2017 


