| 天然斜发沸石水热转化Na-P沸石及其吸附镉的性能研究 |
2. 陕西省无机材料绿色制备与功能化重点实验室,陕西 西安710021
2. Shaanxi Key Laboratory of Green Preparation and Functionalization for Inorganic Materials, Xi'an 710021, Shaanxi, China
天然沸石是一类多孔含水铝硅酸盐矿物,其在自然界的储量非常丰富,仅在我国就达40亿t左右,矿床点已发现400余处,属我国的优势非金属矿产资源。天然沸石因其独特的分子筛、离子交换、吸附和催化等特性,当前已在污水处理、土壤修复和空气净化等环保领域应用[1, 2]。目前已知的天然沸石有80余种,有工业开采和利用价值的主要有斜发沸石、丝光沸石、菱沸石、毛沸石、片沸石和钙十字沸石等,以斜发沸石和丝光沸石为主,其中斜发沸石储量最为丰富[3]。然而,由于斜发沸石为中硅沸石(硅铝比大多为4~6),其与低硅沸石(硅铝比为1~2)相比,可交换阳离子数量相对较少,且含有一定数量离子交换性相对较低的二价阳离子(如Ca2+),从而使其对阳离子污染物(如重金属阳离子)的处理效果较差[4]。
Na-P沸石是一种具有GIS结构的沸石,其主孔道由8元环组成,孔尺寸为0.31 nm×0.45 nm和0.28 nm×0.48 nm[5]。Na-P沸石的化学组成一般为Na6Al6Si10O32·15H2O,其Si/Al比较低,结构中含有丰富的可交换离子Na+,具有优异的离子交换性能和吸附性能[6, 7]。目前Na-P沸石已被广泛应用于水中多种离子(如NH4+[8]、Ca2+[9]、Zn2+[9-10]、Mn2+[11]、Cd2+[11-12]、Pb2+[11]、Sr2+[11]、Ba2+[5]、Cu2+[9-10]、Ni2+[9])的处理。Na-P沸石主要采用水热方法制得,所用原料一般为高纯化学试剂(如硅溶胶和偏铝酸钠[9, 11-12]),其成本相对较高。近年来,研究者尝试采用固体废物(如粉煤灰[10, 13-14])、天然矿物(如天然沸石[6, 15-17])等廉价原料替代化学试剂制备Na-P沸石。这其中,利用天然沸石制备Na-P沸石具有显著的优势,主要体现在[6, 15-17]:(1)天然沸石转化Na-P沸石时,一般不需要添加额外的硅源和铝源;(2)天然沸石中的沸石矿物可通过“沸石间转化作用”,在相对温和的条件下实现Na-P沸石的转化。
尽管前期研究已证实,采用水热方法可将天然沸石转化为Na-P沸石,但关于水热改性过程的影响因素及其机理、水热改性产物的组成结构及演变规律、(富)Na-P沸石结构和重金属离子去除性能等问题尚有待深入研究和明确。为此,本论文以河北承德围场地区天然斜发沸石为研究对象,对其进行水热碱处理改性以制备Na-P沸石吸附剂。探讨水热碱处理浓度、水热温度和时间等因素对水热产物组成结构的影响及其机理,深入研究所制备Na-P沸石的组成结构特征和重金属离子去除性能。为天然沸石资源的高效利用及Na-P沸石的制备与环境应用提供一定的理论和技术支持。
1 试验部分 1.1 试验样品及方法天然沸石样品由北京国投盛世有限公司提供,产自河北承德围场地区。X射线衍射定量分析法测试(k值法)结果显示,该样品主要含84.74%斜发沸石、10.13%石英和5.14%伊利石。由于斜发沸石与杂质矿物石英和伊利石的物化性质接近,很难分选,因此本试验未对样品进一步提纯。氢氧化钠、氯化镉(分析纯)购自上海阿拉丁科技股份有限公司。
水热碱处理工艺为:取5 g经60 ℃真空干燥24 h的沸石样品加入到50 mL氢氧化钠溶液中,将悬浊液超声15 min后,倒入聚四氟乙烯反应釜中,将反应釜置于烘箱中反应一段时间,之后将釜内悬浊液依次离心、多次水洗至中性、干燥、密封备用。
1.2 表征分析采用X射线衍射仪(AXS D8-Focus, 德国布鲁克公司)对样品晶体结构进行分析,Cu靶,工作电流和电压分别为40 mA和40 kV。采用X射线光电子能谱仪(AXIS SUPRA,日本岛津Kratos公司)对样品的表面元素和结合状态进行分析。采用气体吸附仪(Gemini Ⅶ2390,美国麦克默瑞提克公司)对样品的比表面积和孔结构进行分析。采用扫描电镜(Verios 460,美国FEI公司)和配备的能谱分析仪对样品的微观形貌和表面元素含量进行分析。
1.3 重金属离子去除性能评价采用Cd2+离子评价材料的离子交换性能。吸附试验的步骤如下:将一定量沸石样品加入一定浓度的Cd2+离子溶液中,在室温下混合搅拌一定时间。吸取一定量的上清液,经高速离心后,采用电感耦合等离子发射光谱测试溶液中离子的浓度。样品对Cd2+的吸附容量采用如式(1)计算:
| $ {q_e} = \left( {{C_0} - {C_e}} \right)*V/W $ | (1) |
式中:qe为吸附容量,mg/g;C0和Ce分别为溶液初始和最终浓度,mg/L;V为溶液的体积,L;W为吸附剂的用量,g。
采用准一级和准二级动力学模型研究Cd2+的吸附动力学特征,二者的方程如式(2)和(3)所述:
| $ {\rm{ln}}({q_e} - {q_t}) = {\rm{ln}}{q_e} - {k_1}t $ | (2) |
| $ t/{q_t} = {\rm{ }}1/\left( {{k_2}q{e^2}} \right) + \left( {1/{q_e}} \right)t $ | (3) |
式中:k1是准一级速率常数(min-1);k2是准二级速率常数(g·mg-1·min-1)。
采用Langmuir和Freundlich吸附模型对吸附等温线进行拟合,二者的方程如式(4)和(5)所述:
| $ 1/{q_e} = 1/{q_{mon}} + 1/({K_L}{q_{mon}}{C_e}) $ | (4) |
| $ {\rm{ln}}{q_e} = {\rm{ln}}{K_F} + 1/n\;{\rm{ln}}Ce $ | (5) |
式中:qmon是样品对污染物的最大吸附容量(mg/g);KL是Langmuir常数(L/mg);KF是吸附容量的指标
图 1是天然斜发沸石(记为NZ)和1、2、3、4 mol/L NaOH处理(水热温度100 ℃、水热时间12 h)样品(分别记为NZ-1M、NZ-2M、NZ-3M、NZ-4M)的X射线衍射(XRD)图谱。从图中可以看出,天然斜发沸石样品中主要含斜发沸石、石英和伊利石。其中,NZ-1M和NZ-2M样品的XRD图谱与NZ样品相比未发生明显变化,表明此条件下天然沸石的结构未发生转变;但二者XRD图谱中斜发沸石(020)处特征峰的强度较NZ样品显著降低,说明样品的结晶度下降,这可能是由于碱处理的脱硅作用所致[18]。NZ-3M和NZ-4M样品的XRD图谱中,斜发沸石的特征峰几乎消失,出现了明显的Na-P沸石的特征峰,表明在此条件下,斜发沸石转变为Na-P沸石。此外,不同浓度碱处理样品XRD图谱中石英和伊利石的特征峰均未发生明显变化,表明石英和伊利石几乎未参与反应。
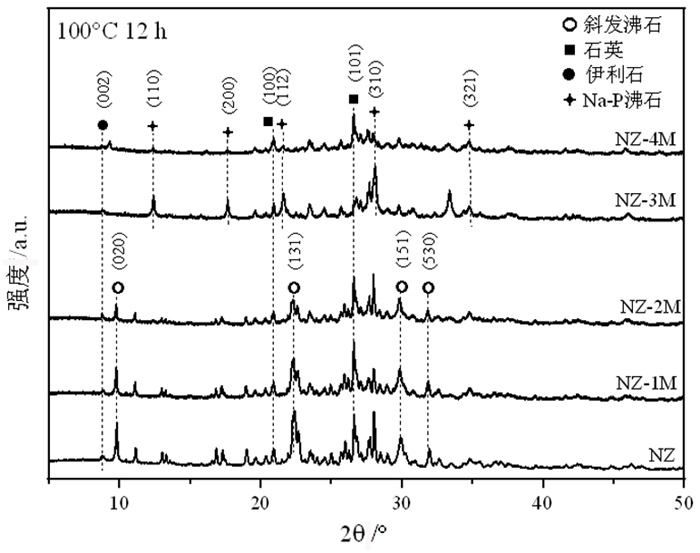 |
| 图 1 不同NaOH浓度处理下样品的XRD图谱 Fig.1 XRD patterns of samples treated by NaOH with different concentrations |
图 2是天然斜发沸石和80、100、120、140 ℃条件下(碱处理浓度3 mol/L、水热时间12 h)样品(分别记为NZ-80 ℃、NZ-100 ℃、NZ-120 ℃、NZ-140 ℃)的XRD图谱。图中可以看出,NZ-80 ℃样品XRD图谱中除斜发沸石的特征峰外,还出现了Na-P沸石的特征峰,表明此条件下部分斜发沸石转变为Na-P沸石。NZ-120 ℃样品XRD图谱中除Na-P沸石的特征峰外,出现了明显的方沸石的特征峰,表明此条件下斜发沸石可转变为Na-P沸石和方沸石混晶。NZ-140 ℃样品XRD图谱中主要为方沸石的特征峰,表明此条件下斜发沸石转变为方沸石。此外,NZ-120 ℃和NZ-140 ℃样品XRD图谱中石英特征峰的强度明显减弱,表明在上述过程中,石英可能参与了反应。
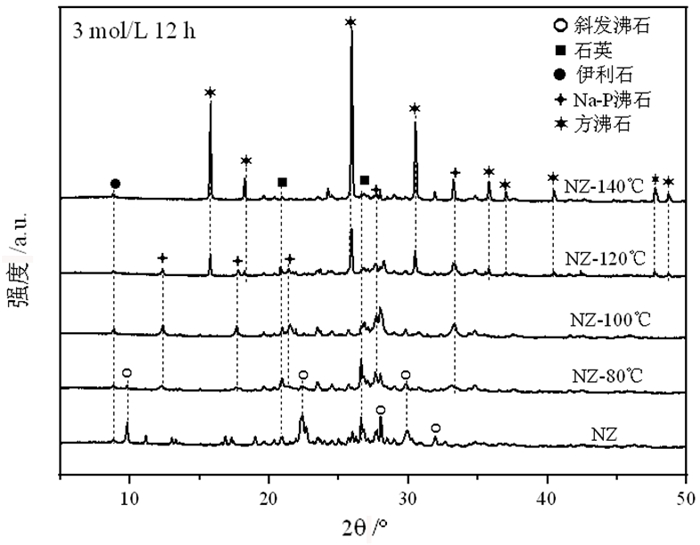 |
| 图 2 不同水热温度下样品的XRD图谱 Fig.2 XRD patterns of samples treated under different hydrothermal temperatures |
图 3是天然斜发沸石和6 h、12 h、24 h、36 h水热处理条件下(碱处理浓度3 mol/L、水热温度100 ℃)样品(分别记为NZ-6h、NZ-12h、NZ-24h、NZ-36h)的XRD图谱。图中可以看出,NZ-6h样品为斜发沸石和Na-P沸石混晶结构,NZ-24h和NZ-36h样品为Na-P沸石和方沸石混晶结构。表明随着水热时间的延长,斜发沸石先转变为Na-P沸石,后向方沸石转变。
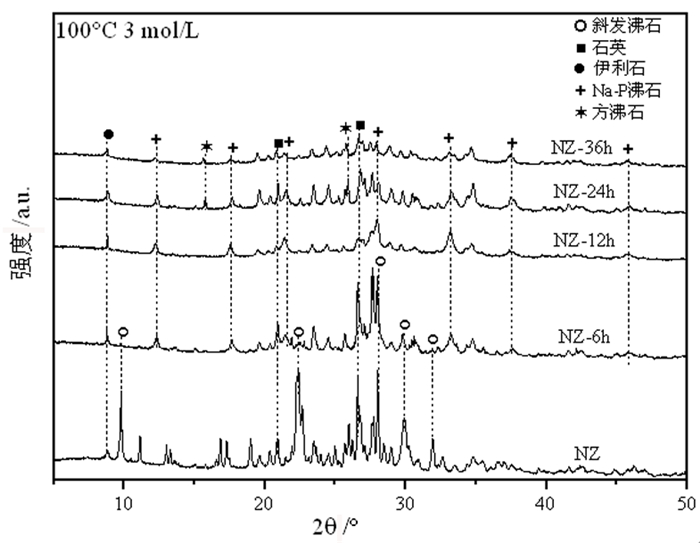 |
| 图 3 不同水热时间下样品的XRD图谱 Fig.3 XRD patterns of samples treated under different hydrothermal times |
综合以上XRD分析结果可以看出,当NaOH浓度为3 mol/L、水热温度为100 ℃、水热时间为12 h时,斜发沸石可转化为Na-P沸石,所得样品中不含斜发沸石和其他类型沸石。
2.2 Na-P沸石的组成结构特征为了进一步考察制备的Na-P沸石(ZP)的组成和结构特征,对天然斜发沸石NZ和ZP进行X射线衍射分析(XPS)、比表面积及孔结构分析、扫描电镜(SEM)和能谱(EDX)分析。
图 4为NZ和ZP样品的XPS分析结果。样品的XPS全谱分析结果显示,样品表面均含有Si、Al、O、K和Ca,其中NZ样品表面几乎不含Na,而ZP样品表面存在大量Na元素,各元素的含量如图 4b所示。图 4b显示,NZ和ZP样品表面Si/Al比分别为4.15和2.25。图 4c, d, e中ZP样品Si、Al和O谱的特征峰相对于NZ样品均向低结合能方向偏移,表明样品结构中上述元素的离子性提高[19],这主要是由于水热碱处理过程中斜发沸石脱硅并转化为硅铝比更低的Na-P沸石所致[18]。图 4d中NZ和ZP样品的Al特征峰均可分峰拟合为两个,高结合能处的特征峰对应骨架Al、低结合能处的特征峰对应非骨架Al[20];其中,NZ样品骨架Al和非骨架Al的含量分别为总含量的29.41%和70.59%;ZP样品中骨架Al的含量降低至1.46%,非骨架Al的含量上升至98.54%,表明ZP样品表面含有大量的非骨架Al,这可能是由于斜发沸石向Na-P沸石转化过程中,沸石结构中大量Al迁移至表面形成非骨架Al所致。图 4e中NZ和ZP样品的O特征峰均可分分峰拟合为两个,高结合能处的特征峰对应Si-O-Si中的O,低结合能处的特征峰对应Si-O-Al中的O[16]。NZ和ZP样品中高结合能O和低结合能O的比例分别为31.22%、68.78%和3.46%、96.54%,ZP样品表面Si-O-Si中O的含量大大降低,这主要是由于ZP样品的硅铝比相较于NZ样品显著降低所致。图 4f中ZP样品Na谱的特征峰强显著高于NZ样品,表明ZP样品表面含有大量Na+。
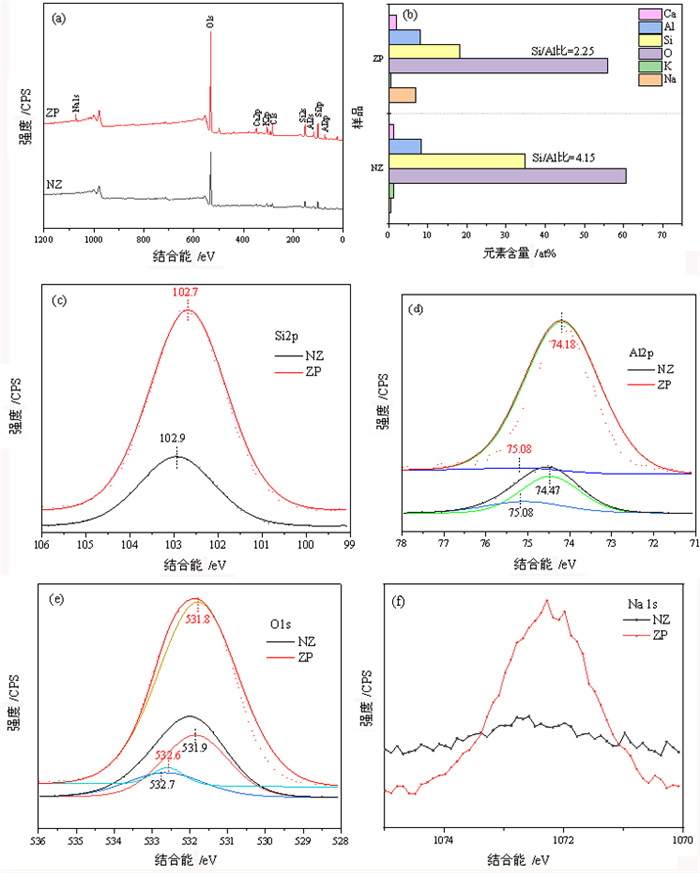 |
| 图 4 天然沸石和Na-P沸石的XPS全谱(a), 表面元素含量和硅铝比(b), Si2p谱(c), Al2p谱(d), O1s谱(e)和Na1s谱(f) Fig.4 XPS spectra (a), surface elements contents and Si/Al ratio (b), Si2p spectra (c), Al2p spectra (d), O1s spectra (e) and Na1s spectra (f) |
图 5是NZ和ZP样品的N2吸附—脱附曲线和孔径分布。图中可以看出,二者N2吸附—脱附曲线在低的相对压强下有上升,在高的相对压强下存在滞后环,表明样品均含有微孔和介孔。微孔和介孔主要分布在1.3 nm和3.8 nm。ZP样品的比表面积较NZ样品稍有降低,分别为20 m2/g和23 m2/g。
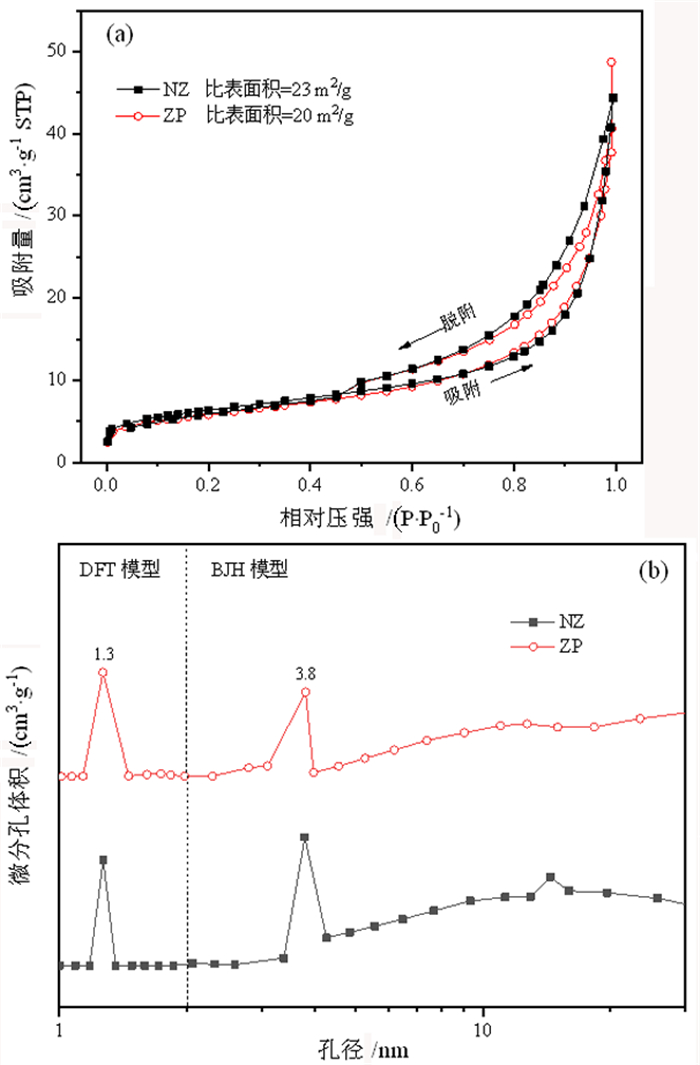 |
| 图 5 天然沸石和Na-P沸石的N2吸附-脱附曲线(a)和孔径分布图(b) Fig.5 N2 adsorption-desorption curves (a) and pore width distributions (b) of natural zeolite and zeolite Na-P |
图 6为NZ和ZP样品的SEM照片和EDX能谱分析。从图中可以看出,NZ样品和ZP样品的微观形貌差异较大,其中ZP样品出现大量规则形状的颗粒,结合XRD和XPS分析结果可知,该规则状颗粒为P型沸石颗粒。二者的EDX能谱分析结果显示,NZ样品和ZP样品的硅铝比分别为5.47和3.27,该结果与XPS分析结果基本一致。
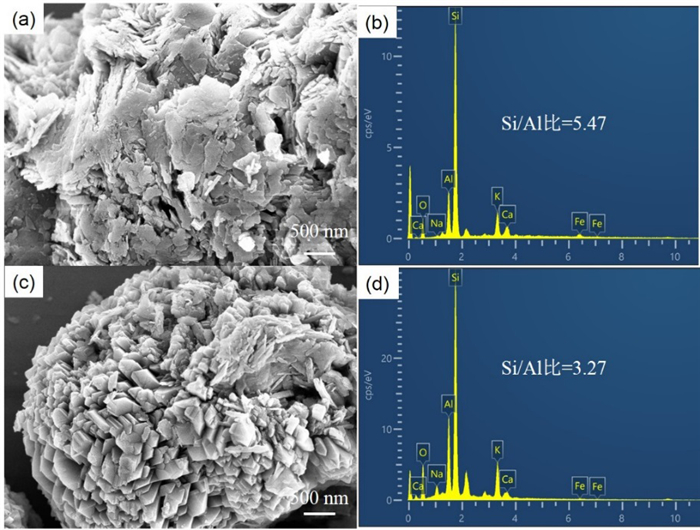 |
| 图 6 天然沸石(a, b)和Na-P沸石(c, d)的SEM照片和EDX能谱 Fig.6 SEM images and EDX spectra of natural zeolite (a, b) and zeolite Na-P (c, d) |
2.3 Na-P沸石对Cd2+的去除性能
图 7是NZ和ZP样品在不同吸附时间下对Cd2+离子的吸附容量和样品对不同初始浓度Cd2+的吸附等温线。其中,吸附时间试验中,Cd2+的浓度为100 mg/L,吸附剂用量为0.1 g/L,吸附时间为0.5~240 min;不同初始浓度试验中,Cd2+的浓度为60~240 mg/L,吸附时间为2 h。从图中可以看出,ZP样品和NZ样品对Cd2+的吸附平衡时间分别为60 min和15 min。ZP样品对Cd2+的最大吸附容量为35.7 mg/g,显著高于NZ样品的4.5 mg/g,提升了7倍。
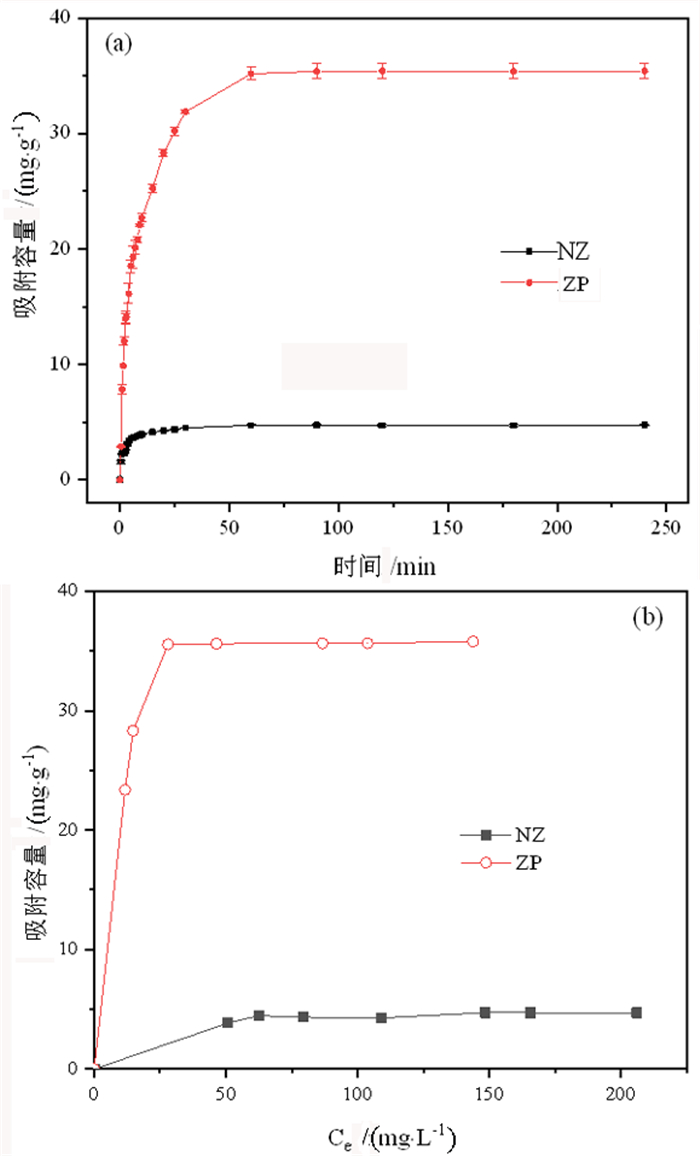 |
| 图 7 天然沸石和Na-P沸石在不同吸附时间下对Cd2+的吸附容量(a)和对不同初始浓度Cd2+的吸附等温线(b) Fig.7 Adsorption capacity of natural zeolite and zeolite Na-P for Cd2+ under different adsorption times (a) and adsorption isotherms of the samples for Cd2+ under different initial concentrations (b) |
图 8是NZ和ZP样品吸附Cd2+的准一级动力学(a)、准二级动力学(b)、Langmuir(c)和Freundlich(d)拟合结果。对比模型拟合相关系数,可以看出NZ和ZP吸附Cd2+符合准二级动力学模型和Langmuir吸附模型,表明NZ和ZP对Cd2+的吸附为单层化学吸附。其中,利用准二级动力学拟合方程计算得到NZ和ZP的最大吸附容量分别为4.8 mg/g和36.4 mg/g,准二级速率常数K2分别为0.120 6和0.006 0 g/(mg·min)。利用Langmuir拟合方程计算得到NZ和ZP的最大吸附容量分别为1.28 mg/g和27.9 mg/g。
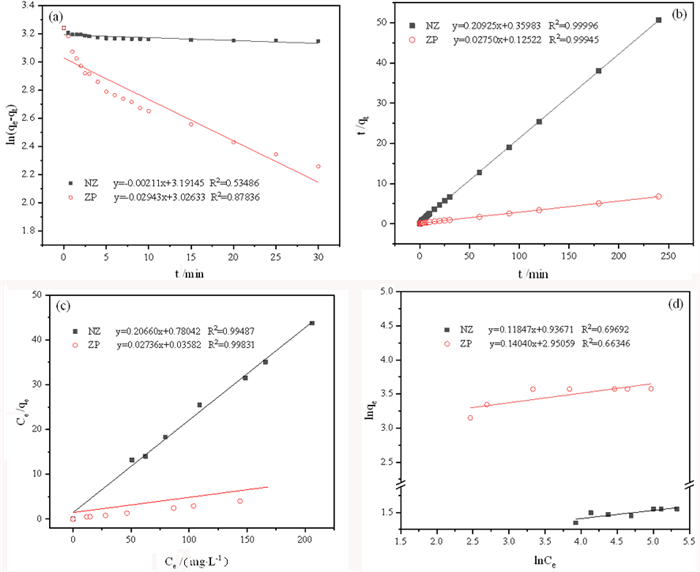 |
| 图 8 天然沸石和Na-P沸石吸附Cd2+的准一级动力学(a)、准二级动力学(b)、Langmuir(c)和Freundlich(d)拟合图 Fig.8 Plots of pseudo-first-order (a), pseudo-second-order kinetic models (b), Langumir (c) and Freundlich models (d) for adsorption of Cd2+ on natural zeolite and zeolite Na-P |
结合材料的组成结构和Cd2+去除性能分析结果可以看出,天然斜发沸石在合适的水热碱处理条件下可转变为(富)Na-P沸石,该沸石具有低的硅铝比和高的表面Na+含量(相关结构示意图见图 9),因此表现出较天然斜发沸石更高的重金属离子去除性能。
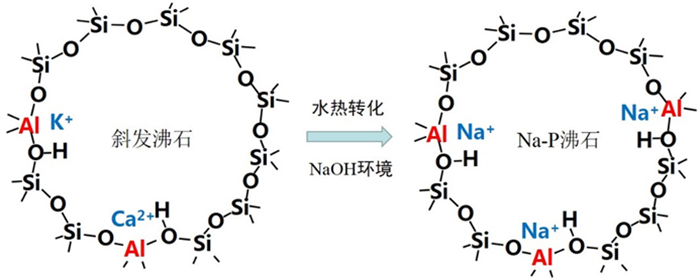 |
| 图 9 斜发沸石和水热转化Na-P沸石的结构示意图 Fig.9 Structure schematics of clinoptiloite and hydrothermal transferred zeolite Na-P |
3 结论
(1) 碱处理浓度、水热温度和时间对天然斜发沸石的组成和结构具有较大影响,当碱处理浓度3 mol/L、水热温度100 ℃和水热时间12 h时,可获得纯度较高的Na-P沸石。
(2) Na-P沸石的Si/Al比为2.25,显著低于天然沸石的4.15(基于XPS分析结果),且其Na+含量显著高于天然沸石;样品中均含有微孔和介孔,主要分布在1.3 nm和3.8 nm。Na-P沸石的比表面积为20 m2/g,稍低于天然沸石的23 m2/g。
(3) Na-P沸石对Cd2+的吸附容量为35.7 mg/g,是天然斜发沸石的7倍。二者对Cd2+的吸附符合准二级动力学模型和Langmuir吸附模型。
上述研究对于天然沸石资源的高效利用和Na-P沸石的制备及环境应用具有积极的促进作用。
| [1] |
MISAELIDES P. Application of natural zeolites in environmental remediation: A short review[J]. Microporous and Mesoporous Materials, 2011, 144: 15-18. DOI:10.1016/j.micromeso.2011.03.024 |
| [2] |
李超, 王丽萍. 矿物材料处理废水的研究进展[J]. 矿产保护与利用, 2020, 40(1): 65-71. |
| [3] |
佘振宝. 沸石加工与应用: 第2版[M]. 北京: 化学工业出版社, 2013.
|
| [4] |
杨磊. 改型斜发沸石与钙、镁离子水溶液体系离子交换平衡研究[D]. 天津: 河北工业大学, 2010.
|
| [5] |
YANG S J, LACH-HAB M, VAISMAN I I, et al. Framework-type determination for zeolite structures in the inorganic crystal structure database[J]. Journal of Physical and Chemical Reference Data, 2010, 39: 1-45. |
| [6] |
BEHIN J., KAZEMIAN H., ROHANI S. Sonochemical synthesis of zeolite NaP from clinoptilolite[J]. Ultrasonics Sonochemistry, 2016, 28: 400-408. DOI:10.1016/j.ultsonch.2015.08.021 |
| [7] |
ALDAHRI T, BEHIN J, KAZEMIAN, et al. Synthesis of zeolite Na-P from coal fly ash by thermo-sonochemical treatment[J]. Fuel, 2016, 182: 494-501. DOI:10.1016/j.fuel.2016.06.019 |
| [8] |
LIU Y, YAN C J, ZHAO J J, et al. Synthesis of zeolite P1 from fly ash under solvent-free conditions for ammonium removal from water[J]. Journal of Cleaner Production, 2018, 202: 11-22. DOI:10.1016/j.jclepro.2018.08.128 |
| [9] |
ALIAS M Y, NIK A N N M, NURUL A K, et al. Removal of Ca2+ and Zn2+ from aqueous solutions by zeolites NaP and KP[J]. Environmental Technology, 2010, 31: 41-46. DOI:10.1080/09593330903313794 |
| [10] |
ZHANG Y N, CHEN Y G, KANG W, et al. Excellent adsorption of Zn (Ⅱ) using NaP zeolite adsorbent synthesized from coal fly ash via stage treatment[J]. Journal of Cleaner Production, 2020, 258: 120736. DOI:10.1016/j.jclepro.2020.120736 |
| [11] |
NERY J G, YVONNE P M, ANTHONY K C. A study of the highly crystalline, low-silica, fully hydrated zeolite P ion exchanged with (Mn2+, Cd2+, Pb2+, Sr2+, Ba2+) cations[J]. Microporous and Mesoporous Materials, 2003, 57: 229-248. DOI:10.1016/S1387-1811(02)00594-2 |
| [12] |
CHENM Y, NONG S Y, ZHAO Y T, et al. Renewable P-type zeolite for superior absorption of heavy metals: Isotherms, kinetics, and mechanism[J]. Science of the Total Environment, 2020, 726: 138535. DOI:10.1016/j.scitotenv.2020.138535 |
| [13] |
LIU Y, WANG G D, WANG L, et al. Zeolite P synthesis based on fly ash and its removal of Cu (Ⅱ) and Ni (Ⅱ) ions[J]. Chinese Journal of Chemical Engineering, 2019, 27: 341-348. DOI:10.1016/j.cjche.2018.03.032 |
| [14] |
DENG H, GE Y. Formation of NaP zeolite from fused fly ash for the removal of Cu(Ⅱ) by an improved hydrothermal method[J]. RSC Advances, 2015, 5: 9180-9188. DOI:10.1039/C4RA15196H |
| [15] |
KANG S J, KAZUHIKO E, AKIRA Y. Transformation of a low-grade Korean natural zeolite to high catadsorbent by hydrothermal reaction with or without fusion with sodium hydroxide[J]. Applied Clay Science, 1998, 13: 117-135. DOI:10.1016/S0169-1317(98)00019-2 |
| [16] |
WANG Y F, FENG L. Synthesis of high capacity catadsorbents from a low-grade Chinese natural zeolite[J]. Journal of Hazardous Materials, 2009, 166: 1014-1019. DOI:10.1016/j.jhazmat.2008.12.001 |
| [17] |
LIMLAMTHONG M, LEE M, JONGSOMJIT B, et al. Solution-mediated transformation of natural zeolite to ANA and CAN topological structures with altered active sites for ethanol conversion[J]. 2021, 32: 4155-4166.
|
| [18] |
WANG C, LENG S Z, GUO H D, et al. Acid and alkali treatments for regulation of hydrophilicity/hydrophobicity of natural zeolite[J]. Applied Surface Science, 2019, 478: 319-326. DOI:10.1016/j.apsusc.2019.01.263 |
| [19] |
WANG X Y, PLACKOWSKI C X, NGUYEN A V X-ray photoelectron spectroscopic investigation into the surface effects of sulphuric acid treated natural zeolite[J]. Powder Technology, 295: 27-34.
|
| [20] |
CORMA A, FORNES V, PALLOTA O, et al. Determination of framework and non-framework aluminium in HY dealuminated zeolites by X-ray photoelectron spectroscopy[J]. Journal of the Chemical Society, Chemical Communications, 1986, 333-334. |
 2021
2021


