| NaOH溶液体系浸出工业氧化钼试验研究 |
2. 中国地质科学院郑州矿产综合利用研究所,河南 郑州 450006;
3. 自然资源部多金属矿评价与综合利用重点实验室,河南 郑州 450006
2. Zhengzhou Institute of Multipurpose Utilization of Mineral Resources, CAGS, Zhengzhou 450006, China;
3. Key Laboratory of Evaluation and Multipurpose Utilization of Polymetallic Ores of Ministry of Natural Resources, Zhengzhou 450006, China
工业三氧化钼由辉钼矿焙烧而成, 其传统的处理方法是将工业氧化钼氨浸得到钼酸铵溶液, 再经一系列流程将钼酸铵溶液除杂并结晶, 最终转变为钼酸铵产品。但氨浸浸出率一般为85%~98%, 未浸出的钼损失在渣中, 影响钼金属回收率[1-5]。造成浸出率低的主要原因是精矿中伴生的硫化铜、硫化铅和硫化铁等物质, 在焙烧过程中, 上述铜、铅、铁等硫化物在600 ℃左右发生氧化反应生成铜、铅和铁的氧化物, 继而这些金属氧化物与氧化钼结合生成铜、铅和铁等的难溶钼酸盐, 生成的钼酸盐在500~730 ℃会与三氧化钼再反应, 生成低熔点的共晶体, 或者是焙烧过程未得到完全氧化的低价钼化合物[6-15]。为减少渣中钼损失则须提高钼浸出率, 解决焙砂中难溶钼酸盐(钼铜、钼铅共晶体及低价钼化合物)的浸出则是首要问题。从钼酸盐矿物中提取钼的技术鲜有报道, 李飞等[16]从热力学角度对氢氧化钠浸出不溶性CaMoO4、Fe2(MoO4)3、CuMoO4混合盐进行理论分析, 通过理论验算得出NaOH分解CaMoO4、Fe2(MoO4)3、CuMoO4混合盐是可行的。唐忠阳等[17]采用高压氧分解—萃取法回收铜钼矿中的钼提供了一种氧气氧化浸出的方法。本文采用氢氧化钠浸出体系, 开展了工业三氧化钼浸出试验, 并研究了助浸剂对氢氧化钠体系浸钼的影响。
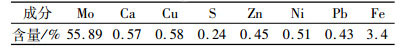
1 试验原料及方法 1.1 试验原料与设备试验所用原料来源于伊春鹿鸣矿业有限公司, 其主要成分如表 1所示, XRD图谱见图 1, 试验仪器及分析设备见表 2。
| 表 1 试验原料的主要成分 Table 1 The main ingredients of test raw materials |
 |
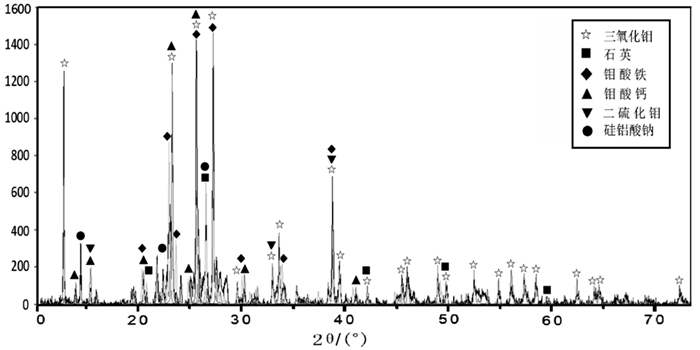 |
| 图 1 钼焙砂XRD图谱 Fig.1 XRD diffraction pattern of test industrial molybdenum trioxide |
| 表 2 试验仪器及设备 Table 2 Test instruments and equipment |
 |
1.2 试验原理
通过原料的杂质分析及XRD图谱可以看出, 钼焙砂中钼的主要存在形态为MoO3, 同时还含有少量的钼酸铁、钼酸钙等钼酸盐及未氧化的二硫化钼。因此可以推测钼焙砂与NaOH溶液混合后加热搅拌, 焙砂中有价元素和碱及助浸剂反应的方程式主要有:
| $ {\rm{Mo}}{{\rm{O}}_{\rm{3}}}{\rm{ + 2NaOH = N}}{{\rm{a}}_{\rm{2}}}{\rm{Mo}}{{\rm{O}}_{\rm{4}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (1) |
| $ {\rm{MeMo}}{{\rm{O}}_{\rm{4}}}{\rm{ + 2NaOH = Me}}{\left( {{\rm{OH}}} \right)_{\rm{2}}}{\rm{ + N}}{{\rm{a}}_{\rm{2}}}{\rm{Mo}}{{\rm{O}}_{\rm{4}}} $ | (2) |
(式中Me代表Ca、Fe等)
| $ {\rm{CaMo}}{{\rm{O}}_{\rm{4}}}{\rm{ + N}}{{\rm{a}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}}{\rm{ = N}}{{\rm{a}}_{\rm{2}}}{\rm{Mo}}{{\rm{O}}_{\rm{4}}}{\rm{ + CaC}}{{\rm{O}}_{\rm{3}}} $ | (3) |
| $ {\rm{3CaMo}}{{\rm{O}}_{\rm{4}}}{\rm{ + 2N}}{{\rm{a}}_{\rm{3}}}{\rm{P}}{{\rm{O}}_{\rm{4}}}{\rm{ = 3N}}{{\rm{a}}_{\rm{2}}}{\rm{Mo}}{{\rm{O}}_{\rm{4}}}{\rm{ + C}}{{\rm{a}}_{\rm{3}}}{{\rm{(P}}{{\rm{O}}_{\rm{4}}}{\rm{)}}_{\rm{2}}} $ | (4) |
| $ {\rm{2Mo}}{{\rm{S}}_{\rm{2}}}{\rm{ + 9}}{{\rm{O}}_{\rm{2}}}{\rm{ + 12NaOH = 2N}}{{\rm{a}}_{\rm{2}}}{\rm{Mo}}{{\rm{O}}_{\rm{4}}}{\rm{ + 4N}}{{\rm{a}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ + 6}}{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (5) |
浸出试验在2 L烧杯中进行, 将钼焙砂用制样机磨细至-0.106 mm含量占100%, 单次试验焙砂质量为300 g, 试验体积依液固质量比不同, 试验过程均采用水浴加热, 以达到反应温度时开始计反应时间, 搅拌速度设定为150 r/min。
将钼焙砂、无盐水、片碱(AR)经计量后加入烧杯, 搅拌、水浴加热至反应结束后, 将烧杯内浆料用布什漏斗过滤, 200 mL无盐水洗涤, 滤液、洗液分别计量、取样分析其中的Mo浓度, 渣于100 ℃烘干2 h称重, 取样分析渣含Mo, 计算钼浸出率。其中渣含钼和溶液中的钼均采用硫氰酸盐比色法分析; 焙砂中总钼采用钼酸铅重量方法分析, 焙砂中其余元素采用ICP(电感藕合等离子发射光谱仪)分析。
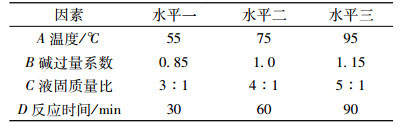
首先, 采用四因素三水平的正交试验考察温度、碱过量系数、液固质量比、反应时间四因素对浸出率的影响程度, 并通过延伸试验提高钼的碱浸出率。正交试验相关参数见表 3。
| 表 3 正交试验安排 Table 3 Orthogonal test table |
 |
2 试验结果及讨论 2.1 正交试验
正交试验结果及结果分析见表 4。
| 表 4 试验结果及结果分析 Table 4 The analysis of the test results |
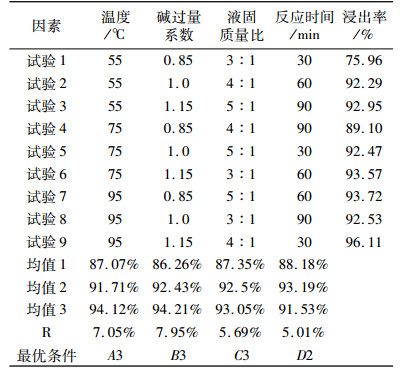 |
通过碱浸温度、碱过量系数、液固质量比及反应时间进行正交试验, 考察上述四因素在焙砂碱浸时对钼浸出率的影响。从表 2中可以看出, 各因素对焙砂浸出影响的大小顺序:碱过量系数>温度>液固质量比>反应时间; 浸出反应最优条件为:碱过量系数1.15, 反应温度95 ℃, 液固质量比5:1, 反应时间60 min; 碱过量系数是钼浸出率的主要影响因素; 碱过量系数1.15时, 钼浸出率最高能达到96.11%。
2.2 浸出渣XRD分析考虑到试验6及试验9浸出率较高, 对其渣样进行XRD分析, 衍射图谱见图 2, 通过图谱可以看出, 浸出渣的主成分为石英、钠硅渣、CaMoO4及MoS2等, 含钼矿物主要是CaMoO4及MoS2, 在浸出过程中, 若希望达到比较高的浸出率, 需要采用一定的措施, 将上述矿物中的钼浸出。
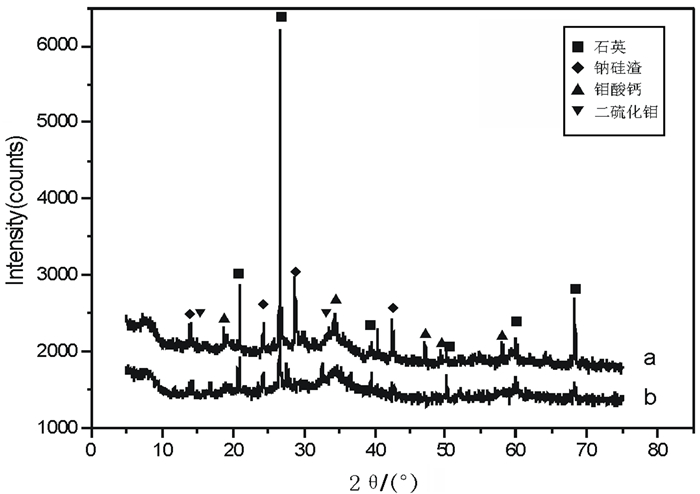 |
| 图 2 浸出渣XRD图谱 Fig.2 XRD diffraction pattern of test 6(a)& test 9(b) a—试验6浸出渣;b—试验9浸出渣 |
2.3 碱加入量试验
一方面, 正交试验表明碱过量系数为浸出反应的主要影响因素; 另外, 考虑到钼焙砂存在明显的钼酸钙物相, 而难溶钼酸盐如CaMoO4、Fe2(MoO4)3、CuMoO4和PbMoO4等, 通过提高碱度也能分解[2], 因此, 在保持反应温度、液固质量比、反应时间为最优条件下, 开展了进一步提高碱过量系数的试验, 结果如表 5。
| 表 5 不同碱过量系数下钼浸出率 Table 5 The effect of different alkali excessive coefficient on the molybdenum leaching rate |
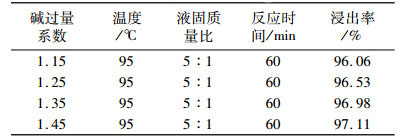 |
由表 5数据可以看出, 在其他条件不变的情况下, 提高碱过量系数, 钼浸出率逐渐提高, 当碱过量系数达到1.35后钼浸出率上升趋势变平缓; 此时, 钼浸出率为96.98%, 浸出效果并没有达到比较好的效果。考虑到进一步提高碱过量系数, 可能导致大量金属以羟基配合物离子的形式存在[16], 会增加后续除杂难度, 另外, 碱过量系数过高, 碱耗成本也会增加, 故碱过量系数不能太高。
2.4 碳酸钠和磷酸三钠对Mo浸出率的影响为了将原矿中浸出不彻底的CaMoO4进一步的浸出, 考虑在碱浸出过程中加入能与Ca2+形成溶度积小于CaMoO4的阴离子, 将MoO42-置换出来, 促进CaMoO4分解。表 6列出了CaMoO4、CaCO3及Ca3(PO4)2等物质的溶度积常数, 可以看出CO32-及PO43-更容易和Ca2+离子形成沉淀, 在其他浸出体系中, 也有人将CO32-和PO43-用作助浸剂提高钼浸出率[18]。基于以上分析, 开展了碳酸钠和磷酸三钠对Mo浸出率的影响试验。
| 表 6 常见难溶钨钼酸盐溶度积常数表 Table 6 Common refractory tungsten molybdenum acid salt solubility product of constants |
 |
主要试验条件为碱过量系数1.15、温度95 ℃、液固质量比5:1, 浸出时间60 min, 通过XRD物相分析可知, 不溶性的钼酸盐主要为CaMoO4, 因此分别按照原矿中钙含量加入助浸剂, 按照不同过量系数加入碳酸钠、磷酸三钠进行浸出试验, 试验所得数据如图 3。
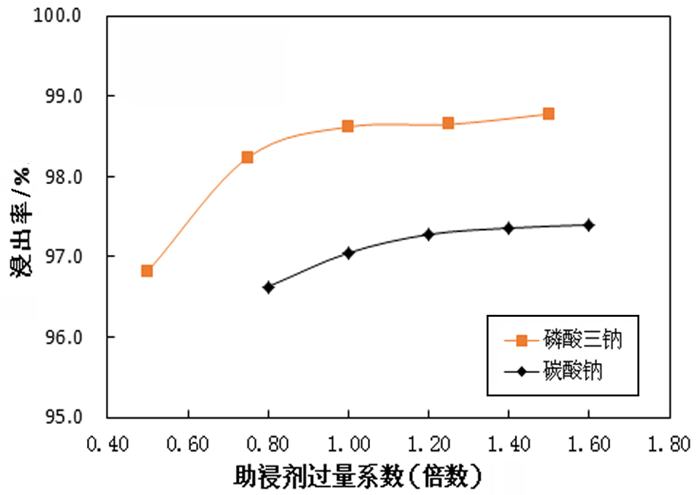 |
| 图 3 助浸剂磷酸三钠及碳酸钠过量系数与浸出率关系 Fig.3 The relationship between trisodium phosphate & sodium carbonate excessive coefficient and leaching rate |
从图 3可以看出, 随着磷酸三钠过量系数提高浸出率上升, 过量系数超过1.0后浸出率上升趋势变缓, 以磷酸三钠为助浸剂钼的浸出率最高可达98.8%。随着碳酸钠过量系数提高浸出率上升, 过量系数超过1.0以后浸出率上升趋势变缓, 说明过量的碳酸钠可以浸出一部分钼, 但过量系数达到1.6倍时钼的浸出率为97.53%, 明显低于以磷酸三钠为助浸剂时的浸出率, 所以助浸剂选择磷酸三钠为宜。
2.5 氧气对Mo浸出率的影响根据XRD分析结果, 浸出渣中部分钼以MoS2形式赋存, 根据文献[15]介绍二硫化钼在有氧化剂存在时可溶于无机酸中。为提高钼浸出率, 开展了在碱浸过程中持续通入氧气的试验, 并考察了不同通氧时间下, 钼浸出率变化情况。
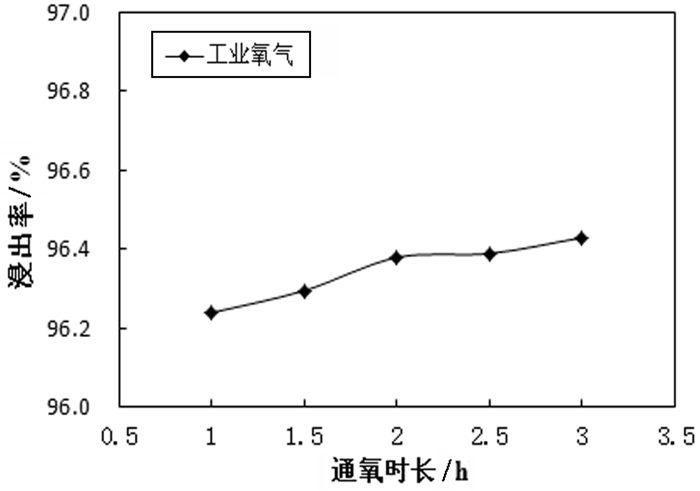
主要试验条件是碱过量系数1.15、温度95 ℃、液固质量比5:1, 浸出同时通入氧气, 控制不同的浸出时间, 试验数据如图 4所示。
 |
| 图 4 通氧时长与浸出率关系 Fig.4 The relationship between the length of oxygen time and the leaching rate |
从图 4可以看出, 随着通氧时长增加, 浸出率呈上升趋势, 但整体提升较慢, 通气量为3 h时, 钼的浸出率最高为96.43%, 相较于仅单独使用氢氧化钠碱浸略有提高, 说明氧气有利于提高钼浸出率, 但浸出效果改善并不明显。
2.6 验证试验由2.4、2.5的延伸试验可以看出, 加入碳酸钠作为助浸剂或通入氧气作为氧化剂来提升钼的浸出率虽然有效果, 但浸出效果改善并不明显, 而加入磷酸三钠作为助浸剂能够有效的提升原矿中钼的浸出率, 因此, 以磷酸三钠过量系数1.00、1.25及1.50继续做三组试验(A, B, C), 验证2.4试验的有效性, 其他主要试验条件为碱过量系数1.15、温度95 ℃、液固质量比5:1, 浸出时间60 min。试验结果见表 7。
| 表 7 不同磷酸三钠过量系数下钼浸出率 Table 7 The relationship between the different excess coefficient of trisodium phosphate and the leaching rate of molybdenum |
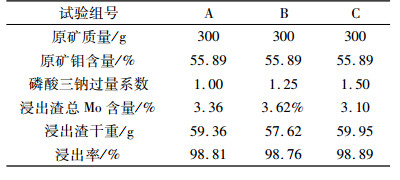 |
通过表 7可以看出, 磷酸三钠作为助浸剂效果较好, 钼浸出率提升了2.8%, 与2.4对比可以看出重现性也较好, 浸出率比较稳定。
3 结论(1) 正交试验表明, 各因素对钼浸出率的影响大小顺序为:碱过量系数>温度>液固质量比>反应时间, 浸出反应最优条件为碱过量系数1.15, 反应温度95 ℃, 液固质量比5:1, 反应时间60 min。
(2) 碱过量系数是影响钼浸出率的最重要因素, 随着碱过量系数增加, 钼的浸出率上升。当碱过量系数超过1.35后钼浸出率上升趋势变平缓。
(3) 碱浸过程加入磷酸三钠后浸出率可以达到98.89%, 加入碳酸钠后浸出率最高可以达到97.53%, 磷酸三钠的效果明显优于碳酸钠。
(4) 在采用氢氧化钠浸出体系, 在碱过量系数1.15、温度95 ℃、液固质量比5:1、浸出时间60 min条件下, 加入理论量的磷酸三钠, 钼浸出率达到98.81%, 浸出率高于常规氨浸出体系, 具有很好的工业化应用前景。
| [1] |
向铁根, 杨伯华. 钼冶金[M]. 长沙: 中南大学出版社, 2009, 16-18.
|
| [2] |
张启修, 赵秦生. 钨钼冶金[M]. 北京: 冶金工业出版社, 2005, 43-45.
|
| [3] |
何树荣. 钼酸铵生产的湿法冶炼工艺[J]. 中国钼业, 2012(5): 12-15. DOI:10.3969/j.issn.1006-2602.2012.05.003 |
| [4] |
陈志刚. 离子交换法生产钼酸铵工艺研究[D]. 长沙: 中南大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10533-2009240804.htm
|
| [5] |
郭军刚. 工业氧化钼水浸除杂工艺研究[D]. 西安: 西北大学, 2008. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1430720
|
| [6] |
彭俊, 王学文, 王明玉, 等. 从镍钼矿中提取镍钼的工艺[J]. 中国有色金属学报, 2012(2): 553-559. |
| [7] |
马飞, 赵中伟, 曹才放, 等. 磷酸三钠分解彩钼铅矿热力学研究[J]. 中国钼业, 2008(1): 44-47. DOI:10.3969/j.issn.1006-2602.2008.01.009 |
| [8] |
张刚, 赵中伟, 李江涛, 等. 氢氧化钠分解钼酸铅矿的热力学分析[J]. 中南大学学报(自然科学版), 2008(5): 902-906. |
| [9] |
廖元双, 杨大锦, 鲁顺利. 钼铅矿提钼工艺研究[J]. 有色金属(冶炼部分), 2006(4): 26-27. DOI:10.3969/j.issn.1007-7545.2006.04.007 |
| [10] |
赵德平, 吴继华, 阮鸿兴. 钼矿石中钼的化学物相分析[J]. 云南冶金, 2000(5): 48-50. |
| [11] |
罗振中. 钼的应用及其发展[J]. 中国钼业, 2003(2): 7-9. DOI:10.3969/j.issn.1006-2602.2003.02.002 |
| [12] |
Osseo-AsareK. Metallurgical transations: B[M]. 1982, 13: 555-564.
|
| [13] |
李洪桂. 稀有金属冶金学[M]. 北京: 冶金工业出版社, 2001, 142-146.
|
| [14] |
李洪桂. 有色金属提取手册—稀有高熔点金属(上)[M]. 北京: 冶金工业出版社, 1999, 112-114.
|
| [15] |
张文钲. 钼冶炼[M]. 西安: 西安交通大学出版社, 1991, 46-53.
|
| [16] |
李飞, 陈星宇, 何利华, 等. 氢氧化钠分解不溶性钼酸盐的浸出热力学[J]. 中国有色金属学报, 2014(11): 2921-2926. |
| [17] |
唐忠阳, 李洪桂, 霍广生. 高压氧分解-萃取法回收铜钼中矿中的钼[J]. 稀有金属与硬质合金, 2003(3): 1-3. DOI:10.3969/j.issn.1004-0536.2003.03.001 |
| [18] |
秦文峰, 彭金辉, 樊希安, 等. 利用钼酸钙废物制取钼酸铵的新工艺[J]. 矿产综合利用, 2003(1): 46-48. DOI:10.3969/j.issn.1000-6532.2003.01.011 |
 2018
2018 

