| 硅胶负载二氧化锰吸附重金属的研究 |
我国是矿产资源大国,但由于长期开采,矿山环境的污染和破坏越来越严重, 而其中矿山废水是矿区环境的主要污染源之一[1]。据统计, 我国矿山每年因采矿、选矿而排放的废水量达12~15亿t, 占有色金属工业废水总量的30%左右[2]。矿山废水中富含许多重金属离子, 如果未经处理直接排放, 危害巨大,不仅造成严重的环境污染, 而且是一种巨大的水资源浪费。土壤和水体中一旦受到污染, 特别是重金属的污染、治理和修复是非常困难和复杂的。重金属离子易在食物链中富集, 水中的重金属离子会使鱼类、浮游生物、藻类等中毒而大量死亡, 严重时会造成农作物大面积的死亡, 造成粮食减产,会对环境和人体健康造成严重危害, 因而一旦进入生态系统后就会不断地在生态环境中积累而难以去除, 造成环境的长期污染[3]。因此,矿山废水必须进行深度地净化处理,提高水源的质量,如此才能最大限度降低废水对生态环境的污染。
要想使得水资源问题得到有效解决,需积极研发新的处理技术。从水体中去除重金属的方法有很多, 如氧化还原法、絮凝沉淀法、膜分离法、吸附法、离子交换法、生物处理法等[4-6],而吸附法因具有适应范围广、操作简单、成本低等优点, 成为重金属污染治理的常用方法之一[7, 8]。目前, 将锰氧化物作为吸附材料用于污染物的处理是研究热点, 在水处理领域应用广泛。纳米材料具有不饱和性, 易与其他原子相结合而稳定下来的特性, 被广泛用于水体环境中重金属离子的去除与固化[9]。纳米微孔材料特殊表面结构和表面化学特性使其对重金属具有吸附能力, 易于质子化以及脱质子化, 能够为金属离子提供结合位点,对重金属离子具有明显的吸附作用[10]。但二氧化锰纳米材料在水溶液中很容易自发团聚而失去吸附能力。因此,本文选择无毒无害的硅胶作为载体材料,解决纳米二氧化锰容易团聚的问题。
1 材料与方法 1.1 样品制备试验所用的重金属盐购自金锦乐化工有限公司,其他化学试剂均从国药化学试剂有限公司购得,其中包括硫酸(H2SO4)、盐酸(HCl)、氢氧化钠(NaOH)、硅酸钠(Na2SiO3)、高锰酸钾(KMnO4)、硫酸锰一水合物(MnSO4·H2O)。试验所有的溶液均用去离子水配制。
S-MnO2吸附剂是参考Zeng L[11]提出的方法制得,该方法的优点在于能提高硅胶与二氧化锰复合材料的物理性能。先将100 mL 1 mol/L的Na2SiO3溶液与300 mL 1 mol/L的NaOH溶液混合搅拌,待搅拌均匀后加入100 mL 0.4 mol/L的KMnO4溶液和100 mL 0.6 mol/L的MnSO4·H2O溶液,使产生胶凝状的沉淀。产生沉淀过程中的混合物pH值控制在3~10之间,形成的硅锰复合浆料的最终pH值应保持在6~8之间,以完成沉淀反应并提供吸附剂接近中性的pH值。最后,将凝胶状的复合硅锰浆料连续搅拌2 h,然后老化4 h,用过滤或离心的方法清洗、脱水。通过挤压的方法将脱水固体颗粒化到所需的尺寸和形状,在该研究中,选择球形颗粒。最后在200 ℃~250 ℃之间干燥5 h,制得硅锰比为1:1的S-MnO2吸附剂。
1.2 样品表征采用XRD(Parnacre X射线衍射仪)和FTIR(Agilent Cary 670 FTIR红外光谱仪)分析了吸附剂的结构特征,SEM(FEI-Magellan 400L XHR场发射扫描电子显微镜)观察了吸附剂的形貌特征及通过BET/BJH表面分析仪(Quantachrome-NovaWin)测定吸附剂在77 K时液氮的吸附等温线,并测定了其比表面积和微孔特性。待测样品溶液用0.45 μm膜过滤,用电感耦合等离子体质谱仪(ICP-MS: SPECTRO BlueⅡ)分析残留的重金属离子含量。所有的待测样品均在采集后1 d内进行检测。
1.3 重金属吸附性能测试取50 mL浓度为40 mg/L的重金属离子溶液(As5+、Cu2+、Pb2+、Zn2+、Sb3+等)分别加入容积为100 mL的烧杯中,自然pH值条件下, 再加入一定量S-MnO2吸附剂,室温下于水浴磁力搅拌器搅拌混合, 转速设定为150 r/min, 搅拌一定时间后取出,过滤。样品用0.45 μm微孔滤膜去除S-MnO2, 得到的滤液用电感耦合等离子体原子发射光谱法(ICP-AES)检测金属浓度。金属的去除率采用(1)式计算:
| $ E = \left( {{C_0} - {C_e}} \right)/{C_0} $ | (1) |
式中,E为去除率,C0和Ce分别为金属离子的初始浓度和平衡浓度,单位为mg/L。
2 结果与讨论 2.1 S-MnO2结构特征图 1为S-MnO2吸附剂的XRD图谱。从XRD谱图中可以看出,该吸附剂在15°~30°处有一个馒头峰,在其他位置没有发现明显的结晶峰,这说明S-MnO2是非晶态的,即MnO2在硅胶上的形成是以非晶体结构形式存在的,这是因为硅酸盐的存在阻止了它们的晶体生长[12]。众所周知,硅胶是一种非晶态材料,MnO2的存在并没有改变硅胶本身的性能,所以该吸附剂可以应用于硅胶应用的各个领域。从吸附剂的角度来看,不需要MnO2的结晶形式,因为晶体的表面积远小于其非晶态或低结晶形式[11]。
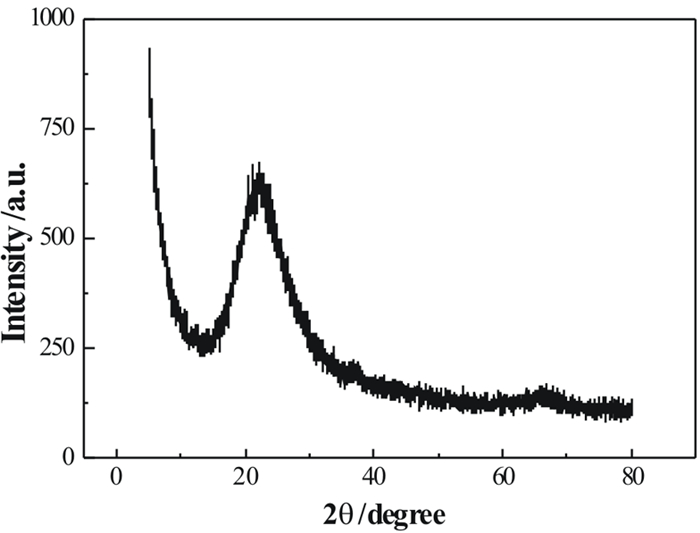 |
| 图 1 S-MnO2的XRD图谱 Fig.1 XRD pattern of S-MnO2 |
FT-IR光谱有助于了解硅胶与二氧化锰复合材料的形成。图 2显示了S-MnO2吸附剂的光谱,在450-4 000 cm-1波数范围内进行了样品结构的红外光谱研究。结果表明,在该吸附剂的低频区(约500 cm-1)观察到一个宽频带,这应归因于Mn-O和Mn-O-Mn的振动[13]。约1 600 cm-1处微弱的吸收峰属于H-O-H弯曲振动[14]。此外,在1 000 cm-1左右处的频带属于Si-O-Si非对称拉伸振动,在790.84 cm-1处有个尖锐的频带为Si-O-Si对称拉伸和弯曲振动[15]。基于以上分析,进一步证实了二氧化锰成功被硅胶负载。
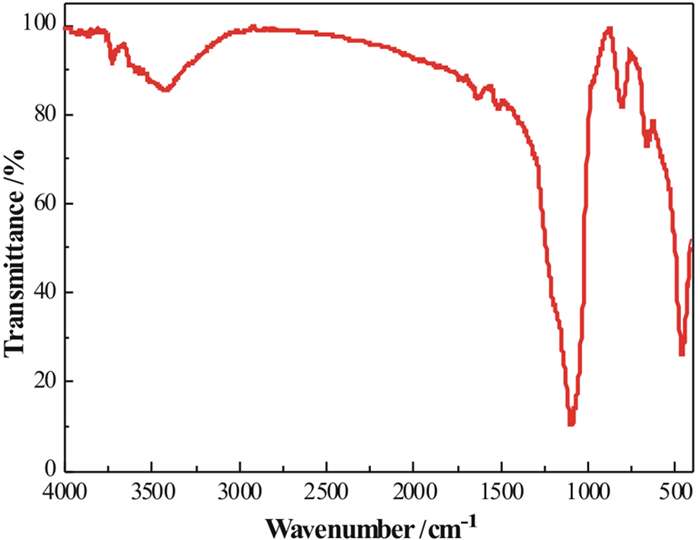 |
| 图 2 S-MnO2的FT-IR光谱图 Fig.2 FT-IR image of S-MnO2 |
2.2 S-MnO2形貌与孔隙特征
采用扫描电镜分析对S-MnO2吸附剂作了形貌观察。结果如图 3所示,制备所得的产物为球形颗粒,粒径约150~250 μm。与FT-IR分析结果相符,从图中可以看见二氧化锰均匀分布在硅胶表面。吸附剂表面略微粗糙,同时球形颗粒具有较大的比表面积,这有利于二氧化锰对重金属离子的吸附。
 |
| 图 3 S-MnO2的SEM图片 Fig.3 SEM picture of S-MnO2 |
图 4为S-MnO2的N2吸附-脱附等温曲线和孔径分布曲线。图 3(a)说明了S-MnO2等温线属于H2型滞后环的Ⅳ型等温线[11],这表明其具有介孔结构,图 4(b)的孔径分布曲线进一步证实了这一点。S-MnO2的比表面积(BET)为334.6 m2/g,比其他类型二氧化锰吸附材料的比表面积要大许多[16, 17],对比结果如表 1所示。比表面积的增大使得二氧化锰对重金属离子的接触位点增多,增大了其吸附性能,这与SEM分析结果相一致。
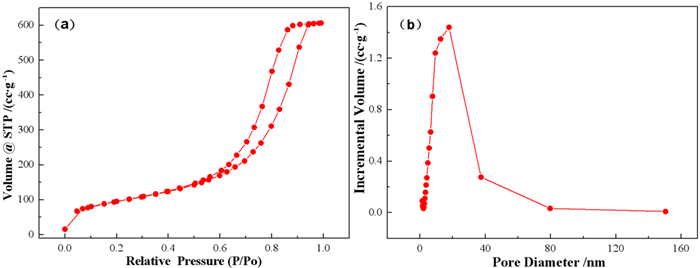 |
| 图 4 S-MnO2的等温吸附脱附曲线(a)和孔径分布曲线(b) Fig.4 Isotherm adsorption-desorption curve (a) and pore size distribution curve (b) of S-MnO2 |
| 表 1 不同类型MnO2吸附材料比表面积的比较 Table 1 Comparison of specific surface areas of different types of MnO2 adsorption materials |

|
2.3 重金属吸附性能
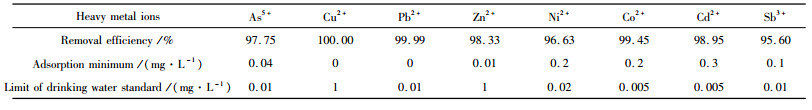
为初步探究S-MnO2对重金属的吸附效果,取50 mL浓度为40 mg/L的重金属离子溶液(As5+、Cu2+、Pb2+、Zn2+、Sb3+等)分别加入容积为100mL的烧杯中,自然pH值及室温条件下, 再加入5 g S-MnO2吸附剂。在磁力搅拌作用下, 混合物被搅拌5min后取出吸附后样品过滤、检测。表 2为ICP测结果。从表 2中可见, S-MnO2对大部分常见重金属As5+、Cu2+、Pb2+、Zn2+都具很强的吸附能力,几乎能达到饮用水的标准,而对Ni2+、Co2+、Cd2+、Sb3+等离子有较好的吸附效果。
| 表 2 S-MnO2对重金属的吸附效果 Table 2 Adsorption capacity of S-MnO2 on heavy metals |
|
为进一步探究不同试验条件下(包括反应时间、吸附剂用量、溶液温度及pH值),S-MnO2吸附剂对重金属离子的吸附效果,本研究选择普遍存在、毒性较大的As5+ [18]做了时间、用量、温度及pH值条件试验。所有条件试验中所用的砷溶液均为50 mL的40 mg/L As5+溶液。
2.3.1 时间、用量对吸附效果的影响图 5为S-MnO2在不同吸附时间、吸附剂用量条件下对As5+的吸附曲线图。
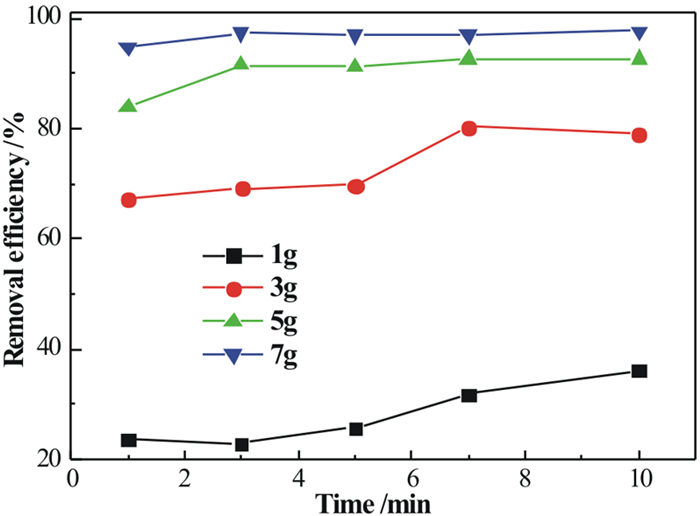 |
| 图 5 时间、用量对S-MnO2吸附As5+的影响 Fig.5 Effects of time and dosage on adsorption of As5+ by S-MnO2 |
从图 5可以看出,As5+的去除率是随着反应时间的延长而上升的。同一反应时间段下,当吸附剂用量为1 g时,As5+的去除率最高都不足50%。随着吸附剂用量的增加,去除率大幅度提高,当用量超过5 g时,As5+的去除率达到了95%以上,并且吸附速率在吸附前4 min很快,5 min后就达到了平衡,相比其他二氧化锰类型吸附材料更加快速[19, 20]。迅速的吸附过程可大幅降低吸附工艺耗时, 这对吸附剂在实际工程中的应用非常有利[21]。因此,所有后续吸附试验均采用5 min的反应时间和5 g的吸附剂用量。
2.3.2 温度对吸附效果的影响图 6给出了S-MnO2在不同环境温度下(25~65 ℃)对As5+的吸附效率。由图得知随着温度的增加,As5+的去除率几乎保持不变, 都维持在92%以上,说明温度对S-MnO2的吸附性能影响不大。
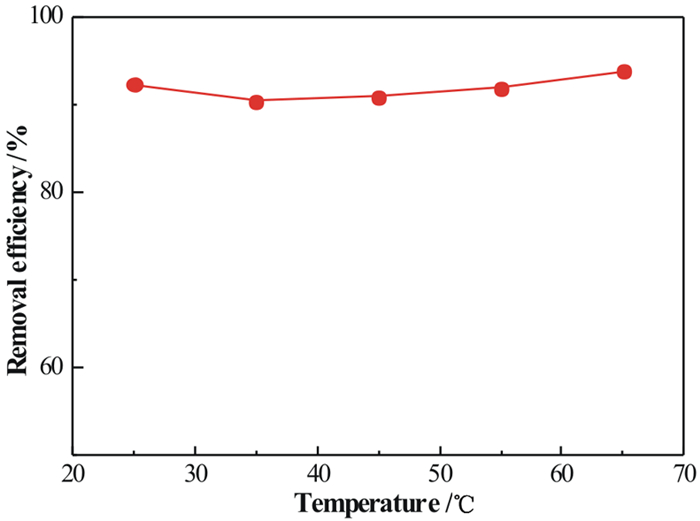 |
| 图 6 温度对S-MnO2吸附As5+的影响 Fig.6 Effect of temperature on adsorption of As5+ by S-MnO2 |
2.3.3 pH值对吸附效果的影响
根据以上所得试验结论,pH值条件试验设定在室温下进行。将5 g吸附剂加入50 mL质量浓度为40 mg/L的As5+模拟废水中,分别改变溶液的pH值(2~10),强磁搅拌5 min后测定As5+的剩余浓度,得到不同溶液pH值对吸附剂去除As5+的影响,结果见图 7。
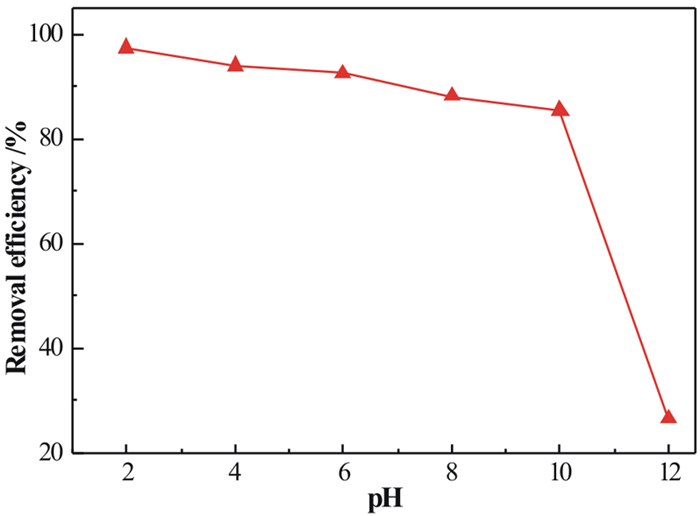 |
| 图 7 pH对S-MnO2吸附As5+的影响 Fig.7 Effect of pH on adsorptions of As5+ by S-MnO2 |
从图 7可看出,S-MnO2对As5+的在不同pH值条件下的吸附效果不同,当pH值为2时,As5+的去除率最高,为97.75%,而随着溶液pH值的增大,As5+的去除率缓慢下降。在大多数pH值条件下,As5+主要以酸根离子形式存在,pH值为2~10时,As5+以H2AsO4-和HAsO42-形式存在[22]。二氧化锰的零点电荷pHpzc为4.8[16],当pH值低于4.8时,S-MnO2表面带正电荷,此后带负电荷。因此,在中性—碱性反应体系中,OH-含量较多,产生的负电荷与酸性自由基离子的电学性质相一致,从而导致S-MnO2吸附位点的竞争和静电排斥的形成,这使得S-MnO2对砷酸根离子的吸附减弱。
3 结论二氧化锰通过原位合成法与硅胶合成S-MnO2吸附剂,探究了S- MnO2吸附剂对几种常见重金属的去除效果及研究了不同吸附条件下, S- MnO2对As5+的吸附。结果表明,S-MnO2是一种低成本、高效、无二次污染、容易实现固液分离的吸附剂,对砷、铜、铅、锌等重金属离子的高吸附能力使其成为一种潜在的吸附剂,在矿山废水处理领域中具有良好的应用前景。
| [1] |
严群, 黄俊文, 唐美香, 等. 矿山废水的危害及治理技术研究进展[J]. 金属矿山, 2010(8): 183-186. |
| [2] |
徐师, 张大超, 吴梦, 等. 硫酸盐还原菌在处理酸性矿山废水中的应用[J]. 有色金属科学与工程, 2018, 9(1): 92-97. |
| [3] |
白润才, 李彬, 李三川, 刘光伟. 矿山酸性废水处理技术现状及进展[J]. 长江科学院院报, 2015, 32(2): 14-19. |
| [4] |
Seval Kutlu Akal Solmaz, Gökhan Ekrem üstün, Aşkın Birgül, et al. Treatability studies with chemical precipitation and ion exchange for an organized industrial district (OID) effluent in Bursa, Turkey[J]. Desalination, 2007, 217(1-3): 301-312. DOI:10.1016/j.desal.2007.04.053 |
| [5] |
杨瑞香. 水体重金属污染来源及治理技术研究进展[J]. 资源节约与环保, 2016(4): 66. DOI:10.3969/j.issn.1673-2251.2016.04.055 |
| [6] |
陈玉洁, 韩凤兰, 罗钊. 镁渣固化/稳定污酸渣中重金属铜和镉[J]. 无机盐工业, 2015, 47(7): 48-51. |
| [7] |
张超智, 张骁, 孙晓飞, 等. 分子筛去除水体中重金属离子的应用进展[J]. 化工新型材料, 2015, 43(8): 22-24. |
| [8] |
Xiaoliu Huangfu, Chengxue Ma, Jun Ma, et al. Significantly improving trace thallium removal from surface waters during coagulation enhanced by nanosized manganese dioxide[J]. Chemosphere, 2017, 168: 264-271. DOI:10.1016/j.chemosphere.2016.10.054 |
| [9] |
黄一帆, 于志红, 廉菲, 等. 纳米二氧化锰对水中Cu2+和Cd2+的吸附特性[J]. 环境工程技术学报, 2016, 6(4): 350-356. DOI:10.3969/j.issn.1674-991X.2016.04.052 |
| [10] |
刘云.多壁碳纳米管/铁氧化物复合材料的制备和应用研究[D].开封: 河南大学, 2011. http://d.wanfangdata.com.cn/Thesis/D146169
|
| [11] |
Le Zeng. A method for preparing silica-containing iron(Ⅲ) oxide adsorbents for arsenic removal[J]. Water Research, 2003, 37(18): 4351-4368. DOI:10.1016/S0043-1354(03)00402-0 |
| [12] |
Zhang Yanqing, Li Meng, Zhang Qian. Silicon-modified ferric hydroxide for catalytic ozonation of nitrobenzene in aqueous solution[J]. Desalination and Water Treatment, 2015, 54(10): 2902-2908. DOI:10.1080/19443994.2014.905979 |
| [13] |
Yang B, Gong Q, Zhao L, et al. Preconcentration and determination of lead and cadmium in water samples with a MnO2 coated carbon nanotubes by using ETAAS[J]. Desalination, 2011, 278(1-3): 65-69. DOI:10.1016/j.desal.2011.05.010 |
| [14] |
Al-Nidawi, Ali J A, Matori K A, et al. Effect of MnO2, doped on physical, structure and optical properties of zinc silicate glasses from waste rice husk ash[J]. Results in Physics, 2017, 7: 955-961. DOI:10.1016/j.rinp.2017.02.020 |
| [15] |
Dessai R R, Desa J A E, Sen D, et al. Effects of pressure and temperature on pore structure of ceramic synthesized from rice husk:A small angle neutron scattering investigation[J]. Journal of Alloys and Compounds, 2013, 564(26): 125-129. |
| [16] |
Wei X U, Lan H, Wang H, et al. Comparing the adsorption behaviors of Cd, Cu and Pb from water onto Fe-Mn binary oxide, MnO2 and FeOOH[J]. Frontiers of Environmental Science & Eng, 2015, 9(3): 385-393. |
| [17] |
曾超, 俞亭超, 王晓卉, 等. 二氧化锰改性多壁碳纳米管吸附水中Sb(Ⅲ)[J]. 浙江大学学报(工学版), 2013, 47(11): 1951-1957, 1964. |
| [18] |
Dabrowski A, Hubicki Z, Podkoscielny P, et al. Selective removal of the heavy metal ions from waters and industrial wastewaters by ion-exchange method[J]. Chemosphere, 2004, 56(2): 91-106. DOI:10.1016/j.chemosphere.2004.03.006 |
| [19] |
Escudero C, Núria Fiol, Villaescusa I, et al. Arsenic removal by a waste metal (hydr)oxide entrapped into calcium alginate beads[J]. Journal of Hazardous Materials, 2009, 164(2-3): 533-541. DOI:10.1016/j.jhazmat.2008.08.042 |
| [20] |
Véronique Lenoble, Laclautre C, Serpaud B, et al. As(Ⅴ) retention and As(Ⅲ) simultaneous oxidation and removal on a MnO2-loaded polystyrene resin[J]. Science of the Total Environment, 2004, 326(1-3): 197-207. DOI:10.1016/j.scitotenv.2003.12.012 |
| [21] |
宋嘉慧, 皇甫小留, 何强, 等. δ-MnO2对重金属Ti(Ⅰ)的吸附效能及影响因素[J]. 中国给水排水, 2019(9): 53-57. |
| [22] |
Virender K. Aquatic arsenic:Toxicity, speciation, transformations and remediation[J]. Environment International, 2009, 35(4): 743-759. DOI:10.1016/j.envint.2009.01.005 |
 2020
2020

