| 浮选过程中辉钼矿的氧化溶解特性 |
矿物表面的氧化和溶解对矿物的可浮性影响较大,尤其是硫化矿物在矿浆中的过度氧化以及氧化产物在矿浆中的溶解行为都将对其浮选效果产生不利影响。前苏联学者最早注意到矿物表面的氧化溶解与浮选之间的关系[1],国内也有学者针对黄铜矿的氧化过程进行了研究,如牛晓鹏[2]的研究结果表明,黄铜矿在矿浆环境中会发生表面氧化,适度氧化会产生疏水性的单质硫和多硫化物有利于浮选,而过度氧化则会产生亲水性的硫氧酸根并抑制其浮选。肖策环[3]对微细粒黄铜矿表面的溶解性进行了探讨,结果表明常温下微细粒黄铜矿在纯水中长时间搅拌会发生溶解,并且微细粒黄铜矿表面铁离子的溶解性比铜离子好。此外,溶液的酸性越强,黄铜矿表面金属离子溶解度就越高。朱阳戈等人[4]在矿物表面溶解对其可浮性的研究中认为,钛铁矿和钛辉石的表面晶格离子表现出很强的溶解性能,表面溶解产生的离子可以迁移到介质体系,进而对矿物的分选效果产生影响。何发钰[5]则通过晶体结构分析,发现辉铜矿在溶液中的氧化溶解作用很易进行且较强烈,添加Fe3+和其它矿物、降低pH值及升高温度,都将加速辉铜矿的氧化溶解。虽然硫化铜矿物与辉钼矿均属于硫化矿物,但由于它们的晶体结构不同,导致它们在溶液中的氧化性和溶解性也有很大的差异。大量生产实践和研究结果[6-11]也表明,辉钼矿因其特有的晶体结构而具有较好的天然可浮性,但辉钼矿尤其是微细粒级辉钼矿在其浮选过程中极易与介质中的氧气发生氧化反应,进而改变其表面性质,从而对辉钼矿的浮选行为产生不利影响。D. W. Fuerstenau等人[12]的研究证明,氧化作用对辉钼矿的可浮性影响显著,辉钼矿氧化后接触角下降,导致其亲水性增强而可浮性下降。目前关于辉钼矿氧化溶解过程的研究多围绕于其焙烧过程或浸出过程进行,关于浮选过程中的辉钼矿氧化溶解过程研究则鲜见报道,为阐明辉钼矿在浮选过程中的氧化溶解特性,本文以细粒级辉钼矿为对象,对其氧化溶解过程进行研究,以期为通过调控辉钼矿氧化溶解性能来提高辉钼矿的选别效果提供理论基础。
1 试验 1.1 试验材料辉钼矿单矿物取自河南某钼矿,经手选、破碎、陶瓷球磨后筛取-0.075 mm+0.045 mm粒级的产品密封保存作为试验原料。研究对样品进行了XRD衍射分析,结果如图 1所示。
 |
| 图 1 辉钼矿的XRD谱图 Fig.1 The XRD pattern of molybdenite |
由图 1可以看出,原料中MoS2的特征吸收峰峰形尖锐,与MoS2的标准特征衍射峰基本吻合,且无其它杂质物相的特征衍射峰,结合化学分析可知其纯度高达99%以上,可作为纯矿物的氧化溶解试验原料。试验用水均为实验室自制的二次蒸馏水。
1.2 试验及检测方法 1.2.1 氧化溶解试验方法辉钼矿的氧化溶解试验流程如图 2所示。
 |
| 图 2 辉钼矿氧化溶解试验流程 Fig.2 Flow chart of oxidation-dissolution test of molybdenite |
辉钼矿的氧化溶解试验在XFD型挂槽式浮选机(武汉洛克粉磨设备制造有限公司)中进行。试验时称取5.0 g单矿物矿样配置成质量浓度为10.0%的矿浆,在搅拌速率为1 700 r/min且不充气的条件下进行氧化溶解试验,每隔一定时间分别对矿浆的pH值和电导率进行检测,待到预定时间后进行离心处理,并检测上清液的硫酸根离子浓度,最后将产品过滤脱水、烘干并制样。
1.2.2 检测方法SO42-浓度检测:参考DZ/T 0064.64-1993进行,采用乙二胺四乙酸二钠标准溶液滴定溶液中SO42-浓度。在被测溶液中加入过量的Ba2+使其与SO42-生成BaSO4沉淀,再用EDTA溶液滴定过量的Ba2+。通过计算沉淀用的Ba2+用量,换算得到被测液中SO42-的浓度。
电导率测量:对不同氧化溶解时间的矿浆进行电导率测定,测量时先将MP515-01型电导率仪(上海三信仪表厂)进行校准,然后将测量电极插入矿浆中,取3次测量值的平均值作为最终结果。
Raman分析:采用Invia型激光显微共焦拉曼光谱仪(英国Renishaw公司)对辉钼矿样品进行分析,激光波长532 nm,光谱扫描范围100~4 000 cm-1,光谱分辨率为2 cm-1。
XPS分析:利用Al靶发射的K-Alpha型X射线光电子能谱仪(英国Thermo Fisher Scientific公司)对辉钼矿样品进行XPS分析,其激发源能量1 436.8 eV,分析面积400 m2,分辨率0.1 eV,真空度3×10-9 mbar,并采用C1s 284.6 eV进行标定。
SEM分析:利用SSX-550型扫描电镜(日本岛津公司)观察辉钼矿样品形貌,并结合EDS能谱仪分析辉钼矿样品表面元素种类及相对含量,加速电压为15 kV,放大倍率3 000、5 000和6 000等。
2 结果与讨论 2.1 氧化溶解时间对矿浆pH值和硫酸根离子浓度的影响为了解不同氧化溶解时间内矿浆pH值和硫酸根离子浓度的变化规律,对矿浆的pH值及上清液中硫酸根离子浓度进行了检测,结果如图 3和图 4所示。
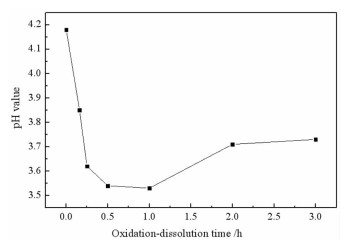 |
| 图 3 氧化溶解时间对矿浆pH值的影响 Fig.3 Effect of oxidation-dissolution time on pH value |
 |
| 图 4 氧化溶解时间对溶液中硫酸根离子浓度的影响 Fig.4 Effect of oxidation-dissolution time on sulfite concentration |
结合图 3和图 4可知,与未氧化溶解的辉钼矿矿浆相比,在氧化溶解0.5 h时辉钼矿矿浆的pH值减小了0.64,而此时上清液中的SO42-浓度达到了最大值即56.8 mg/L。这是由于在辉钼矿氧化溶解过程中其表面的氧化产物MoO3与水反应[13, 14]释放H+,而辉钼矿表面的硫离子被氧化水解[15]生成SO42-和HSO4-也向溶液中释放H+,使得矿浆pH值迅速下降,而溶液中SO42-浓度迅速上升。当氧化溶解时间大于1.0 h时,矿浆pH值呈增大趋势,而溶液中SO42-浓度却趋于平稳。在氧化溶解时间为2.0 h时,矿浆的pH值增大至3.73,这是由于随着辉钼矿氧化程度的增大,辉钼矿表面的钼离子会生成一系列氧化产物,而这些氧化产物与溶液中的H+反应生成HMoO4-并消耗溶液中的H+,导致矿浆pH值增大,直至矿浆pH值达到平衡。
2.2 氧化溶解时间对矿浆电导率的影响为了解氧化溶解时间对矿浆电导率的影响,对离心处理后矿浆上清液的电导率进行了检测,结果如图 5所示。
 |
| 图 5 氧化溶解时间对溶液电导率的影响 Fig.5 Effect of oxidation-dissolution time on the conductivity of solution |
由图 5可知,随着氧化溶解时间的增加,溶液的电导率也在逐渐增加,并且在氧化溶解时间大于2.0 h后,溶液的电导率为0.51 S/m且基本不变。这是由于随着氧化溶解时间的增加,辉钼矿表面氧化程度逐渐增大,并且氧化产物逐渐迁移至溶液中[16-18]转化为HMoO4-、SO42-和HSO4-,使得溶液中的离子数目增加,进而导致溶液的电导率增大。而当氧化溶解时间大于2.0 h后,辉钼矿表面氧化产物的溶解反应逐渐平衡,使得溶液中的离子数目基本保持不变,溶液电导率基本不变。
2.3 辉钼矿样品的Raman光谱分析为了进一步了解辉钼矿氧化溶解后其表面的物相组成,对辉钼矿的样品进行了拉曼光谱分析,结果如图 6所示。
 |
| 图 6 辉钼矿样品Raman光谱图 Fig.6 Raman spectra of molybdenite samples |
由图 6可知,在未氧化溶解的辉钼矿拉曼光谱图中382 cm-1和406 cm-1附近有两个明显的特征波数,分别对应MoS2的E2g1振动峰和A1g振动峰[19, 20],其中E2g1是硫原子和钼原子平面内的振动,而A1g是硫原子和钼原子沿层间的原子振动。氧化溶解后辉钼矿的拉曼光谱图中的特征峰发生了一定变化,即在284.69cm-1附近出现了较弱的MoO3的特征峰。与氧化溶解0.5 h相比,辉钼矿氧化溶解1.0 h时样品中MoO3的相对含量减少了0.44个百分点,原因在于辉钼矿的氧化产物MoO3与溶液中的H+反应进一步转化为HMoO4-。在氧化溶解时间小于1.0 h时,辉钼矿表面硫离子的氧化水解导致拉曼特征峰向短波方向偏移,即出现了蓝移现象,而在氧化溶解时间大于1.0 h后,辉钼矿表面的氧化产物MoO3的水解导致拉曼特征峰向长波方向偏移,即出现了红移现象。
2.4 辉钼矿样品的XPS分析为了解氧化溶解时间对辉钼矿表面元素相对含量及其价键组成的影响,对辉钼矿样品进行了XPS检测,结果如图 7所示。
 |
| 图 7 辉钼矿样品的XPS谱 Fig.7 XPS spectra of molybdenite samples |
由图 7可知,氧化溶解后辉钼矿试样的表面主要有钼、硫、氧和碳等元素,其中碳元素是空气中的污染物。与未氧化溶解的辉钼矿样品相比,经过氧化溶解0.5 h后的辉钼矿表面Mo(3d3/2)、Mo(3d5/2)和O(1s)的电子结合能分别增加了0.06 eV、0.07 eV和0.78 eV,而S(2p3/2)的电子结合能则减小了0.1 eV,说明经过氧化溶解的辉钼矿表面的钼、氧和硫元素的化学环境发生了变化,即辉钼矿表面的元素发生了化学反应。为进一步了解辉钼矿表面钼的存在形态差异,研究对辉钼矿样品中钼的结合能进行了分峰处理,结果分别如图 8和表 1所示。
 |
| 图 8 不同氧化溶解时间下样品表面钼元素的分峰拟合图 Fig.8 Peak fitting spectra of molybdenum on sample surface under different oxidation-dissolution times |
| 表 1 Mo(3d3/2)的价健形态及分布 Table 1 The valence bond morphology and distribution of Mo(3d3/2) |

|
由图 8可知,辉钼矿氧化溶解后的样品中Mo的价键包括Mo-S键和Mo-O键两种键型,并且Mo-S键和Mo-O键中均存在Mo(3d3/2)。其中结合能为229.0 eV、232.0 eV分别对应于Mo-S键中Mo (3d5/2)和Mo (3d3/2)的结合能,而结合能为234.0 eV则对应于Mo-O键中Mo (3d3/2) 的结合能[21]。结合表 1还可知,当氧化溶解时间为1.0 h时,样品中Mo-O键的相对含量比氧化溶解时间为0.5 h时减少了0.99个百分点,这是由于覆盖在辉钼矿表面的氧化产物与溶液中H+的反应导致表面Mo-O键的相对含量减少,而氧化产物的溶解使得Mo-S键在其表面的相对含量增加。此外,当氧化溶解时间大于2.0 h后,Mo-O键的相对含量基本保持不变,结合溶液电导率变化规律及拉曼分析可知这是由于辉钼矿中钼的氧化反应逐渐完全并且其氧化物的溶解反应达到了动态平衡状态。
2.5 辉钼矿样品的SEM和EDS分析为对比氧化溶解时间对辉钼矿不同破裂面和不同元素的影响程度差异,对辉钼矿样品的不同破裂面进行了SEM及EDS检测,结果如图 9和表 2所示。
 |
| 图 9 辉钼矿样品的SEM照片 Fig.9 SEM images of molybdenite samples |
| 表 2 辉钼矿样品不同破裂面的元素相对含量 Table 2 Relative content of elements at different fracture plane of molybdenite |

|
由表 2可知,氧在非极性面上的相对含量均小于其在极性面上的含量,这说明在氧化溶解过程中辉钼矿极性面比非极性面更易氧化。辉钼矿极性面上的硫的相对含量在氧化溶解时间为0.5 h时为最小值24.92%,结合溶液中硫酸根离子浓度分可知,这是由于硫的氧化产物在溶液中的充分溶解所致。与未氧化溶解的辉钼矿样品相比,辉钼矿极性面上钼的相对含量在氧化溶解时间为0.5 h时减小了3.18个百分点,当氧化溶解时间增加至1.0 h时钼的相对含量增加至68.47%,继续增加氧化溶解时间,辉钼矿极性面上钼的相对含量逐渐减小,并且在2.0 h后变化幅度较小。这是由于当氧化溶解时间小于0.5 h时,辉钼矿发生了氧化反应且生成的氧化产物覆盖在其表面降低了辉钼矿表面钼的相对含量;而当氧化溶解时间大于1.0 h时,辉钼矿表面氧化产物的溶解使得其表面暴露的钼增加。此外,从图 9还可以看出,未发生氧化溶解的辉钼矿不同晶面较为光滑且质地致密,经过氧化溶解后辉钼矿样品的非极性面基本保持光滑。而图 9(b)中辉钼矿的极性面开始出现裂纹,(c)和(d)中辉钼矿的极性面则有明显断痕,(e)中辉钼矿的极性面呈现残缺不全的层状结构。由此可见,辉钼矿极性面和非极性面上钼和硫的氧化能力有所不同,且硫更易氧化,同时辉钼矿极性面上不同元素氧化产物的溶解能力也有不同,其中硫的氧化产物更容易溶解。
3 结论(1) 在辉钼矿的氧化溶解过程中,矿浆的pH值呈先减小后增大的趋势,原因在于辉钼矿表面硫的氧化产物向溶液中的迁移以及钼的氧化产物MoO3与溶液中H+的反应。溶液电导率则随着辉钼矿氧化溶解时间的增加呈先增加后基本不变的规律,这是由于辉钼矿表面的氧化产物迁移至溶液中逐渐转化为HMoO4-、SO42-和HSO4-并达到平衡。
(2) 辉钼矿极性面和非极性面上钼和硫的氧化能力有所不同,且硫更易氧化。辉钼矿极性面上不同元素氧化产物的溶解能力也有不同,其中硫的氧化产物更容易溶解。辉钼矿极性面上硫的氧化产物在氧化溶解时间为0.5 h时充分溶解,而辉钼矿极性面上钼的氧化产物在氧化溶解2.0 h时达到了溶解平衡。研究可为实现浮选过程中辉钼矿水化能力的调控提供理论依据,对提高辉钼矿的选别效率也有一定的参考意义。
| [1] |
В. А. Γлембоцкиий. 浮选过程物理化学基础[M]. 北京: 冶金工业出版社, 1985.
|
| [2] |
牛晓鹏. 方铅矿、黄铜矿和黄铁矿表面氧化与可浮性研究[D]. 北京: 中国科学院大学(中国科学院过程工程研究所), 2019.
|
| [3] |
肖策环. 微细粒黄铜矿表面特性与可浮性关系研究[D]. 赣州: 江西理工大学, 2016.
|
| [4] |
ZHU Y G, ZHANG G F, FENG Q M, et al. Effect of surface dissolution on flotation separation of fine ilmenite from titanaugite[J]. Transactions of Nonferrous Metals Society of China, 2011, 21(5): 1149-1154. DOI:10.1016/S1003-6326(11)60835-2 |
| [5] |
何发钰, 张文彬, 戈保梁. 辉铜矿氧化溶解行为的研究[J]. 矿冶, 1994(4): 45-49. |
| [6] |
柯家骏. 辉钼矿晶面特性工艺矿物学的研究[J]. 化工冶金, 1981(4): 35-41. DOI:10.3321/j.issn:1009-606X.1981.04.005 |
| [7] |
黄霞光, 卢可可. 微细粒辉钼矿浮选行为研究[J]. 矿产保护与利用, 2014(2): 18-21. |
| [8] |
林清泉, 詹信顺, 张红华, 等. 辉钼矿和黄铁矿的晶体结构与表面性质研究[J]. 矿冶工程, 2019, 39(3): 40-45. |
| [9] |
吕建业, 沈耀平, 张洪恩. 辉钼矿表面特性及其可浮性的研究[J]. 有色金属(选矿部分), 1992(4): 4-8, 41. |
| [10] |
李希明, 柯家骏. 硫化钼矿浸取过程热力学分析[J]. 化工冶金, 1982(4): 89-95. DOI:10.3321/j.issn:1009-606X.1982.04.011 |
| [11] |
赵中伟, 刘大学. 使用氧逸度-pH图对辉钼矿浸出过程的热力学分析[J]. 中国钼业, 2009, 33(1): 18-21. DOI:10.3969/j.issn.1006-2602.2009.01.006 |
| [12] |
CHANDER S, FUERSTENAU D W. On the natural floatability of molybdenite[J]. Transaction of American Institute of Mining, Metallurgical, and Petroleum Engineers, 1972(1): 62-69. |
| [13] |
BERTRAND. Surface-phonon dispersion of MoS2[J]. Physical Review. B, Condensed matter, 1991, 44(11): 5745-5749. DOI:10.1103/PhysRevB.44.5745 |
| [14] |
LEE C G, YAN H G, BRUS L E, et al. Anomalous lattice vibrations of single- and few-layer MoS2[J]. ACS Nano, 2010, 4(5): 2695-700. DOI:10.1021/nn1003937 |
| [15] |
林清泉, 顾帼华, 陈雄, 等. 微细粒辉钼矿的浮选动力学研究[J]. 中南大学学报(自然科学版), 2018, 49(7): 1573-1581. |
| [16] |
付云枫. 氧压水浸法分解辉钼矿提取分离钼硫资源的应用基础研究[D]. 北京: 中国科学院大学(中国科学院过程工程研究所), 2018.
|
| [17] |
李忠瑞, 姜明, 伏义路. 硫化Mo-K-Rh/Al2O3表面物种的XPS研究[J]. 化学物理学报, 1997(3): 50-53. |
| [18] |
魏淑贤, 李阳, 葛少辉, 等. MoS2催化剂活性位形成及甲硫醇脱硫机理的研究[J]. 高校化学工程学报, 2018, 32(4): 956-962. DOI:10.3969/j.issn.1003-9015.2018.04.028 |
| [19] |
WANG L, JI X H, WANG T, et al. Novel red emission from MoO3/MoS2-MoO2-MoO3 core-shell belt surface[J]. ACS Applied Materials & Interfaces, 2018, 10(42): 36297-36303. |
| [20] |
LI H, ZHANG Q, YAP C C R, et al. From bulk to monolayer MoS2: evolution of Raman scattering[J]. Advanced Functional Materials, 2012, 22(7): 1385-1390. DOI:10.1002/adfm.201102111 |
| [21] |
HIRAJIMA T, MORI M, ICHIKAWA O, et al. Selective flotation of chalcopyrite and molybdenite with plasma pre-treatment[J]. Minerals Engineering, 2014, 66/67/68(11): 102-111. |
 2020
2020



