| 二次铝灰钙化煅烧提取氧化铝的试验研究 |
2. 辽宁科技学院 冶金学院,辽宁 本溪 117004
2. Liaoning Institute of Science and Technology School of Metallurgy, Benxi 117004, Liaoning, China
铝灰是电解铝和再生铝生产过程中产生的一种浮渣[1-4],其在铝生产、应用和回收的各个工序中都会产生,每生产1 t铝或铝合金约产生铝灰30~50 kg,全国每年约产生铝灰2.5×106 t [5]。熔炼铝及铝合金产生的铝灰一般被称为一次铝灰,由于一次铝灰中往往含有超过50%的金属铝,工厂一般通过炒灰或球磨回收金属铝,提取金属铝后剩余的铝灰被称为二次铝灰,由于二次铝灰可利用价值低,一般堆弃或填埋。但由于铝灰中含有少量可溶于水的氯化物和氟化物,在潮湿空气中极易反应生成有毒、有害、易爆的恶臭气体,因此铝灰被认定为是一种有害的、高度易燃的且具有刺激性的物质[6-8]。二次铝灰在堆积或填埋时,会造成水资源、大气、土壤的污染,对环境产生严重的影响[9-11]。2016年环境保护部已将铝灰列入到《国家危险废物名录》中[6]。
由于铝灰是一种危险废弃物,必须要进行处理。国内外专家学者对铝灰处理进行了大量研究,如李燕龙[12]使用铝灰作为钢包改质剂,胡保国[13]将铝灰用于制备铝灰基絮凝剂,康文通[14]以铝灰为原料制备硫酸铝,刘瑞琼[15]采用低温冶炼的方法将铝灰制备成棕刚玉,李家镜[16]以铝灰为原料制备陶瓷材料等。但尚未有一种技术可行经济合理的工业应用方法。目前,二次铝灰的处理问题已成为制约铝工业发展的主要问题之一[17]。二次铝灰主要成分是氧化铝(氧化铝含量达50%以上,部分二次铝灰氧化铝含量在60%~70%之间),此外还含有5%以上的金属铝,铝含量高于铝土矿。二次铝灰与碳酸钙配料后煅烧可以形成以铝酸钙为主要成分的煅烧渣,利用铝酸钙碱法溶出氧化铝是一种较好的铝灰利用方法。本论文以二次铝灰与碳酸钙为原料,对二次铝灰钙化煅烧过程中铝灰的钙化及钙化渣中氧化铝的浸出过程进行了研究。
2 试验 2.1 试验原料本试验所用的主要原料有碳酸钙和二次铝灰,其中碳酸钙是由国药化学试剂有限公司生产的、纯度大于99%的分析纯试剂;二次铝灰来自于我国北方某电解铝厂,其主要成分如表 1所示,物相组成如图 1所示。
| 表 1 二次铝灰主要成分 Table 1 The main components of secondary aluminum ash |

|
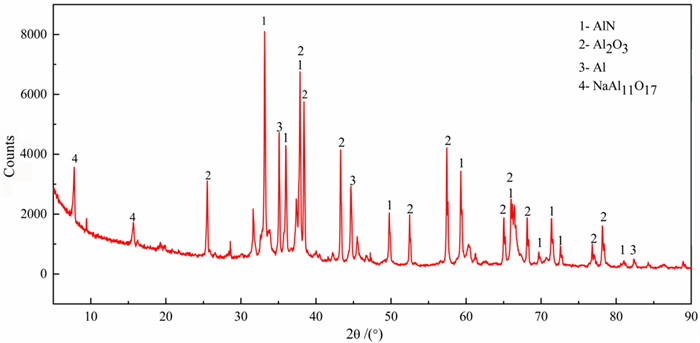 |
| 图 1 铝灰的X射线衍射物相分析 Fig.1 X-ray diffraction phase analysis of aluminum ash |
由表 1和图 1可以看出,二次铝灰的主要成分为AlN、Al2O3、金属铝和β-氧化铝(NaAl11O17,即Na2O·11Al2O3)。若N全部以AlN形式存在,则AlN含量为17.78%,氧化铝含量在50%以上(包括β-氧化铝),通过稀碱溶液溶出法[18]测得铝灰中金属铝的含量约为6%。
2.2 试验原理二次铝灰的主要成分为Al2O3和AlN,另外还含有一部分金属铝。煅烧试验的原理是以二次铝灰和碳酸钙为原料进行煅烧,通过煅烧使得铝灰中的氧化铝与添加料反应生成铝酸钙。由于铝灰中的铝主要以氧化铝形式存在,而氧化铝难以直接用碱液溶出生产氧化铝,且铝灰中的氟化物主要以NaF和Na3AlF6形式存在,这两种物质均溶于碱液,会给后续的氧化铝溶出与分解带来不利影响。铝灰与碳酸钙混合煅烧,碳酸钙首先分解为高活性的氧化钙,氧化钙与氧化铝结合成为铝酸钙(如反应式1所示),铝酸钙中的氧化铝可通过碱液溶出。在煅烧过程中,NaF和Na3AlF6同样会与CaO发生反应(反应式2和3),生成不溶于水的CaF2,降低氟化物对氧化铝溶出过程的影响。碱法溶出氧化铝的试验原理是用强碱NaOH或Na2CO3等处理煅烧产物,使煅烧料中的氧化铝以铝酸钠的形式溶解出来(反应式4和5),而铝酸钙中的杂质依然存留于固体残渣中,固液分离后的铝酸钠溶液就可以分解析出氢氧化铝加以利用[19-20]。二次铝灰钙化溶出氧化铝的工艺流程图如图 2所示。
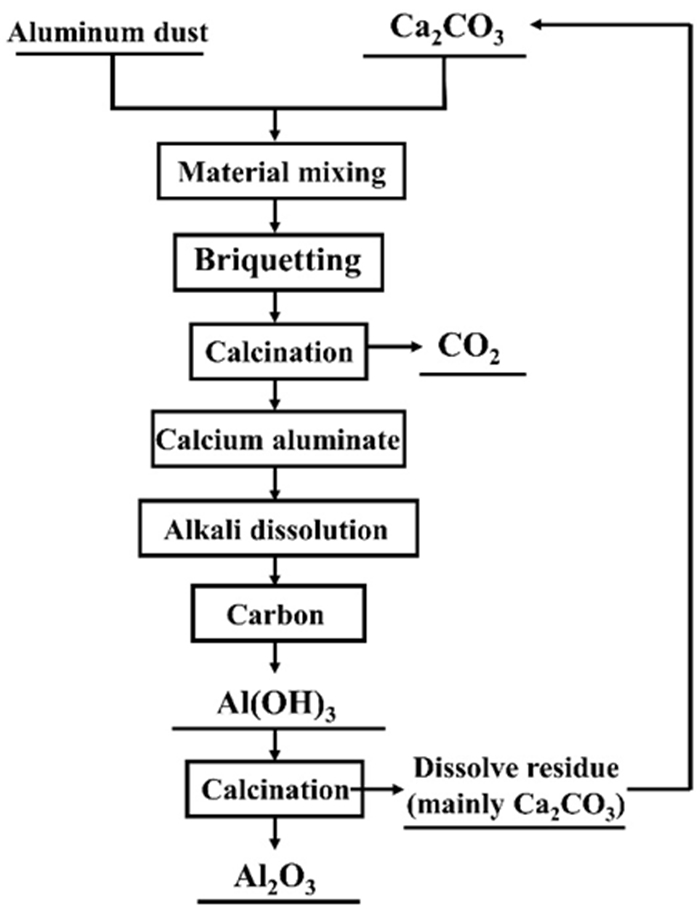 |
| 图 2 二次铝灰钙化溶出氧化铝的工艺流程图 Fig.2 Process flow chart of alumina dissolution by secondary aluminum ash calcification |
| $ {12{\rm{CaO}}({\rm{s}}) + 7{\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3}({\rm{s}}) = 12{\rm{CaO}} \cdot 7{\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3}} $ | (1) |
| $ {7{\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3} + 12{\rm{CaO}}({\rm{s}}) + 2{\rm{NaF}} = 11{\rm{CaO}} \cdot {\rm{Ca}}{{\rm{F}}_2} \cdot 7{\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3} + {\rm{N}}{{\rm{a}}_2}{\rm{O}}} $ | (2) |
| $ \begin{array}{l} 17{\rm{CaO}}({\rm{s}}) + 6{\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3} + 2{\rm{N}}{{\rm{a}}_3}{\rm{Al}}{{\rm{F}}_6} = \\ 5{\rm{Ca}}{{\rm{F}}_2} + 3{\rm{N}}{{\rm{a}}_2}{\rm{O}} + 11{\rm{CaO}} \cdot {\rm{Ca}}{{\rm{F}}_2} \cdot 7{\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3} \end{array} $ | (3) |
| $ \begin{array}{l} 12{\rm{CaO}} \cdot 7{\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3} + 12{\rm{N}}{{\rm{a}}_2}{\rm{C}}{{\rm{O}}_3} + 33{{\rm{H}}_2}{\rm{O}} = \\ 14{\rm{NaAl}}{({\rm{OH}})_4} + 12{\rm{CaC}}{{\rm{O}}_3} + 10{\rm{NaOH}} \end{array} $ | (4) |
| $ \begin{array}{l} 11{\rm{CaO}} \cdot {\rm{Ca}}{{\rm{F}}_2} \cdot 7{\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3} + 11{\rm{N}}{{\rm{a}}_2}{\rm{C}}{{\rm{O}}_3} + 32{{\rm{H}}_2}{\rm{O}} = \\ 14{\rm{NaAl}}{({\rm{OH}})_4} + 11{\rm{CaC}}{{\rm{O}}_3} + {\rm{Ca}}{{\rm{F}}_2} + 8{\rm{NaOH}} \end{array} $ | (5) |
取碳酸钙粉末15 g放入坩埚电阻炉中煅烧,煅烧一定时间后取出称量。待冷却后逐滴加水直到有多余的水不再被碳酸钙煅烧生成的CaO吸收,将CaO放入烘箱内烘干再次称质量。根据所测得的数据按式(6)和(7)计算出碳酸钙的分解率及煅烧后碳酸钙的活性度[21]。通过碳酸钙的煅烧试验获得碳酸钙的最佳煅烧条件。
| $ \mu = \frac{{{M_f} - {M_t}}}{{{M_f} - {M_d}}} \times 100\% $ | (6) |
| $ \eta = \frac{{{M_x} - {M_d}}}{{{M_x}}} \times 100\% $ | (7) |
其中:μ——碳酸钙的分解率,%;Mf——煅烧前碳酸钙质量,g;Mt——煅烧时间为t时碳酸钙质量,g;Md——煅烧后碳酸钙质量, g;η——煅烧后碳酸钙的活性度, %;Mx——吸水后碳酸钙质量, g。
将二次铝灰与碳酸钙按照一定比例称量后混合均匀、制团,然后将制取的团块放入坩埚电阻炉中在碳酸钙的最佳煅烧条件下煅烧,对煅烧获得的产物进行分析。将煅烧生成的铝酸钙置于碱液中进行氧化铝的溶出试验,对溶出液中的氧化铝进行滴定测量,计算氧化铝的溶出率。
3 结果与讨论 3.1 碳酸钙的分解率和活性度不同煅烧时间和煅烧温度对碳酸钙分解率的影响如图 3所示。由图 3可知,煅烧温度为900 ℃和1 000 ℃时,当煅烧时间大于90 min时,碳酸钙的分解率基本不变,所以煅烧时间最少设定为90 min;煅烧时间设置为90 min时,随着煅烧温度的升高,碳酸钙的分解率逐渐上升,当煅烧温度大于950 ℃时,碳酸钙的分解率基本保持不变。由此得出结论,在950 ℃之后煅烧90 min煅烧效果较好。图 4所示为不同煅烧时间和煅烧温度对碳酸钙活性度的影响。由图 4可知在900 ℃煅烧时,前60 min碳酸钙的活性度基本不变,这可能是因为煅烧时间短碳酸钙分解不完全所致。随着煅烧时间的延长,煅后碳酸钙(氧化钙)的活性度升高且在90 min达到最大值。继续延长煅烧时间,碳酸钙失活导致其活性有所降低;煅烧温度为1 000 ℃时,碳酸钙活性度随着煅烧时间的延长呈先上升后下降的趋势,煅烧时间为60 min时活性度最高,此后随煅烧时间的延长活性度下降。煅烧温度为1 000 ℃时碳酸钙的活性度均比900 ℃时的活性度小,这是因为高温虽然会加快碳酸钙的分解率,但是温度过高碳酸钙表面会产生过烧现象从而影响活性度。在煅烧时间为90 min的情况下,碳酸钙的活性度随温度的升高逐渐降低,煅烧温度为900 ℃时活性度较高,这与刚刚分析的温度对活性度的影响结果一致。
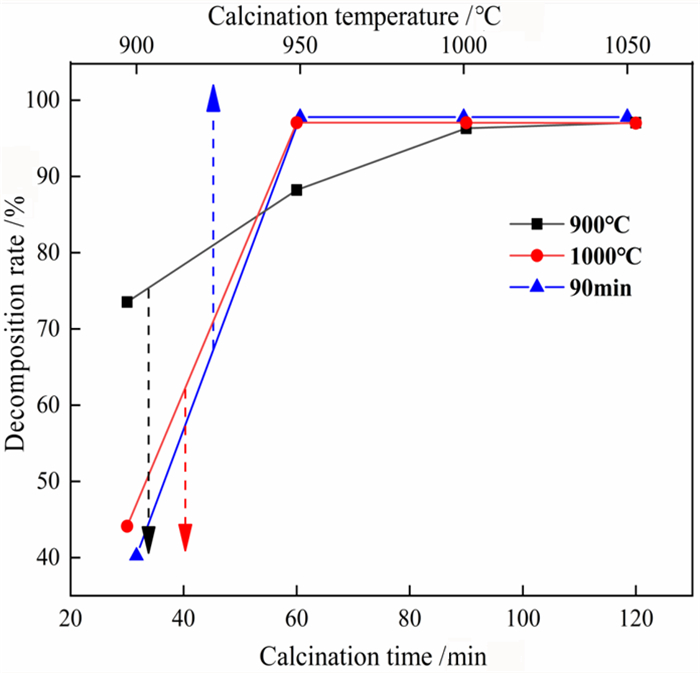 |
| 图 3 不同煅烧时间煅烧温度对碳酸钙分解率的影响 Fig.3 Effect of calcination time and calcination temperature on the decomposition rate of calcium carbonate |
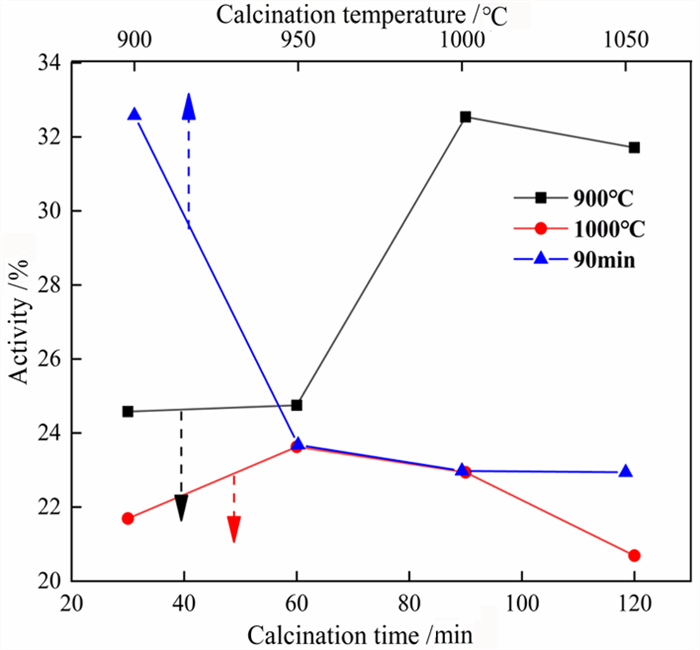 |
| 图 4 不同煅烧时间和煅烧温度对碳酸钙活性度的影响 Fig.4 Effect of calcination time and calcination temperature on the activity of calcium carbonate |
3.2 煅烧温度对碳酸钙与二次铝灰混合物料煅后料物相组成的影响
在碳酸钙与二次铝灰配比为1.0、煅烧时间为90 min的条件下,煅烧温度对混合物料煅后料的物相组成影响如图 5所示。
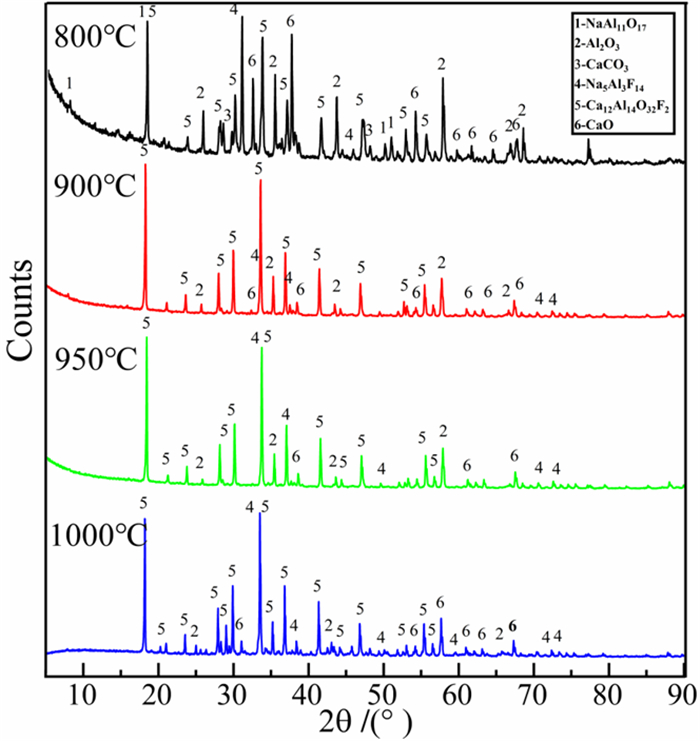 |
| 图 5 不同煅烧温度下煅烧产物的X射线衍射物相分析 Fig.5 X-ray diffraction phase analysis of calcined products at different calcination temperatures |
由图 5可知,铝灰与碳酸钙混合配料煅烧后生成主要成分为Ca12Al14O32F2的煅后渣。800 ℃时,煅后料的物相中还存在许多未分解的碳酸钙、β-Al2O3和较多的氧化钙,这表明氧化钙还未完全与氧化铝结合,此时部分氧化钙已与铝灰中存在的氟盐反应生成了氟化钙,而生成的氟化钙也和氧化钙与氧化铝结合成为Ca12Al14O32F2相。当煅烧温度达到900 ℃以上时,碳酸钙基本分解完全,此时β-Al2O3也与氧化钙发生反应(发生的反应如式8所示)。
| $ \begin{array}{*{20}{c}} {2{\rm{NaA}}{{\rm{l}}_{11}}{{\rm{O}}_{17}} + 3{\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3} + 22{\rm{CaO}} + 2{\rm{Ca}}{{\rm{F}}_2} = }\\ {2{\rm{C}}{{\rm{a}}_{12}}{\rm{A}}{{\rm{l}}_{14}}{{\rm{O}}_{32}}{{\rm{F}}_2} + {\rm{N}}{{\rm{a}}_2}{\rm{O}}} \end{array} $ | (8) |
根据碳酸钙的煅烧结果,当温度达到1 000 ℃,煅烧时间达到90 min后,碳酸钙可完全分解,碳酸钙分解生成的氧化钙基本与铝灰中的氧化铝完全反应。虽然煅烧温度为1 000 ℃时氧化钙的活性度比900 ℃时低,但考虑到本试验的目的是为了让更多的氧化铝转化为铝酸钙,因此最终确定的煅烧温度为1 000 ℃。当碳酸钙与二次铝灰配料进行煅烧时,由于煅烧生成的CaO很容易与二次铝灰中的Al2O3结合成为Ca12Al14O32F2(反应式如式9所示),因此可降低碳酸钙的分解温度。
| $ 7{\rm{A}}{{\rm{l}}_2}{{\rm{O}}_3} + 11{\rm{CaO}} + {\rm{Ca}}{{\rm{F}}_2} = {\rm{C}}{{\rm{a}}_{12}}{\rm{A}}{{\rm{l}}_{14}}{{\rm{O}}_{32}}{{\rm{F}}_2} $ | (9) |
煅烧过程中除了煅烧温度对煅后物料的物相组成影响较大以外,碳酸钙与二次铝灰的配比对煅后物料的影响也很大,碳酸钙配入量不足,二次铝灰中的氧化铝不能完全转化为铝酸钙,氧化铝溶出率必然比较低;而碳酸钙配入量过多,多余的碳酸钙会以氧化钙形式存在,不仅浪费资源,而且增加了煅烧过程的能耗。在相同的煅烧条件下(煅烧温度1 000 ℃,煅烧时间90 min),不同碳酸钙与二次铝灰配料比对煅后物料物相组成的影响如图 6所示。
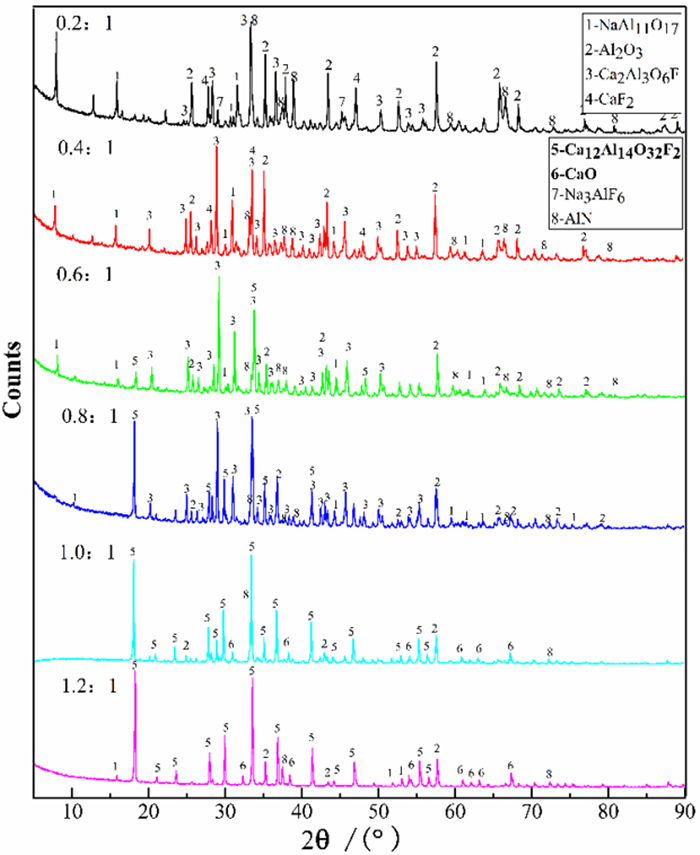 |
| 图 6 不同碳酸钙与二次铝灰配料比的煅后物料的X射线衍射物相分析 Fig.6 X-ray diffraction phase analysis of calcined materials with different proportions of calcium carbonate and secondary aluminum ash |
由图 6可以得出:
(1) 当碳酸钙配入量较少时,碳酸钙煅烧获得的氧化钙量较少,不能与铝灰中的氧化铝和氟盐完全反应,因此煅烧料中存在较多的氟化物。同时随着碳酸钙的加入,碳酸钙与铝灰反应生成分子式为Ca2Al3O6F的中间产物。此时氧化钙主要与氧化铝结合生成Ca12Al14O32F2,其反应方程式如式(9)所示。
(2) 随着混合料中碳酸钙与二次铝灰的质量比的增加,煅后料的主要成分由NaAl11O17、Al2O3、Ca2Al3O6F、CaF2变为NaAl11O17、Al2O3、Ca12Al14O32F2、Ca2Al3O6F。铝灰中存在的氟化物与氧化钙完全反应生成了氟化钙。但此时氧化钙的含量仍然不足,煅后料中仍然存在大量的氧化铝没有反应。
(3) 当混合料中碳酸钙与二次铝灰的质量比达到0.8以后,煅后料中的主要物相变为Ca12Al14O32F2,但此时仍然存在较多量的Ca2Al3O6F;当碳酸钙的配入量达到1.0以后,Ca2Al3O6F相消失;继续增加碳酸钙的配入量,煅后料的主要物相仍然为Ca12Al14O32F2,但随着碳酸钙配入量的增加,煅后料中的CaO含量也会增加。因此碳酸钙与二次铝灰的最佳质量比为1.0 : 1。AlN性质十分稳定,在煅烧过程中不论煅烧料的配比如何变化,AlN都不与CaO发生反应。
3.4 氧化铝的浸出试验将质量比为1 : 1的碳酸钙与二次铝灰铝灰置于坩埚电阻炉中,在1 000 ℃下煅烧90 min,然后对煅后料进行氧化铝的浸出试验。在浸出过程中,煅后料中的铝酸钙和氟铝酸钙会与碱液中的碳酸钠反应生成铝酸钠进入碱液中,而煅后渣中的AlN在碱液中也会发生分解反应(反应式10):
| $ {\rm{AlN}} + {\rm{NaOH}} + 4{{\rm{H}}_2}{\rm{O}} = {\rm{N}}{{\rm{H}}_3} \cdot {{\rm{H}}_2}{\rm{O}} + {\rm{NaAl}}{({\rm{OH}})_4} $ | (10) |
在碱法浸出氧化铝过程中,影响浸出率的主要因素是溶出温度、溶出时间、碱液中苛碱和碳碱的浓度。试验分别探究了在溶出温度为85 ℃时,溶出时间、NaOH和Na2CO3的浓度对氧化铝浸出率的影响。
在溶出温度85 ℃、Na2CO3浓度为106.67 g/L、NaOH浓度为160 g/L、液固比5 : 1的条件下,溶出时间对氧化铝浸出率的影响如图 7所示。由图 7可知,随着溶出时间的延长,氧化铝的溶出率逐渐下降,当溶出时间为45 min时氧化铝的浸出率最高,浸出率可达到66.23%。
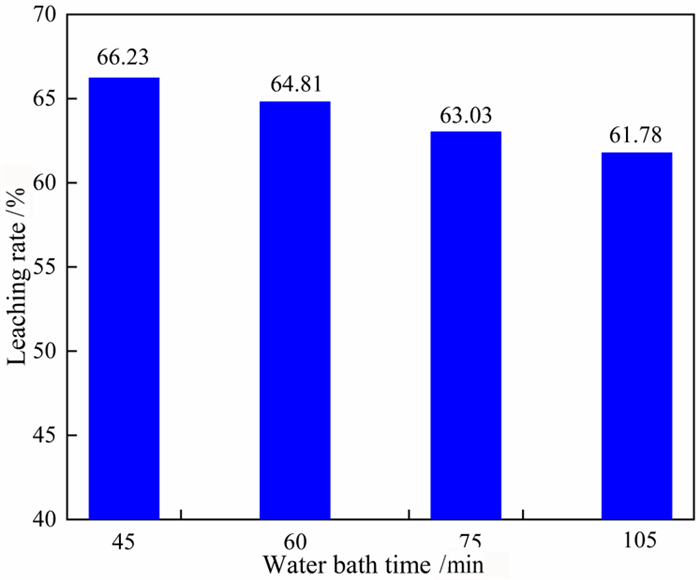 |
| 图 7 溶出时间对氧化铝浸出率的影响 Fig.7 Effect of dissolution time on the leaching rate of alumina |
在Na2CO3浓度为106.67 g/L、液固比5 : 1、水浴85 ℃加热45 min时,不同NaOH浓度对氧化铝浸出率的影响如图 8所示。由图 8可知,随着NaOH浓度的增加氧化铝的浸出率逐渐上升,当NaOH浓度为160 g/L时,氧化铝浸出率可达到66.23%,继续增加NaOH浓度,氧化铝浸出率降低。由此可以确定NaOH的最佳浸出浓度为160 g/L。
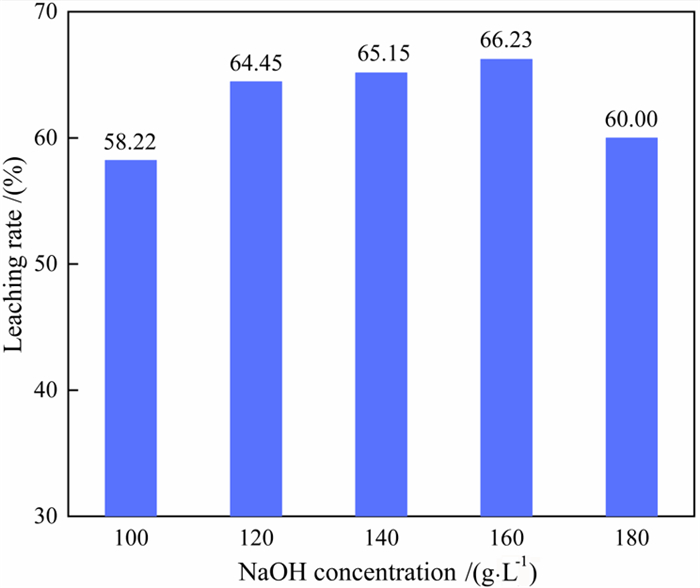 |
| 图 8 NaOH浓度对氧化铝浸出率的影响 Fig.8 Effect of NaOH concentration on the leaching rate of alumina |
在NaOH的浓度为160 g/L、液固比5 : 1、水浴85 ℃加热45 min时,不同Na2CO3浓度对氧化铝浸出率的影响如图 9所示。由图 9可知,当加入的Na2CO3的浓度为66.67 g/L时,氧化铝的浸出率可达到79.22%,此时氧化铝浸出率最高。根据三个试验的结果最终确定,当控制NaOH浓度为160 g/L、Na2CO3的浓度为66.67 g/L、水浴85 ℃加热45 min时氧化铝浸出率最大,浸出率为79.22%。
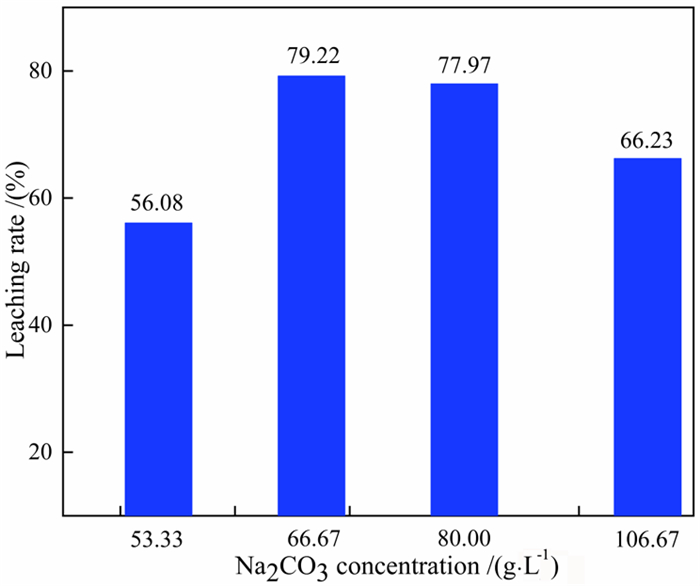 |
| 图 9 Na2CO3浓度对氧化铝浸出率的影响 Fig.9 Effect of Na2CO3 concentration on the leaching rate of alumina |
4 结论
(1) 碳酸钙的分解率和活性度随着煅烧温度的升高和煅烧时间的增加而增大,当煅烧温度和煅烧时间达到一定值后,其分解率和活性度达到最大值,继续升高温度并延长煅烧时间,其分解率基本不变,活性度变小。最佳的煅烧条件为在950 ℃时煅烧90 min,此时碳酸钙分解完全,分解生成的氧化钙活性度较高。
(2) 二次铝灰与碳酸钙配料煅烧过程中,随着煅烧温度的升高和配料中碳酸钙量的增加,氧化钙与铝灰中的氧化铝反应越来越完全。AlN性质较稳定,即使在很高的温度下也不与CaO反应。当煅烧温度为1 000 ℃时,碳酸钙分解生成的氧化钙基本与铝灰中的氧化铝完全反应;当碳酸钙与二次铝灰的配比为1.0时,二次铝灰中的氧化铝完全转化成为铝酸盐。在该条件下进行煅烧可获得主要成分是Ca12Al14O32F2的煅后料。
(3) 氧化铝浸出试验表明,当控制NaOH的浓度为160 g/L、Na2CO3的浓度为66.67g/L、水浴85 ℃加热45 min时氧化铝浸出率最大,浸出率为79.22%。
| [1] |
梁诚, 彭建平, 狄跃忠, 等. 铝灰中铝及其氧化物回收方法现状[J]. 矿产保护与利用, 2019, 39(3): 37-41. |
| [2] |
吴龙, 胡天麒, 郝以党. 铝灰综合利用工艺技术进展[J]. 有色金属工程, 2016, 6(6): 45-49. |
| [3] |
马英, 杜建伟, 项赟, 等. 铝灰渣中回收氧化铝的研究现状和进展[J]. 轻金属, 2017(2): 29-33. |
| [4] |
郭菁. 电解铝灰铝渣的回收利用现状[J]. 材料导报:纳米与新材料专辑, 2013, 27(1): 285-289. |
| [5] |
柴登鹏, 周云峰, 李昌林, 等. 铝灰综合回收利用的国内外技术现状及趋势[J]. 轻金属, 2015(6): 1-4. |
| [6] |
陈吉宁, 徐绍史, 郭声琨. 国家危险废物名录[J]. 上海建材, 2016(4): 1-11. |
| [7] |
HONG JIANPING, WANG JUN. Process of aluminum drossrecycling and life cycle assessment for Al-Sialloys and brown fused alumi[J]. Transactions of Nonferrous Met-al Society of China, 2010(11): 2155-2161. |
| [8] |
周长祥, 王卿, 张文娟, 等. 铝渣灰中氨氮的回收[J]. 矿产保护与利用, 2012(3): 42-45. |
| [9] |
SHEN H, FORSSBERG E. An overview of recovery of metalsfrom slags[J]. Waste Managent, 2003(23): 933-949. |
| [10] |
王伟菁, 齐涛, 李永利, 等. 钛铝危废的资源化利用和无害化处理进展[J]. 矿产保护与利用, 2019, 39(3): 28-36. |
| [11] |
张含博. 电解铝厂铝灰处理工艺现状及发展趋势[J]. 有色冶金节能, 2019(2): 5. |
| [12] |
李燕龙, 张立峰, 杨文, 等. 铝灰用于钢包渣改质剂试验[J]. 钢铁, 2014(3): 17-23. |
| [13] |
胡保国, 蒋晨, 赵海侠, 等. 铝灰酸溶法制备聚合氯化铝[J]. 化工环保, 2013(4): 325-329. |
| [14] |
康文通, 李小云, 李建军, 等. 以铝灰为原料生产硫酸铝新工艺[J]. 四川化工与腐蚀控制, 2000(5): 18-20. |
| [15] |
刘瑞琼, 智利彪, 智国彪. 利用铝灰低温冶炼制备棕刚玉[J]. 耐火材料, 2014(2): 145-146. |
| [16] |
李家镜.利用铝灰制备Sialon材料的研究[D].上海: 上海交通大学, 2012. http://d.wanfangdata.com.cn/thesis/Y2335400
|
| [17] |
尤晶, 王耀武. 以二次铝灰为还原剂还原炼镁-还原渣溶出氧化铝的试验研究[J]. 轻金属, 2016(9): 38-42. |
| [18] |
王剑云, 王雪红, 张光爽. 铝灰中金属铝的物相分析[J]. 浙江冶金, 2012(2): 22-24. |
| [19] |
仇振琢. 苛化溶出铝酸钙[J]. 轻金属, 1999(4): 16-19. |
| [20] |
范娟, 阮复昌. 铝酸钙的溶出工艺研究[J]. 应用化工, 2002(1): 1-3. |
| [21] |
李佳容, 朱建国, 朱书骏, 等. 快速加热条件下碳酸钙分解动力学[J]. 中国粉体技术, 2018(24): 1-7. |
 2020
2020



