| N263萃取分离锌铁及其热力学研究 |
2. 上海大学省部共建高品质特殊钢冶金与制备国家重点实验室, 上海 200444
2. State Key Laboratory of Advanced Special Steel, Shanghai University, Shanghai 200444, China
锌铁的湿法分离在湿法炼锌[1-2]、钢铁冶金含锌尘泥的资源化利用[3-4]、镀锌行业废液治理[5-6]等过程中有重要的作用,高效的分离方法不仅能提高产品质量,还能提高金属资源的利用率并解决废渣废液造成的环境污染问题。
溶液中的锌铁分离主要有化学沉淀法[7]、离子交换法[8-9]和溶剂萃取法[10-11]等。由于共沉淀的存在,除非多次沉淀,否则化学沉淀分离效果难以令人满意。离子交换法分离程度较好,但受制于交换容量,该法难以满足工业上处理量大、金属含量高的需要。溶剂萃取法由于具有金属回收率高、处理能力大、分离效果好、设备简单和易于自动化操作等优点,最具工业应用前景。
Mansur等[12]比较了TBP、Cyanex301和Cyanex302三种萃取剂对锌的萃取能力,发现TBP和Cyanex301的萃取分离效果较好,但是TBP萃取时会将一定量的水带入有机相,Cyanex301在溶液中存在Fe3+时不稳定。Long等[13]以P204为萃取剂研究了从硫酸锌溶液中萃取锌,对比了P204皂化前后的萃取能力,发现皂化前锌的萃取率仅为37.88%,皂化后萃取率达到75%,用2mol/L硫酸可将88.60%的锌反萃出来,但是铁的反萃率仅为1.76%,铁留在有机相中,会降低有机相的负载能力,不利于萃取剂的循环使用。Marszalkowska等[14]比较了四种季膦盐离子液体在盐酸介质中萃取分离锌和铁的性能,结果发现Cyphos IL 101和Cyphos IL 104较Cyphos IL 109和Cyphos IL 111有好的分离效果。但是目前离子液体价格昂贵,并不适宜工业应用。
N263属于季铵盐类萃取剂,主要应用于钒的萃取[15-16]和钨与钼的分离[17]等方面。本文以热镀锌工业产生的酸洗废液处理为研究背景,采用N263从盐酸体系中选择性萃取锌和铁,探究最佳的萃取分离条件。分析了N263萃取锌和铁的机理,并通过研究温度对萃取反应的影响,计算锌铁萃取反应的热力学函数,以期为热镀锌酸洗废液萃取法处置工艺的应用提供参考。
1 试验部分 1.1 试验试剂与仪器试验料液:根据某热镀锌厂排出废液的组成配制模拟液,其大致组成为Zn2+10 g/L,Fe2+ 50 g/L,Fe3+ 5 g/L,HCl浓度(质量浓度,下同)为2%。
主要试剂:萃取剂N263购自厦门先端科技有限公司,纯度为99%;稀释剂260#溶剂油购自上海莱雅仕化工有限公司;改性剂正己醇、盐酸、氯化锌、氯化亚铁和氯化铁等均为分析纯,购自国药集团化学试剂有限公司。
主要仪器:MYP11-2A磁力搅拌器(上海梅颖浦仪器仪表制造有限公司),气浴恒温振荡器(常州澳华仪器有限公司),YP1002N电子天平(上海精密科学仪器有限公司),超级数显恒温水浴锅(上海浦东荣丰科学仪器有限公司)。
1.2 试验方法将含有萃取剂N263的有机相和含锌铁离子的水相按一定体积比加入到分液漏斗中,并置于气浴恒温振荡器,振荡混合一定时间后,静置至两相分层,取下层水相分析,测定其中Zn2+、Fe2+、Fe3+离子的浓度。用差减法求出两相中相应离子浓度,根据式(1)~(3)计算Zn2+、Fe2+、Fe3+的分配比(D)、萃取率(E)和分离系数(βa/b)。
| $ D = \frac{{{C_O}}}{{{C_R}}} $ | (1) |
| $ E = \frac{D}{{D + \frac{{{V_A}}}{{{V_O}}}}} \times 100\% $ | (2) |
| $ {\beta _{a/b}} = \frac{{{D_a}}}{{{D_b}}} $ | (3) |
式中:
CO——负载有机相金属离子浓度,g/L;
CR——萃余液中金属离子浓度,g/L;
VA——水相体积,mL;
VO——有机相体积,mL;
βa/b——a、b离子间的分离系数。
1.3 分析方法水相中Fe2+采用重铬酸钾滴定法测定,Fe3+、Zn2+通过控制溶液的pH采用EDTA络合滴定法连续测定[18]。
1.4 试验原理本试验使用的萃取剂为常用的季铵盐类萃取剂N263(R3CH3NCl),N263属于强碱性萃取剂,其自身含有R3CH3N+,能够直接与金属络合阴离子结合形成疏水性萃合物[19]。在氯化物体系中,Zn2+、Fe3+可以和Cl-形成络阴离子,而Fe2+很难和Cl-络合,仍以阳离子形式存在于溶液中[20]。并且对于不同金属离子,萃取反应平衡常数大的金属离子越容易进入到有机相中。因此,在氯化物体系中可控制适当条件进行锌铁离子的分离。萃取反应方程式如下:
| $ {{\rm{M}}^{n + }} + m{\rm{C}}{{\rm{l}}^ - } = {\rm{MCl}}_m^{\left( {m - n} \right) - } $ | (4) |
| $ \begin{array}{l} \;\;{\rm{MCl}}_m^{(m - n) - } + (m - n){{\rm{R}}_3}{\rm{C}}{{\rm{H}}_3}{\rm{NC}}{{\rm{l}}_{({\rm{O}})}} = \\ {({{\rm{R}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{N}})_{(m - n)}}\cdot {({\rm{MC}}{{\rm{l}}_m})_{({\rm{O}})}} + (m - n){\rm{C}}{{\rm{l}}^ - } \end{array} $ | (5) |
式中,Mn+为Zn2+或Fe3+,且n<m。下标O表示在有机相中。
2 试验结果和讨论 2.1 锌铁萃取影响因素 2.1.1 振荡时间的确定在室温,料液中Zn2+、Fe2+、Fe3+浓度分别为9.51 g/L、50.29 g/L和4.35 g/L,HCl浓度为2%,有机相组成为20%N263+20%正己醇+60%260#溶剂油,相比(O/A)为1:1的条件下,考察了振荡时间对锌铁萃取率的影响,结果如图 1所示。
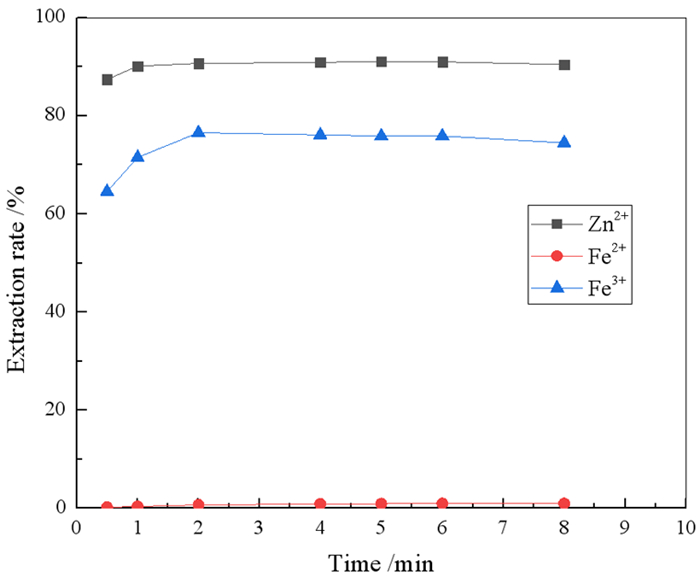 |
| 图 1 振荡时间对锌铁萃取率的影响 Fig.1 Effect of mixing time on extraction of zinc and iron |
由图 1可知,Zn2+、Fe3+萃取反应进行得很快,Fe2+基本不萃取,2 min后,Zn2+、Fe3+的萃取率基本保持不变,表明Zn2+、Fe3+的萃取已经达到平衡,继续增加振荡时间对萃取率基本没有影响,为确保N263萃取锌、铁离子的反应充分并达到平衡,振荡时间确定为5 min。
2.1.2 N263浓度的影响在室温,料液中Zn2+、Fe2+、Fe3+浓度分别为9.51 g/L、50.29 g/L和4.35 g/L,HCl浓度为2%,相比O/A=1:1,振荡时间5 min的条件下,考察了萃取剂浓度对锌铁萃取率和分离系数的影响,结果分别如图 2和图 3所示。
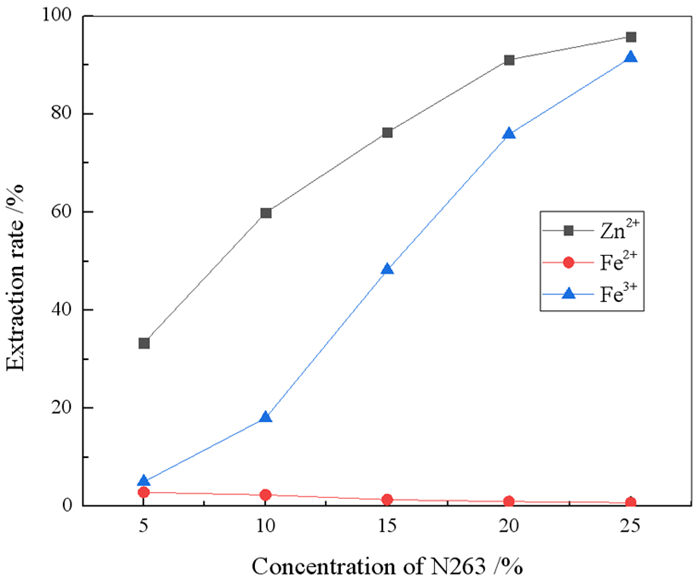 |
| 图 2 萃取剂浓度对锌铁萃取率的影响 Fig.2 Effect of N263 concentration on extraction of zinc and iron |
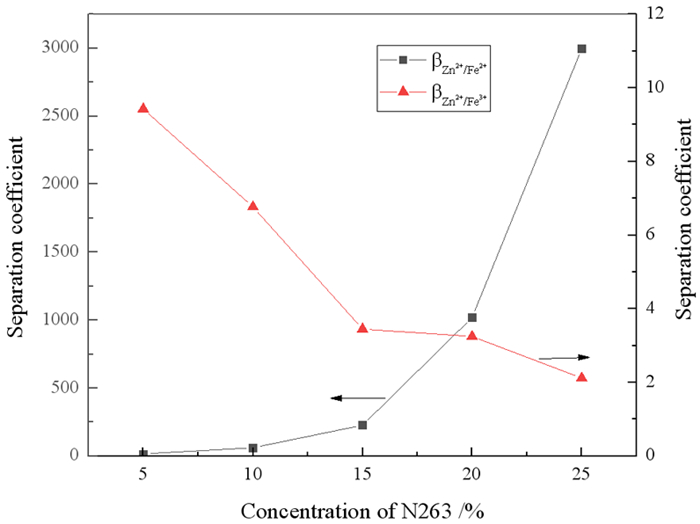 |
| 图 3 N263浓度对锌铁分离系数的影响 Fig.3 Effect of N263 concentration on separation coefficient of zinc over iron |
由图 2可知,随着N263浓度的增大,Zn2+、Fe3+的萃取率逐渐增大,Fe2+的萃取率基本保持不变。随着萃取剂浓度增加,Zn2+、Fe3+的萃取率逐渐上升,因此,N263浓度的增大有利于金属离子进入有机相。但试验中发现,N263在有机相中的比例越高,有机相的黏度越大,从而增加分相的难度。
从图 3中可看出,βZn2+/Fe2+随着N263浓度增大而增大,这是由于N263的量增加,有利于Zn2+的萃取,但对Fe2+影响甚微。在Cl-浓度大于1 mol/L,酸度较高的氯化物体系中,Zn2+主要以ZnCl42-存在,Fe3+主要以FeCl4-存在[21-22],它们分别和N263中的R3CH3N+以静电引力的形式结合成疏水性缔合体进入有机相,且静电引力的强弱取决于络阴离子所带电荷,显然,ZnCl42-较FeCl4-更容易与R3CH3N+结合,因此Zn2+的萃取率始终高于Fe3+。但随着N263浓度的增大,水相中Zn2+浓度降低,更多的Fe3+进入有机相,所以βZn2+/Fe3+逐渐减小。综合考虑锌和铁的萃取率、分离系数以及分相性能,N263浓度取20%为宜。
2.1.3 正己醇浓度的影响在料液中Zn2+、Fe2+、Fe3+浓度分别为9.65 g/L、50.23 g/L和4.33 g/L,HCl浓度为2%,有机相组成为20%N263+正己醇+260#溶剂油,相比O/A=1:1,振荡时间5 min以及室温条件下考察了改性剂正己醇浓度对锌铁萃取率的影响,结果如表 1所示。
| 表 1 不同浓度正己醇对锌铁萃取率的影响 Table 1 Effect of n-Hexanol concentration on extraction of zinc and iron |
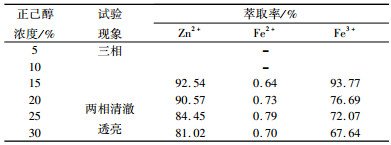
|
260#溶剂油作为稀释剂可以改善分相性能,但萃取剂或萃合物和稀释剂不匹配时,会降低它们在稀释剂中的溶解度,通过加入极性改善剂可以提高N263在260#溶剂油中的溶解性能,并且有助于消除萃取时产生的三相[23]。从表 1中可看出,加入正己醇浓度较低时,萃取后生成三相,这是因为反应生成的萃合物极性较大,在极性很小的260#溶剂油中溶解度较小,所以析出产生第三相。当正己醇浓度大于10%后,三相消失,两相清澈透亮,而正己醇与N263之间的相互作用减弱了N263的萃取性能[24],导致Zn2+、Fe3+的萃取率逐渐降低。根据萃取后的分相情况以及萃取效果,确定正己醇的浓度为20%。
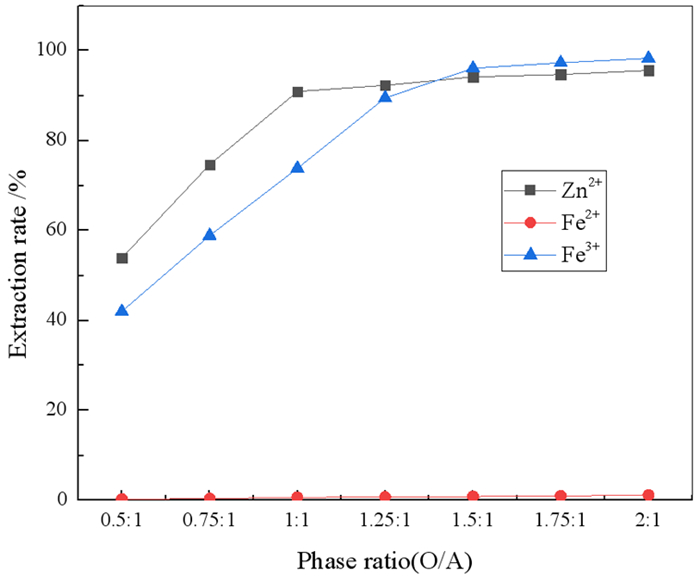
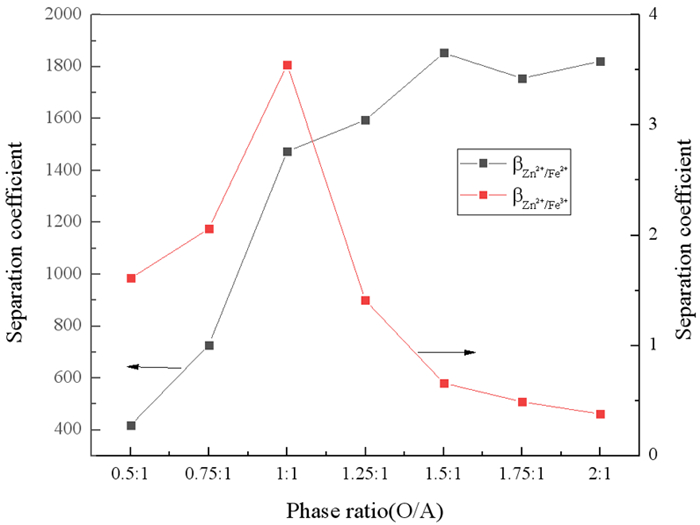
2.1.4 相比的影响在有机相组成20%N263+20%正己醇+60%260#溶剂油,料液中Zn2+、Fe2+和Fe3+浓度分别为9.59 g/L、50.47 g/L和4.09 g/L,HCl浓度为2%,振荡时间5 min,室温条件下,考察了相比对锌铁萃取率和分离系数的影响,结果分别见图 4和图 5。
 |
| 图 4 相比对锌铁萃取率的影响 Fig.4 Effect of phase ratio on extraction of zinc and iron |
 |
| 图 5 相比(O/A)对锌铁分离系数的影响 Fig.5 Effect of phase ratio(O/A) on separation coefficient of zinc over iron |
从图 4可以看出,Zn2+、Fe3+的萃取率随着相比的增大而逐渐升高,这是由于萃取等体积水相时,有机相的体积增大,则其中N263的量增多,有利于萃取反应的正向进行。当相比O/A=1:1时,Zn2+的萃取率为90.93%,继续增大相比对其萃取率的增加几乎没影响,而Fe3+的萃取率在相比大于1.25:1后基本保持不变。图 5中,随着相比的增大,βZn2+/Fe2+呈增大趋势,在相比大于1:1后,βZn2+/Fe2+增大得不明显,而βZn2+/Fe2+在相比为1:1时达到最大。因此,为获得较高的Zn2+的萃取率,尽量少萃取Fe3+,以提高锌和铁的分离系数,萃取相比确定为1:1较为合适。
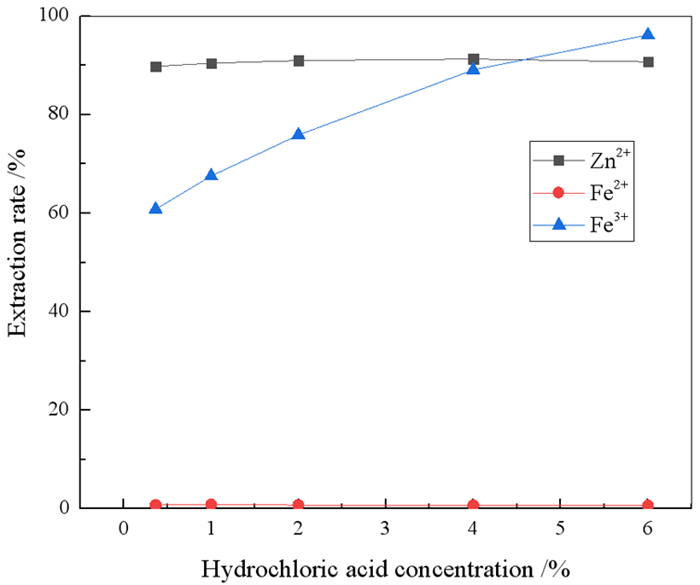
2.1.5 HCl浓度的影响在有机相组成为20%N263+20%正己醇+60%260#溶剂油,相比O/A=1:1,振荡时间5 min和室温条件下,考察了溶液中HCl浓度对锌铁萃取率的影响,结果见图 6。
 |
| 图 6 HCl浓度对锌铁萃取率的影响 Fig.6 Effect of HCl concentration on extraction of zinc and iron |
由图 6可知,随着HCl浓度的增大,Zn2+的萃取率基本保持不变,Fe3+的萃取率逐渐升高。HCl浓度较低时,部分Fe3+由于水解作用以Fe(OH)2+和Fe(OH)2+的形式存在[25],而N263萃取是与金属络阴离子结合,故此时Fe3+的萃取率较低;随着HCl浓度逐渐增大,溶液pH降低,更多的Fe3+与Cl-结合形成FeCl4-,使得Fe3+萃取率逐渐升高。因此,溶液中适宜的HCl浓度范围为0.365%~2%。
2.1.6 串级模拟试验为达到满意的萃取分离效果,工业上一般需进行多级逆流萃取,本文采用实验室常用的分液漏斗模拟法进行多级逆流萃取试验。
多级逆流萃取的理论级数可由公式法计算得出,由克雷姆塞方程可得逆流萃取理论级数的计算公式为[26]:
| $ n = \frac{{{\rm{lg}}({E_A} + {q_{{A_n}}} - 1) - {\rm{lg}}{q_{{A_n}}}}}{{{\rm{lg}}{E_A}}} - 1 $ | (6) |
式中:
n——多级逆流萃取的理论级数;
EA——易萃组分A的萃取因数;
qAn——经过n级逆流萃取后萃余液中易萃组分A的萃余分数。
其中,EA与易萃组分A的分配比DA和相比R存在如下关系:
| $ {E_A} = {D_A} \times R $ | (7) |
料液中Zn2+浓度约为10 g/L,经n级逆流萃取后,萃余液中Zn2+浓度须小于0.5 g/L,根据单级萃取试验结果,取Zn2+的分配比为10,相比为1,由式(6)和式(7)可计算得出n=1.26,取整数为2级。
在有机相组成为20%N263+20%正己醇+60%260#溶剂油,料液中Zn2+、Fe2+和Fe3+的浓度分别为9.61 g/L、49.70 g/L和4.26 g/L,HCl浓度为2%,相比O/A=1:1,振荡时间5 min,室温25 ℃的条件下用分液漏斗模拟2级逆流萃取。当萃取达到平衡时,萃余液中Zn2+浓度低至0.36 g/L,Zn2+占金属离子的含量从料液中的15.06%降至萃余液中的0.72%。
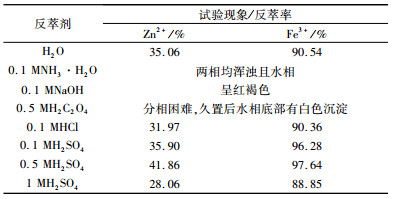
2.1.7 反萃试验在完整的萃取工艺中,为使金属离子得到利用及萃取剂重复使用,反萃取是必不可少的一环。因为只有很少量的Fe2+进入了有机相,故在反萃试验中只考虑Zn2+和Fe3+的反萃效果。在室温25 ℃,负载有机相中Zn2+、Fe3+的浓度分别为8.04 g/L、2.81 g/L,相比O/A=1:1,振荡时间5 min的条件下,试验结果见表 2。
| 表 2 反萃剂的反萃效果 Table 2 Stripping effect of different reagents |
|
由表 2可知,NH3·H2O和NaOH与Fe3+易生成氢氧化物沉淀,使得水相呈红褐色。用草酸反萃时,易生成草酸锌沉淀,阻碍反萃过程的正常进行。水、稀盐酸和稀硫酸均能将Zn2+和Fe3+反萃出来,且Fe3+的反萃率始终高于Zn2+,其中0.5 mol/L的H2SO4反萃效果最佳。考虑到为避免反萃时出现金属离子的水解,以0.5 mol/L的H2SO4作为反萃剂为宜。
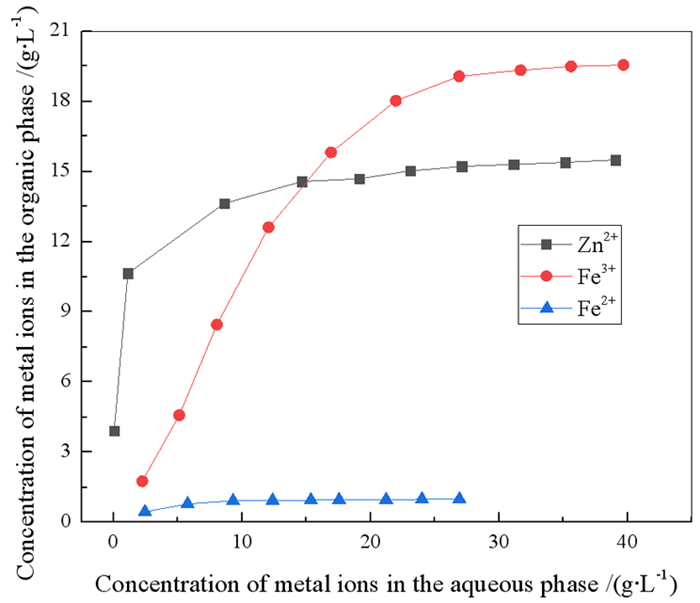
2.2 萃取热力学研究 2.2.1 N263萃取金属离子的反应方程为了阐明N263萃取Zn2+、Fe2+和Fe3+的机理,在25 ℃,有机相组成为20%N263+10%正己醇+70%260#溶剂油,HCl浓度为2%,相比O/A=1:1,振荡时间为5分钟的条件下,采用系列浓度法分别测定了N263对单一Zn2+、Fe2+和Fe3+溶液的萃取饱和容量,试验结果如图 7所示。
 |
| 图 7 金属离子的萃取平衡等温线 Fig.7 The extraction equilibrium isotherm of metal ions |
由图 7可知,随着水相中Zn2+、Fe3+浓度增大,有机相中Zn2+、Fe3+浓度也随之增加,后续逐渐平缓,最终有机相中金属离子浓度基本不升高,表明N263萃取Zn2+、Fe3+达到饱和,而Fe2+在有机相中的浓度随水相中Fe2+浓度增加变化很小。由图可知,20%的N263萃取Zn2+、Fe3+、Fe2+的饱和容量分别为15.49 g/L、19.55 g/L和0.99 g/L。因此,Zn2+与N263的摩尔比为1.75,接近于2;Fe3+与N263的摩尔比为1.19,接近于1。
在氯化物体系中,当Cl-浓度较高时,Zn2+主要以ZnCl42-存在,Fe3+主要以FeCl4-存在,Fe2+主要以FeCl+形式存在[27],根据萃取反应机理,Fe2+不参与反应。所以萃取反应方程式为:
| $ {\rm{ZnC}}{{\rm{l}}_{\rm{4}}}^{{\rm{2 - }}}{\rm{ + 2}}{{\rm{R}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{}}{{\rm{N}}_{{\rm{(O)}}}}^{\rm{ + }}{\rm{ = (}}{{\rm{R}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{N}}{{\rm{)}}_{\rm{2}}}{\rm{\cdot (ZnC}}{{\rm{l}}_{\rm{4}}}{\rm{}}{{\rm{)}}_{{\rm{(O)}}}} $ | (8) |
| $ {\rm{FeC}}{{\rm{l}}_{\rm{4}}}^{\rm{ - }}{\rm{ + }}{{\rm{R}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{}}{{\rm{N}}_{{\rm{(O)}}}}^{\rm{ + }}{\rm{ = (}}{{\rm{R}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{N)\cdot (FeC}}{{\rm{l}}_{\rm{4}}}{\rm{}}{{\rm{)}}_{{\rm{(O)}}}} $ | (9) |
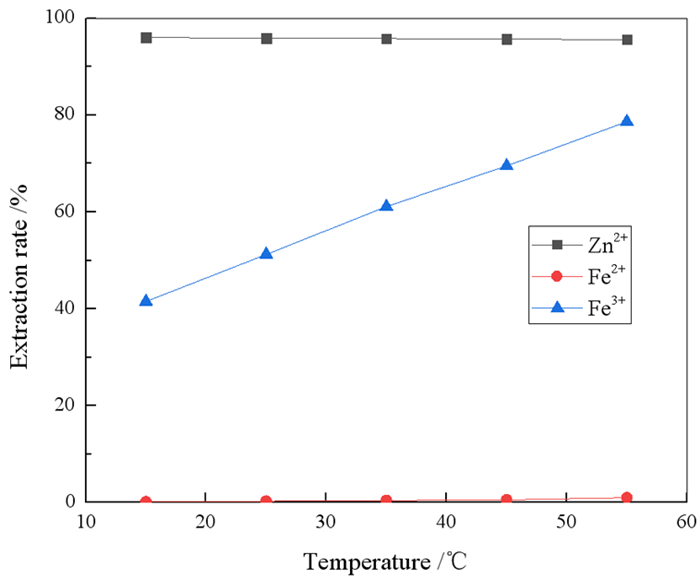
为了探究温度对N263萃取锌、铁离子的影响,分别配制了单一的Zn2+、Fe2+和Fe3+溶液,浓度分别为9.71 g/L、70.71 g/L和9.82 g/L,HCl浓度为2%,在有机相组成为20%N263+10%正己醇+70%260#溶剂油,相比O/A=1:1,振荡时间为5 min的条件下,考察了温度对锌、铁萃取率的影响,结果如图 8所示。
 |
| 图 8 温度对锌铁萃取率的影响 Fig.8 Effect of temperature on extraction of zinc and iron |
根据萃取反应热力学,温度、分配比和热焓之间的关系为[28]:
| $ {\rm{lg}}D = \frac{{ - \Delta H}}{{2.303RT}} + C $ | (10) |
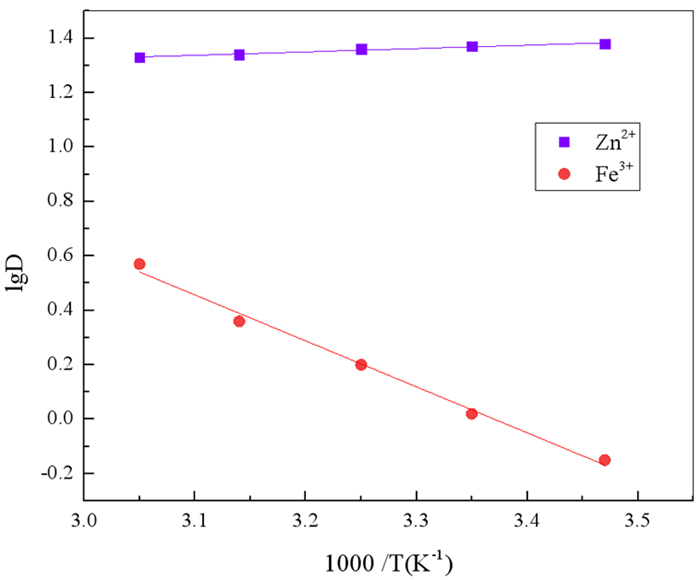
通过不同温度下各金属离子的分配比D,由公式(10)可知,以lgD对T-1作图得到图 9。各拟合曲线所对应方程及相关参数见表 3。
 |
| 图 9 lgD与T-1的关系 Fig.9 The relationbetweenlgD and T-1 |
| 表 3 萃取时的lgD和T-1之间的拟合直线方程 Table 3 The equation of fitting line between lgD and T-1 |

|
拟合曲线所对应方程及相关参数见表 3。
由公式(10)和表 3方程计算得出,N263萃取Zn2+和Fe3+的热焓分别为-2.36 kJ/mol和32.34 kJ/mol,表明N263萃取Zn2+为放热反应,升高温度不利于反应的进行;Fe3+的萃取反应为吸热反应,升高温度有利于反应的进行。因此,为提高Zn2+的萃取率,并使Zn2+与Fe3+之间更好地分离,萃取在低温条件下进行为宜。
根据热力学原理,萃取反应自由能ΔG0与温度、平衡常数Kex的关系为:
| $ \Delta {G^0} = - RT{\rm{ln}}{K_{ex}} $ | (11) |
结合前述萃取反应式(8)和式(9),Kex可表示为:
| $ {K_{ex\left( {{\rm{Zn}}} \right)}} = {\rm{ }}\frac{{[{{{\rm{(}}{{\rm{R}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{N)}}}_{\rm{2}}}{\rm{\cdot ZnC}}{{\rm{l}}_{\rm{4}}}{\rm{]}}}}{{{\rm{[ZnC}}{{\rm{l}}_{\rm{4}}}^{{\rm{2 - }}}{\rm{]}} \cdot {{{\rm{[}}{{\rm{R}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{}}{{\rm{N}}^{\rm{ + }}}{\rm{]}}}^{\rm{2}}}}} $ | (12) |
| $ {K_{ex\left( {{\rm{Fe}}} \right)}} = \frac{{{\rm{ [(}}{{\rm{R}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{N)\cdot FeC}}{{\rm{l}}_{\rm{4}}}{\rm{]}}}}{{{\rm{[FeC}}{{\rm{l}}_{\rm{4}}}^{\rm{ - }}{\rm{]}} \cdot {\rm{[}}{{\rm{R}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{}}{{\rm{N}}^{\rm{ + }}}{\rm{]}}}} $ | (13) |
根据分配比D的定义:
| $ {D_{{\rm{Zn}}}} = \frac{{{\rm{[(}}{{\rm{R}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{N}}{{\rm{)}}_{\rm{2}}}{\rm{\cdot ZnC}}{{\rm{l}}_{\rm{4}}}{\rm{]}}}}{{{\rm{[ZnC}}{{\rm{l}}_{\rm{4}}}^{{\rm{2 - }}}{\rm{]}}}} $ | (14) |
| $ {D_{{\rm{Fe}}}} = \frac{{{\rm{[(}}{{\rm{R}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{N)\cdot FeC}}{{\rm{l}}_{\rm{4}}}{\rm{]}}}}{{{\rm{[FeC}}{{\rm{l}}_{\rm{4}}}^{\rm{ - }}{\rm{]}}}} $ | (15) |
将式(14)和式(15)分别带入式(12)和式(13),则有:
| $ {K_{ex\left( {{\rm{Zn}}} \right)}} = \frac{{{D_{{\rm{Zn}}}}}}{{{{{\rm{[}}{{\rm{R}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{}}{{\rm{N}}^{\rm{ + }}}{\rm{]}}}^{\rm{2}}}}} $ | (16) |
| $ {K_{ex\left( {{\rm{Fe}}} \right)}} = \frac{{{D_{{\rm{Fe}}}}}}{{{\rm{[}}{{\rm{R}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{}}{{\rm{N}}^{\rm{ + }}}{\rm{]}}}} $ | (17) |
根据本试验结果,由式(16)、(17)可计算出在298.15 K时,N263萃取Zn2+、Fe3+的表观平衡常数Kex,再代入式(11)可计算出ΔG0。
根据热力学基本方程,萃取熵变ΔS0与ΔG0、ΔH0和温度T的关系式为:
| $ \Delta {S^0} = \frac{{\Delta {H^0} - \Delta {G^0}}}{T} $ | (18) |
由此得到N263萃取Zn2+、Fe3+的相关热力学数值,结果如表 4所示。
| 表 4 N263萃取锌铁的热力学数值 Table 4 Thermodynamic functions of N263 extraction of zinc and iron |

|
由表 4可知,当温度为298.15 K时,两金属离子萃取反应的ΔG0均为负值,说明在此条件下,Zn2+和Fe3+的萃取均可自发进行。
3 结论(1) 采用N263在氯化物体系中萃取分离锌和铁时,在室温25 ℃,有机相组成为20%N263+20%正己醇+60%260#溶剂油,相比O/A=1:1,振荡时间5 min的条件下,采用2级逆流萃取,水相中Zn2+浓度从9.61 g/L降至0.36 g/L,Zn2+占金属离子的百分含量从料液中的15.06%降至萃余液中的0.72%,锌铁分离效果较好。以0.5 mol/L的H2SO4作为反萃剂有较好的反萃效果,Zn2+的反萃率为41.86%,Fe3+反萃率超过97%。
(2) N263与Zn2+和Fe3+萃取反应的摩尔比分别为2:1和1:1。N263萃取Zn2+为热效应较小的放热反应,萃取Fe3+为热效应较大的吸热反应,低温下有利于锌和铁的分离。在室温下,Zn2+和Fe3+的萃取均可自发进行。
| [1] |
张国华, 朱北平, 陈先友, 等. 湿法炼锌中锌铁分离方法与运用探讨[J]. 有色金属(冶炼部分), 2021(2): 20-26. DOI:10.3969/j.issn.1007-7545.2021.02.003 |
| [2] |
YA NH, CHAIL Y, PENGB, et al. A novel method to recover zinc and iron from zinc leaching residue[J]. Minerals Engineering, 2014, 55: 103-110. DOI:10.1016/j.mineng.2013.09.015 |
| [3] |
DUTRA AJB, PAIVA PRP, TAVARES LM. Alkaline leaching of zinc from electric arc furnace steel duste[J]. Minerals Engineering, 2006, 19: 478-485. DOI:10.1016/j.mineng.2005.08.013 |
| [4] |
付筱芸, 王碧侠, 刘欢, 等. 钢铁厂含锌粉尘处理技术和锌的回收[J]. 热加工工艺, 2019, 48(2): 10-13. |
| [5] |
吴勇基, 李敏, 李楚喜, 等. 含锌含铁废酸处理方法的研究[J]. 广东化工, 2016, 43(7): 144-145. DOI:10.3969/j.issn.1007-1865.2016.07.071 |
| [6] |
SINHA M K, PRAMANIK, SAHU S K, et al. Development of an efficient process for the recovery of zinc and iron asvalue added products from the waste chloride solution[J]. Separation and Purification Technology, 2016, 167: 37-44. DOI:10.1016/j.seppur.2016.04.049 |
| [7] |
FORMANEKJ, JANDOVAJ, CAPEK J. Iron removal from zinc liquors originating from hydrometallurgicalprocessing of spent Zn/MnO2 batteries[J]. Hydrometallurgy, 2013, 138: 100-105. DOI:10.1016/j.hydromet.2013.06.010 |
| [8] |
MIESIAC I. Removal of zinc(Ⅱ) and iron(Ⅱ) from spent hydrochloric acid by means of anionic resins[J]. Industrial & Engineering Chemistry Researach, 2005, 44(4): 1004-1011. |
| [9] |
MACHADO R M, GAMEIRO M L F, KRUPA M, et al. Selective separation and recovery of zinc and lead from galvanizing industrial effluents by anion exchange[J]. Separation Science and Technology, 2015, 50(17): 2726-2736. |
| [10] |
SINHA M K, SAHU S K, MESHRAM P, et al. Solvent extraction and separation of zinc and iron from spent pickle liquor[J]. Hydrometallurgy, 2014, 147: 103-111. |
| [11] |
RANDAZZO S, CARUSO V, CIAVARDELLI D, et al. Recovery of zinc from spent pickling solutions by liquid- liquid extraction usingTBP[J]. Desalination and Water Treatment, 2019, 157: 110-117. DOI:10.5004/dwt.2019.24111 |
| [12] |
MANSUR M B, FERREIRA ROCHA S D, et al. Selective extraction of zinc(Ⅱ) over iron(Ⅱ) from spent hydrochloric acid pickling effluents by liquid-liquid extraction[J]. Journal of Hazardous Materials, 2008, 150(3): 669-678. DOI:10.1016/j.jhazmat.2007.05.019 |
| [13] |
LONG H Z, CHAI L Y, QIN W Q, et al. Solvent extraction of zinc from zinc sulfate solution[J]. Journalof Central South University of Technology, 2010, 17(4): 760-764. DOI:10.1007/s11771-010-0553-x |
| [14] |
MARSZALKOWSKA B, REGEL-ROSOCKA M, NOWAK L, et al. Quaternary phosphonium salts as effective extractants of zinc(Ⅱ) and iron(Ⅲ) ions from acidic pickling solutions[J]. Polish Journal of Chemical Technology, 2010, 12(4): 1-5. DOI:10.2478/v10026-010-0039-5 |
| [15] |
李强, 肖连生, 张贵清, 等. 季铵盐N263萃取分离钨酸钠中的钒[J]. 稀有金属与硬质合金, 2017, 45(2): 20-27. |
| [16] |
陈金清, 林凯, 熊家任, 等. 改性季铵盐从高碱度溶液中萃取钒的研究[J]. 有色金属科学与工程, 2015, 6(2): 21-26. |
| [17] |
卢博, 谢方浩, 邓声华, 等. N263-仲辛醇-煤油体系萃取分离钨钼[J]. 硬质合金, 2011, 28(5): 311-315. DOI:10.3969/j.issn.1003-7292.2011.05.008 |
| [18] |
叶素妹. 镀锌废酸中铁、锌含量的测定方法[J]. 化学分析计量, 2009, 18(1): 52-55. |
| [19] |
汪家鼎, 陈家镛. 溶剂萃取手册[M]. 北京: 化学工业出版社, 2001: 26-27.
|
| [20] |
CIERPISZEWSKI R, MIESIAC I, REGEL-ROSOCKA M, et al. Removal of zinc(Ⅱ) from spent hydrochloric acid solutions from zinc hot galvanizing plants[J]. Industrial & engineering chemistry research, 2002, 41(3): 598-603. |
| [21] |
张启修, 张贵清, 唐瑞仁, 等. 萃取冶金原理与实践[M]. 湖南: 中南大学出版社, 2014: 537-539.
|
| [22] |
LEE MS. Use of the Bromley equation for the analysis of ionic equilibria in mixed ferric and ferrous chloride solutions at 25℃[J]. Metallurgical and materials transactions B-process metallurgy and materials processing science, 2006, 37(2): 173-179. DOI:10.1007/BF02693146 |
| [23] |
丁扬力, 肖连生, 曹佐英, 等. N263从钼酸钠溶液中萃取分离钼钒[J]. 有色金属科学与工程, 2017, 8(1): 15-20. |
| [24] |
朱屯. 萃取与离子交换[M]. 北京: 冶金工业出版社, 2005: 67-69.
|
| [25] |
李洪桂. 湿法冶金学[M]. 湖南: 中南大学出版社, 2002: 345-347.
|
| [26] |
杨佼庸, 刘大星. 萃取[M]. 北京: 冶金工业出版社, 1988: 37-38.
|
| [27] |
REGEL-ROSOCKA M, WISNIEWSKI M. Selective removal of zinc(Ⅱ) from spent pickling solutions in the presence of iron ions with phosphonium ionic liquid Cyphos IL 101[J]. Hydrometallurgy, 2011, 110(1-4): 85-90. DOI:10.1016/j.hydromet.2011.08.012 |
| [28] |
徐光宪. 萃取化学原理[M]. 上海: 上海科学技术出版社, 1984: 25-26.
|
 2021
2021



