| 硫脲-盐酸体系从稀土抛光粉废料中浸出回收稀土氧化物 |
20世纪30年代,欧洲开始采用稀土氧化物来抛光玻璃,并很快将其应用于精密光学仪器的抛光[1-2]。稀土抛光粉的主要有效成分为氧化铈,根据氧化铈含量不同,分为低铈抛光粉、中铈抛光粉和高铈抛光粉,分别应用于阴极射线管/光学眼镜,液晶显示屏/光学玻璃和半导体元件/光学镜头的抛光[3]。稀土抛光粉抛光过程中不断有抛光对象物的组分进入,且抛光摩擦使得抛光粉颗粒变细、棱角磨平,导致抛光性能逐渐下降直至失效[4]。
21世纪以来,随着手机玻璃产量的快速增长和材料表面抛光精度的提高,稀土抛光粉的消耗量及其废料的排放量也快速增长[5]。虽然稀土抛光粉废料属于无危害固体废料,但其中的稀土氧化物总量与稀土抛光粉一样,并没有损失。稀土抛光粉废料的堆放填埋不仅占用土地,而且浪费宝贵的稀土资源[6-8]。为此,从稀土抛光粉废料中回收稀土资源具有重要的意义。
从稀土抛光粉废料中回收稀土氧化物的主要方法有物理分离法、碱焙烧法、硫酸焙烧法和还原浸出法等[9-17]。
物理分离法主要基于稀土氧化物和非稀土杂质之间的物理性质如密度、磁性和亲疏水性的差异而采用重选、磁选、浮选等回收稀土氧化物。涂雅洁等[9]分别以苯甲羟肟酸和N-羟基邻苯二甲酰亚胺为捕收剂进行了浮选试验,二氧化铈含量由2.85%分别提高到14.17%和15.08%,达到了初步富集的目的。Kim等[10]用浮选法和化学溶解分别除去抛光粉废渣中的玻璃粉和絮凝剂,然后经焙烧和化学浸出,再选择性沉淀获得的稀土产品的纯度为94%。物理分离法的主要优点是操作较简单、药剂消耗低,但单级分离效率一般较低。
碱焙烧法一般采用强碱焙烧熔融稀土抛光粉废料中的玻璃组分,然后浸出回收稀土氧化物。Wang等[11]在450 ℃、抛光粉废料与NaOH的质量比为1 1的条件下焙烧,然后在液固比为25 mL/g、浸出温度为25 ℃时脱除稀土抛光粉废料中玻璃组分,回收的氧化铈产品可重新用于抛光。刘晓杰等[12]将稀土抛光粉废料与氢氧化钠混合在550 ℃下焙烧,所得焙烧产物通过水洗、酸化,其中有约10%的稀土和90%以上的硅、铝进入溶液,所剩滤渣中稀土含量得到提高。碱焙烧法有原理简单、稀土回收率较高的特点,缺点是一般需要酸碱转换,药剂消耗较多、成本较高。
硫酸焙烧法利用CeO2、LaOF不易溶于盐酸、硝酸,而易溶于热硫酸的特点,通过稀土抛光粉废渣与硫酸混合焙烧转化为硫酸盐而纯化稀土。Zou等[13]将稀土抛光粉废料与浓硫酸混合后在300 ℃焙烧,焙烧产物25 ℃水浸2 h,经草酸沉淀、焙烧得到产物,La和Ce的回收率最高可分别达到99.39%和89.02%。罗磊等人[14]研究表明,在反应时间100 min、反应温度270 ℃、酸粉比(浓硫酸与抛光粉废料质量之比)为2.6的条件下,约98%的镧、铈等能进入浸出液。硫酸焙烧法稀土的浸出率相对较高,但需要硫酸高温焙烧,对设备腐蚀严重,存在潜在的环境和安全隐患。
还原浸出法是用还原剂将Ce(Ⅳ)还原为易溶于稀酸的Ce(Ⅲ),从而提高稀土抛光粉废渣中铈的浸出率。Poscher等[15]使用盐酸和过氧化氢还原浸出提取铈和镧,在液固比为5.5、浸出温度80 ℃条件下浸出4 h,废玻璃抛光粉中97%的铈被浸出。Jano等[16]将过量的浓硝酸、过氧化氢与抛光粉废料混合,在65~70 ℃下浸出稀土,铈浸出率约为70%。Lu等[17]采用硫脲作还原剂从废稀土抛光渣中提取铈,在浸出温度90 ℃、浸出时间150 min、硫脲用量0.2 g/g(废稀土渣)、盐酸浓度3.5 mol/L条件下,铈回收率为91.23%。与过氧化氢还原浸出相比,硫脲还原浸出操作安全性更高,原料消耗更少。此外,还原浸出法流程较简单、操作方便、不需要高温焙烧、抛光粉废料中稀土元素回收率高,值得进一步深入研究。
本文基于硫脲能将Ce(Ⅳ)还原为易溶于稀酸的Ce(Ⅲ)的特点,采用硫脲-盐酸体系还原浸出稀土抛光粉废料中的铈元素,重点考察浸出温度、浸出时间、液固比(L/S)、盐酸浓度和硫脲用量对稀土抛光粉废料中铈浸出率的影响。在此基础上,采用草酸沉淀分离出浸出液中的稀土离子,然后焙烧稀土草酸沉淀制备稀土氧化物产品,并对其进行激光粒度、XRD和SEM等分析与表征。
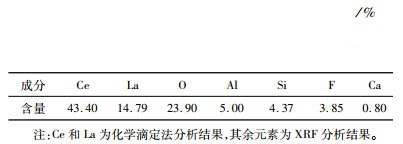
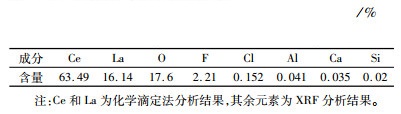
1 试验部分 1.1 原料及试剂稀土抛光粉废料样品由湖南浏阳某企业提供,呈灰白色。在120 ℃下干燥2 h后过筛备用,其化学组成见表 1。表 1可见,稀土抛光粉废料中稀土元素主要为铈和镧,此外还含有铝、硅、氟、钙等元素。试验使用的盐酸(36%~38%)、草酸、氨水(25%~28%)、硫脲均为分析纯,购自国药集团化学试剂公司。
| 表 1 稀土抛光粉废料的化学组成 Table 1 Chemical composition of rare earth polishing powder waste |
|
1.2 试验方法
还原浸出:取5 g稀土抛光粉废料样品,加入盐酸溶液,水浴升温至给定温度后加入硫脲,磁力搅拌(400 r/min)浸出一定时间,然后取出冷却至室温后过滤,得到稀土浸出液。此过程发生的主要化学反应见式(1)[18]:
| $ \begin{gathered} 6 \mathrm{H}^{+}+2 \mathrm{CS}\left(\mathrm{NH}_{2}\right)_{2}+2 \mathrm{CeO}_{2} \underset{60 \min }{\stackrel{90℃}{\longrightarrow}}\left(\mathrm{SCN}_{2} \mathrm{H}_{3}\right)_{2}+ \\ 2 \mathrm{Ce}^{3+}+4 \mathrm{H}_{2} \mathrm{O} \end{gathered} $ | (1) |
二硫化甲脒[(SCN2H3)2]在酸性溶液中不稳定,会分解产生单质硫和氰胺[18],见式(2):
| $ \left(\mathrm{SCN}_{2} \mathrm{H}_{3}\right)_{2} \underset{60 \min }{\stackrel{90℃}{\longrightarrow}} \mathrm{CS}\left(\mathrm{NH}_{2}\right)_{2}+\mathrm{NH}_{2} \mathrm{CN}+\mathrm{S} $ | (2) |
沉降-焙烧[17]:用氨水将浸出液的pH值调节至1.8~2.0后升温至80 ℃,缓慢加入一定量的草酸,保温一定时间,搅拌至沉淀析出,然后冷却到室温后过滤,得到白色的稀土草酸沉淀。稀土草酸沉淀在管式炉中800 ℃焙烧120 min得到最终产品[19]。此阶段发生的主要化学反应见式(3)和(4):
| $ 2 \mathrm{Ce}^{3+}+3 \mathrm{H}_{2} \mathrm{C}_{2} \mathrm{O}_{4}+n \mathrm{H}_{2} \mathrm{O} \stackrel{80{ }^{\circ} \mathrm{C}}{\longrightarrow} \mathrm{Ce}_{2}\left(\mathrm{C}_{2} \mathrm{O}_{4}\right)_{3} \cdot n \mathrm{H}_{2} \mathrm{O} \downarrow+6 \mathrm{H}^{+} $ | (3) |
| $ \mathrm{Ce}_{2}\left(\mathrm{C}_{2} \mathrm{O}_{4}\right)_{3} \cdot n \mathrm{H}_{2} \mathrm{O}+2 \mathrm{O}_{2} \stackrel{800{ }^{\circ} \mathrm{C}}{\longrightarrow} 2 \mathrm{CeO}_{2}+6 \mathrm{CO}_{2}+n \mathrm{H}_{2} \mathrm{O} $ | (4) |
稀土抛光粉中氧化铈含量采用化学滴定法分析[20]:取0.100 0 g试料置于250 mL锥形瓶中,用少量水润湿试料,加入10 mL磷酸、1 mL高氯酸,在低温电热板上加热溶解,待高氯酸冒烟剧烈反应后,取下稍冷,加入80 mL硫酸溶液(1 mol/L),冷却至室温。然后加2滴苯代邻氨基苯甲酸溶液为指示剂,用硫酸亚铁铵标准溶液滴定至亮绿色为终点。按式(5)计算试样中CeO2的质量分数(%):
| $ \rm\omega\left(\mathrm{CeO}_{2}\right)=\frac{c\left(\mathrm{Fe}^{2+}\right) \cdot V \times 172.13 \times 10^{-3}}{m} \times 100 $ | (5) |
式中:c(Fe2+)为硫酸亚铁铵溶液的浓度,mol/L; m为试样质量,g; V为消耗的硫酸亚铁铵溶液体积,mL。
稀土抛光粉废料和稀土氧化物产品的组成通过X射线荧光光谱(XRF; 型号:S4-FPioneer,德国布鲁克)和化学滴定法分析; 采用热分析仪(型号:METTLER-TOLEDO TGA-2,瑞士)对稀土草酸沉淀进行热重分析; 物相分析则采用X射线衍射光谱仪(XRD; 型号:D/max 2500,日本); 稀土氧化物产品的粒度分析采用激光粒度仪(型号:BT-9300ST,中国丹东); 其微观形貌则通过扫描电子显微镜(SEM; 型号:JSM-7610FPlus,日本)获取。
2 结果与讨论 2.1 浸出工艺参数对废料中铈浸出率的影响 2.1.1 液固比取稀土抛光粉废料5 g,加入4 mol/L的稀盐酸和0.2 g硫脲,在90 ℃下搅拌反应60 min,液固比对废料中铈浸出率的影响见图 1。
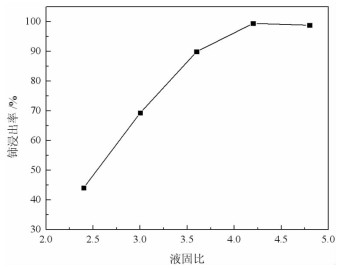 |
| 图 1 液固比对铈浸出率的影响 Fig.1 Effect of liquid-solid ratio on cerium leaching rate |
图 1表明,铈浸出率随着盐酸用量的增加而提高,当液固比从2.4增加到4.2时,铈浸出率从44.12%提高到99.37%,再继续增大盐酸用量,铈浸出率增长不显著,故选定液固比为4.2进行后续试验。
2.1.2 盐酸浓度取稀土抛光粉废料5 g,加入21 mL稀盐酸和0.2 g硫脲,在90 ℃下搅拌反应60 min,探索盐酸浓度对废料中铈浸出率的影响,试验结果见图 2。
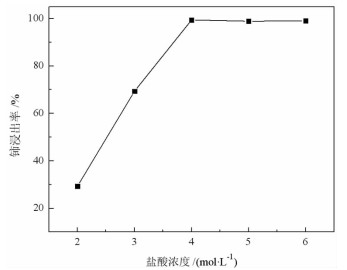 |
| 图 2 盐酸浓度对铈浸出率的影响 Fig.2 Effect of hydrochloric acid concentration on cerium leaching rate |
图 2表明,随着盐酸浓度的增加,铈浸出率增加,当盐酸浓度达到4 mol/L时,铈浸出率达到99.37%,继续增加盐酸浓度,铈浸出率基本保持不变,确定4 mol/L盐酸进行后续试验。
2.1.3 硫脲用量取稀土抛光粉废料5 g,加入21 mL的4 mol/L稀盐酸和一定量的硫脲,在90 ℃下搅拌反应60 min,探索硫脲用量对废料中铈浸出率的影响,结果见图 3。
 |
| 图 3 硫脲用量对铈浸出率的影响 Fig.3 Effect of thiourea dosage on cerium leaching rate |
图 3表明,铈浸出率随着硫脲用量的增加而提高。不加硫脲时,稀土抛光粉废料中铈浸出率仅为31.74%,硫脲加入量增加到0.2 g(即硫脲和稀土抛光粉废料质量比为1 25)时,铈浸出率增至99.37%,这说明硫脲能促进稀土抛光粉废料的铈进入浸出溶液。继续增加硫脲用量,铈浸出率变化很小,故选定硫脲用量为抛光粉废料量的4%(质量分数)进行后续浸出试验。
2.1.4 浸出时间取稀土抛光粉废料5 g,加入21 mL的4 mol/L稀盐酸和0.2 g硫脲,在90 ℃下搅拌浸出,浸出时间对废料中铈浸出率的影响见图 4。
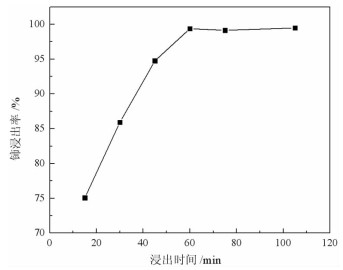 |
| 图 4 浸出时间对铈浸出率的影响 Fig.4 Effect of leaching time on cerium leaching rate |
图 4表明,铈浸出率随处理时间的延长而增加,在浸出时间为60 min时,铈回收率为99.37%,继续延长浸出时间,铈浸出率基本保持不变,确定优选浸出时间为60 min。
2.1.5 浸出温度取稀土抛光粉废料5 g,加入4 mol/L稀盐酸21 mL和0.2 g硫脲,在一定温度下搅拌浸出60 min。浸出温度对废料中铈浸出率的影响见图 5。结果表明,随着浸出温度的增加,稀土抛光粉废料中铈浸出率增大。当浸出温度从50 ℃增加到90 ℃时,铈浸出率从32.19%提高到99.37%。说明升高温度,有利于提高硫脲活性[21-22],促进Ce(Ⅳ)被还原,提高铈元素的浸出率。考虑到继续增加温度可能会造成盐酸快速挥发,因此确定优选的反应温度为90 ℃。
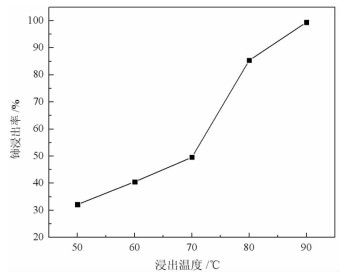 |
| 图 5 浸出温度对铈浸出率的影响 Fig.5 Effect of leaching temperature on cerium leaching rate |
2.2 浸出液中稀土元素的回收与稀土产品表征
对浸出液采用草酸沉淀-氧化焙烧回收稀土,同时,为认识稀土离子草酸沉淀焙烧分解的机制以及稀土氧化物产品的组成和性质,对稀土草酸沉淀物进行了热重分析,对稀土氧化物产品进行了粒度、XRD和SEM等分析与表征。
2.2.1 草酸沉淀-氧化焙烧回收稀土在盐酸浓度为4 mol/L、L/S为4.2、浸出温度90 ℃、浸出时间60 min、硫脲用量0.04 g/g给料的优选浸出条件下,获得铈含量为16.56 g/L的浸出液。浸出液经氨水调pH至1.8~2.0后,升温至80 ℃,缓慢加入草酸搅拌至沉淀析出,冷却后过滤得到稀土草酸沉淀,在管式炉和空气气氛下800 ℃焙烧稀土草酸沉淀2 h得到稀土氧化物产物[17, 19]。硫脲-稀盐酸还原浸出-草酸沉淀-氧化焙烧从稀土抛光粉废料中分离和回收稀土元素的工艺流程见图 6,铈和镧在各固体产品中的含量及其分布率也列于图 6中,最终所得稀土氧化物的成分分析结果见表 2。图 6和表 2表明,稀土氧化物产品主要由铈和镧的氧化物组成,其含量之和达到96.93%,如果氟也是以铈或镧化合物的形式存在,则稀土氧化物产品中稀土物种的总含量超过99%。以抛光粉废料为计算基准,稀土氧化物产品中铈的回收率达到91.66%,镧的为68.44%。与原料稀土抛光粉废料相比,稀土氧化物中铝、硅、钙等元素非常少,说明经过硫脲-稀盐酸还原浸出-草酸沉淀-氧化焙烧工艺处理,稀土抛光粉抛光玻璃制品过程中进入其中的杂质基本上被除干净,这为稀土抛光粉的循环利用提供了可能。
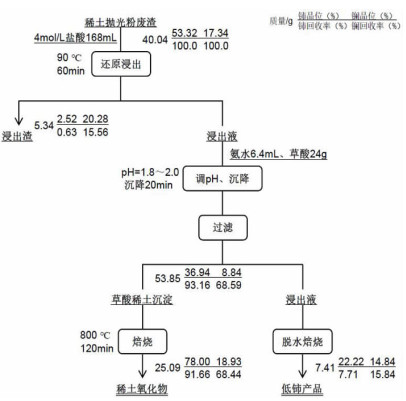 |
| 图 6 稀土抛光粉废料回收稀土元素数质量流程 Fig.6 Number and quality process of rare earth element recovery from rare earth polishing powder waste |
| 表 2 稀土氧化物产品的化学组成 Table 2 Chemical composition of rare earth oxide products |
|
2.2.2 稀土草酸沉淀热重分析
将制备的稀土草酸沉淀放入鼓风干燥箱中,在80 ℃下干燥2 h后,使用同步热分析仪,在升温速率为10 ℃/min、氧气流速为50 mL/min条件下进行热重分析,结果见图 7。图 7表明,稀土草酸盐的热分解主要有两个失重阶段:第一阶段,在200 ℃之前,水合稀土草酸盐会脱去9个结晶水分子,理论质量损失率为22.95%,见化学反应式(6),这与实际质量减少22.28%非常相近。第二阶段,从约200 ℃到400 ℃,无水稀土草酸盐分解形成稀土氧化物,化学反应见式(7)和(8),这表明,CO2的逸出和三价铈转化为四价铈造成的质量增加,一共造成理论质量损失率为29.03%,这与实际质量损失28.49%接近。在400 ℃之后,曲线基本为直线,表明试样热分解基本完成。稀土草酸盐的热分解过程总质量损失率为约50.77%,与理论损失率(51.98%)基本相符[23]。
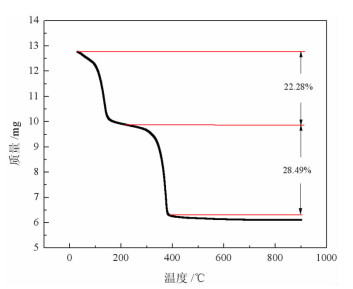 |
| 图 7 稀土草酸盐热分解曲线 Fig.7 Thermal decomposition curve of rare earth oxalate |
| $ \mathrm{RE}_{2}\left(\mathrm{C}_{2} \mathrm{O}_{4}\right)_{3} \cdot 9 \mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{RE}_{2}\left(\mathrm{C}_{2} \mathrm{O}_{4}\right)_{3}+9 \mathrm{H}_{2} \mathrm{O}(\mathrm{g}) $ | (6) |
| $ \mathrm{Ce}_{2}\left(\mathrm{C}_{2} \mathrm{O}_{4}\right)_{3}+2 \mathrm{O}_{2}(\mathrm{~g}) \rightarrow 2 \mathrm{CeO}_{2}+6 \mathrm{CO}_{2}(\mathrm{~g}) $ | (7) |
| $ 2 \mathrm{La}_{2}\left(\mathrm{C}_{2} \mathrm{O}_{4}\right)_{3}+3 \mathrm{O}_{2}(\mathrm{~g}) \rightarrow 2 \mathrm{La}_{2} \mathrm{O}_{3}+12 \mathrm{CO}_{2}(\mathrm{~g}) $ | (8) |
以去离子水为分散介质,稀土氧化物产品的粒度分布见图 8。图 8表明,制备的稀土氧化物产品的粒度分布较窄,d10、d50和d90分别为2.755 μm、9.073 μm和20.66 μm。若用作稀土抛光粉,其较窄的粒度分布有助于稀土氧化物抛光玻璃表面时减少划痕,获得光洁度较好的玻璃表面[24]。
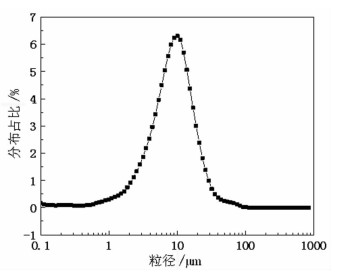 |
| 图 8 稀土氧化物产品粒度分布曲线 Fig.8 Particle size distribution curve |
2.2.4 X射线衍射分析
在温度25 ℃,以Cu Kα作为辐射源,扫描速度为8 °/min,扫描范围为10°~80°,获得的稀土氧化物样品的XRD(X射线衍射)见图 9。图 9(a)表明,稀土抛光粉废料中除二氧化铈外,还有镧的氧化物[25]和二氧化硅。而图 9(b)表明,制备的稀土氧化物产品主要由二氧化铈组成,未见二氧化硅的衍射峰。此外,La2O3的X射线衍射峰未出现在所制备的稀土氧化物中,可能与焙烧温度为800 ℃不利于La2O3晶面的生长有关[26-27],也可能是烧结过程中形成Ce0.8La0.2O2-δ结构导致La2O3的X射线衍射峰弱[28]。
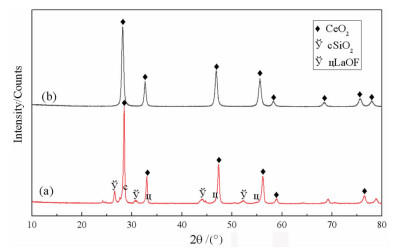 |
| 图 9 样品的XRD曲线:(a)稀土抛光粉废料,(b)稀土氧化物产品 Fig.9 XRD curves of samples : (a) rare earth polishing powder waste, (b) rare earth oxide products |
2.2.5 扫描电镜分析
稀土抛光粉废料和回收产品稀土氧化物的扫描电子显微镜图像分别见图 10(a)和(b)。图 10(a)表明,稀土抛光粉废料颗粒团聚明显,多呈椭圆状,大小不一,几乎没有棱角。而图 10(b)表明,所制备的稀土氧化物外观为长方体状,颗粒的表面平整,棱角分明,具有良好的抛光性能。并且,颗粒间无明显团聚现象,颗粒大小较均匀,可用于较精密玻璃器件的抛光,提高光洁度。
 |
| 图 10a 稀土抛光粉废料SEM图像 Fig.10a SEM images of rare earth polishing powder waste |
 |
| 图 10b 稀土氧化物产品SEM图像 Fig.10b SEM images of rare earth oxide products |
3 结论
采用硫脲-稀盐酸体系对稀土抛光粉废料中的稀土氧化物进行了还原浸出研究,获得了优选的浸出工艺条件:盐酸浓度为4 mol/L,L/S为4.2,浸出温度90 ℃,浸出时间60 min,硫脲用量0.04 g/g给料,该优选条件下铈浸出率达99.37%。
浸出液经氨水调pH至1.8~2.0,加入草酸沉淀,然后氧化焙烧稀土草酸沉淀,得到稀土氧化物产物,其中总REO含量约为97%,CeO2 78.00%,La2O3 18.93%,它们的回收率分别为91.66%和68.44%。激光粒度分析、XRD、SEM等研究表明,稀土氧化物产物粒度分布较均匀,主要为CeO2晶体,方形颗粒表面平整,棱角分明。
硫脲-稀盐酸还原浸出-草酸沉淀-氧化焙烧工艺处理稀土抛光粉废料得到稀土氧化物产品,这为稀土抛光粉废渣变废为宝创造了可能,也为稀土抛光粉的循环利用提供了技术途径。
与此同时,现有研究集中于铈元素的回收,对稀土抛光粉废渣中镧的回收涉及较少,稀土氧化物产品中镧的回收率较低。此外,虽然硫脲-稀盐酸还原浸出-草酸沉淀-氧化焙烧工艺得到的两个副产物浸出渣和低铈产品可以采用与现有稀土抛光粉废渣相似的方法填埋处理,但其中还有宝贵的稀土资源,其回收利用值得深入研究。再次,浸出-回收工艺研究中水的循环利用也有很多工作需要做,这些都是未来研究的重点。
| [1] |
BORRA C, VLUGT T, YANG Y, et al. Recovery of cerium from glass polishing waste: A critical review[J]. Metals, 2018, 8(10): 801-817. DOI:10.3390/met8100801 |
| [2] |
UM N, HIRATO T. A hydrometallurgical method of energy saving type for separation of rare earth elements from rare earth polishing powder wastes with middle fraction of ceria[J]. Journal of Rare Earths, 2016, 34(5): 536-542. DOI:10.1016/S1002-0721(16)60059-5 |
| [3] |
罗天纵, 吴希桃, 包新军, 等. 废弃稀土抛光粉回收再利用研究进展[J]. 稀土, 2020, 41(3): 95-104. LUO T Z, WU X T, BAO X J, et al. Research process in recovering and reutilizing of rare earth polishing powder wastes[J]. Chinese Rare Earths, 2020, 41(3): 95-104. |
| [4] |
OH M, NHO J, CHO S, et al. Polishing behaviors of ceria abrasives on silicon dioxide and silicon nitride CMP[J]. Powder Technology, 2011, 206(3): 239-245. DOI:10.1016/j.powtec.2010.09.025 |
| [5] |
BINNEMANS K, JONES P T, BLANPAIN B, et al. Recycling of rare earths: a critical review[J]. Journal of Cleaner Production, 2013, 51: 1-22. DOI:10.1016/j.jclepro.2012.12.037 |
| [6] |
MESHRAM P, ABHILASH. Recovery and recycling of cerium from primary and secondary resources- a critical review[J]. Mineral Processing and Extractive Metallurgy Review, 2020, 41(4): 279-310. DOI:10.1080/08827508.2019.1677647 |
| [7] |
李振民, 王勇, 牛京考. 中国稀土资源开发的生态环境影响及维护政策[J]. 稀土, 2017, 38(6): 144-154. LI Z M, WANG Y, NIU J K. The influence of rare earth resources exploitation on ecology and environment and the protection plicy[J]. Chinese Rare Earths, 2017, 38(6): 144-154. |
| [8] |
TING M H, SEAMAN J. Rare earths: future elements of conflict in asia[J]. Asian Studies Review, 2013, 37(2): 234-252. DOI:10.1080/10357823.2013.767313 |
| [9] |
涂雅洁. 废弃稀土抛光渣梯级循环利用的研究[D]. 武汉: 武汉理工大学, 2012. TU Y J. The study for step recycling of easte rare earth polishing powder[D]. Wuhan: Wuhan University of Technology, 2012. |
| [10] |
KIM J, KIM U, BYEON M, et al. Recovery of cerium from glass polishing slurry[J]. Journal of Rare Earths, 2011, 29(11): 1075-1078. DOI:10.1016/S1002-0721(10)60601-1 |
| [11] |
WANG L, LIU P, CHEN Y. Recovery of cerium oxide abrasive from an abrasive-glass polishing waste through alkaline roasting followed by water leaching[J]. Metals, 2020, 10(6): 752-767. DOI:10.3390/met10060752 |
| [12] |
刘晓杰, 于亚辉, 许涛, 等. 碱焙烧法从稀土抛光粉废渣中回收稀土[J]. 稀土, 2015, 36(4): 75-80. LIU X J, YU Y H, XU T, et al. Recovery of RE from waste RE polishing powder by Alkali roasting[J]. Chinese Rare Earths, 2015, 36(4): 75-80. |
| [13] |
ZOU D, LI H, DENG Y, et al. Recovery of lanthanum and cerium from rare earth polishing powder wastes utilizing acid baking-water leaching-precipitation process[J]. Separation and Purification Technology, 2021, 261: 118244. DOI:10.1016/j.seppur.2020.118244 |
| [14] |
罗磊. 从废弃稀土抛光粉中回收稀土金属的工艺条件研究[D]. 合肥: 合肥工业大学, 2015. LUO L. Technological conditions of recovering rare earth metals from an abandoned rare earth polishing power[D]. Hefei: Hefei University of Technology, 2015. |
| [15] |
POSCHER A, LUIDOLD S, ANTREKOWITSCH H. Extraction of cerium and lanthanum from spent glass polishing agent: rare earth elements symposium[C]. Montreal, 2013.
|
| [16] |
JANOŠ P, KURÁÑ P, EDERER J, et al. Recovery of cerium dioxide from spent glass-polishing slurry and its utilization as a reactive sorbent for fast degradation of toxic organophosphates[J]. Advances in Materials Science and Engineering, 2015(22): 1-8. |
| [17] |
LU S, SUN S, HUANG X, et al. Optimization of recovering cerium from the waste polishing powder using response surface methodology[J]. Green Processing and Synthesis, 2017, 6(2): 217-224. |
| [18] |
JING-YING L, XIU-LI X, WEN-QUAN L. Thiourea leaching gold and silver from the printed circuit boards of waste mobile phones[J]. Waste Management, 2012, 32(6): 1209-1212. DOI:10.1016/j.wasman.2012.01.026 |
| [19] |
SADRI F, RASHCHI F, AMINI A. Hydrometallurgical digestion and leaching of Iranian monazite concentrate containing rare earth elements Th, Ce, La and Nd[J]. International Journal of Mineral Processing, 2017, 159: 7-15. DOI:10.1016/j.minpro.2016.12.003 |
| [20] |
全国稀土标准化技术委员会. 稀土抛光粉化学分析方法第1部分: 氧化铈量的测定滴定法[S]. 北京: 中国标准出版社, 2012. National rare earth standardization technical committee. GB/T 20166.1-2012, Chemical analysis methods of rare earth polishing powder-Part1: Determination of cerium oxide content-Titrimetry[S]. Beijing: China Standard Press, 2012. |
| [21] |
赵林治, 杨书廷. 硫脲稳定性研究[J]. 河南师范大学学报(自然科学版), 1992(1): 98-102. ZHAO L Z, YANG S T. Study on the stability of thiourea[J]. Journal of Henan Normal University (Natural Science), 1992(1): 98-102. |
| [22] |
CALLA-CHOQUE D, LAPIDUS G T. Acid decomposition and silver leaching with thiourea and oxalate from an industrial jarosite sample[J]. Hydrometallurgy, 2020, 192: 105289. DOI:10.1016/j.hydromet.2020.105289 |
| [23] |
GABAL M A, ELROBY S A K, OBAID A Y. Synthesis and characterization of nano-sized ceria powder via oxalate decomposition route[J]. Powder Technology, 2012, 229: 112-118. DOI:10.1016/j.powtec.2012.06.017 |
| [24] |
李梅, 杨来东, 柳召刚, 等. 粒度及粒度分布对铈基稀土抛光粉性能影响的研究[J]. 稀土, 2016, 37(4): 144-147. L IM, YANG L D, LIU Z G, et al. The study of the ipact of particle size and particle size distribution of the Ce-based rare earth polishing powder on its performance[J]. Chinese Rare Earths, 2016, 37(4): 144-147. |
| [25] |
YU B, JIANG J, YANG C. Conversion of lanthanum and cerium recovered from hazardous waste polishing powders to hazardous ammonia decomposition catalysts[J]. Journal of Hazardous Materials, 2019, 379: 120773. DOI:10.1016/j.jhazmat.2019.120773 |
| [26] |
周筱桐, 肖汉宁, 刘井雄, 等. 草酸沉淀法制备稀土抛光粉及其抛光性能[J]. 机械工程材料, 2014, 38(8): 57-60. ZHOU X T, XIAO H N, LIU J X, et al. Preparation of polishing powders by oxalate deposition and its polishing performance[J]. Materials of Mechanical Engineering, 2014, 38(8): 57-60. |
| [27] |
ZHAN G, YU J, XU Z, et al. Kinetics of thermal decomposition of lanthanum oxalate hydrate[J]. Transactions of Nonferrous Metals Society of China, 2012, 22(4): 925-934. DOI:10.1016/S1003-6326(11)61266-1 |
| [28] |
ANJANEYA K C, NAYAKA G P, MANJANNA J, et al. Studies on structural, morphological and electrical properties of Ce0.8Ln0.2O2-δ (Ln=Y3+, Gd3+, SM3+, Nd3+ and La3+) solid solutions prepared by citrate complexation method[J]. Journal of Alloys and Compounds, 2014, 585: 594-601. DOI:10.1016/j.jallcom.2013.09.101 |
 2022
2022



