| 碳对石膏还原分解的影响 |
现今,钢铁烧结厂主要有3种脱硫技术:干法、半干法和湿法[1-7]。其脱硫技术的脱硫率大小为湿法技术>半干法技术>干法技术,湿法脱硫技术的脱硫效率最高,高于90%[8-11]。湿法脱硫技术中,石灰石-石膏法普遍为钢铁企业所采用,而钢铁企业脱硫过程产生的烟气脱硫石膏,由于其主要成分硫酸钙分解温度高、杂质成分复杂、水分含量高、石膏质量不均一、直接利用途径少等原因,几乎被堆存、搁置,未得到妥善的利用[12-17]。实际上,有不少学者开展大量的关于烟气脱硫石膏改性替代天然石膏的研究,以拓展石膏的利用途径。但总的来说,其改性成本较高,很难满足无害化、产量化利用。
对石膏无害化、产量化、高质化利用过程中,石膏分解的CaO可作为冶金助熔剂、水泥速凝剂、电石制造原料等,得以循环利用;石膏分解产生的SO2可作为硫酸原料,其用途广泛。石膏中的主要成分硫酸钙的分解一直是理论研究的难点。陈升等[18]发现当流化床温度为1 273~1 323 K,H2流量为242 mL/min时,有利于硫酸钙的分解;同时张安贵等[19]发现通入适量的CO还原气体时可降低硫酸钙的开始分解温度,促进硫酸钙分解。由此可见,控制体系中还原性气氛,有利于降低硫酸钙开始分解温度。苏航等[20-23]以焦炭为固体还原剂,添加到硫酸钙中,通过热重质谱联用分析,发现焦炭也能降低硫酸钙分解温度,同时体系反应温度对固体产物的物相生成也有较为明显的影响。
综上所述,目前缺乏石膏中硫酸钙的反应机理研究。本文提出通过高温XRD实验结合热力学结果分析,探讨了硫酸钙分解机理。
1 热力学计算通过热力学软件计算不同温度下各反应的△rGm和△rHm来分别判断体系反应是否能进行及其进行的条件和反应热,得到△rG随温度变化的曲线。碳和硫酸钙反应过程中可能涉及的反应包括:石膏脱水、硫酸钙分解、硫酸钙与碳发生固-固反应、碳的燃烧反应、副产气体一氧化碳与硫酸钙的反应、副产单质硫的反应、副产硫化钙的反应。
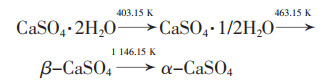
1.1 石膏自身分解的热力学计算脱硫石膏中的主要成分为CaSO4·2H2O,首先发生脱水过程得到硫酸钙。
1) 石膏的脱水过程
|
温度达到403.15 K时,石膏中结合水部分脱去,温度达到463.15 K时,结合水被完全脱去,得到硫酸钙。
2) 硫酸钙分解
脱硫石膏的主要脱水产物硫酸钙分解过程见式(1),该反应发生需要热力学温度达到1 936.49 K,反应困难。通过Factsage计算,得到在1 373.15 K下Ca-S-O的化学势,如图 1所示。
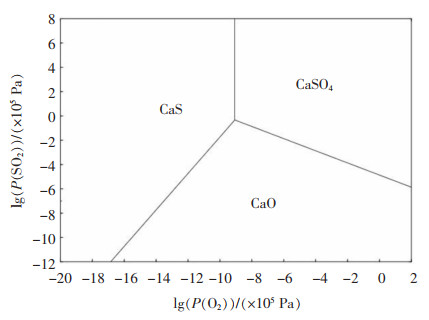 |
| 图 1 在1 373 K下Ca-S-O体系的化学势 |
由图 1可知,在稍低的O2和SO2压力条件下,CaSO4分解为CaO,而较低O2和较高SO2压力条件下,CaS稳定存在。研究表明,反应体系中通入少量的CO或H2还原气体,及加入少量还原剂碳,同时尽可能地降低SO2的分压,将促进脱硫石膏的分解。
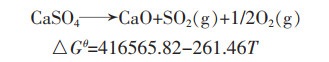
|
(1) |
式(1)中:△Gθ为吉布斯自由能,kJ/mol;T为反应温度,K。
1.2 碳与硫酸钙反应的热力学计算碳与硫酸钙可能发生的反应式如下:
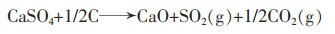
|
(2) |
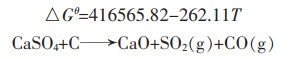
|
(3) |
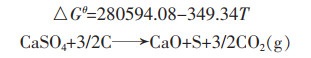
|
(4) |
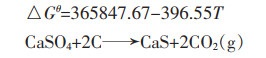
|
(5) |
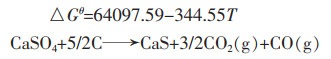
|
(6) |
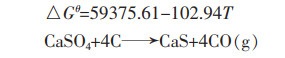
|
(7) |
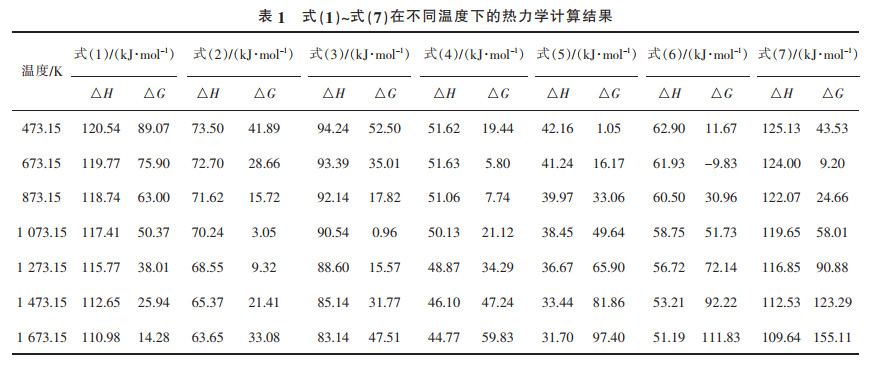
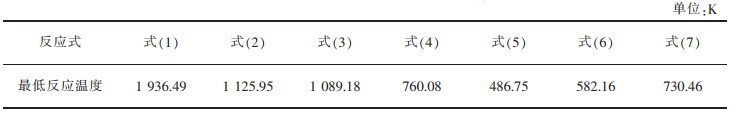
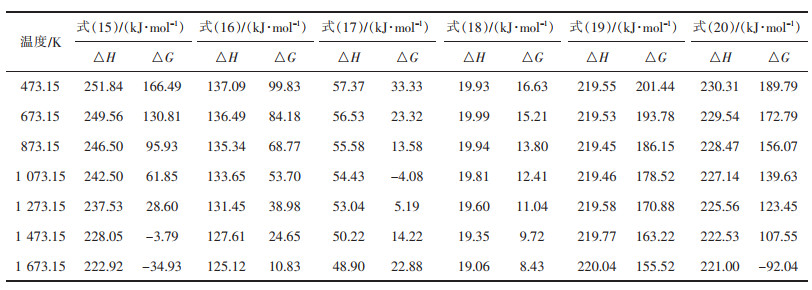
表 1为式(1)~式(7)在不同温度下的热力学计算结果。由表 1可知,温度范围内ΔrGm>0,从热力学角度分析,该反应不发生。经计算,式(1)在T>1 940 K时ΔrGm<0,硫酸钙才开始发生分解反应,且ΔrHm>0,属于强吸热反应。而在硫酸钙中添加不同含量的碳时,开始反应温度降低。结合表 1和图 2,得到式(1)~式(7)的最低反应温度,见表 2。添加碳后,硫酸钙分解温度至少降低约800 K。不难发现,当n(C)﹕n(CaSO4)的值在0~1.5之间时的开始反应温度高于n(C)﹕n(CaSO4)的值在2~4之间的开始反应温度,在高配碳条件下有利于降低硫酸钙分解温度,低配碳更有利于反应向氧化钙的生成方向进行。
|
|
表 1 式(1)~式(7)在不同温度下的热力学计算结果 |
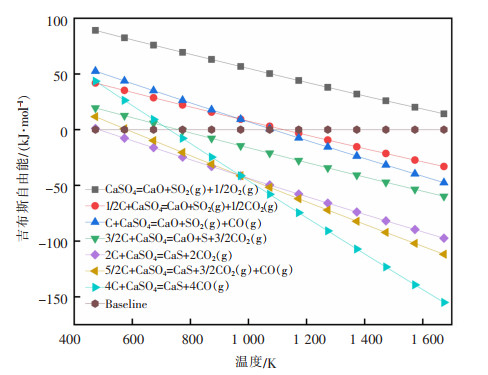 |
| 图 2 式(1)~式(7)的吉布斯自由能随温度的变化 |
|
|
表 2 式(1)~式(7)的最低反应温度 |
碳燃烧可能产生CO气体,气体可能参与的反应如下:

|
(8) |
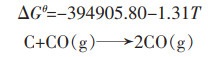
|
(9) |
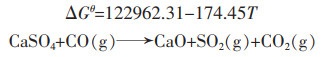
|
(10) |
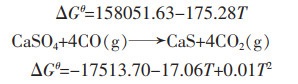
|
(11) |
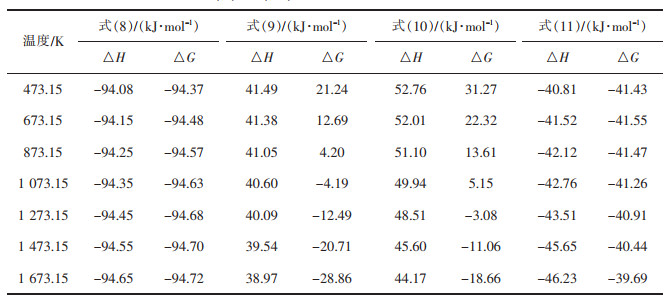
表 3为式(8)~式(11)在不同温度下的热力学计算结果,表 4为式(8)~式(11)的最低反应温度。由表 3,表 4可以看出,从热力学角度考虑,式(8)的ΔrGm<0,在T=1 700 K的范围内均处于图 3的ΔG=0的直线下,因此该反应在常温下就可发生,且ΔrHm<0,属于放热反应,释放大量的热。而式(9)则在T>974.15 K时ΔrGm<0,反应才能进行,且ΔrHm>0,属于吸热反应,该反应需碳过量且温度大于974.15 K才能进行。由于整个反应在氩气环境下,式(8)中的氧气由硫酸钙自身分解获得。式(10)当T>1 200 K时,ΔrGm<0,反应发生,且ΔrHm>0,属于吸热反应。而式(11),从热力学角度考虑,始终得到的ΔrGm<0,理论上,常温下就能发生反应,且属于放热反应。比较式(1)~式(7),式(11)反应更容易进行。由此可知,CO与CaSO4反应更容易生成CaS。而根据体系反应物,没有直接引入CO气体,反应中的CO需从碳的还原过程中获得。为获得更多的氧化钙,提高脱硫率,可采用降低碳的添加量来降低CO浓度,提高反应温度加快反应速率,使得反应向更容易生成氧化钙的方向进行。
|
|
表 3 式(8)~式(11)在不同温度下的热力学计算结果 |
|
|
表 4 式(8)~式(11)的最低反应温度 |
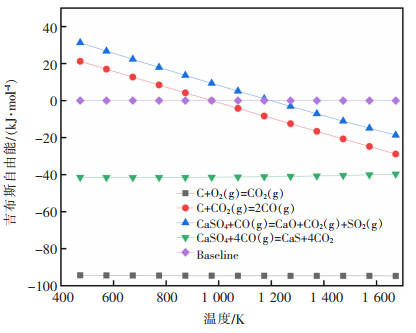 |
| 图 3 式(8)~式(11)的吉布斯自由能随温度的变化 |
结合上述结果,通过Factsage中Phase Diagram模块可得CaSO4-CO-CO2化学势,如图 4所示,当反应体系中P(CO)<101 Pa时,随着反应温度的增加,有利于体系中CaSO4向生成CaO的方向进行。当体系中P(CO)>101 Pa时,低温下容易生成CaS,随着温度升高,开始出现CaO和CaS共同存在区,当P(CO)降低时,CaS向CaO生成方向转化,并出现CaO平衡区。
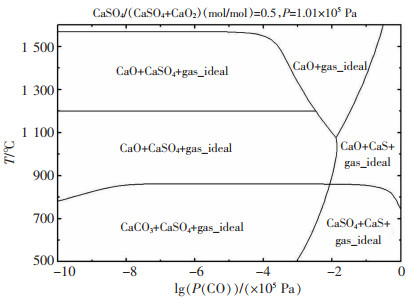 |
| 图 4 在不同温度和CO分压下CaSO4-CO-CO2体系的化学势 |
脱硫过程中由于碳含量导致的CO分压变化,反应过程中可能会有S单质生成,S单质可能发生的副反应如下:
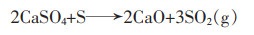
|
(12) |
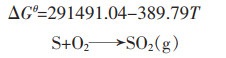
|
(13) |
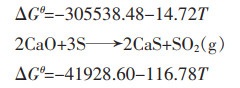
|
(14) |
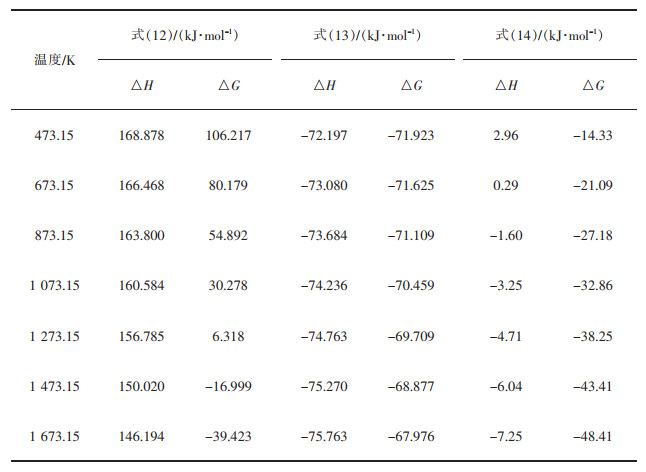
由表 5,表 6和图 5可知,当T>1 328.33 K的条件下,式(12)的ΔrGm<0,故该反应在高于1 328.33 K的条件下进行,且ΔrHm>0,属于吸热反应。式(13)和式(14)始终ΔrGm<0,该反应在室温下就可进行。由式(2)~式(7)不难看出,配碳量低时,式(2)~式(4)分解生成CaO和SO2,当n(C)﹕ n(CaSO4)=1.5时,有S单质生成,当n(C)﹕ n(CaSO4)=2,2.5,4时,体系CO气氛浓烈,产物中有CaS的生成。
|
|
表 5 式(12)~式(14)在不同温度下的热力学计算结果 |
|
|
表 6 式(12)~式(14)的最低反应温度 |
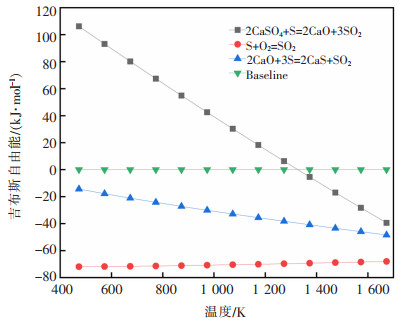 |
| 图 5 式(12)~(14)的吉布斯自由能随温度的变化 |
由于反应过程CO分压的增大,可能会有副产硫化钙的生成,硫化钙可能发生如下副反应:
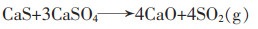
|
(15) |

|
(16) |
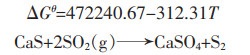
|
(17) |
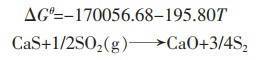
|
(18) |
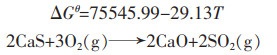
|
(19) |

|
(20) |
由表 7,表 8和图 6可以看出,当T<1 373 K时,式(15)和式(16)ΔrGm>0,该反应在热力学上不符合反应条件,该温度范围内不发生反应。当T<1 373 K时,式(17)ΔrGm<0,满足热力学条件,反应可以发生,ΔrHm<0,为放热反应。当T<1 373 K时,式(18)ΔrGm>0,不满足热力学条件,反应不发生。如图 6所示,式(19)和式(20)均处于ΔrGm=0线以下,即ΔrGm<0,在常温条件下均可发生反应,并且ΔrHm<0,为放热反应。因此,式(19)和式(20)比式(15)和式(18)更容易发生反应。通过控制副产物CaS的生成量,适当的氧气将减少CaS生成,因此在低配碳的条件下,适当的时间内通入一定量的氧气,有利于减少CaS的量。
|
|
表 7 式(15)~式(20)在不同温度下的热力学计算结果 |
|
|
表 8 式(15)~式(20)的最低反应温度 |
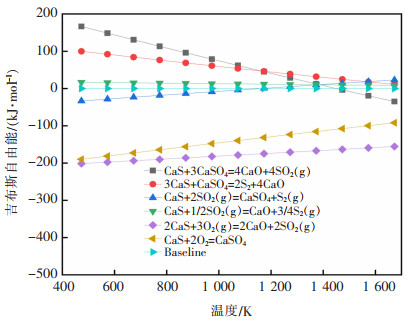 |
| 图 6 式(15)~式(20)的吉布斯自由能随温度的变化 |
基于热力学计算结果,设计高温XRD实验,通过对不同温度下物相变化情况,判断碳还原分解硫酸钙的过程机理。
2.1 实验原料本实验采用分析纯二水合硫酸钙(AR>99%)和纯石墨粉(AR>99%)作为实验原料,所有原料粒度小于75 μm。
2.2 实验过程试样的配制:首先将原料在100 ℃环境下进行烘干,然后按照实验配比通过混匀设备均匀混合,混匀时间为180 min,最后将混匀后的样品放置在真空保温箱中保温,用于后期实验。
原位高温X射线衍射仪:样品质量为300 mg,采用圆盘坩埚放样品,在氩气氛围中以10 ℃/min的速率从室温25 ℃升温至1 100 ℃。在600~900 ℃之间,每50 ℃保温10 min进行X射线衍射;900~950 ℃间,每10 ℃保温10 min进行X射线衍射;在950~1 100 ℃间,每50 ℃保温10 min进行X射线衍射,扫描速度均为10 °/min,扫描角度为10°~90°。设备如图 7所示。
 |
| 图 7 原位高温X射线衍射仪 |
图 8为25~910 ℃之间n(C): n(CaSO4)= 1的XRD结果,由图 8可知,硫酸钙加碳在25~910 ℃之间,C-CaSO4体系无新物相生成,产物中主要为C和CaSO4。
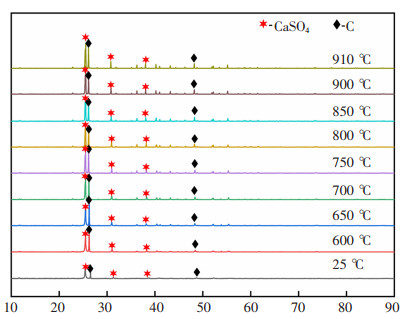 |
| 图 8 温度在25~910 ℃之间n(C)﹕n(CaSO4)=1的物相变化 |
图 9为920~1 100 ℃之间n (C)﹕n (CaSO4)=1的XRD结果,由图 9可知,当温度在920~1 100 ℃之间时,硫酸钙衍射强随着温度的增强逐渐减弱,同时在920 ℃时,出现新的CaO衍射峰,并且峰强随着温度的升高逐渐加强,整个反应温度下无CaS生成。该温度区间硫酸钙和碳发生式(2)和式(9)反应,结合热力学分析结果可知,反应过程中P(CO)<101 Pa。
 |
| 图 9 920~1 100 ℃之间n(C)﹕n(CaSO4)=1的物相变化 |
图 10为温度在25~900 ℃之间n(C)﹕n(CaSO4)=2的物相变化,由图 10可知,温度范围在25~900 ℃之间,产物中主要有C和CaSO4,硫酸钙未发生分解,无新物质生成。
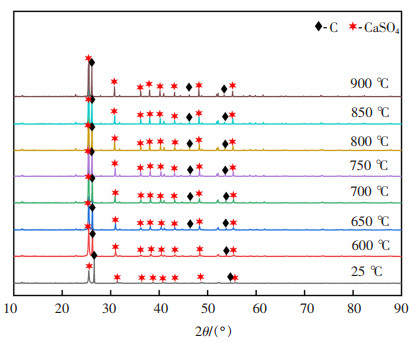 |
| 图 10 温度在25~900 ℃之间n(C)﹕n(CaSO4)=2的物相变化 |
图 11为温度在910~930 ℃之间n(C)﹕n(CaSO4)=2的物相变化,由图 11可知,当温度为910~950 ℃时,产物中主要有C,CaSO4和CaO,有新物相CaO生成,该温度区间有式(2)和式(9)反应发生,当CO达到一定浓度时,发生式(9)反应。
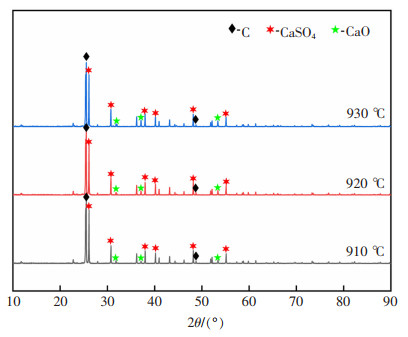 |
| 图 11 温度在910~930 ℃之间n(C)﹕n(CaSO4)=2的物相变化 |
图 12为温度在940~1 100 ℃之间n(C)﹕ n(CaSO4)=2的物相变化,由图 12可知,当温度为950~1 100 ℃时,产物中主要有C,CaSO4,CaO和CaS,有新物相CaS生成,CaO衍射峰强随着温度的升高不断加强,碳峰不断减弱,该温度区间发生式(2),式(3),式(5),式(7)和式(10)反应,当P(CO)>101 Pa时,式(11)反应发生,体系更有利于往生成CaS的方向进行。而温度再升高时,高温状态下更有利于氧化钙的生成反应,因此CaO的峰不断增强,直到硫酸钙在1 100 ℃被完全反应。
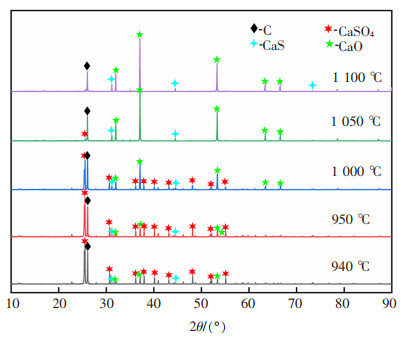 |
| 图 12 温度在940~1 100 ℃之间n(C)﹕n(CaSO4)=2的物相变化 |
通过热力学计算可知硫酸钙分解所需达到的热力学条件,然后通过热力学相图分析硫酸钙在还原体系下的平衡状态,最后通过高温XRD观察不同温度下体系中物相变化情况得到硫酸钙分解的机理,得到如下结论:
1) 通过对碳的副产物一氧化碳与硫酸钙反应的热力学计算,发现当温度达到1 199 K时,硫酸钙与一氧化碳生成氧化钙;通过硫单质与硫酸钙反应的热力学计算表明,在温度达到995 K时,硫单质可将硫酸钙还原成氧化钙和二氧化硫,该热力学计算结果可作为硫磺还原硫酸钙,降低硫酸钙分解能耗,减少温室气体排放,提高烟气二氧化硫浓度制备硫酸的理论依据,为硫酸钙分解提供新思路。
2)热力学结果表明,硫化钙极易被空气氧化成硫酸钙,因此在做硫酸钙分解生产硫化钙的相关研究时,注意产物应在隔绝氧气环境下降温。
3)在没加任何催化剂的情况下,硫酸钙发生分解的温度为1 936 K,加入碳后分解开始温度有很大幅度的降低。从热力学数据中可发现,硫酸钙与碳生成硫化钙所需温度比生成氧化钙的温度低,硫酸钙和碳反应更容易生成硫化钙。碳在反应过程中起到控制CO分压的作用,一定温度条件下,碳含量越低P(CO)越小,P(O2)越低,P(CO)<101 Pa时,有利于氧化钙的生成;碳含量越高,反应过程中P(CO)变大,当P(CO)>101 Pa时有利于硫化钙的生成。
| [1] |
CHEN Z, YOU C F, WANG H M, et al. A novel technical route based on wet flue gas desulfurization process for flue gas dehumidification, water and heat recovery[J]. Applied Thermal Engineering, 2020, 171: 115102. DOI:10.1016/j.applthermaleng.2020.115102 |
| [2] |
赵俊粟, 金圣博. 基于工业产值对二氧化硫排放控制的实证分析[J]. 化工管理, 2020(12): 22-23. DOI:10.3969/j.issn.1008-4800.2020.12.014 |
| [3] |
曹雪娇, 张廷安, 刘燕, 等. 臭氧强化氧化氧化锌法脱硫过程中产生的亚硫酸锌[J]. 有色金属科学与工程, 2020, 11(1): 1-7. |
| [4] |
QIAO Z L, WANG X C, GU H, et al. An investigation on data mining and operating optimization for wet flue gas desulfurization systems[J]. Fuel, 2019, 258: 116178. DOI:10.1016/j.fuel.2019.116178 |
| [5] |
曾勇, 苗应龙, 吴国明. 探究冶金行业烟气脱硫现状[J]. 世界有色金属, 2019(21): 4. DOI:10.3969/j.issn.1002-5065.2019.21.002 |
| [6] |
白凯凯, 张艾俊, 左海滨, 等. 优化配矿结构对烧结矿冶金性能的影响[J]. 有色金属科学与工程, 2019, 10(3): 1-5. |
| [7] |
闫军. 直供料模式下烧结矿质量变化对高炉的影响[J]. 江西冶金, 2019, 39(4): 27-30. |
| [8] |
苏晖. 石灰石膏法烟气脱硫技术在大气污染治理中的应用[J]. 环境与发展, 2019, 31(7): 86-87. |
| [9] |
张武刚. 新钢烧结配料整体优化程序的开发[J]. 江西冶金, 2018, 38(1): 42-44. |
| [10] |
丁振煌, 贺勤. 新钢烧结余热利用生产实践[J]. 江西冶金, 2018, 38(6): 5-9. |
| [11] |
程立国, 武岩鹏, 周铁柱. "钠钙双碱法"脱硫技术探析[J]. 有色金属科学与工程, 2011, 2(4): 16-20. |
| [12] |
SUN W Q, WANG Q, ZHOU Y, et al. Material and energy flows of the iron and steel industry: Status quo, challenges and perspectives[J]. Applied Energy, 2020, 268: 114946. |
| [13] |
张东方. 石灰-石膏脱硫工艺运行的关键技术指标和管理要点[J]. 砖瓦, 2020(4): 20-24. DOI:10.3969/j.issn.1001-6945.2020.04.008 |
| [14] |
ZHOU L, LIU Y, LUO L, et al. Improving the removal of fine particles by chemical agglomeration during the limestone-gypsum wet flue gas desulfurization process[J]. Journal of Environmental Sciences, 2019, 80: 35-44. DOI:10.1016/j.jes.2018.07.013 |
| [15] |
张曦. 提高2×360 m2烧结机碱度一级品率生产实践[J]. 江西冶金, 2018, 38(1): 21-24. |
| [16] |
陈沾金, 芦剑, 袁德良. 烧结用生石灰粉性价比探讨[J]. 江西冶金, 2016, 36(1): 9-12. |
| [17] |
杨志强, 熊良锋, 方林, 等. 利用烧结脱硫灰渣制备新型充填胶凝材料试验[J]. 有色金属科学与工程, 2015, 6(1): 8-12. |
| [18] |
陈升, 刘少文. 氢气还原分解硫酸钙的热力学研究[J]. 化学工业与工程技术, 2012, 33(5): 7-11. DOI:10.3969/j.issn.1006-7906.2012.05.002 |
| [19] |
张安贵, 穆林, 王社斌. 用废弃物脱硫石膏制备铁酸钙的基础研究[J]. 无机盐工业, 2019, 51(1): 62-66. |
| [20] |
宋伟明, 周建安, 李数, 等. 煤焦还原分解烧结烟气脱硫石膏的试验[J]. 钢铁, 2019, 54(11): 110-115. |
| [21] |
苏航, 左海滨, 赵骏. 石膏在高温下的分解脱硫研究[J]. 无机盐工业, 2019, 51(7): 68-73. |
| [22] |
焦楷, 郭凌波, 袁章福, 等. 冶金过程前端和末端相结合的焦炉烟气治理技术[J]. 江西冶金, 2019, 39(1): 1-4. |
| [23] |
张雪梅, 徐仁伟, 孙淑英, 等. 硫酸钙的还原热分解特性研究[J]. 环境科学与技术, 2010, 33(增刊2): 144-148. |
 2021, Vol. 41
2021, Vol. 41