| 钕铁硼二次废渣制备铁系产品路径探析 |
2. 遂川和创金属新材料有限公司, 江西 吉安 343900
2. Suichuan Hechuang Materials Co., Ltd., Ji'an 343900, Jiangxi, China
钕铁硼磁性材料因磁性强、质量轻、存储优异、体积小等优点,广泛应用于电子通信、能源环保、机械设备、医疗设备、电力系统、国防等领域[1-2]。钕铁硼磁性材料主要有烧结钕铁硼、粘结钕铁硼和注塑钕铁硼3种,其中,烧结钕铁硼的生产技术较为完善,仅在2021年我国钕铁硼磁体毛坯产量高达20.71万吨[3]。钕铁硼磁材废料的来源主要有2种渠道:制造磁材本身产生的废料;根据所要求的外形及使用途径进行加工和表面处理的过程中产生的废料,约占产出的25%,废料中含有稀土元素约33%,具有较高的稀土回收价值[4-5]。因此,对钕铁硼磁材废料的回收利用主要集中在稀土的回收,且技术也日趋成熟和完善。目前,主要通过盐酸、硫酸浸取钕铁硼废料,再通过萃取、沉淀等分离方式回收稀土,具体工艺主要有盐酸优溶法[6-8]、硫酸复盐法[9]、全萃取法[10]。酸浸工艺具有浸出率高、操作简单等优点,但会产生大量的污水与浸渣(主要含铁),严重污染环境,且处理成本高。有研究者陆续提出了渣金熔分法处理钕铁硼废料[11],但该方法还处于实验阶段,技术不够完善,离工业化生产还存在一定的距离。近年来,对钕铁硼废料回收稀土后的二次废渣的回收利用已成为研究的热点课题,宋宁等[12]以钕铁硼二次废料为原料制备锰锌铁氧体,在硫酸亚铁的净化阶段以分步沉淀的方式,利用铁屑将Fe3+还原为Fe2+,将Cu2+还原为铜单质;Al3+及大部分重金属离子的去除主要通过加入CaCO3将pH值设置为5~6;Co2+及残留重金属离子通过加入硫化铵生成硫化物沉淀而被去除;再通过加入NH4F以去除Ca2+、Mg2+,制得纯净的硫酸亚铁溶液。钟晓林等[13]将钕铁硼废料二次废渣经酸浸、净化除杂后,加入硫酸锰和硫酸锌,再用碳酸氢铵为沉淀剂制得锰锌铁氧体微粉;王兴尧等[14]采用盐酸全溶法与萃取、中和相结合的方法将钕铁硼二次废料中的有价元素进行综合回收利用,并制备出纳米氧化铁红。
与钕铁硼废料中稀土元素的回收相比,有关钕铁硼二次废渣综合利用的研究报道却较少。针对这种情况,本文结合钕铁硼二次废渣的物料特性,对利用钕铁硼二次废渣制备铁系化工产品的原理与路径进行了分析,以期为治理钕铁硼二次废渣污染、资源循环利用提供参考。
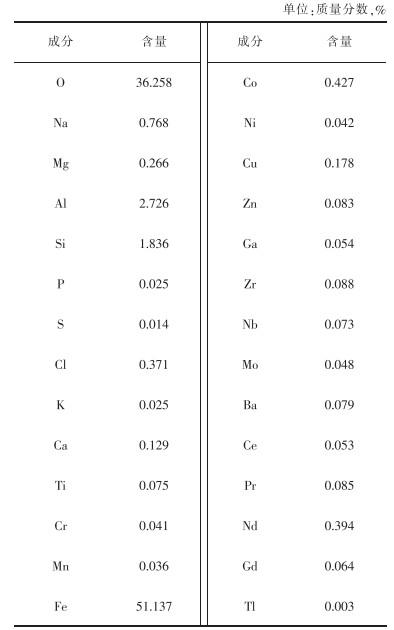
1 钕铁硼二次废渣的物相及化学组成目前,对钕铁硼废料的回收处理主要采用盐酸优溶法。该方法需先在回转窑中将钕铁硼废料进行有氧焙烧,尽可能将钕铁硼废料中的稀土和铁转化为Re2O3和Fe2O3,再用盐酸将Re2O3优先溶出进入浸出液,而大部分铁以Fe2O3的形式存在浸出渣中。浸出渣主要化学成分是Fe2O3,还含有少量的Si、Al、Ca、Mg、Cu、Mn、Co等元素。表 1所列为江西某金属制品有限公司钕铁硼二次废渣的成分。
|
|
表 1 钕铁硼二次废渣成分 |
为进一步了解废渣的物相组成,明确铁元素的存在价态,对二次废渣进行了X射线衍射(XRD)分析,结果如图 1所示。
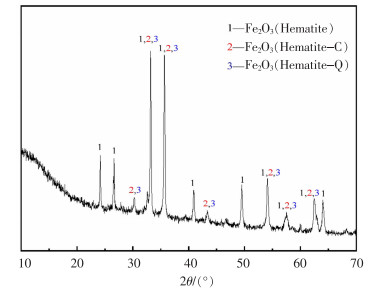 |
| 图 1 钕铁硼二次废料的XRD分析 |
由图 1可以看出,废料主要成分是赤铁矿和磁赤铁矿。由于稀土元素、钴元素的含量较少,对应化合物峰值较低,很难对稀土和钴进行区分,这与文献[15]报道一致。
2 钕铁硼二次废渣铁的回收工艺目前,对钕铁硼二次废渣回收铁的工艺研究较少,可参考钕铁硼废料回收铁的方法,如萃取法[16]、磁选分离法[7]、复盐沉淀法等对二次废渣中的铁进行回收[17]。但由于钕铁硼二次废渣中铁含量较高,常规工艺无法满足要求,需寻找更简单、绿色、低廉的回收方法。
通常碱性氧化物都能溶解于酸,但钕铁硼二次废渣中的铁氧化物在高温煅烧的情况下晶型会发生转变,导致反应活性降低,与酸反应极慢。另外,由于Fe3+盐溶解度小,且易发生水解反应,通常将Fe3+还原为Fe2+后,再利用酸浸提取铁。
2.1 焙烧—还原酸浸法从含铁废渣中回收铁的方法很多,如焙烧—磁选回收法、直接磁选法、还原熔炼法等。焙烧还原法操作简单,还原剂来源广泛,价格低廉。常规工艺是在钕铁硼二次废渣中添加20%(质量分数)的碳粉作为还原剂,5%(质量分数)的Na2CO3作为添加剂,在1 200 ℃条件下进行高温还原焙烧,铁还原率达到97.85%,再用硫酸溶液浸取还原烧渣中的铁元素,其反应如式(1)—式(3)所列。

|
(1) |
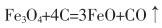
|
(2) |

|
(3) |
通过对二次废渣的物相分析可知,钕铁硼二次废渣矿物组成与赤铁矿类似,有研究者[18-19]分别用盐酸和硫酸处理废渣,用盐酸浸出的较优工艺条件:盐酸浓度为10 mol/L,浸取温度为80 ℃,浸取时间为150 min,铁的浸出率为95.1%;硫酸浸出时用20%(质量分数)的硫酸,当温度超过90 ℃时,铁的浸出率与浸出速度有明显上升。本课题组对钕铁硼二次废渣进行硫酸浸出试验:在浸出温度为80 ℃、硫酸浓度为11 mol/L、浸出时间为30 min的条件下,铁的浸出率达到90%。
综上,在适当的酸浸条件下,可高效地将铁进行分离提取,其中,酸的浓度与温度对提取率的影响最大。其原理是直接酸浸使Fe2O3转化为Fe3+从而进入溶液中,基本反应如式(4)所列。
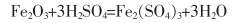
|
(4) |
将所得的硫酸铁溶液用铁粉或废铁屑进行还原,具体方法为:先测定酸浸液中铁和Fe2+的总浓度,铁的总浓度与Fe2+浓度差即为酸浸液中Fe3+的浓度。再根据反应计量关系计算出还原所需废铁屑的量,并通过分析检测还原液中Fe3+浓度变化计算还原率。从反应温度、反应时间、铁粉过量系数3个因素考察还原效果。结果表明,在还原温度为80 ℃、反应时间为120 min、铁粉过量系数为1.2的条件下,铁还原率为98.19%。
3 铁盐的制备钕铁硼二次废渣经酸浸提铁后,再经过进一步的纯化、结晶、转化可制备一系列铁系产品。下文以钕铁硼二次废渣为研究对象,论述铁系产品制备的方法和原理。
3.1 硫酸亚铁硫酸亚铁是应用范围较广的一种无机化工原料,在工业方面,是制备铁盐、聚合硫酸铁、铁系颜料等铁系化工产品的主要原料[20];在农业方面,可用于土壤调节剂[21];在污水处理方面,主要作为净水剂和工业污水除磷药剂[22-23]。
利用钕铁硼二次废渣制备硫酸亚铁的方法有两种,即硫酸浸取法和焙烧—还原酸浸法。
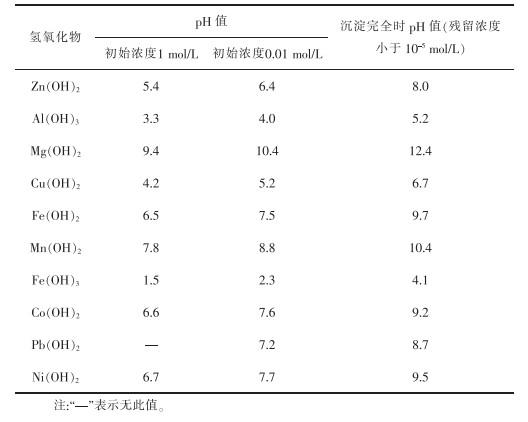
硫酸浸取法是直接用硫酸溶液浸取钕铁硼二次废渣,再调节浸取液的pH值,实现铁离子与其他金属离子分离。常见金属离子形成沉淀的pH值如表 2所列[8]。用一定浓度的硫酸溶液浸取钕铁硼二次废渣,所得浸出液的主要成分是Fe2(SO4)3,还有少量Al3+、Ca2+、Mg2+、Cu2+、Co2+等,再用CaO或CaCO3(用其他碱性物质均会导致溶液盐组分升高,从而会结晶析出)调节溶液的pH值为4,得到Fe(OH)3和CaSO4沉淀(可做高品质硫酸钙晶须原料),所得沉淀物直接用稀H2SO4溶解,过滤,得到纯度较高的Fe2(SO4)3溶液,用铁粉或铁皮还原可得到FeSO4溶液,经浓缩、冷却、结晶、真空干燥,最终得到纯度较高的硫酸亚铁,其工艺流程如图 2所示。
|
|
表 2 常见金属离子氢氧化物开始沉淀和完全沉淀时的pH值 |
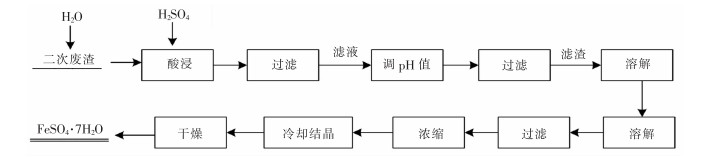 |
| 图 2 硫酸亚铁制备工艺流程 |
焙烧—还原酸浸法主要是用硫酸溶液浸取焙烧—还原烧渣得到硫酸亚铁溶液,再经进一步纯化除杂处理,得到纯度较高的硫酸亚铁。具体方法是先用CaCO3调节浸取液的pH值为5~6,去除Al3+和重金属离子Me2+,再加入硫化铵,去除Co2+、Cu2+等离子,反应如式(5)—式(10)所列。
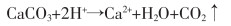
|
(5) |
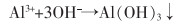
|
(6) |
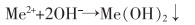
|
(7) |

|
(8) |

|
(9) |
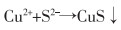
|
(10) |
经上述处理后,需向浸出液中加入氟化铵,做进一步深度净化[24-25],目的是去除Ca2+、Mg2+和Re3+,为了使Ca2+、Mg2+与F-充分反应及降低后序过滤处理的难度,净化除杂温度设置为80~90 ℃,反应时间为1~3 h,反应如式(11)—式(13)所列。

|
(11) |
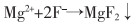
|
(12) |

|
(13) |
已有研究者利用结晶除杂制备高纯硫酸亚铁,张克宁等[26]研究表明,在溶解温度为60 ℃、结晶温度为10 ℃及pH值为2的条件下,利用3次结晶的方法可制得高纯硫酸亚铁。张娟[27]通过加入乙醇的方法,不但缩短了结晶时间,还获得了较高的产率。冷却结晶方式制备硫酸亚铁存在能耗高和收率低的缺点,本文利用溶析结晶技术制备硫酸亚铁,并对其进行系统的研究。从硫酸亚铁初始浓度、乙醇用量、结晶温度及操作条件等因素考察对结晶率的影响,结果表明,溶析温度为10 ℃、硫酸亚铁溶液浓度为200 g/L、乙醇与硫酸亚铁溶液体积比为1∶1,乙醇加入采取连续滴加方式,滴加速度为10 mL/min、搅拌速度为50 r/min、陈化时间为1 h,析晶率超过95%[28-29]。
3.2 聚合硫酸铁(PFS)聚合硫酸铁具有水解速度快、絮凝体密度大、pH值适应范围广、对设备的腐蚀性小、生产成本低等优点[30-32],是极为重要的一种水处理剂。聚合硫酸铁的制备主要以硫酸亚铁为原料,制备方法有废铁硫酸法、钢铁酸洗回收法、钛白副产物法[33]、硫铁矿烧渣酸浸还原法等[34-35]。制备的硫酸亚铁多通过直接氧化法转化为聚合硫酸铁。杨杰[36]以H2O2为氧化剂,在原硫酸亚铁与硫酸摩尔比为3∶1、反应温度为50 ℃、反应时间为3 h的条件下制得聚合硫酸铁;赵海鹏等[37]研究了以KClO3为氧化剂制备聚合硫酸铁。但上述方法存在氧化剂用量大、成本高及氧化剂带来的杂质残留问题,难以实现工业化生产。目前,工业生产聚合硫酸铁主要以NaNO2为催化剂、氧气或空气为氧化剂[38]。其反应如式(14)—式(16)所列。
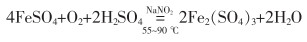
|
(14) |
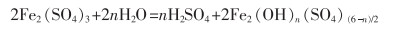
|
(15) |

|
(16) |
三氯化铁作为共价无机化合物,是重要的污水处理剂。主要被用作催化剂、氧化剂、氯化剂及作为锂离子电池正极材料——磷酸铁锂的铁源[39-40]。
利用钕铁硼二次废渣制备三氯化铁的方法:将焙烧—还原后的二次废渣直接用盐酸浸出,得到氯化亚铁溶液,此时铁以Fe2+的形式存在,加入氧化剂(H2O2及氯酸钠等)即可实现Fe2+与Fe3+的转化。经过滤、加热、加H2O2或NaClO3氧化、浓缩、冷却,最终得到FeCl3,主要反应如式(17)—式(18)所列。

|
(17) |

|
(18) |
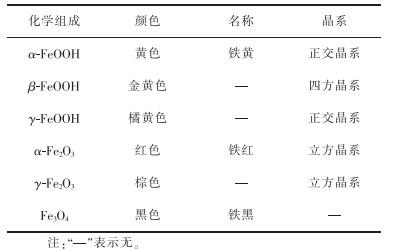
铁系颜料是极为重要的无机合成颜料,其产量仅次于钛白粉[41]。铁系颜料系铁的氧化物或氢氧化物,包括铁红、铁黄、铁黑、铁蓝、铁紫、铁绿和铁棕等。铁系颜料的化学组成及晶体结构形态如表 3所列。
|
|
表 3 铁系颜料的化学组成及晶体结构形态 |
铁系颜料着色力及遮盖力强,化学成分简单,稳定性高,价格低廉,无毒且色彩丰富,具有其他色彩颜料难以替代的优点,因此,用途广泛,需求量大。本文就常用的铁系颜料铁黄、铁红、铁黑展开论述。
4.1 铁黄目前,铁黄的制备方法主要是羟基铁氧化法[42],刘阳等[43]提出了一种改进方法,即目前工业上常用的方法。
利用钕铁硼二次废料制备铁黄最常用的方法是酸法,又称晶种法[44],是将NaOH溶液或氨水加入硫酸亚铁饱和溶液中,搅拌混合均匀,得到深绿色氢氧化亚铁沉淀,再通入空气,氧化得到胶体晶核,最后,在晶种悬浮液中加入铁皮和适量的硫酸亚铁并通空气得到氧化铁黄。具体工艺流程如图 3所示。
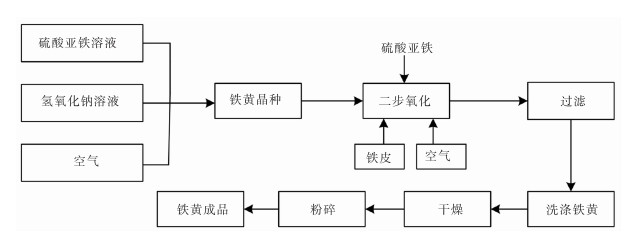 |
| 图 3 铁黄制备工艺流程 |
铁黄制备过程分两步[45-46],即晶种的制备和铁黄的合成。
第一步:晶种的制备。将浓度为10%~20%的氢氧化钠溶液加入40% FeSO4溶液中,调节pH值至4~5,在室温下通入空气,氧化时间为4~6 h,得到黄色晶种,反应如式(19)—式(20)所列。

|
(19) |

|
(20) |
第二步:铁黄的合成。在浓度为7%~10% FeSO4溶液中,加入第一步制得的晶种和精制铁,控制反应温度约为80 ℃,利用空气搅拌发生氧化反应直至生成铁黄。再进行压滤,洗涤,烘干,粉碎,得到产品。加入铁皮的目的是与FeSO4氧化过程中产生的硫酸反应,提供反应体系所需的亚铁离子,维持溶液的pH值,主要反应如式(21)—式(22)所列。

|
(21) |

|
(22) |
王兴尧等[14]以钕铁硼二次废料为原料制备了纳米氧化铁红;肖景波等[47]用沉淀分离的方法,回收钕铁硼二次废料中稀土和有价金属钴,同时制备出铁红,实现了钕铁硼二次废料的综合利用。以钕铁硼二次废渣制备的硫酸亚铁和铁黄为原料制备铁红的方法主要有绿矾煅烧法[48]和铁黄煅烧法[49]。
绿矾煅烧法:将钕铁硼二次废料还原焙烧后,用硫酸浸取制得绿矾(FeSO4·7H2O),绿矾在250~300 ℃的条件下转变为FeSO4·7H2O,粉碎后在700~800 ℃的温度下煅烧得到铁红。水洗去除水溶性杂质,干燥、粉碎后得到铁红产品,其反应如式(23)所列。
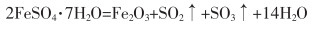
|
(23) |
铁黄煅烧法:制得铁黄后,经高温(200~300 ℃)煅烧直接转化为铁红。此方法制备的铁红呈针状结晶,纯度高,色泽好;吸油量、遮盖力、着色力均优于用绿矾煅烧制得的铁红。其反应如式(24)所列。

|
(24) |
铁黑分子式为Fe3O4或FeO·Fe2O3,具有饱和的蓝墨光黑色,着色力和遮盖力均较高,装饰和保护作用强,广泛应用于油漆、橡胶、建筑、化妆品等行业。制备铁黑的方法主要有中和沉淀法和氧化沉淀法。
中和沉淀法反应原理如式(25)所列。

|
(25) |
将Fe2+和Fe3+按1∶1.5(n/n)混合成一定浓度的溶液,再加入碱,在温度20~80 ℃及pH值大于7的条件下,高速搅拌,发生沉淀反应,过滤、洗涤、干燥,制得铁黑[50-51]。常用的碱有NaOH、NaCO3、NH4HCO3和NH3·H2O等,Fe3+来源于钕铁硼二次废料制得的铁黄和铁红。
以钕铁硼二次废渣制备的硫酸亚铁为原料[52-54],用氧化沉淀法制备铁黑反应原理如式(26)—式(29)所列。

|
(26) |
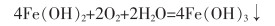
|
(27) |

|
(28) |
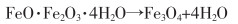
|
(29) |
在pH值约为3的硫酸亚铁溶液中,用NaOH中和至pH值约为7,溶液中部分Fe2+形成暗青色至绿色的Fe(OH)2沉淀物,通空气或氧气进行氧化,并保持pH值为5~6,使Fe(OH)2和Fe(OH)3发生共沉淀反应,蒸煮脱水,即可制得铁黑,其工艺流程如图 4所示。
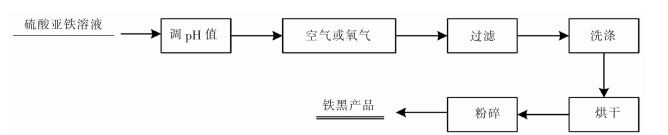 |
| 图 4 铁黑制备工艺流程 |
也可用铁黄还原方法制备铁黑。将合成得到的铁黄,在200~300 ℃下脱水,在300~400 ℃下用氢气还原处理得到铁黑。反应如式(30)—式(31)所列。
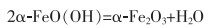
|
(30) |

|
(31) |
磁粉是磁性涂料的核心成分。铁基磁粉主要有:Fe3O4,γ-Fe2O3,α-Fe磁粉,其中Fe3O4是最早使用的磁粉材料之一,但因其稳定性差而逐渐被γ-Fe2O3取代。
一般氧化铁磁粉的制备方法是将铁黄在高温下煅烧,使α-FeOOH脱水生成α-Fe2O3,将α-Fe2O3还原得到Fe3O4,在200~250 ℃进行氧化可制得红褐色的γ-Fe2O3[55-56]。
磁粉的组成、晶体结构、形貌、大小分布及磁粉颗粒密实程度等都对磁粉的质量有较大影响。目前,改善磁粉性能(如包钴[57]、包硅等)已成为该领域的研究热点[58]。
5.2 铁粉铁粉是制备无水铁盐及其化合物的原料,还可用于催化剂、还原剂。直接还原钕铁硼二次废渣所制得的铁含有大量的杂质,因此,以钕铁硼二次废渣制得的铁红为原料,经高温通氢气还原制备铁粉。沈进杰等[59]用氧化焙烧—筛分—氢气还原—解碎—筛分工艺,在850 ℃的温度下氧化焙烧2.5 h,再升温至950 ℃通氢还原90 min,获得还原铁粉,其产品的物理化学及工艺性能指标均达到还原铁粉企业标准DTFHY300牌号的要求。
6 结论钕铁硼二次废渣是回收稀土后的固废物,对其合理利用既有利于保护环境,又有助于资源的再次回收利用。钕铁硼二次废料制备铁系产品是综合利用废渣的重要途径,通过对其原理和途径进行分析,得到以下结论:
1)钕铁硼二次废渣的化学成分主要是氧化铁,还含有少量的Ca、Mg、Si、Co、Cu、Al等元素,通过焙烧—还原酸浸和直接酸浸均可提取废渣中的铁元素,且处理过程简单,所用试剂较少,成本低。
2)焙烧还原酸浸提铁反应条件温和,无需再进行还原处理,且酸浸液易于净化,适合做透明氧化铁颜料、磁性铁氧体等高档用品的原料。直接酸浸还原提铁需要酸的浓度较大,酸浸液净化所需试剂较多,对制备高端的后续产品品质很难保证,适合做净水剂方面的产品。
3)利用钕铁硼二次废料酸浸—还原—溶析技术制备铁系产品工艺成熟,生产过程中每一产物既可做产品,又可做下一道工序的原料,市场领域广,经济效益高。
| [1] |
上海市稀土协会. 国内外稀土永磁材料发展研讨会召开[J]. 稀土信息, 2018(10): 22. |
| [2] |
冯瑞华, 姜山, 马廷灿, 等. 我国稀土永磁材料发展战略和建议[J]. 科技管理研究, 2012, 32(15): 164-167. |
| [3] |
中国稀土行业协会. 稀土行业运行报告——2020年及2021年1—4月稀土行业运行情况[J]. 稀土信息, 2021(6): 8-16. |
| [4] |
付利雯, 汪金良, 雷翔, 等. 钕铁硼废料资源化回收利用研究进展[J]. 有色金属科学与工程, 2020, 11(1): 92-97. DOI:10.13264/j.cnki.ysjskx.2020.01.015 |
| [5] |
刘晓杰, 许涛, 郝茜, 等. 钕铁硼磁性材料生产工艺及其废料综合利用的研究进展[J]. 稀有金属与硬质合金, 2014, 42(3): 48-53. |
| [6] |
VANDER HOOGERSTRAETE T, BLANPAIN B, VAN GERVEN T, et al. From NdFeB magnets towards the rare-earth oxides: a recycling process consuming only oxalic acid[J]. RSC Advances, 2014, 4(109): 64099-64111. DOI:10.1039/C4RA13787F |
| [7] |
刘博文. 废弃钕铁硼磁体中稀土金属的回收工艺研究[D]. 广州: 华南理工大学, 2019.
|
| [8] |
吴继平, 邓庚凤, 邓亮亮, 等. 从钕铁硼废料中提取稀土工艺研究[J]. 有色金属科学与工程, 2016, 7(1): 119-124. |
| [9] |
林河成. 从钕铁硼废料制取氧化钕的研究[J]. 有色冶炼, 1997, 26(3): 31-33. |
| [10] |
马莹, 赵永志. 钕铁硼废料回收方法研究进展[J]. 稀土信息, 2019(11): 11-15. |
| [11] |
卢小能, 邱小英, 张金祥, 等. 渣金熔分法从钕铁硼超细粉废料回收稀土和铁的工艺研究[J]. 中国资源综合利用, 2019, 37(1): 21-25. |
| [12] |
宋宁, 钟晓林, 龚斌, 等. 钕铁硼二次废渣微波加热制备锰锌铁氧体[J]. 稀有金属, 2008, 32(4): 454-458. DOI:10.3969/j.issn.0258-7076.2008.04.012 |
| [13] |
钟晓林, 宋宁, 龚斌. 用钕铁硼废料回收处理废渣制备Mn-Zn铁氧体微粉的研究[J]. 磁性材料及器件, 2007, 38(6): 57-60. |
| [14] |
王兴尧, 陈莉. 一种由钕铁硼二次废料制备纳米氧化铁红的方法: CN107055627B[P]. 2018-06-19.
|
| [15] |
吴冕. 钕铁硼磁性材料二次废料综合回收利用技术研究[D]. 合肥: 合肥工业大学, 2020.
|
| [16] |
陈云锦. 全萃取法回收钕铁硼废渣中的稀土与钴[J]. 中国资源综合利用, 2004, 22(6): 10-12. |
| [17] |
许涛, 李敏, 张春新. 钕铁硼废料中钕、镝及钴的回收[J]. 稀土, 2004, 25(2): 31-34. |
| [18] |
谢武明, 张宁, 李俊, 等. 酸浸出提取赤泥中铝和铁的工艺条件优化[J]. 环境工程学报, 2017, 11(10): 5677-5682. |
| [19] |
LIU Z R, ZENG K, ZHAO W, et al. Effect of temperature on iron leaching from bauxite residue by sulfuric acid[J]. Bulletin of Environmental Contamination and Toxicology, 2009, 82(1): 55-58. |
| [20] |
陈翔, 尹礼华, 熊怀忠, 等. 高温氧化分解硫酸亚铁制酸工艺研究[J]. 四川化工, 2022, 25(4): 28-31. |
| [21] |
MANZANO R, ESTEBAN E, PEÑALOSA J M, et al. Amendment application in a multi-contaminated mine soil: effects on soil enzymatic activities and ecotoxicological characteristics[J]. Environmental Science and Pollution Research International, 2014, 21(6): 4539-4550. |
| [22] |
卫艳新, 侯曼玲. 聚磷硫酸铁絮凝剂的制备及其应用[J]. 精细化工中间体, 2006, 36(3): 31-33. |
| [23] |
GEORGIOU D, AIVAZIDIS A, HATIRAS J, et al. Treatment of cotton textile wastewater using lime and ferrous sulfate[J]. Water Research, 2003, 37(9): 2248-2250. |
| [24] |
唐谟堂, 杨声海, 彭长宏, 等. 矿物共沉法制取低功耗软磁铁氧体扩大试验研究[J]. 磁性材料及器件, 2003, 34(6): 23-25, 29. |
| [25] |
张保平, 唐谟堂, 杨声海. 共沉淀法制备锰锌软磁铁氧体前躯体共沉过程中钙、镁深度脱除的热力学分析[J]. 湿法冶金, 2003, 22(4): 200-203. |
| [26] |
张克宇, 吴鉴, 高腾飞, 等. 结晶法提纯钛白副产硫酸亚铁的数学模型与实验研究[J]. 高校化学工程学报, 2016, 30(2): 371-377. |
| [27] |
张娟. Fenton铁泥制备硫酸亚铁和聚合硫酸铁及其应用研究[D]. 南宁: 广西大学, 2013.
|
| [28] |
付海阔, 钟晖, 吴理觉, 等. 溶析结晶法制备硫酸钴的实验研究[J]. 矿冶工程, 2020, 40(6): 87-90. |
| [29] |
LI X, YIN Q X, ZHANG M J, et al. Process design for antisolvent crystallization of erythromycin ethylsuccinate in oiling-out system[J]. Industrial & Engineering Chemistry Research, 2016, 55(27): 7484-7492. |
| [30] |
龚竹青, 刘立华, 郑雅杰, 等. 固体聚合硫酸铁的制备及对生活污水的处理[J]. 工业水处理, 2003, 23(9): 31-34. |
| [31] |
黄英, 王利, 黄永辉, 等. 聚合硫酸铁对化学镀Ni-P废液的处理[J]. 水处理技术, 2008, 34(2): 76-78. |
| [32] |
贺仁星, 郑雅杰, 龚竹青. 絮凝剂聚合硫酸铁的制备与应用[J]. 环境科学与技术, 2004, 27(增刊1): 146-149. |
| [33] |
郑雅杰. 硫铁矿烧渣制备聚合硫酸铁和聚磷硫酸铁新工艺及基础理论研究[D]. 长沙: 中南大学, 2002.
|
| [34] |
冯俊瑜. 用硫酸烧渣制取硫酸亚铁[J]. 化工环保, 1994, 14(5): 311-312. |
| [35] |
孙石, 宋平, 郑小明. 硫铁矿烧渣制备硫酸亚铁的研究[J]. 化工环保, 1999, 10(4): 227-229. |
| [36] |
杨杰. 氧化法制备聚合硫酸铁工艺的优化及应用研究[J]. 当代化工, 2019, 48(8): 1730-1732. |
| [37] |
赵海鹏, 洪建功, 苏瑞敏, 等. 制备新型环保聚合硫酸铁(PFS)的技术探讨[J]. 漯河职业技术学院学报, 2018, 17(5): 20-22. |
| [38] |
李思扬. 聚合硫酸铁絮凝剂的制备及应用条件研究[J]. 广东化工, 2018, 45(12): 77-78. |
| [39] |
王敏娟. 一种新型锂离子电池负极材料MgS的制备及其电化学性能研究[D]. 杭州: 浙江大学, 2014.
|
| [40] |
YANG S F, WEN Y, YI P, et al. Effects of chitosan inhibitor on the electrochemical corrosion behavior of 2205 duplex stainless steel[J]. International Journal of Minerals, Metallurgy, and Materials, 2017, 24(11): 1260-1266. |
| [41] |
王敏. 氧化铁颜料在建材业中的应用[J]. 山东建材, 2004(4): 54-56. |
| [42] |
GILES W H, WILSON H A. Improvements relating to the manufacture of iron oxide pigments and polishing materials[P]. GB1813324, 1924-7-29.
|
| [43] |
刘阳, 王红. 以尿素为沉淀剂制备超细α-Al2O3粉体[J]. 陶瓷学报, 2009, 30(1): 64-68. |
| [44] |
熊玉梅, 周晓东, 胡黎明. 滴加法制备超细α-FeOOH的工艺过程研究[J]. 华东理工大学学报(自然科学版), 1996, 22(5): 541-547. |
| [45] |
李春忠, 陈军, 陈劲松, 等. 酸法合成针形超微粒α-FeOOH过程研究Ⅰ. 晶种制备[J]. 华东理工大学学报(自然科学版), 1995, 21(6): 670-674. |
| [46] |
KOGA N, TAKEMOTO S, NAKAMURA T, et al. A kinetic study of the thermal decomposition of iron(Ⅲ) oxide-hydroxides. Part 3.Shape control and thermal decomposition of α-FeO(OH)[J]. Thermochimica Acta, 1996, 282/283: 81-90. |
| [47] |
肖景波, 陈居玲, 夏娇彬. 一种钕铁硼废料酸浸渣的综合利用方法: CN105734296B[P]. 2017-10-31.
|
| [48] |
孙德慧, 张吉良. 氧化铁红制备工艺进展[J]. 贵州化工, 2000, 25(3): 7-9. |
| [49] |
SESIGUR H, ACMA E, ADDEMIR O, et al. The preparation of magnetic iron oxide[J]. Materials Research Bulletin, 1996, 31(12): 1573-1579. |
| [50] |
程士哲. 钛白粉厂生产中副产硫酸亚铁和钛废液的综合利用[J]. 矿产综合利用, 1993(5): 36-40. |
| [51] |
邹月飞. 用酸洗废液生产氧化铁系颜料[J]. 现代化工, 1989, 9(6): 34-36. |
| [52] |
WERNER O, HENNING W, ROLAND B. Preparation of Magnetite Pigments Control of Particle Size[P]. 美国: US4702775, 1986-06-25.
|
| [53] |
JAKOB R, FRANZ H, INGO P. Production of black iron oxide pigments[P]. 美国: US4090888, 1978-05-23.
|
| [54] |
KATSUYUKI T. Manufacture of Magnetite Ultrafine Particle by Oxidation of Ferrous Compound[P]. 日本: JP2002160925, 2002-06-04.
|
| [55] |
李文融, 屠德容. 无极(NP)磁粉性能与制备[J]. 化工新型材料, 1994, 22(8): 1-5, 9. |
| [56] |
邝生鲁. 现代精细化工高新技术与产品合成工艺[M]. 北京: 科学技术文献出版社, 1997.
|
| [57] |
袁伟, 金鑫, 谢进. γ-Fe2O3磁粉的包钴工艺研究[J]. 精细化工, 1997(1): 31-35. |
| [58] |
PRENE P, TRONC E, JOLIVET J P, et al. Magnetic properties of isolated gamma-Fe/sub 2/O/sub 3/particles[J]. IEEE Transactions on Magnetics, 1993, 29(6): 2658-2660. |
| [59] |
沈进杰, 孙炳泉, 高春庆, 等. 铁红制取还原铁粉试验[J]. 金属矿山, 2019(6): 204-208. |
 2023, Vol. 43
2023, Vol. 43