| NaCl-KCl熔盐中TiB2阳极溶解和电化学还原行为研究 |
钛及其合金具有耐腐蚀性强、密度低、强度高等优良的物理化学性能,被广泛应用于航空航天、国防军工和医疗设备等领域[1-4]。目前工业金属钛主要通过Kroll工艺[5]提取,主要包括碳热氯化制备TiCl4、镁热还原制备金属钛和氯化镁电解金属镁3个步骤,存在生产成本高和环境污染严重等问题[6-7],制约了钛的大规模应用。
熔盐电解法被认为是最有希望替代Kroll法的低成本、清洁钛冶炼技术,近年来相关研究主要集中于阴极二氧化钛电还原(如FFC[8]、OS[9]等)和可溶性钛化合物阳极电解(如USTB[10-11])。特别是,USTB法是一种连续、绿色的提钛工艺,在能耗和成本方面具有显著优势。在USTB工艺中,可溶性碳氧钛(TiOxCy)阳极被电化学氧化,产生的低价钛离子溶解进入熔盐,并迁移至阴极电化学还原为金属钛,同时CO在阳极析出。
TiB2具有良好的导电导热性,在室温下其电阻率与纯铁的电阻率相近,为1.5×10-5 Ω·cm,导热率为25 W/(m·K)[12],目前对于TiB2在熔盐电解过程中阳极行为和电化学还原的研究还鲜有报道。基于USTB工艺,本文使用TiB2代替Ti-C-O可溶性阳极,探究了TiB2在NaCl-KCl熔盐中作为可溶性阳极的可行性,并进一步研究TiB2阳极的电化学溶解机理。
1 实验试剂和器材 1.1 熔盐准备采用分析纯无水NaCl和KCl作为熔盐,购自上海阿拉丁生化科技股份有限公司。将含有100 g NaCl和KCl(摩尔比为1∶1)的氧化铝坩埚放入立式管式电阻炉等温加热区内,以50 cm3/min的流速通入干燥氩气(99.99 %)吹扫炉体内残留空气。在200 ℃下真空除水10 h,随后在氩气保护下加热至750 ℃保温1 h,之后,将电极缓慢浸入熔融电解质中,进行后续测试。
1.2 电极准备三电极测试体系中,使用自制Ag/AgCl参比电极,经校准后,Ag/AgCl的电位相对于Cl2/Cl-为-1.08 V。对电极为直径10 mm的石墨棒。用线切割将烧结成型的TiB2(密度为4.28 g/m3,纯度可达99.5%)加工成10 mm×60 mm×5 mm块体,用铁丝将TiB2块体与不锈钢杆连接作为工作电极。玻璃碳棒(ϕ3 mm)、Ti丝(ϕ0.5 mm)、Pt丝(ϕ0.5 mm)作为对比工作电极。恒电流电解采用两电极体系,TiB2(10 mm×60 mm×5 mm)作为阳极,镍片(30 mm×5 mm×0.5 mm)为阴极。
1.3 电解和测试装置使用PARSTAT 4000A电化学工作站进行电化学测试。在开路电压到高于0的电位范围内进行线性扫描(LSV)测试。以50 mV/s的扫描速率进行循环伏安和方波伏安测试,其中方波伏安振幅为25 mV,频率为15 Hz。恒电流电解时,阳极电流密度设定为0.25 A/cm2,阴极电流密度为0.3 A/cm2。
采用Kratos AXIS SUPRA X射线光电子能谱仪(XPS,英国Kratos)和Agilent 7700电感耦合等离子体光谱(ICP,美国安捷伦)分析电解后熔盐中硼和钛存在形态;采用配备EDS的JSM-6480LV扫描电子显微镜(SEM,日本JEOL)表征阴极电解产物。
2 结果与讨论 2.1 TiB2溶解行为采用线性扫描法测试了TiB2在NaCl-KCl熔盐中的阳极极化曲线。为进行比较,在相同条件下测试了Pt电极阳极极化曲线。如图 1所示,以Pt丝作为工作电极,从开路电位进行线性伏安扫描,扫描速率为50 mV/s,在电位约为-0.45 V(vs. Cl2/Cl-)时,电流密度开始明显增大,此时Pt电极上主要发生氯气析出反应。然而,当以TiB2为工作电极时,在-1.16 V(vs. Cl2/Cl-)电位时,电流密度就开始快速增大,此时未检测到氯气产生,说明TiB2发生了电化学溶解。因此,TiB2作为可溶性阳极具有可行性。
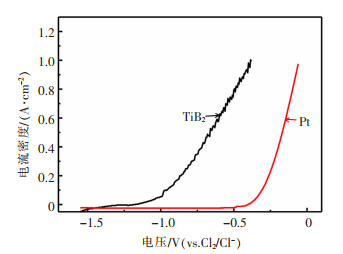 |
| 图 1 750 ℃时,TiB2和Pt电极在NaCl-KCl熔盐中阳极极化曲线 |
基于线性扫描结果,TiB2在NaCl-KCl熔盐中可发生阳极电化学溶解。因此,TiB2有望作为可溶性阳极电解提取金属钛。为了明确TiB2阳极电化学溶解和钛离子阴极电沉积过程和机理,以TiB2作为可溶阳极,在NaCl-KCl熔盐中,采用0.25 A/cm2的阳极电流密度进行恒电流电解。图 2显示了相应的电解时间-电压关系,可以看出在电解初始4 h,槽电压较大,随电解时间缓慢降低,当电解时间进一步延长,槽电压快速降低,电解达到8 h后,又趋于稳定。由于电解开始前熔盐中不含低价钛离子,尽管电解初期钛离子从阳极溶解进入熔盐,但浓度较低,浓差极化大,钛阴极电沉积过电位大,导致槽电压大。当电解一定时间后,钛离子在熔盐中积累到一定程度,阴极电沉积动力学显著改善,浓差极化和钛电沉积过电位明显降低,因此槽电压也显著降低[13]。插图为阳极在电解前后的光学照片对比,可以看出,电解后TiB2发生了明显消耗,由电解前的10.62 g减少为7.91 g,质量消耗率为0.27 g/h。
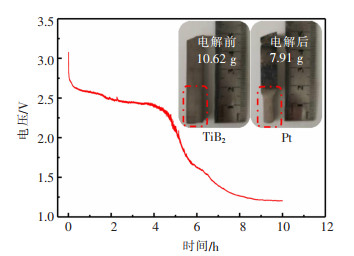 |
| 图 2 0.25 A/cm2恒电流电解时间-电压曲线 |
为了探讨TiB2电化学溶解机理,对电解前后的NaCl-KCl熔盐进行循环伏安测试,结果如图 3所示。以玻璃碳电极作为工作电极,Ag/AgCl为参比电极,石墨棒为对电极,在未进行TiB2电解的空白盐中进行循环伏安扫描,扫描速率为50 mV/s。从开路电位-1.08 V(vs. Cl2/Cl-)向负电势方向扫描至-3.58 V(vs. Cl2/Cl-)后正向扫描至0.42 V(vs. Cl2/Cl-),最后返回开路电位-1.08 V(vs. Cl2/Cl-),形成一个闭环。从图 3(a)中可以看出,当负向扫描至约-2.5 V(vs. Cl2/Cl-)电位处,开始出现还原电流并随着电位负移逐渐增大,这可能归因于熔盐中碱金属的电化学还原行为;当正向扫描至约0.1 V(vs. Cl2/Cl-)时,开始出现氧化电流并随着电位正移急剧增加,这是由氯气析出反应造成的。在-2.0~-0.5 V(vs. Cl2/Cl-)的电位范围内,没有任何氧化还原峰出现。TiB2恒电流电解10 h后,对NaCl-KCl熔盐进行相同条件的循环伏安扫描,从图 3(b)中可以看到,出现了2对氧化还原峰(R1,O1)和(R2,O2)。因此,可以推断,TiB2阳极恒电流电解过程中,溶出的钛离子是导致出现2对氧化还原峰的根本原因。在-1.72 V和-1.59 V(vs. Cl2/Cl-)电位处出现的2个还原峰,应该对应于溶解钛离子的两步还原反应。
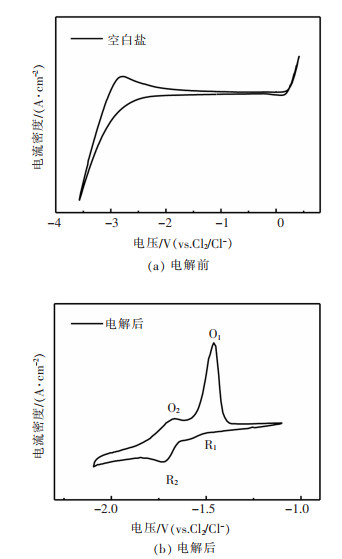 |
| 图 3 TiB2电解前和电解后的NaCl-KCl熔盐的循环伏安测试 |
为了进一步明确从TiB2阳极溶解的钛离子价态,在与循环伏安测试相同条件下,进行方波伏安测试。从图 4中可以看到,在R1(-1.63 V(vs. Cl2/Cl-))和R2(-1.80 V(vs. Cl2/Cl-))出现2个还原峰,并且电位位置与循环伏安曲线的2个还原峰相近。同时对测得的方波伏安曲线进行高斯拟合,计算曲线的半峰宽,由公式(1)确定电子转移数:
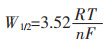
|
(1) |
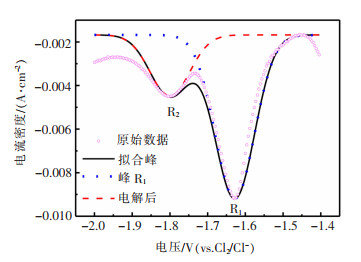 |
| 图 4 TiB2电解后,NaCl-KCl熔盐的方波伏安测试 |
公式(1)中:R为理想气体常数,J/(mol·K);T为绝对温度,K;F为法拉第常数,C/mol;n为电子转移数,个。
经计算,峰R1电子转移数为1.32,峰R2电子转移数为2.02。因此,可以确定,在TiB2阳极电解过程中,钛主要以Ti3+溶解到NaCl-KCl熔盐中,然后迁移至阴极,通过以下两步过程电还原为金属钛。
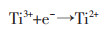
|
(2) |
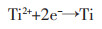
|
(3) |
为了了解TiB2电解过程B的去向,对电解后TiB2阳极表面熔盐、电解后坩埚内的熔盐(取于坩埚熔盐上层)和电解过程中挥发的熔盐分别进行XPS分析,检测元素为B和Ti。结果如图 5所示,在B元素的谱线中,TiB2阳极表面熔盐出现2个峰。虽然B单质(B 1s,B,187.30 eV)和TiB2(B 1s,TiB2,187.50 eV)[14-15]的峰位置比较相近不易区分,但对应的Ti元素谱线几乎未检测到TiB2的衍射峰,所以可以确定,在187.30 eV位置所对应的物质为B单质,而另一个峰为B2O3[15]的衍射峰。另外,在电解后坩埚内的熔盐和电解过程中挥发的熔盐中均检测到B2O3衍射峰。尽管电解过程一直处于氩气气氛下,但在实际电解过程中,难除净的空气中微量氧,极易将B氧化为B2O3,因此,在XPS分析中检测到B2O3。电解后坩埚内熔盐对应的Ti元素谱线显示,主要物质为Ti3+,这与之前的循环伏安和方波伏安测试结果一致。电解过程中挥发熔盐中仅检测到B2O3。对挥发熔盐进行ICP检测,发现B元素和Ti元素含量分别为1.40%和0.06%,进一步说明了挥发盐中硼元素主要是B2O3。由此可以得到,阳极TiB2中的B组分被氧化为单质B,成为阳极泥。同时,部分单质B被进一步氧化为B2O3,挥发进入尾气。
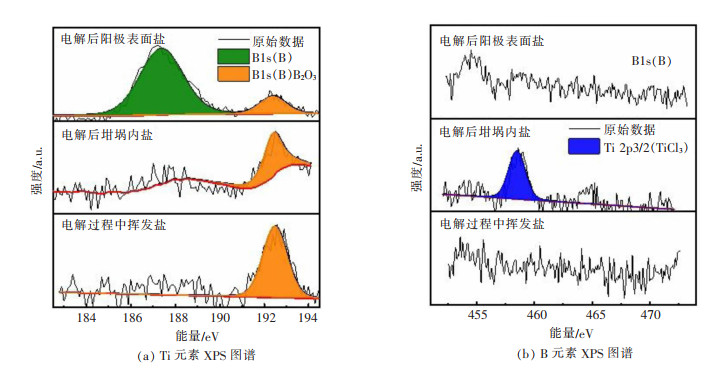 |
| 图 5 电解后阳极表面盐、坩埚内盐和电解过程中挥发盐的XPS图谱 |
以TiB2为阳极和镍片为阴极,在0.3 A/cm2阴极电流密度下恒电流电解6 h,见图 6。电解结束后,清洗阴极表面残余盐分,烘干后进行分析检测。图 6(a)显示了恒电流电解后阴极镍片表面的结构和形态,可以看出阴极镍片表面的沉积层致密且平整。EDS点扫描(图 6(b))和面扫描(图 6(c)和图 6(d))证实沉积层为钛元素。研究结果说明以TiB2为可溶阳极,可以电解提取金属钛。
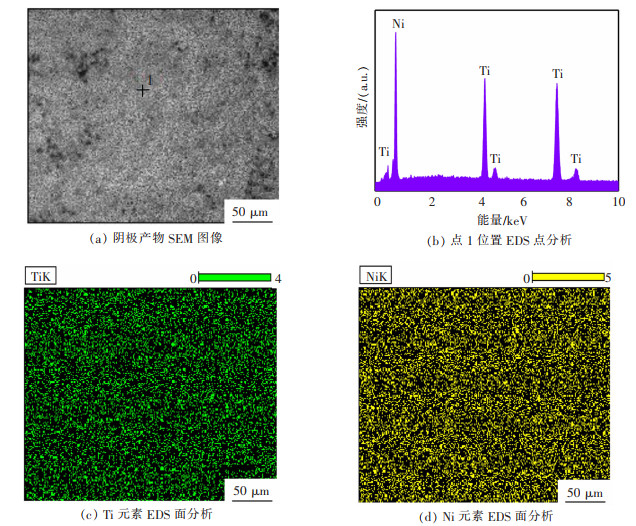 |
| 图 6 以TiB2为可溶性阳极,0.3 A/cm2电流密度下阴极电解产物 |
本文提出了以TiB2为可溶性阳极,熔盐电解提取金属钛的思路。得出以下结论:
1)在无水NaCl-KCl共晶熔盐中,750 ℃下电解时,TiB2会发生电化学溶解,因此,TiB2是一种可行的可溶性阳极材料。
2)TiB2阳极中的Ti会以Ti3+形式电化学溶解进入熔盐,Ti3+迁移至阴极表面通过Ti3+ + e- → Ti2+和Ti2++2e- → Ti两步电化学还原为金属钛。TiB2阳极中的B元素则转变为单质B成为阳极泥。同时,部分B被反应器中的微量氧气氧化为B2O3,随氩气挥发。
| [1] |
LIU Y, CHEN L F, TANG H P, et al. Design of powder metallurgy titanium alloys and composites[J]. Materials Science and Engineering: A, 2006, 418(1/2): 25-35. |
| [2] |
TADDEI E B, HENRIQUES V A R, SILVA C R M, et al. Production of new titanium alloy for orthopedic implants[J]. Materials Science and Engineering: C, 2004, 24(5): 683-687. DOI:10.1016/j.msec.2004.08.011 |
| [3] |
王向东, 郝斌, 逯福生, 等. 钛的基本性质、应用及我国钛工业概况[J]. 钛工业进展, 2004(1): 6-10. DOI:10.3969/j.issn.1009-9964.2004.01.001 |
| [4] |
董瑞峰, 李金山, 唐斌, 等. 航空紧固件用钛合金材料发展现状[J]. 航空制造技术, 2018, 61(4): 86-91. |
| [5] |
KROLL W. The production of ductile titanium[J]. Transactions of the Electrochemical Society, 1940, 78(1): 35. DOI:10.1149/1.3071290 |
| [6] |
朱鸿民, 焦树强, 宁晓辉. 钛金属新型冶金技术[J]. 中国材料进展, 2011, 30(6): 37-43. |
| [7] |
谢珊珊, 李慧, 梁精龙, 等. 金属钛的制备工艺[J]. 热加工工艺, 2017, 46(14): 18-20. |
| [8] |
CHEN G Z, FRAY D J, FARTHING T W. Direct electrochemical reduction of titanium dioxide to titanium in molten calcium chloride[J]. Nature, 2000, 407(2): 361-364. |
| [9] |
ONO K, SUZUKI R O. A new concept for producing Ti sponge: Calciothermic reduction[J]. JOM, 2002, 54(2): 59-61. DOI:10.1007/BF02701078 |
| [10] |
JIAO S Q, ZHU H M. Novel metallurgical process for titanium production[J]. Journal of Materials Research, 2006, 21(9): 2172-2175. DOI:10.1557/jmr.2006.0268 |
| [11] |
WANG Q Y, SONG J X, WU J Y, et al. A new consumable anode material of titanium oxycarbonitride for the USTB titanium process[J]. Physical Chemistry Chemical Physics, 2014, 16(17): 8086-8091. DOI:10.1039/c4cp00185k |
| [12] |
黄飞, 傅正义, 王为民, 等. 二硼化钛陶瓷在不同温度下的氧化行为[J]. 硅酸盐学报, 2008, 36(5): 584-587. DOI:10.3321/j.issn:0454-5648.2008.05.003 |
| [13] |
TIAN D H, WANG M Y, JIAO H D, et al. Improved USTB titanium production with a Ti2CO anode formed by casting[J]. Journal of the Electrochemical Society, 2019, 166(8): E226-E230. DOI:10.1149/2.0271908jes |
| [14] |
杨金华, 郭全贵, 刘占军, 等. 石墨基体表面原位生成的TiB2-C涂层结构研究[J]. 新型炭材料, 2017, 32(5): 474-480. |
| [15] |
王曦. TiB2超硬薄膜的合成及性能[J]. 材料研究学报, 1996(2): 191-194. |
 2021, Vol. 41
2021, Vol. 41


