2. 中国科学院大学地球科学学院, 北京 100049
2. College of Earth Science, University of Chinese Academy Sciences, Beijing 100049, China
0 引言
在地球系统碳循环研究中,人们对陆地分解作用的过程、机制和效应的了解尚待深入。在分解作用(尤其是中低纬区)中起关键作用的微生物组合复杂多变、测定难度大是导致人们对其认识不足的重要原因之一。
BIOLOG微平板法[1, 2]是与变性梯度凝胶电泳法[3]近乎同时应用于微生物生态学的研究手段。BIOLOG微平板法通过测试微生物对单一碳源的利用程度来反映微生物群体水平的群落结构、测定微生物群落的功能多样性[4, 5, 6, 7]。其优点是简便、快捷、灵敏度高、分辨率强[4],已被广泛应用于土壤[1, 8, 9, 10, 11, 12, 13, 14, 15, 16]、水体[1, 17, 18, 19]、活性污泥[20, 21]的微生物群落功能多样性研究中,但在新鲜凋落物和半分解层凋落物研究中鲜有使用。若能被引入植物凋落物降解初期的研究中,将有望增强对这一重要环节的认识。欲将BIOLOG法应用于凋落物分析中,必须先充分开展方法学研究。
BIOLOG法的使用基于微孔中溶液的显色程度[1, 2];因此,培养液含有的干扰物质会直接影响平板显色结果。前人[22, 23, 24, 25, 26]研究土壤样品时对接种液浓度选择、离心操作等的试验表明,较高的接种密度利于BIOLOG平板更客观地反映微生物群落信息[22, 26, 27]。然而,接种液浓度越高,由样品本身所含可溶性有机质产生的额外的颜色变化也越大[28]。虽然离心操作能在一定程度上减少样品稀释液中的有机悬浮颗粒,但上清液中细菌和真菌菌丝也会有不同程度的损失[26, 27];会导致样品接种液中的可培养微生物物种减少[29, 30]。
离心操作中,溶液中微生物数量减少主要有两种途径:其一是游离的菌体受到离心力作用而自主沉降;其二是细菌个体和真菌菌丝体附着在土壤悬浮颗粒上,伴随悬浮颗粒而沉降。由于大量微生物附着在土壤悬浮颗粒上,因此对土壤样品稀释液进行离心操作时,很难区分这两种沉降效应。
那么,在凋落物的处理过程中,离心操作具体将产生怎样的影响,影响程度又如何呢?
为回答这一问题,笔者尝试用凋落物的淋洗液作为微生物培养液,尽量避免悬浮颗粒对微生物个体的吸附作用;在探讨BIOLOG法测定凋落物微生物群落功能多样性的过程中,通过控制离心操作来观察离心与否对培养液可溶性有机质和可培养微生物群落数量产生的影响,以求为今后的研究工作寻找最佳技术路线。
1 材料与方法
1.1 样品采集
采样地点位于北京东灵山地区(39° 48′ N,115° 24′ E)一次生林东坡,海拔1 500~1 600 m,主要植被有白桦(Betulaplatyphylla)、辽东栎(Quercusliaotungenisis)和蒙古栎(Quercusmongolicus),另有少量五角枫(Acer mono)和胡桃楸(Juglansmandshurica)伴生。
根据凋落物的新鲜程度和物理性状差异,可区分新鲜凋落物层(fresh litter layer,F)和半分解凋落物层(fragmented litter layer,R)。其中:F层为新鲜黄色或轻微变色的未分解凋落物,叶片基本完整,仅局部有微小破损,干燥易碎;R层为中度到强度破碎成片段的凋落物,叶脉可见,叶肉呈棕黑色,湿度大。二者分层清晰,外观差别明显。
用五点取样法分别采集F层和R层样品,装入信封后立即封口,用冷藏箱带回实验室,在4 ℃冰箱内暂时保存备用。
1.2 实验方法
准确称取相当于5 g干物质质量的凋落物,置于95 mL无菌NaCl溶液(0.85%)中,振荡摇匀30 min,每个样品均设置未离心(分别记为F-1,R-1)和离心(分别记为F-2,R-2)两组不同处理,其中做离心处理的相对离心力为1 500 g,离心时间为10 min。在超净台中,用10倍稀释法将样品淋洗液浓度稀释至10-3梯度。移取150 μL样品稀释液于预热至25 ℃的BIOLOGTM ECO板微孔后,25 ℃避光恒温培养228 h,每隔12 h在BIOLOG读数器上读取590 nm和750 nm两波段下的吸光度值。对微生物群落第72 h的CLPP进行主成分分析(principal component analysis,PCA)和多样性指数分析[6, 31, 32]。样品测定在中国科学院生态环境研究中心系统生态重点实验室完成。
1.3 数据统计
微生物代谢活性用590 nm(颜色+浊度)与750 nm(浊度)两波段处吸光度的差值表示[33]。计算微孔的平均颜色变化率(average well color development,AWCD): AWCD=[∑(Ci-Ri)]/30 。 其中,Ci,Ri分别为反应孔和对照孔在两波段处吸光度的差值。当(Ci-Ri)<0.06时以0值计算。
分别用Microsoft®Excel2003和SPSS对实验数据进行方差分析和主成分分析。
2 结果
2.1 离心操作对样品培养液浊度的影响
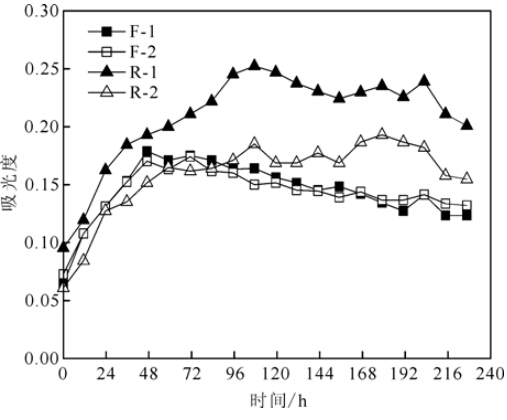
BIOLOGTM ECO微平板的对照孔(A1,A5,A9)中无单一碳底物,其在波长750 nm[33]处吸光度的变化可以指示培养液浊度的变化、追踪浊度对平板显色的干扰程度。
R层的吸光度总体高于F层(图 1),反映其浊度总体高于F层。分别比较F-1与F-2、R-1与R-2两组曲线(图 1)发现:进行离心操作与否,F层稀释液的吸光度几乎无变化,反映其浊度无变化;但R层的浊度则对离心操作较为敏感,离心操作后,其稀释液的吸光度减小约0.13。
 |
| 图 1 凋落物层微生物培育过程中微孔吸光度变化 Fig. 1 Variations of absorbance of micro pores in the proass of microbial communities overtime in BIOLOGTM ECO micro-plates |
| |
2.2 离心操作对微生物群落功能多样性的影响
2.2.1 AWCD曲线
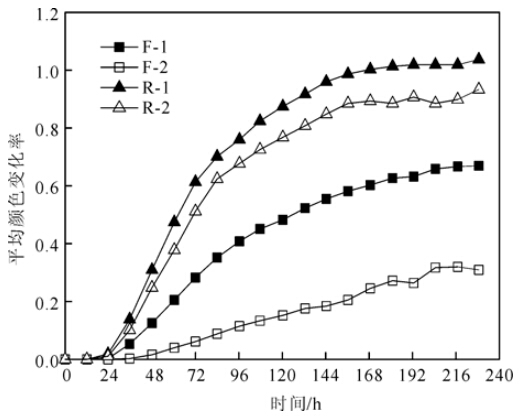
从BIOLOGTM ECO微平板展示的平均颜色变化率曲线(图 2)可以看出:总体上,R-1、R-2曲线明显高于F-1、F-2曲线;F-2曲线明显低于F-1曲线,而R-2曲线略低于R-1曲线。
 |
| 图 2 凋落物层微生物培育过程中AWCD变化 Fig. 2 Variations of AWCD over time in the process of microbial communities in BIOLOGTM ECO micro-plates |
| |
可见,采用离心操作的凋落物样品,微生物群落代谢单一碳底物的总能力较低。离心操作对半分解层凋落物层微生物群落的影响比较小,而对新鲜凋落物层的影响较为明显。
2.2.2 多样性指数
BIOLOGTM ECO微平板上,微孔中单一碳底物的代谢种类和数量直接反映了微生物群落结构特征,平板上呈现的代谢碳源的差异是微生物群落特征差异的反映。
从微生物群落功能多样性指数(表 1)可以看出,R层凋落物微生物群落多样性指数稳定,是否进行离心操作对其没有明显影响;而F层微生物群落的丰富度指数(H′)则因采用离心操作而显著降低,均匀度指数(E)也略有减小。
2.2.3 PCA成分图
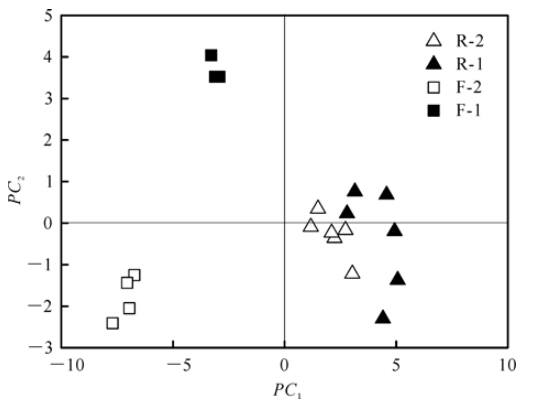
微生物群落代谢碳源特征在主成分分析图(图 3)上得到分离。其中:PC1表示第一主成分,其方差贡献率为66.2%,即所占信息总量为66.2%;PC2表示第二主成分,其方差贡献率为11.6%。F层和R层分别分布在PC1的正负两端(图 3),起分异作用的首要碳底物为D-葡萄糖、聚合物和羧酸类物质(表 2)。离心操作对新鲜凋落物微生物代谢多样性的影响主要体现在PC2上,羧酸、糖类和双性化合物是引起分异的主要碳源(表 2)。离心操作对半分解层凋落物微生物代谢多样性的影响。
 |
| 图 3 微生物群落碳源利用特性的主成分分析图 Fig. 3 Principal component analysis of microbial communities in fallen leaves for sole carbon sources |
| |
| PC1(R>0.95) | PC2(R>0.50) | ||||
| 碳源 | 类别 | R | 碳源 | 类别 | R |
| D-葡萄糖 | 糖 | 0.95 | β-甲基-D葡萄糖苷 | 糖 | 0.74 |
| 土温40 | 聚合物 | 0.95 | D-半乳糖醛酸 | 羧酸 | 0.58 |
| 衣康酸 | 羧酸 | 0.98 | 1-磷酸葡萄糖 | 双性化合物 | 0.75 |
| γ-羟丁酸 | 羧酸 | 0.96 | D,L-α-磷酸甘油 | 双性化合物 | 0.85 |
注:R为主成分和相应原先变量的相关系数。
总体上,进行离心操作,半分解层凋落物微生物群落多样性指数几乎不受影响,代谢单一碳底物的总能力有所下降,浊度则明显降低。新鲜凋落物除 浊度不受影响外,其他参数均有不同程度的降低。
对照孔浊度在前36 h的增幅较大,之 后趋于平稳(图 1)。这可能是由于微生物短期内利用培养液中含有的有机质进行生命代谢、微孔内微生物群落数量增多造成的。当可利用的有机质消耗殆尽,微生物生命代谢变弱,群落数量逐渐稳定。这一现象也证明,微生物会利用培养液本身的有机质,导致额外的颜色反应[28],干扰平板显色结果。
F层凋落物经历风化、分解时间较短,破碎程度很小;而R层凋落物经历一定时期(本试验采集凋落物样品为400~460 d)的分解过程,破碎程度大,可溶性有机成分和细小颗粒含量较多[35, 36, 37, 38],微生物群落数量也多。因此,半分解层凋落物的微生物群落活性高于新鲜凋落物。同时,这也是导致半分解层凋落物离心(1 500 g,10 min)后溶液浊度减小幅度较大(图 1)的原因。
从微生物代谢碳源的数量和类型看,离心操作并没有对半分解层凋落物微生物群落产生明显影响,但对新鲜凋落物层微生物群落代谢碳源的总能力和多样性均有显著影响(图 2,3;表 1)。
4 结论
当研究对象可溶有机质含量高、微生物群落数量丰富时,离心操作能降低培养液本身产生的额外颜色变化和溶液浊度对显色程度的干扰,且对微生物群落功能多样性无明显影响,故推荐使用离心操作;当研究对象可溶有机质含量低、微生物群落数量较少时,离心操作可能导致测得的群落功能多样性减小,故不推荐使用。简言之,离心操作适用于培养液中有机质含量较高且微生物群落数量丰富的样品。在实际工作中,应针对研究对象和研究目标进行选择。
感谢中国科学院生态环境研究中心系统生态重点实验室郑华研究员对测定工作的指导和帮助。
| [1] | Garland J L, Mills A L. Classification and Characte-rization of Heterotrophic Microbial Communities on the Basis of Patterns of Community-Level Sole-Carbon-Source Tilization[J]. Applied and Environmental Microbiology, 1991, 57(8): 2351-2359. |
| [2] | 吴才武, 赵兰坡. 土壤微生物多样性的研究方法[J]. 中国农学通报, 2011, 27(11): 231-235. Wu Caiwu, Zhao Lanpo.Technologies on Soil Microbiology Diversity[J]. Chinese Agricultural Science Bulletin, 2011, 27(11): 231-235. |
| [3] | 苏小四, 孟祥菲, 张文静, 等. 人工回灌过程中地下水微生物群落变化[J]. 吉林大学学报:地球科学版, 2015, 45(2): 573-583. Su Xiaosi, Meng Xiangfei, Zhang Wenjing, et al. Change of the Groundwater Microbial Community During Artificial Recharge Process[J]. Journal of Jilin University: Earth Science Edition, 2015, 45(2): 573-583. |
| [4] | Li S H, Liu K X, Liao Z W. Method for Simplification of Characteristic Carbon Sources for Biolog Analysis of Soil Microbial Community and Its Application[J]. Scientia Agricultura Sinica, 2010, 43(3): 523-528. |
| [5] | Myers R T, Zak D R, White D C, et al. Landscape-Level Patterns of Microbial Community Composition and Substrate Use in Upland Forest Ecosystems[J]. Soil Science Society of America Journal, 2001, 65(2): 359-367. |
| [6] | Garland J L. Analytical Approaches to the Characterization of Samples of Microbial Communities Using Patterns of Potential C Source Utilization[J]. Soil Biology and Biochemistry, 1996, 28(2): 213-221. |
| [7] | Garland J L. Analysis and Interpretation of Community-Level Physiological Profiles in Microbial Ecology[J]. FEMS Microbiology Ecology, 1997, 24(4): 289-300. |
| [8] | De Fede K L, Panaccione D G, Sexstone A J. Characterization of Dilution Enrichment Cultures Obtained from Size-Fractionated Soil Bacteria by BIOLOGTM Community-Level Physiological Profiles and Restriction Analysis of 16Sr RNA Genes[J]. Soil Biology and Biochemistry, 2001, 33(11): 1555-1562. |
| [9] | De Fede K L, Sexstone A J. Differential Response of Size-Fractionated Soil Bacteria in BIOLOG® Microtitre Plates[J]. Soil Biology and Biochemistry, 2001, 33(11): 1547-1554. |
| [10] | 金剑, 王光华, 陈雪丽, 等. Biolog-ECO解析不同大豆基因型R1期根际微生物群落功能多样性特征[J]. 大豆科学, 2007, 26(4): 565-570. Jin Jian, Wang Guanghua, Chen Xueli, et al. Analysis of Microbial Community Functional Diversity in Rhizosphere of Different Soybean Genotypes R1 Stage Using Biolog-ECO Method[J]. Soybean Science,2007, 26(4): 565-570. |
| [11] | Zak J C, Willig M R, Moorhead D L, et al. Functional Diversity of Microbial Communities: A Quantitative Approach[J]. Soil Biology and Biochemistry, 1994, 26(9): 1101-1108. |
| [12] | Schutter M E, Sandeno J M, Dick R P. Seasonal, Soil Type, and Alternative Management Influences on Microbial Communities of Vegetable Cropping Systems[J]. Biology and Fertility of Soils, 2001, 34(6): 397-410. |
| [13] | 郑丽萍, 龙涛, 林玉锁, 等. Biolog-ECO解析有机氯农药污染场地土壤微生物群落功能多样性特征[J]. 应用与环境生物学报, 2013, 19(5): 759-765. Zheng Liping, Long Tao, Lin Yusuo, et al. Biolog-ECO Analysis of Microbial Community Functional Diversity in Organochlorine Contaminated Soil[J]. Chinese Journal of Applied and Environmental Biology, 2013, 19(5): 759-765. |
| [14] | 郑华, 欧阳志云, 王效科, 等. 不同森林恢复类型对土壤微生物群落的影响[J]. 应用生态学报,2004,15(11): 2019-2024. Zheng Hua, Ouyang Zhiyun, Wang Xiaoke, et al. Effects of Forest Restoration Patterns on Soil Microbial Communities[J]. Chinese Journal of Applied Ecology, 2004, 15(11): 2019-2024. |
| [15] | 董立国, 蒋齐, 蔡进军, 等. 基于Biolog-ECO技术不同退耕年限苜蓿地土壤微生物功能多样性分析[J]. 干旱区研究, 2011, 28(4): 630-637. Dong Liguo, Jiang Qi, Cai Jinjun, et al. Anaysis on Functional Diversity of Edaphon Communities in Medicago Sativa Fields of Different Growth Years Based on Biolog-ECO Plates[J]. Arid Zone Research, 2011, 28(4): 630-637. |
| [16] | 岳冰冰, 李鑫, 张会慧, 等. 连作对黑龙江烤烟土壤微生物功能多样性的影响[J]. 土壤, 2013, 45(1): 116-119. Yue Bingbing, Li Xin, Zhang Huihui, et al. Soil Microbial Diversity and Community Structure Under Continuous Tobacco Cropping[J]. Soil, 2013, 45(1): 116-119. |
| [17] | Williams M A, Rice C W. Seven Years of Enhanced Water Availability Influences the Physiological, Structural, and Functional Attributes of a Soil Microbial Community[J]. Applied Soil Ecology, 2007, 35(3): 535-545. |
| [18] | Kersters I,Van Vooren L,Verschuere L,et al.Utility of the Biolog System for the Characterization of Heterotrophic Microbial Communities[J]. Systematic and Applied Microbiology, 1997, 20(3): 439-447. |
| [19] | Choi K H, Dobbs F C. Comparison of Two Kinds of Biolog Microplates (GN and ECO) in Their Ability to Distinguish Among Aquatic Microbial Communities[J]. Journal of Microbiological Methods, 1999, 36(3): 203-213. |
| [20] | Guckert J B, Carr G J, Johnson T D, et al. Community Analysis by Biolog: Curve Integration for Statistical Analysis of Activated Sludge Microbial Habitats[J]. Journal of Microbiological Methods, 1996, 27(2): 183-197. |
| [21] | Kaiser S K, Guckert J B, Gledhill D W. Comparison of Activated Sludge Microbial Communities Using BiologTM Microplates[J]. Water Science and Technology, 1998, 37(4): 57-63. |
| [22] | Garland J L, Mills A L, Young J S. Relative Effectiveness of Kinetic Analysis vs Single Point Readings for Classifying Environmental Samples Based on Community-Level Physiological Profiles (CLPP)[J]. Soil Biology and Biochemistry, 2001, 33(7): 1059-1066. |
| [23] | Engelen B, Meinken K, Von Wintzingerode F, et al. Monitoring Impact of a Pesticide Treatment on Bacterial Soil Communities by Metabolic and Genetic Fingerprinting in Addition to Conventional Testing Procedures[J]. Applied and Environmental Microbiology, 1998, 64(8): 2814-2821. |
| [24] | Franklin R B, Garland J L, Bolster C H, et al. Impact of Dilution on Microbial Community Structure and Functional Potential: Comparison of Numerical Simulations and Batch Culture Experiments[J]. Applied and Environmental Microbiology, 2001, 67(2): 702-712. |
| [25] | Gomez E, Garland J, Conti M. Reproducibility in the Response of Soil Bacterial Community-Level Physiological Profiles from a Land Use Intensification Gradient[J]. Applied Soil Ecology, 2004, 26(1): 21-30. |
| [26] | Calbrix R, Laval K, Barray S. Analysis of the Potential Functional Diversity of the Bacterial Community in Soil: A Reproducible Procedure Using Sole-Carbon-Source Utilization Profiles[J]. European Journal of Soil Biology, 2005, 41(1): 11-20. |
| [27] | 郑华, 欧阳志云, 方治国, 等. BIOLOG在土壤微生物群落功能多样性研究中的应用[J]. 土壤学报, 2004, 41(3): 456-461. Zheng Hua, Ouyang Zhiyun, Fang Zhiguo, et al. Application of Biolog to Study on Soil Microbial Community Functional Diversity[J]. Acta Pedologica Sinica, 2004, 41(3): 456-461. |
| [28] | Preston-Mafham J, Boddy L, Randerson P F. Analysis of Microbial Community Functional Diversity Using Sole-Carbon-Source Utilisation Profiles:A Critique[J]. FEMS Microbiology Ecology, 2002, 42(1): 1-14. |
| [29] | Warcup J. The Soil-Plate Method for Isolation of Fungi from Soil[J]. Nature, 1950, 166: 117-118. |
| [30] | Warcup J. Isolation of Fungi from Hyphae Present in Soil[J]. Nature, 1955, 175: 953-954. |
| [31] | Verschuere L, Fievez V, Van Vooren L, et al. The Contribution of Individual Populations to the Biolog Pattern of Model Microbial Communities[J]. FEMS Microbiology Ecology, 1997, 24(4): 353-362. |
| [32] | 郑华, 欧阳志云, 赵同谦, 等. 不同森林恢复类型对土壤生物学特性的影响[J]. 应用与环境生物学报, 2006, 12(1): 36-43. Zheng Hua, Ouyang Zhiyun, Zhao Tongqian, et al. Effect of Different Forest Restoration Approaches on Soil Biological Properties[J]. Chinese Journal of Applied and Environmental Biology, 2006, 12(1): 36-43. |
| [33] | Classen A T, Boyle S I, Haskins K E, et al. Community-Level Physiological Profiles of Bacteria and Fungi: Plate Type and Incubation Temperature Influences on Contrasting Soils[J]. FEMS Microbiology Ecology, 2003, 44(3): 319-328. |
| [34] | 杨永华, 姚键, 华晓梅. 农药污染对土壤微生物群落功能多样性的影响[J]. 微生物学杂志, 2000, 20(2): 23-25. Yang Yonghua, Yao Jian, Hua Xiaomei. Effect of Pesticide Pollution Against Functional Microbial Diversity in Soil[J]. Journal of Microbiology, 2000, 20(2): 23-25. |
| [35] | 张万儒, 许本彤, 杨承栋, 等. 山地森林土壤枯枝落叶层结构和功能研究[J]. 土壤学报, 1990, 27(2): 121-131. Zhang Wanru, Xu Bentong, Yang Chengdong, et al. Studies on Structure and Function of Forest Floors of Mountain Forest Soils[J]. Acta Pedologica Sinica, 1990, 27(2): 121-131. |
| [36] | 莫江明, 布朗, 孔国辉, 等. 鼎湖山生物圈保护区马尾松林凋落物的分解及其营养动态研究[J]. 植物生态学报, 1996,20(6): 534-542. Mo Jiangming, Bu Lang, Kong Guohui, et al. Litter Decomposition and Its Nutrient Dynamics of a Pine Forest in Dinghushan Biosphere Reserve[J]. Acta Phytoecologica Sinica, 1996,20(6): 534-542. |
| [37] | Ribeiro C, Madeira M, Araújo M C. Decomposition and Nutrient Release from Leaf Litter of Eucalyptus Globulus Grown Under Different Water and Nutrient Regimes[J]. Forest Ecology and Management, 2002, 171(1): 31-41. |
| [38] | Moretto A S, Distel R A. Decomposition of and Nutrient Dynamics in Leaf Litter and Roots of Poa Pigularis and Stipa Gyneriodes[J]. Journal of Arid Environments, 2003, 55(3): 503-514. |


