2. 黑龙江工程学院 材料与化学工程学院, 黑龙江 哈尔滨 150050
2. College of Materials and Chemical Engineering, Heilongjiang Institute of Technology, Harbin 150050, China
药物载体材料分为可降解生物材料和非降解生物材料两类。可降解生物材料以其在包装、生物材料、薄膜材料以及医学领域发挥着越来越重要的作用[1]。在诸多的可降解生物材料中,国际PDA组织认证的聚乳酸-羟基乙酸共聚物(poly lactic-co-glycolic acid,PLGA)以其良好的生物相容性、成球性、无毒性等性能在药物输送、医用工程和分子成像等领域得到了广泛的应用[2-3]。
载药微球或微囊是应用广泛的功能性材料[4]。过去,研究者采用溶剂挥发法(W/O/W,O/W)制备了多种PLGA可生物降解单层载药微球[5-6]。这些传统的微球合成方法两个最大的缺点是突释效应较大和释放时间较短,从而降低了药物的有效期和治疗效果[7]。近几年,研究者应用不同方法合成的双层微球有效的避免了以上缺点[8-9]。在众多的制备方法中,W1/O1/O2/W2溶剂挥发法是一种能降低双层微球的药物突释和延长药物释放时间的有效的方法[10]。Wang Zheng采用这种方法首次制备出了双层载药微球[11]。同时,Burcu Devrim等尝试把卵清蛋白负载于双层微球中[12]。对于载药微球的研究,人们更多关注于负载一种药物的微球或微囊的制备[13-14]。近年来,随着载药体系的迅速发展,对于双重载药体系的研究越来越受到人们的关注。单一给药体系已经不能满足诊疗需求。一些可以进行联合使用的药物对于特殊疾病的治疗起到良好的治疗效果。同时负载于体系中的双重药物可以对病患部位可以起到协同治疗的作用,增强药效[15-16]。而亲水性药物和亲油性药物由于其溶解性不同,又很难共存于同一体系中。在双重给药系统中,两种药物协同作用于病变部位,提高载药系统的诊疗效果的同时降低了对生物体的毒副作用。目前,一些新型的技术已经应用于合成双层给药系统。Xu Qingxing等利用粒子精密制造技术合成了负载壳聚糖p53和阿霉素的双载药系统[17]。Xu Jiqing等把牛血清白蛋白和安息香包覆于壳聚糖微球中[18]。随着研究者对于功能性单独载药微球或微囊研究的不断成熟和完善,双重抗癌药物的研究已经逐渐成为近年的研究热点。双重抗癌药物共同作用于癌细胞,能够提高治疗效果。本文通过把溶剂挥发W1/O1/O2/W2法和双重给药体系结合起来,成功的把两种有效的抗癌药物姜黄素(亲油性)和阿霉素(亲水性)结合在同一系统中。
1 实验与结果分析 1.1 试剂与仪器PLGA (50:50)和PLGA (75:25)购于山东医疗器械有限公司;阿霉素购于阿拉丁试剂公司;姜黄素购于合肥生物技术有限公司;聚乙烯醇(分子量为1 750)和二氯甲烷购于天津市科密欧化学试剂有限公司,所有试剂均为分析纯。
分析测试仪器如下:扫描电子显微镜-能谱仪(日本,JSM-6480 A型);工作电压20 kV,分辨率3 nm。红外光谱仪(美国,Avater 370型),溴化钾压片,扫描范围400~4 000 cm-1,扫描次数为32次/min;粒径分布议(LS603型);紫外-可见分光光度计(日本,UV-1601型);超声波细胞破碎仪(中国,BILON96-Ⅰ型)。
1.2 实验过程 1.2.1 双层载药微球的制备本文采用W1/O1/O2/W2法,成功合成出了负载双重抗癌药物的双层微球。如图 1所示,实验过程如下:把150 mg姜黄素和300 mg PLGA 50:50溶解于3 mL的二氯甲烷中,并在超声清洗机中充分混合。在上述混合液中注入0.3 mL阿霉素溶液,并在超声波细胞破碎仪下于180 W超声破碎3 min(开3 s,停1 s)。然后将得到的乳化液和溶解二氯甲烷的PLGA 75:25溶液(3 mL)再次超声破碎乳化3 min。随后把得到的二次乳化液在磁力搅拌下用注射器滴入到100 mL聚乙烯醇(质量体积浓度为0.5%)中。同时在800 r/min下室温搅拌8 h使有机溶剂二氯甲烷挥发彻底。用蒸馏水洗涤和离心机离心三次以去除杂质。最后冰箱冷冻24 h,通过冷冻干燥得到的微球粉末。
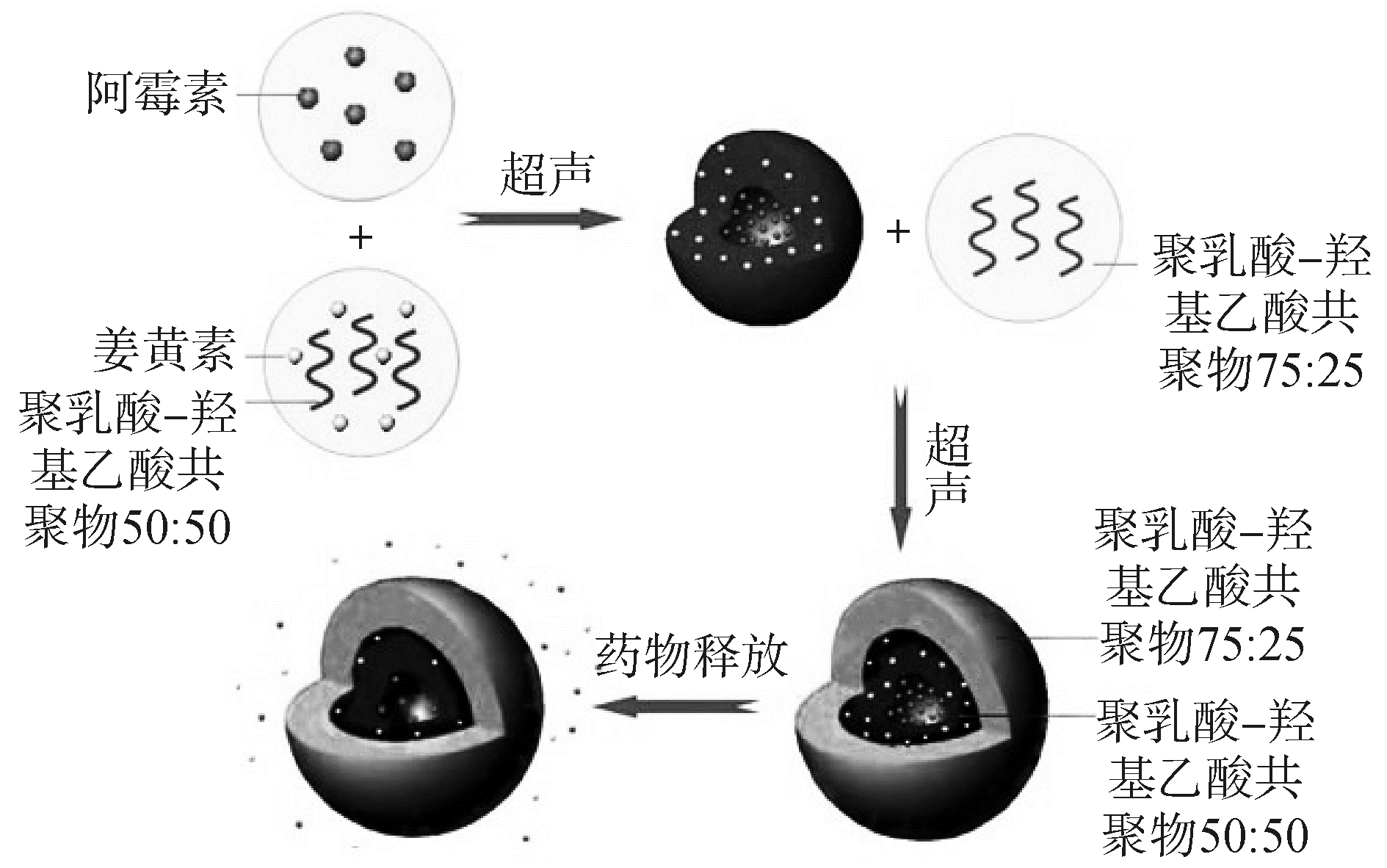
|
图 1 制备流程图和药物释放 Fig.1 Schematic illustration of the preparation |
单层微球的合成方法类似于上述双层微球合成过程,不同之处在于第二步和PLGA 75:25的乳化被省略。
1.2.2 载药量和包封率的测定通过紫外分光光度法来测定药物的载药量和包封率。1 mg微球溶解于磷酸盐缓冲液中(pH=7.4),超声30 s使其混和均匀。在密闭的环境下于37 ℃。
持续搅拌。通过紫外-可见分光光度计在490 nm处测定阿霉素的吸光度值。然后进行姜黄素载药量和包封率的实验,1 mg微球溶解于包含0.2 %的十二烷基硫酸钠的磷酸盐缓冲液中(pH=7.4),于相同温度下搅拌。在426 nm处测定姜黄素的吸收峰。载药量和包封率的计算公式如下
| $ {\rm{LE\% = }}{W_{\rm{e}}}/{W_{\rm{m}}} \times 100{\rm{\% }} $ | (1) |
| $ {\rm{NE}}\% = {C_f}/{C_{\rm{t}}} \times 100\% $ | (2) |
式中:LE表示载药量,We表示微球中药物的质量,Wm表示微球质量,NE表示包封率,Cf表示微球中药物的量,Ct表示投入药量。
1.2.3 体外药物释放实验在模拟人体正常pH(7.4)和正常温度37 ℃下,首先进行阿霉素的体外释放研究。将100 mg冻干样品放入预先处理好的透析袋中。把透析袋浸入50 mL的磷酸盐缓冲液(pH=7.4)中持续缓慢磁力搅拌,使阿霉素药物透过透析袋逐渐溶解于溶液中。在特定的间隔时间点,在烧杯中提取3 mL溶液在紫外分光光度计下于490 nm处进行测试阿霉素的吸光度值。同时向烧杯中及时补充相同体积的新鲜的缓冲溶液以保持总液量不变。而后进行姜黄素溶出的实验。姜黄素的药物缓释实验过程和上述阿霉素释放的实验过程相似,在相同的温度和pH下将100 mg样品放入透析袋中,并在释放介质为含0.2%的十二烷基硫酸钠的磷酸盐缓冲液(pH=7.4)中持续搅拌24 h。在特定时间分别于426 nm处测定姜黄素的吸光度值。经测定计算,阿霉素的标准曲线为
| $ y = 0.012\;4x + 0.012\;\left( {{R^2} = 0.999\;3} \right) $ |
姜黄素的标准曲线为
| $ y = 0.100\;5x + 0.023\;9\;\left( {{R^2} = 0.991\;9} \right) $ |
将测定的阿霉素和姜黄素的各个时间点的吸光度值根据标准曲线计算对应的药物释放量,再根据下式计算两种药物的释放率:
| $ {\rm{RE}}\% {\rm{ = }}\frac{{\sum {{M_{{\rm{SD}}}}} }}{{{M_{{\rm{LD}}}}}} \times 100\% $ |
式中MLD为载体负载药物的最终质量, MSD为某一时间药物释放量。
2 结果与讨论 2.1 双层载药微球的形成本文通过W1/O1/O2/W2溶剂挥发法,制备出了一种新型的同时包覆姜黄素和阿霉素两种抗癌药物的双层微球,使得亲水药物和亲油药物在同一体系内可以共存。制备路线如图 1所示:亲水性药物阿霉素溶解于蒸馏水中形成W1相,亲油性药物姜黄素溶解于PLGA50:50中形成O1相。在超声乳化下,二者形成W1/O1体系。随后,形成的初乳液再次和PLGA75:25超声乳化形成复乳液W1/O1/O2。最后,把复乳液迅速滴入聚乙烯醇中,形成W1/O1/O2/W2体系。磁力搅拌8 h以完全挥发二氯甲烷同时使微球固化。当两种聚合物的浓度达到临界浓度的时候,微球的双层结构得以形成。在此结构中,亲水性抗癌药物存在于W1相中,亲油性药物被包覆于O1中。把两种不同溶解性的药物分别设计到不同的相中,使得同一体系兼容水溶性和油溶性两种物质。同时,由于PLGA50:50和PLGA75:25两层油相的双层保护使载药微球的突释得到了降低,同时总药物释放时间得到了提高。
2.2 微球的形貌图 2为双层载药微球的表面和内部扫描电镜图。图 2(a)为载药微球的表面形貌图。从图中可以看出,样品为形状较规则的圆形微球,表面光滑,没有明显的孔洞和塌陷。微球分散性良好,没有团聚现象。图 2(b)为双层载药微球的内部结构图,从破碎的球体中可以清晰地看出微球的内外双层结构。内层为内油相(PLGA50:50),外层为外油相(PLGA75:25)。

|
图 2 双层微球的扫描电镜图 Fig.2 SEM of double-walled microsphere |
图 3(a)为双层微球的粒径分布图。从图中可以看出,双层微球的平均尺寸为12.9 μm,此尺寸相较于其他双层微球得到了降低[11-12],在合成过程中,如果PLGA的浓度过高,会使溶液粘度增加,从而增加微球的粒径。PLGA浓度过低,则成球形貌不好,可以通过控制成球材料浓度来改变粒径。因此本实验通过适当的降低PLGA50:50和PLGA75:25的浓度来降低双层微球的粒径。同时,把复乳液(W1/O1/O2)向聚乙烯醇转移的过程中,用医用最小型号注射器代替滴管进行滴加,可以控制粒径。另外,滴入的过程中,提高磁力搅拌速度也可以使体系在固化时形成更小的微粒,使微球的粒径得到有效的降低。在最后一步离心洗涤微球时,对微球进行差速分离,即在500 r/min的离心速度下离心5 min,把30 μm以上的微球分离掉;在1 500 r/min的离心速度下离心5 min,把20 μm以上的微球分离掉;将得到的20 μm以下的微球重新分散于蒸馏水中,在3 000 r/min的离心速度下离心5 min,分离出15 μm左右的微球。使用差速离心,有效的降低双层微球粒径,同时也对微球的粒径分布进行了控制。
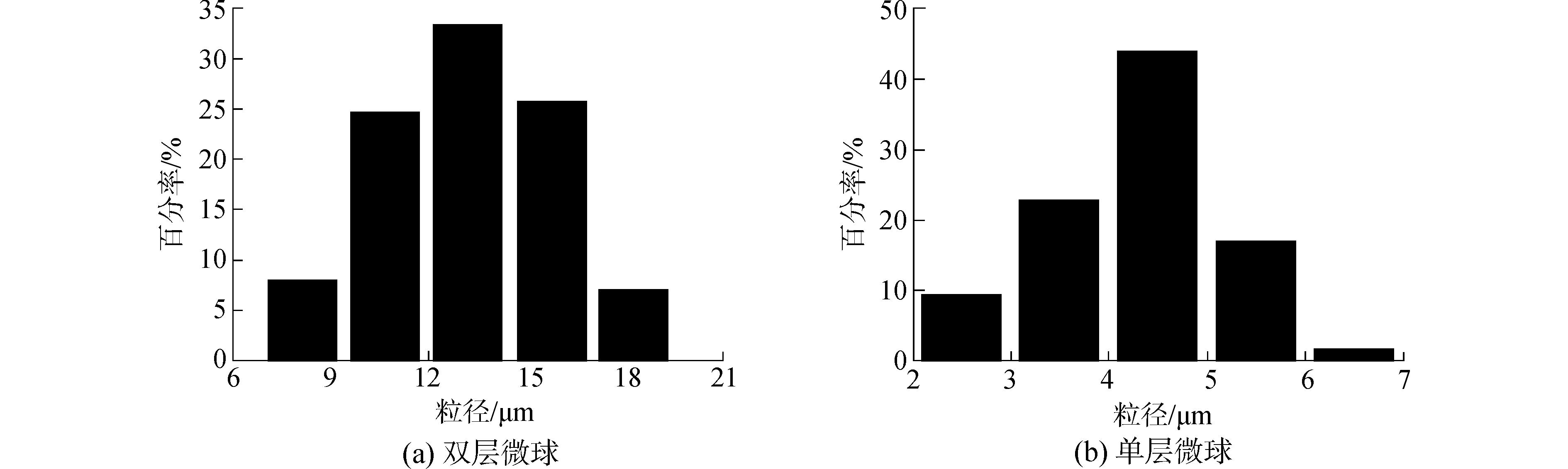
|
图 3 微球的粒径分布图 Fig.3 Size distribution of microspheres |
图 3(b)为单层微球的粒径分布图, 单层微球的平均粒径为4.2 μm。同样可以通过上述差速离心方法控制单层微球的粒径大小和粒径分布。比较单层微球和双层微球的粒径大小,可以看出双层微球的粒径得到了明显的增大。原因是单层微球只有一层PLGA50:50成球包覆材料,而双层微球在单层微球的基础上,又多了一层PLGA75:25的包覆。通过粒径分布分析,可以再次确定合成的样品具有双层结构。
2.4 微球的红外光谱分析图 4为在相同条件下测定的聚乳酸-聚羟基乙酸共聚物50:50、纯阿霉素、纯姜黄素和双层载药微球的红外光谱图。通过分析聚乳酸-聚羟基乙酸共聚物(PLGA)50:50的一系列特征吸收峰得知:2 938 cm-1处吸收峰归属于-CH, -CH2和-CH3的伸缩振动,1 762 cm-1、1 183 cm-1处的特征吸收峰分别归属于-C=O和C-O的伸缩振动。从纯阿霉素的红外光谱图中可以看出:1 900~1 650 cm-1处为C=O的吸收峰,1 600~1 900 cm-1处为醌基的吸收振动峰。同时1 602 cm-1为姜黄素中C=C的吸收峰。通过载药微球的光谱图可以看出,各个对应的特征吸收峰位置没有明显改变,程度得到了降低。该测试研究结果表明各个目标材料均已存在于PLGA双层微球中。
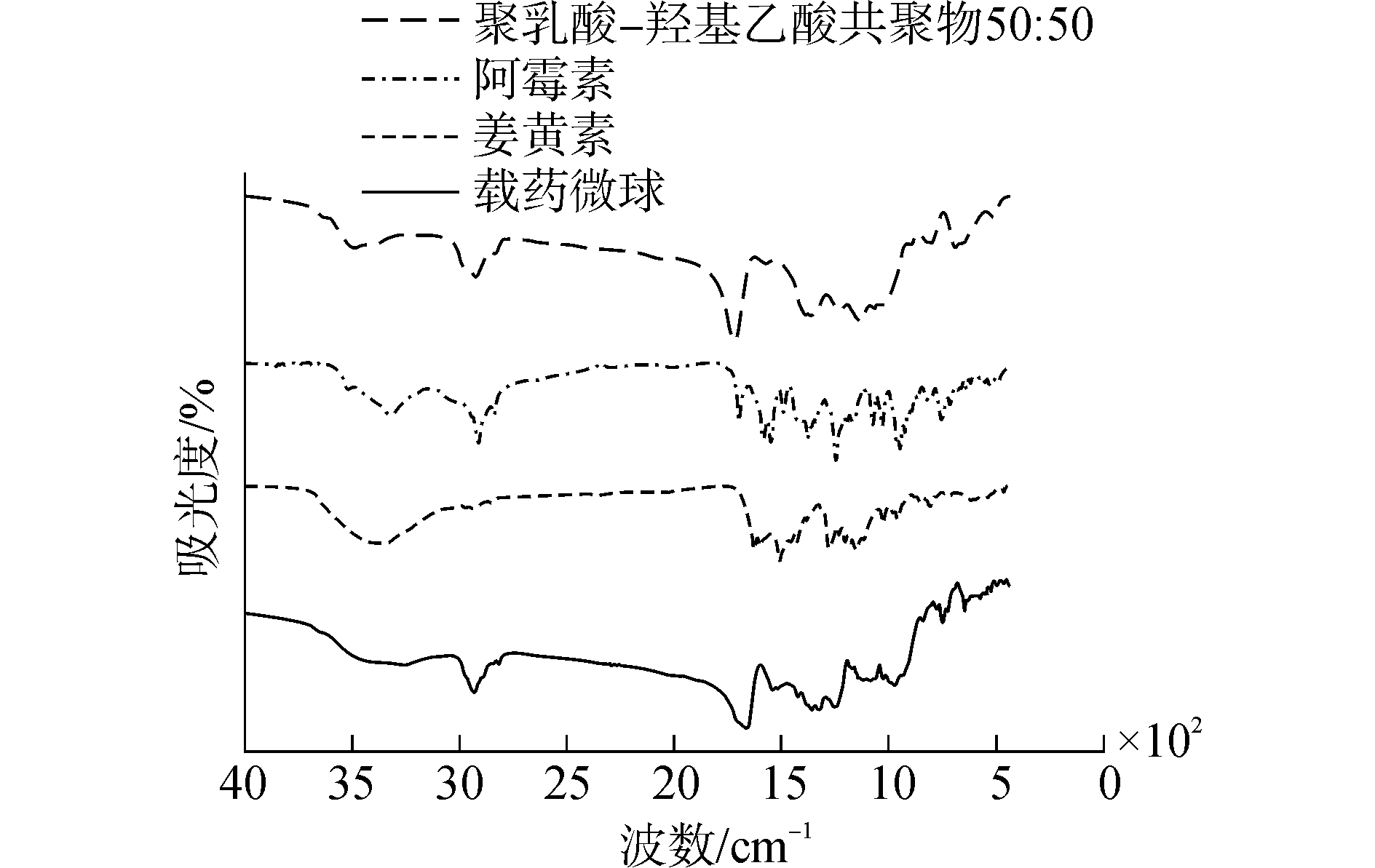
|
图 4 红外光谱图 Fig.4 FT-IR spectrum |
载药量和包封率是评价载药体系的一个重要因素。本实验采用紫外分光光度法来评价载药量和包封率。实验测定的相关数据通过式(1)、(2)进行计算,得到最终结果。阿霉素的载药量和包封率分别为6.7±0.1%和78.6±2.2%。姜黄素的载药量和和包封率分别为14.8±0.1%和45.2±3.1%。
2.6 体外药物释放姜黄素作为姜黄的主要成分,被普遍用于医药、食品调味、着色等领域。同时,由于其具有抗炎症、抗癌性能及抗氧化剂等作用在医疗界得到广泛应用[19-20]。阿霉素同样是一种得到普遍认可的抗癌药物,尤其针对肺癌、肝癌、软组织肉瘤、成骨肉瘤乳、腺癌和卵巢癌等诸多癌症有着明显地治疗效果[21-22]。双重抗癌药物的协同释放有利于控制增长较快的肿瘤细胞。在生物医疗临床医学中有重大的应用价值。
药物释放曲线如图 5所示。图 5(a)为纯的阿霉素和姜黄素在pH=7.4的磷酸盐缓冲液中的药物释放曲线。从图中可以看出,纯的阿霉素在5 h内释放率达91.7 %。与此同时,纯姜黄素在40 h内释放较快,最终在53 h内达到89.3%的释放率。油溶性药物在介质中的释放要比水溶性药物更加缓慢。图 5(b)为微球中的阿霉素和姜黄素的释放曲线图。如图所示,阿霉素在34 d内进行持续的药物释放,释放量达到81.3%。在1 d之内的初期释放率为6.2%。采用W1/O1/O2/W2方法,制得的其他双层微球也有类似的较小初期释放率[23]。由此可见,该方法可以有效地降低药物的突释,使药物有一个平缓的释放过程。其原因是阿霉素包覆于微球的最内层(W1)相,在释放的过程中要受到来自于PLGA50:50(O1)和PLGA75:25(O2)的两层阻碍,因此总的释放时间比纯阿霉素要大得多。在姜黄素的药物释放介质pH=7.4的磷酸盐缓冲液中加入了十二烷基硫酸钠,以帮助姜黄素的溶出。姜黄素总释放量为82.5%,总释放时间为39 d,药物的释放没有明显的突释过程。相较于其他的单层微球中姜黄素的释放,本实验中的姜黄素的释放时间得到了延长,突释率得到了降低。根本原因在于单层微球中,负载于O1相的姜黄素直接溶解于释放介质中。而在双层微球中,同样负载于O1相的姜黄素要穿过O2相才能溶入到溶解介质中。通过以上讨论,证明了阿霉素和姜黄素被包覆于微球中。同时在内油相和外油相的双重保护下,药物分子的缓释时间和突释得到了明显的改善。该研究在药物缓释系统中有重大研究意义。
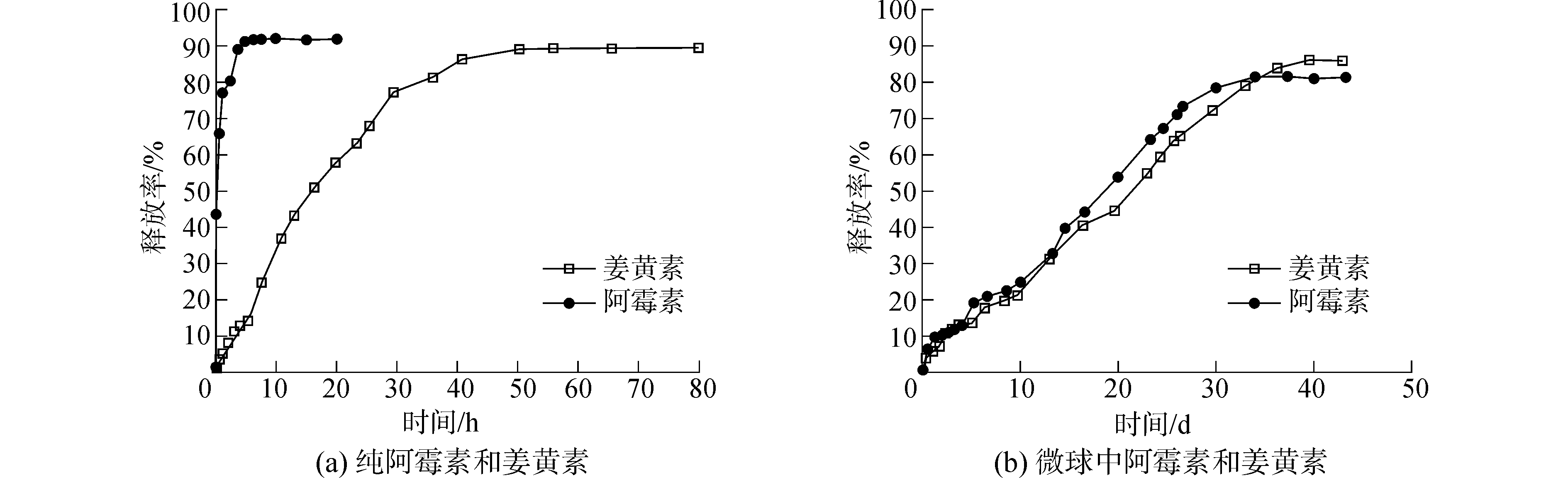
|
图 5 阿霉素和姜黄素的药物释放曲线 Fig.5 Release curves of DOX and cur |
药物释放的根本原因是可降解的天然或人工合成的生物大分子在自然条件下可以自行分解成较小的分子,最后裂解成稳定基本单元结构。本实验采用PLGA为包覆材料,其中的酯键不断水解断裂,最终分解成乳酸。药物释放过程示意图如图 1所示,黄色颗粒为姜黄素,被负载于外油相(O2)中。随着可降解聚合物PLGA75:25的分解,药物逐渐的溶解于释放介质中。红色颗粒为阿霉素,被负载于内油相(PLGA50:50,O1)中,外面又多包覆一层油相。随着两层聚合物的降解,阿霉素逐步溶出。如图 6所示,在微球降解8 d之后,表面开始出现较多的孔洞,聚合物逐渐分解。在21 d之后,微球形貌已坍塌,聚合物发生大面积降解。随着微球的降解,药物逐渐进行释放。

|
图 6 载药微球的降解 Fig.6 The degradation of microspheres |
1) 本文设计了负载溶解性不同的双重抗癌药物微球,以溶解性不同的两种抗癌药物为基底材料,以聚合物PLGA 50:50和PLGA75:25为成球包覆材料,成功构建了亲水性和亲油性共存的可降解生物载药体系。
2) 对两种药物进行了药物缓释分析。相较于传统的单层微球,该体系的药物缓释时间得到增加,同时初期释放得到降低,为生物医学领域未来对双抗癌药物协同作用的研究提供了参考。
3) 对双层载药微球的降解机理及降解过程进行了探讨。结果表明在21 d内微球进行逐步的降解,药物随之释放。
尽管本实验通过改变实验条件,使双层微球得粒径得以进一步降低,但仍存在相对于单层微球尺寸偏大的问题。如何降低双层微球尺寸而又保证载药量和包封率不减少,期待在未来的研究中能够得到有效解决。
| [1] |
MOHAMED F, VAN DER WALLE C F. Engineering biodegradable polyester particles with specific drug targeting and drug release properties[J]. Journal of pharmaceutical sciences, 2008, 97: 71-87. DOI:10.1002/jps.21082 (  0) 0)
|
| [2] |
ACHARYA S, SAHOO S K. PLGA nanoparticles containing various anticancer agents and tumour delivery by EPR effect[J]. Advanced drug delivery reviews, 2011, 63: 170-183. DOI:10.1016/j.addr.2010.10.008 (  0) 0)
|
| [3] |
WHEATLEY M A, FORSBERG F, OUM K, et al. Comparison of in vitro and in vivo acoustic response of a novel 50:50 PLGA contrast agent[J]. Ultrasonics, 2006, 44: 360-367. DOI:10.1016/j.ultras.2006.04.003 (  0) 0)
|
| [4] |
景晓燕, 吴颉, 王君, 等. 磁性PF微球的制备及性质[J]. 哈尔滨工程大学学报, 2003, 24(3): 344-346. JING Xiaoyan, WU Jie, WANG Jun, et al. Preparation and characteristics of magnetic PF microspheres[J]. Journal of Harbin Engineering University, 2003, 24(3): 344-346. (  0) 0)
|
| [5] |
XU B, DOU H J, TAO K, et al. "Two-in-One" fabrication of Fe3O4/MePEG-PLA composite nanocapsules as a potential ultrasonic/MRI dual contrast agent[J]. Langmuir, 2011, 27: 12134-12142. DOI:10.1021/la202096x (  0) 0)
|
| [6] |
LI F X, LI X L, LI B, et al. Preparation of magnetic polylactic acid microspheres and investigation of its releasing property for loading curcumin[J]. Journal of magnetism and magnetic materials, 2011, 323: 2770-2775. DOI:10.1016/j.jmmm.2011.05.045 (  0) 0)
|
| [7] |
YEO Y, PARK K. Control of encapsulation efficiency and initial burst in polymeric microparticle systems[J]. Archives of pharmacal research, 2004, 27: 1-12. DOI:10.1007/BF02980037 (  0) 0)
|
| [8] |
BERKAND C, POLLAUF E, PACK D W. Uniform double-walled polymer microspheres of controllable shell thickness[J]. Journal of controlled release, 2004, 96: 101-111. DOI:10.1016/j.jconrel.2004.01.018 (  0) 0)
|
| [9] |
LEE T H, WANG J, WANG C H. Double-walled microspheres for the sustained release of a highly water soluble drug:characterization and irradiation studies[J]. Journal of controlled release, 2002, 83: 437-452. DOI:10.1016/S0168-3659(02)00235-3 (  0) 0)
|
| [10] |
NAVAEI A, RASOOLIAN M, MOMENI A, et al. Double-walled microspheres loaded with meglumine antimoniate:preparation, characterization and in vitro release study[J]. Drug development and industrial pharmacy, 2014, 40: 701-710. DOI:10.3109/03639045.2013.777734 (  0) 0)
|
| [11] |
ZHENG W A. water-in-oil-in-oil-in-water (W/O/O/W) method for producing drug-releasing, double-walled microspheres[J]. International journal of pharmaceutics, 2009, 374: 90-95. DOI:10.1016/j.ijpharm.2009.03.015 (  0) 0)
|
| [12] |
DEVRIM B, BOZKIR A. Preparation and evaluation of double-walled microparticles prepared with a modified water-in-oil-in-oil-in-water (W1/O/O/W3) method[J]. Journal of microencapsulation, 2013, 30: 741-754. DOI:10.3109/02652048.2013.788082 (  0) 0)
|
| [13] |
SELLERS D L, KIM T H, MOUNT C W, et al. Poly(lactic-co-glycolic) acid microspheres encapsulated in Pluronic F-127 prolong hirudin delivery and improve functional recovery from a demyelination lesion[J]. Biomaterials, 2014, 35: 8895-8902. DOI:10.1016/j.biomaterials.2014.06.051 (  0) 0)
|
| [14] |
SOKOLSKY P M, AGASHI K, OLAYE A, et al. Polymer carriers for drug delivery in tissue engineering[J]. Advanced drug delivery reviews, 2007, 59: 187-206. DOI:10.1016/j.addr.2007.04.001 (  0) 0)
|
| [15] |
LEE J S, BAE J W, JOUNG Y K, et al. Controlled dual release of basic fibroblast growth factor and indomethacin from heparin-conjugated polymeric micelle[J]. International journal of pharmaceutics, 2008, 346: 57-63. DOI:10.1016/j.ijpharm.2007.06.025 (  0) 0)
|
| [16] |
KONISHI M, TABATA Y, KARIYA M, et al. In vivo anti-tumor effect of dual release of cisplatin and adriamycin from biodegradable gelatin hydrogel[J]. Journal of controlled release, 2005, 103: 7-19. DOI:10.1016/j.jconrel.2004.11.014 (  0) 0)
|
| [17] |
XU Q X, XIA Y J, WANG C H, et al. Monodisperse double-walled microspheres loaded with chitosan-p53 nanoparticles and doxorubicin for combined gene therapy and chemotherapy[J]. Journal of controlled release, 2012, 163: 130-135. DOI:10.1016/j.jconrel.2012.08.032 (  0) 0)
|
| [18] |
XU J Q, JIAO Y P, SHAO X H, et al. Controlled dual release of hydrophobic and hydrophilic drugs from electrospun poly(l-lactic acid) fiber mats loaded with chitosan microspheres[J]. Materials letters, 2011, 65: 2800-2803. DOI:10.1016/j.matlet.2011.06.018 (  0) 0)
|
| [19] |
ZHANG J F, TANG Q, XU X Y, et al. Development and evaluation of a novel phytosome-loaded chitosan microsphere system for curcumin delivery[J]. International journal of pharmaceutics, 2013, 448: 168-174. DOI:10.1016/j.ijpharm.2013.03.021 (  0) 0)
|
| [20] |
SAMPATH M, LAKRA R, KORRAPATI P, et al. Curcumin loaded poly(lactic-co-glycolic) acid nanofiber for the treatment of carcinoma[J]. Colloids and surfaces B:biointerfaces, 2014, 117: 128-134. DOI:10.1016/j.colsurfb.2014.02.020 (  0) 0)
|
| [21] |
EISENBREY J R, MUALEM BURSTEIN O, KAMBHAMPATI R, et al. Development and optimization of a doxorubicin loaded poly lactic acid contrast agent for ultrasound directed drug delivery[J]. Journal of controlled release, 2010, 143: 38-44. DOI:10.1016/j.jconrel.2009.12.021 (  0) 0)
|
| [22] |
SINGAL P, ILISKOVIC N. Doxorubicin-induced cardiomyopathy[J]. New england journal of medicine, 1998, 339: 900-905. DOI:10.1056/NEJM199809243391307 (  0) 0)
|
| [23] |
RAHMAN N A, MATHIOWITZ E. Localization of bovine serum albumin in doublewalled microspheres[J]. Journal of controlled release, 2004, 94: 163-175. DOI:10.1016/j.jconrel.2003.10.010 (  0) 0)
|
 2017, Vol. 38
2017, Vol. 38


