实验采用氯化铵(NH4Cl)和磷酸二氢钠(NaH2PO4)配制模拟氮磷废水,所用镁源为氯化镁(MgCl2·6H2O),药剂均为分析纯,国药集团化学试剂有限公司生产。
1.2 实验方法试验采用蒸馏水配水,向1 L水中加入NaH2PO4,再加入NH4C1,最后加入MgCl2·6H2O,使水中摩尔比n(Mg):n(N):n(P)达到设定值,再用NaOH和HCl调节溶液的pH值到预定值。在转速180 r/min下快速搅拌1 min,在转速120 r/min下慢速搅拌30 min, 最后沉淀30 min[15]。沉淀接收后,取上清液,用0.45 μm醋酸纤维滤膜过滤,滤液进行NH4+-N, PO43--P以及pH值的检测。利用单因素实验以及热力学平衡计算,从pH、镁盐浓度、磷酸盐浓度等影响因素的角度,分析MAP法对氮磷废水的影响。
1.3 分析方法NH4+-N的测定采用纳氏试剂光度法,PO43--P的测定采用钼锑抗分光光度法,pH值的测定采用雷磁PHS-3C型pH计。
1.4 热力学平衡计算方法瑞典KTH大学开发的Medusa软件,是一款可以用于预测物质在实验室或自然水环境中平衡形态的热力学平衡的软件。添加MAP溶度积常数的负对数pKsp为13.26,其他所有平衡常数使用程序默认值。输入实验中的阴阳离子浓度以及pH值,离子强度I通过Medusa软件计算得到,根据I的大小选择包括Debye-Hückel方程在内的经验方程计算离子活度。Medusa软件预测的磷酸盐沉淀物组分生成量以其所含PO43-的摩尔量表示,Mg (OH)2以其所含Mg2+的摩尔量表示。
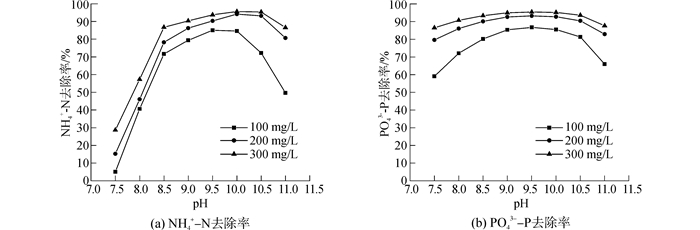
2 结果与讨论 2.1 pH值的影响在摩尔比n(Mg):n(N):n(P)=1:1:1,[NH4+-N]TOT=100,200,300 mg/L的条件下,对pH值由7.5升高到11.0时,NH4+-N去除率、PO43--P去除率与pH值的关系进行了研究,结果如图 1所示。
|
| 图1 NH4+-N和PO43--P去除率与pH值的关系曲线 Figure 1 NH4+-N and PO43--P removal ratio at different pH |
由图 1可知,[NH4+-N]TOT越大,NH4+-N、PO43--P去除率越高。随着pH值的升高,NH4+-N去除率和PO43--P去除率先增大后减小,NH4+-N去除率在pH值在9~10.5范围内取得最大值,PO43--P去除率在pH值等于9~10范围内取得最大值。NH4+-N去除率和PO43--P去除率变化趋势相似,但数值相差较大,这是由于除了MAP沉淀,MgHPO4·3H2O以及Mg3(PO4)2等磷酸盐沉淀也会贡献PO43--P去除率。
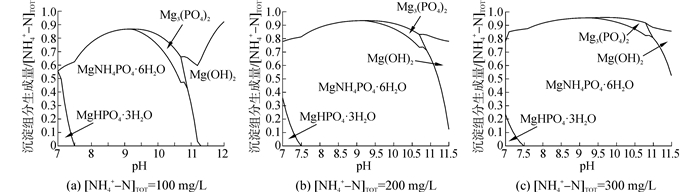
利用Medusa软件对该条件下,pH值对NH4+-PO43--Mg2+水溶液中沉淀组分生成量的影响进行了热力学计算,结果如图 2所示。
|
| 图2 沉淀组分的生成量与pH值的关系曲线 Figure 2 Precipitate production at different pH |
由图 2可知,随着pH值的增大,MAP的生成量先增大后减小,这与NH4+-N去除率和PO43--P去除率的变化趋势相同,MAP的生成量最大值出现在pH值在9~9.5范围内。pH < 7.5时,沉淀中存在MgHPO4·3H2O,当pH>9.25时,又会有Mg3(PO4)2和Mg (OH)2出现。
由于MAP、Mg3(PO4)2以及Mg (OH)2的生成均会生成H+或者消耗OH-,造成溶液pH值降低,使得溶液的平衡pH值小于初始pH值,而Medusa软件预测的是各组分在固定pH值条件下的热力学平衡,所以实验值与预测值存在差异,并且[NH4+-N]TOT越大,差异越大。而通过测量实验结束时溶液pH值发现,该pH值下Medusa软件预测的NH4+-N去除率和PO43--P去除率和实验值差异较小,尤其是后者。所以,Medusa软件的预测值具有较高的准确性。而由于MAP法实际应用时都是动态调节pH值,所以为更好地指导实际应用,本文所给出的最优pH值为最优平衡pH值,即9~9.5,这与已有文献[16-17]给出的结果相同。在此pH值下,不但NH4+-N去除率和PO43--P去除率最高,而且MAP沉淀中的其他沉淀物较少,是MAP法回收废水中氮磷的最优pH值,NH4+-N去除率为79.35%~93.76%,PO43--P去除率为86.76%~95.43%。
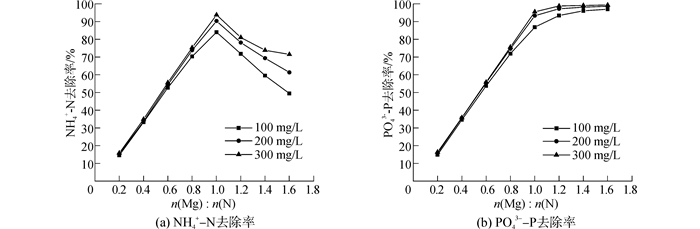
2.2 镁盐浓度的影响在摩尔比n(Mg):n(N)=1:1,[NH4+-N]TOT=100, 200, 300 mg/L,pH=9.5的条件下,对摩尔比n(Mg):n(N)由0.2:1增大到1.6:1时,NH4+-N去除率、PO43--P去除率与摩尔比n(Mg):n(N)的关系进行了研究,结果如图 3所示。
|
| 图3 NH4+-N和PO43--P去除率与摩尔比n(Mg):n(N)的关系曲线 Figure 3 NH4+-N and PO43--P removal ratio at different molar ratio n(Mg):n(N) |
由图 3可知,当摩尔比n(Mg):n(N) < 1:1时,NH4+-N去除率和PO43--P去除率均随着摩尔比n(Mg):n(N)的增大线性增大;当摩尔比n(Mg):n(N)>1:1时,NH4+-N去除率逐渐减小,而PO43--P去除率继续增大并逐渐趋于稳定。这是因为随着摩尔比n(Mg):n(N)的增大,MAP的沉淀趋势逐渐增大,与文献[18]结论一致,但当摩尔比n(Mg):n(N)>1:1时,原本不沉淀的Mg3(PO4)2开始沉淀,并且逐渐取代MAP成为主要沉淀物。
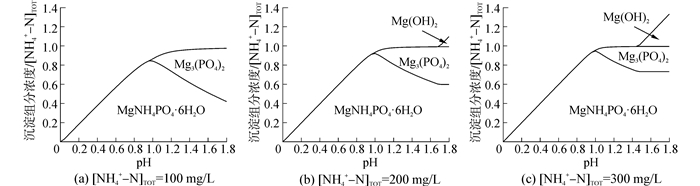
利用Medusa软件对该条件下,摩尔比n(Mg):n(N)对NH4+-PO43--Mg2+水溶液中沉淀组分生成量的影响进行了热力学计算,结果如图 4所示。
|
| 图4 沉淀组分的生成量与摩尔比n(Mg):n(N)的关系曲线 Figure 4 Precipitate production at different molar ratio n(Mg):n(N) |
由图 4可知,当摩尔比n(Mg):n(N) < 1:1时,沉淀的主要成分是MAP,其他沉淀物的生成量非常小,可以忽略。MAP的生成量随着摩尔比n(Mg):n(N)的增大线性增大,当摩尔比n(Mg):n(N)=1:1时,MAP的生成量达到最大值,此时MAP法回收废水中氮磷的效率达到最大值。继续增大摩尔比n(Mg):n(N),部分MAP逐渐转化为Mg3(PO4)2,废水中PO43--P的去除率缓慢增大,而NH4+-N去除率逐渐减小。摩尔比n(Mg):n(N)较大时,废水中会有新的沉淀物Mg (OH)2出现。
所以,最优摩尔比n(Mg):n(N)=1:1,当摩尔比n(Mg):n(N)>1:1时,继续投加的镁盐对废水中NH4+-N的去除率贡献不大,反而会使MAP的纯度降低。当然若以去除PO43--P为目的,可以将摩尔比n(Mg):n(N)增大到1.2:1,PO43--P去除率可提高为90.36%~98.68%,但此时沉淀中含有大量Mg3(PO4)2,并要注意NH4+-N残余量不要超标。
2.3 磷酸盐浓度的影响在摩尔比n(Mg):n(N)=1:1,[NH4+-N]TOT=100, 200, 300 mg/L,pH=9.5的条件下,对摩尔比n(P):n(N)由0.2:1增大到1.6:1时,NH4+-N去除率、PO43--P去除率与摩尔比n(P):n(N)的关系进行了研究,结果如图 5所示。
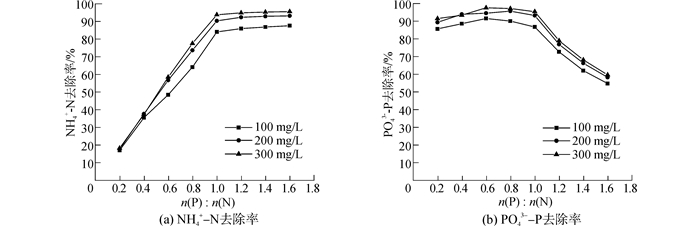
|
| 图5 NH4+-N和PO43--P去除率与摩尔比n(P):n(N)的关系曲线 Figure 5 NH4+-N and PO43--P removal ratio at different molar ratio n(P):n(N) |
由图可知,当摩尔比n(P):n(N) < 1:1时,NH4+-N去除率随着摩尔比n(P):n(N)的增大线性增大,PO43--P去除率先增大后减小,但较NH4+-N去除率变化不大;当摩尔比n(P):n(N)>1:1时,NH4+-N去除率缓慢增大,而PO43--P去除率逐渐减小。这是因为随着摩尔比n(P):n(N)的增大,MAP的沉淀趋势逐渐增大[18],但当摩尔比n(P):n(N)>1:1时,由于溶液中残余NH4+和Mg2+浓度较低,继续投加的PO43-难以通过生成沉淀去除。
利用Medusa软件对该条件下,P与N摩尔比对NH4+-PO43--Mg2+水溶液中沉淀组分生成量的影响进行了热力学计算,结果如图 6所示。
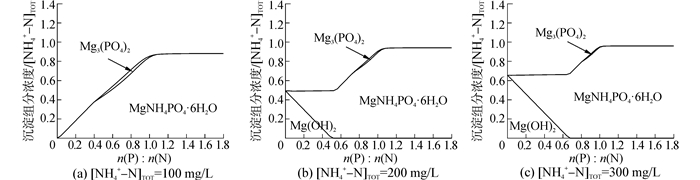
|
| 图6 沉淀组分的生成量与摩尔比n(P):n(N)的关系曲线 Figure 6 Precipitate production at different molar ratio n(P):n(N) |
由图 6可知,当摩尔比n(P):n(N)较小而[NH4+-N]TOT较大时,沉淀的主要成分是Mg (OH)2而不是MAP,随着摩尔比n(P):n(N)的增大,Mg (OH)2的生成量逐渐减小,而MAP的生成量逐渐增大,均与摩尔比n(P):n(N)呈线性关系。但摩尔比n(P):n(N)增大到一定值时,有新的沉淀物Mg3(PO4)2出现,[NH4+-N]TOT越大,Mg3(PO4)2出现的摩尔比n(P):n(N)范围越小,在沉淀中所占比例越小。在摩尔比n(P):n(N)=1:1附近,沉淀中Mg3(PO4)2消失,同时MAP的生成量趋于稳定。此时,继续投加的磷酸盐对废水中MAP的生成量和纯度影响不大。
对NH4+-N去除率、PO43--P去除率、沉淀组分生成量以及处理成本进行综合分析,可知最优摩尔比n(P):n(N)=1:1。当然,若以去除NH4+-N为目的,可以适当增加磷酸盐投加量,但NH4+-N去除率提高量较小,而且要注意PO43--P残余量不要超标。
3 结论通过单因素实验及热力学平衡计算对MAP法处理氮磷模拟废水进行了研究分析,结果如下:
1) MAP法处理氮磷废水的最优工况为:pH=9~9.5,摩尔比n(Mg):n(N):n(P)=1:1:1,此时MAP的纯度最高,NH4+-N去除率为79.35%~93.76%,PO43--P去除率为86.76%~95.43%;
2)改变pH值或摩尔比n(Mg):n(N):n(P)时,生成MgHPO4·3H2O、Mg3(PO4)2以及Mg (OH)2等沉淀;
3)若以去除PO43--P为目的,可将摩尔比n(Mg):n(P)提高为1.2:1,PO43--P去除率可提高到90.36%~98.68%,但此时沉淀中含有大量Mg3(PO4)2,同时NH4+-N的去除率降低;
4)可通过增加磷酸盐投加量提高NH4+-N的去除率,但提高量非常有限,并可能造成PO43--P残余量的超标。
| [1] | YU Rongtai, GENG Jinju, REN Hongqiang, et al. Struvite pyrolysate recycling combined with dry pyrolysis for ammonium removal from wastewater[J]. Bioresource technology, 2013, 132: 154–159. DOI:10.1016/j.biortech.2013.01.015 |
| [2] |
时永辉, 张韬, 刘峰, 等. MAP法处理高氨氮废水的影响因素研究[J].
中国给水排水, 2010, 26(7): 80–82.
SHI Yonghui, ZHANG Tao, LIU Feng, et al. Influencing factors of high ammonia nitrogen wastewater treatment by MAP method[J]. China water & wastewater, 2010, 26(7): 80–82. |
| [3] | STRATFUL I, SCRIMSHAW M D, LESTER J N. Conditions influencing the precipitation of magnesium ammonium phosphate[J]. Water research, 2001, 35(17): 4191–4199. DOI:10.1016/S0043-1354(01)00143-9 |
| [4] |
李士松.基于MAP法海水混凝处理含氮磷废水的研究[D].哈尔滨:哈尔滨工程大学, 2013: 10-12.
LI Shisong. Treatment of nitrogen and phosphorus wastewater using seawater coagulation based on MAP method[D]. Harbin: Harbin Engineering University, 2013: 10-12. http://cdmd.cnki.com.cn/Article/CDMD-10217-1014132951.htm |
| [5] | RYU H D, LIM C S, KANG M K, et al. Evaluation of struvite obtained from semiconductor wastewater as a fertilizer in cultivating Chinese cabbage[J]. Journal of hazardous materials, 2012, 221-222: 248–255. DOI:10.1016/j.jhazmat.2012.04.038 |
| [6] |
郝凌云, 周荣敏, 周芳, 等. 磷酸铵镁沉淀法回收污水中磷的反应条件优化[J].
工业用水与废水, 2008, 39(1): 58–61.
HAO Lingyun, ZHOU Rongmin, ZHOU Fang, et al. A reaction condition optimization for phosphorus removal from wastewater by magnesium ammonium phosphate sedimentation[J]. Industrial water & wastewater, 2008, 39(1): 58–61. |
| [7] | MARTI N, BOUZAS A, SECO A, et al. Struvite precipitation assessment in anaerobic digestion processes[J]. Chemical engineering journal, 2008, 141(1/2/3): 67–74. |
| [8] | PASTOR L, MANGIN D, FERRER J, et al. Struvite formation from the supernatants of an anaerobic digestion pilot plant[J]. Bioresource technology, 2010, 101(1): 118–125. DOI:10.1016/j.biortech.2009.08.002 |
| [9] | LAHAV O, TELZHENSKY M, ZEWUHN A, et al. Struvite recovery from municipal-wastewater sludge centrifuge supernatant using seawater NF concentrate as a cheap Mg (II) source[J]. Separation and purification technology, 2013, 108: 103–110. DOI:10.1016/j.seppur.2013.02.002 |
| [10] | TRIGER A, PIC J S, CABASSUD C. Determination of struvite crystallization mechanisms in urine using turbidity measurement[J]. Water research, 2012, 46(18): 6084–6094. DOI:10.1016/j.watres.2012.08.030 |
| [11] | HUANG H M, XIAO X M, YANG L P, et al. Removal of ammonium from rare-earth wastewater using natural brucite as a magnesium source of struvite precipitation[J]. Water science and technology, 2011, 63(3): 468–474. DOI:10.2166/wst.2011.245 |
| [12] | ICHIHASHI O, HIROOKA K. Removal and recovery of phosphorus as struvite from swine wastewater using microbial fuel cell[J]. Bioresource technology, 2012, 114: 303–307. DOI:10.1016/j.biortech.2012.02.124 |
| [13] | MASSEY M S, IPPOLITO J A, DAVIS J G, et al. Macroscopic and microscopic variation in recovered magnesium phosphate materials: implications for phosphorus removal processes and product re-use[J]. Bioresource technology, 2010, 101(3): 877–885. DOI:10.1016/j.biortech.2009.08.110 |
| [14] | ZHANG Tao, DING Lili, REN Hongqiang, et al. Ammonium nitrogen removal from coking wastewater by chemical precipitation recycle technology[J]. Water research, 2009, 43(20): 5209–5215. DOI:10.1016/j.watres.2009.08.054 |
| [15] |
孙同亮, 成功. MAP法处理氮磷废水的影响因素研究[J].
环境科学与管理, 2015, 40(7): 105–107.
SUN Tongliang, CHENG Gong. Influencing factors for nitrogen phosphorus wastewater treatment with MAP method[J]. Environmental science and management, 2015, 40(7): 105–107. |
| [16] | BOOKER N A, PRIESTLEY A J, FRASER I H. Struvite formation in wastewater treatment plants: opportunities for nutrient recovery[J]. Environmental technology, 1999, 20(7): 777–782. DOI:10.1080/09593332008616874 |
| [17] | RYU H D, KIM D, LEE S I. Application of struvite precipitation in treating ammonium nitrogen from semiconductor wastewater[J]. Journal of hazardous materials, 2008, 156(1/2/3): 163–169. |
| [18] | WANG Jiansen, SONG Yonghui, YUAN Peng, et al. Modeling the crystallization of magnesium ammonium phosphate for phosphorus recovery[J]. Chemosphere, 2006, 65(7): 1182–1187. DOI:10.1016/j.chemosphere.2006.03.062 |



