2. Department of Mechanical and Electrical Engineering, Vocational Technical Institute of Langfang Yanjing, Langfang 065200, China
在铝/钢异种金属焊接过程中,因两者之间的热物理性能差异较大,在焊接过程中极易形成一定厚度脆硬的Fe-Al金属间化合物,且随着化合物层厚度的增加,铝/钢接头的塑性、韧性降低,从而影响焊接接头的力学性能[1-2]。Mathieu等[3]采用激光焊实现了镀锌钢板与铝合金的搭接,研究发现铝/钢焊接界面区生成的金属间化合物以Fe2Al5和FeAl3为主,且化合物层厚度小于15μm。西本·浩司[4]等对A1050H24一种工业纯铝与SGCC-F08镀锌钢板进行激光压力焊研究,发现在铝/镀锌钢板的焊接接头界面区,不仅仅形成Fe-Al金属间化合物,还生成了Fe2Al5Zn0.4三元金属间化合物相。且指出,Fe2Al5Zn0.4相的硬度明显小于脆性化合物Fe2Al5的硬度。可知Fe2Al5Zn0.4相的形成可以提高接头的韧性,改善接头的性能。针对铝钢界面Fe-Al化合物的成分,许多学者从热力学的角度出发,研究了铝/钢界面区金属间化合物生成的机理。冯吉才等[5]通过对铝板和镀锌钢板CMT熔钎焊的界面反应进行热力学分析,发现形成FeAl3的吉布斯自由能比形成其他化合物的大的多,并且在整个温度范围内均大于零,所以该化合物在焊接过程中不可能生成,而其他化合物均可以形成;Fe2Al5和FeAl3具有较低的吉布斯自由能,因而在CMT熔钎焊连接铝板和镀锌钢板时,Fe2Al5和FeAl3两种化合物相最容易生成。在实际焊接过程中,某种金属间化合物是否会形核长大,需要对其形成热力学进行计算,进而判断其形成的可能性。研究异种金属焊接过程热力学特性,对铝/钢异种金属焊接接头金属间化合物形成机理的深入研究具有重要意义。
文中通过脉冲旁路耦合电弧熔钎焊[6],获得成形良好的铝/镀锌钢焊接接头,通过对接头的Fe-Al-Zn三元金属间化合物进行分析,建立了基于相图模型的Fe-Al- Zn三元系统的热力学计算模型,分析了界面金属间化合物的形成机理。
1 Fe-Al-Zn三元系统的热力学模型 1.1 Fe-Al-Zn金属间化合物的吉布斯自由能计算对于多元混合体系,其摩尔吉布斯自由能[5]可表示为
| $\begin{align} & {{G}_{m}}={}^{srf}G+{}^{cfg}G+{}^{E}G= \\ & \sum\limits_{i}{X_{i}^{0}}G(T)+RT\sum\limits_{i}{{{X}_{i}}\ln {{X}_{i}}+} \\ & {{X}_{i}}{{X}_{j}}\sum\limits_{v}{L{{({{X}_{i}}-{{X}_{j}})}^{v}}} \\ \end{align}$ | (1) |
式中:前两项是理想部分的参考面自由焓和理想部分的混合熵,第三项是剩余部分的自由能;Xi表示组分i的摩尔分数;0Gi是组分i的吉布斯自由能,是温度的函数;R是气体常数;T是绝对温度;L是A、B组元间的相互作用参数。
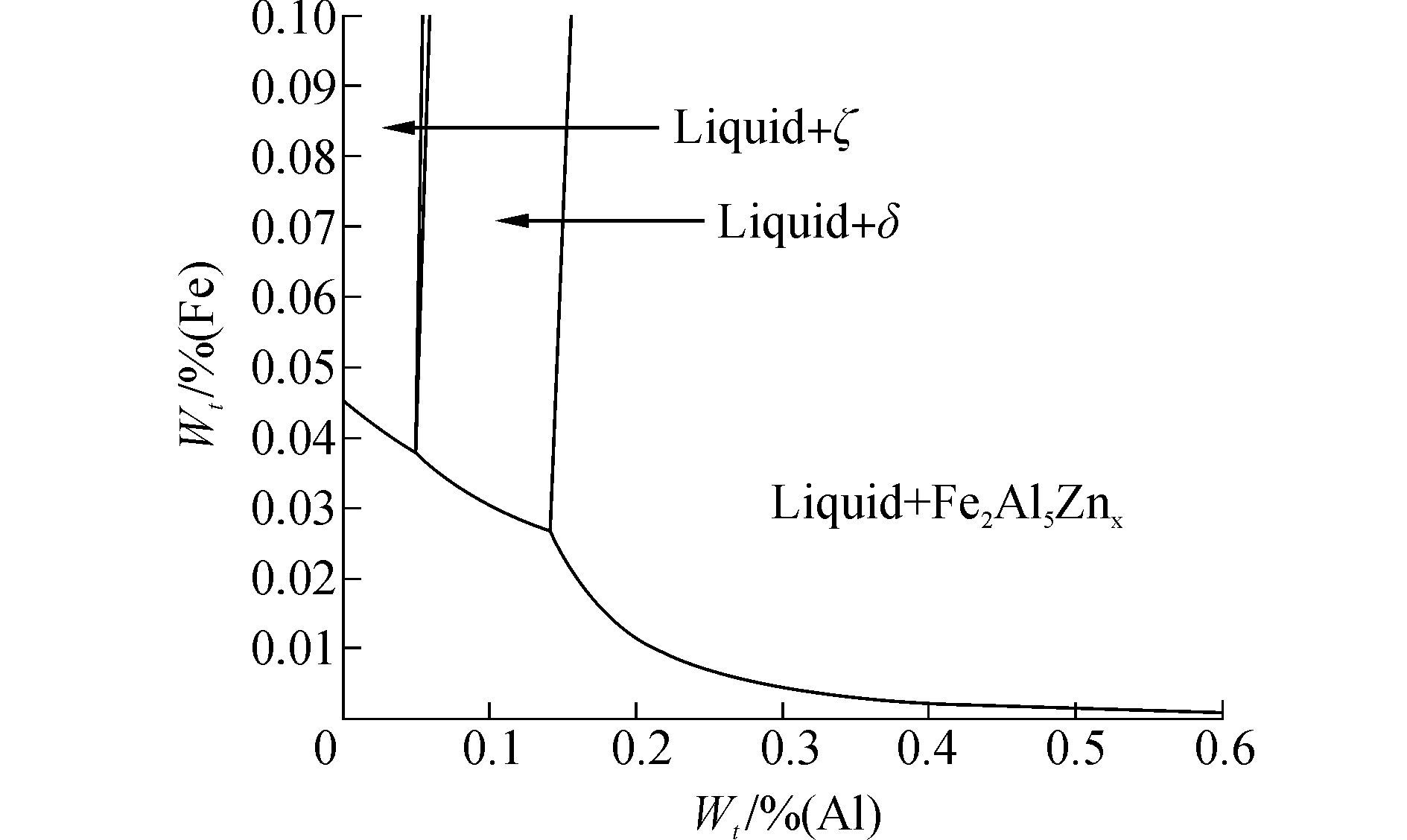
对于Fe-Al-Zn三元系统的吉布斯自由能,可根据相图模型进行计算。根据如图 1所示温度为460℃时Fe-Al-Zn三元相图[5],铝、铁、锌三者相互作用可以形成一系列Fe-Al-Zn金属间化合物,如δ相(Fe0.1288Al0.0667Zn0.8045)、Fe2Al5Znx。
|
| 图1 Fe-Al-Zn三元相图 Figure 1 Fe-Al-Zn ternary phase diagram |
将式(1)推广到三元系统,故在Fe-Al-Zn三元系统中,所形成的金属间化合物相的摩尔Gibbs标准自由能可表示为
| $\begin{align} & {{G}_{m}}=X_{Fe}^{o}{{G}_{Fe}}+X_{Al}^{O}+{{G}_{Al}}+X_{Zn}^{o}{{G}_{Zn}}+ \\ & RT({{X}_{Fe}}\ln {{X}_{Fe}}+{{X}_{Al}}\ln {{X}_{Al}}+{{X}_{Zn}}\ln {{X}^{Zn}}+ \\ & {{X}_{Fe}}{{X}_{Zn}}[{}^{O}{{L}_{Fe,Zn}}+{}^{1}{{L}_{Fe,Zn}}({{X}_{Fe}}-{{X}_{Zn}})+ \\ & {}^{2}{{L}_{Fe,Zn}}{{({{X}_{Fe}}-{{X}_{Zn}})}^{2}}]+{{X}_{Al}}{{X}_{Zn}}[{}^{O}{{L}_{Al,Zn}}]+ \\ & {{X}_{Fe}}{{X}_{Al}}[{}^{O}{{L}_{Al,Fe}}+{}^{1}{{L}_{Al,Fe}}({{X}_{Al}}-{{X}_{Fe}})+ \\ & {}^{2}{{L}_{Al,Fe}}{{({{X}_{Al}}-{{X}_{Fe}})}^{2}}] \\ \end{align}$ | (2) |
式中:0GFe、0GAl和0GZn分别是纯液态Fe、Al和Zn的自由能。XFe、XAl和XZn分别是Fe、Al和Zn的摩尔分数,LFe,Zn、LAl,Zn和LFe,Al分别是Fe-Zn、Al-Zn和Fe-Al的相互作用参数。
文献[7]对纯液态铁和铝的吉布斯标准自由能0GFe的计算进行了详细的阐述,计算如下:
纯液态铁的自由能0GFe为
| $^{0}{{G}_{Fe}}{{=}^{0}}G_{Fe}^{bcc}-G_{Fe}^{mag}+\vartriangle G_{Fe}^{hbcc-liq}$ | (3) |
其中,0GFebcc是体心立方晶格的铁的标准Gibbs自由能,GFemag是具有磁性的铁的Gibbs自由能,ΔGFehbcc→liq是非磁性bcc铁转化为液态铁时的Gibbs自由能的变化:
| $G_{Fe}^{mag}=RT\ln (\beta +1)f(\tau ),\tau =T/{{T}_{c}}$ | (4) |
| $f(\tau )=1-\frac{0.9053}{\tau }-0.30602(\frac{{{\tau }^{3}}}{2}+\frac{{{\tau }^{9}}}{45}+\frac{{{\tau }^{15}}}{200})$ | (5) |
其中,Tc=1043K为铁的磁性转变温度;β=2.22为铁的玻尔磁子数。
ΔGFehbcc→liq的表达式可表示为
| $\begin{align} & \Delta G_{Fe}^{hbcc\to liq}=12040.17-6.55843T- \\ & 3.675155\times {{10}^{-21}}{{T}^{7}} \\ \end{align}$ | (6) |
液态铝和液态锌的标准Gibbs自由能
| $^{0}{{G}_{Al}}{{=}^{0}}G_{Al}^{bcc}$ | (7) |
| $^{0}{{G}_{Zn}}{{=}^{0}}G_{Zn}^{hcp}$ | (8) |
在Fe-Al-Zn三元混合系统中,根据化学反应方程式,反应前后吉布斯自由能变化为
| $\Delta G={{G}_{m}}-x{{G}_{Fe}}-y{{G}_{Al}}-z{{G}_{Zn}}$ | (9) |
对于1 mol纯铁、纯铝或纯锌,其自由能和化学势相等,即
| ${{\mu }_{Fe}}={{G}_{Fe}};{{\mu }_{Al}}={{G}_{Al}};{{\mu }_{Zn}}={{G}_{Zn}}$ |
在二元组分体系中,某一组分的偏摩尔吉布斯自由能即为该组分的化学势,这一规律同样适用于Fe-Al-Zn三元系统,故铁的化学势可表示为
| ${{\mu }_{Fe}}={{G}_{m}}+\frac{\partial {{G}_{m}}}{\partial {{X}_{Fe}}}-{{X}_{Fe}}\frac{\partial {{G}_{m}}}{\partial {{X}_{Fe}}}-{{X}_{Zn}}\frac{\partial {{G}_{m}}}{\partial {{X}_{Zn}}}-{{X}_{Al}}\frac{\partial {{G}_{m}}}{\partial {{X}_{Al}}}$ | (10) |
将式(2)代入式(10)可得铁的化学势为
| $\begin{align} & {{\mu }_{Fe}}{{=}^{0}}{{G}_{Fe}}+RT\ln {{X}_{Fe}}+{{X}_{Zn}}{{({{X}_{Zn}}+{{X}_{Al}})}^{0}}{{L}_{Fe,Zn}}+ \\ & {{[2{{X}_{Zn}}{{X}_{Fe}}(2{{X}_{Zn}}+{{X}_{Al}})-X_{Zn}^{2}]}^{1}}{{L}_{Fe,Zn}}+ \\ & [{{X}_{Zn}}{{X}_{Fe}}(3{{X}_{Fe}}-3X_{Fe}^{2}+6{{X}_{Fe}}{{X}_{Zn}}-4{{X}_{Zn}}-3X_{Zn}^{2})+ \\ & X_{Zn}^{3}{{]}^{2}}{{L}_{Fe,Zn}}+{{X}_{Al}}{{({{X}_{Al}}+{{X}_{Zn}})}^{0}}{{L}_{Al,Fe}}+ \\ & {{[X_{Al}^{2}-2{{X}_{Al}}{{X}_{Fe}}(2{{X}_{Al}}+{{X}_{Zn}})]}^{1}}{{L}_{Al,Fe}}+ \\ & [{{X}_{Al}}{{X}_{Fe}}(3{{X}_{Fe}}-3X_{Fe}^{2}+6{{X}_{Fe}}{{X}_{Al}}-4{{X}_{Al}}-3X_{Al}^{2})+ \\ & X_{Al}^{2}{{]}^{2}}{{L}_{Al,Fe}}-{{X}_{Al}}{{X}_{Zn}}^{0}{{L}_{Al,Zn}} \\ \end{align}$ | (11) |
同理,可分别得Al和Zn的化学势:
| $\begin{align} & {{\mu }_{Al}}{{=}^{0}}{{G}_{Al}}+RT\ln {{X}_{Al}}+{{X}_{Fe}}{{({{X}_{Zn}}+{{X}_{Fe}})}^{0}}{{L}_{Fe,Al}}+ \\ & {{[2{{X}_{Al}}{{X}_{Fe}}({{X}_{Zn}}+2{{X}_{Fe}})-X_{Fe}^{2}]}^{1}}{{L}_{Fe,Al}}+ \\ & [{{X}_{Al}}{{X}_{Fe}}(3{{X}_{Al}}-3X_{Al}^{2}+6{{X}_{Fe}}{{X}_{Al}}-4{{X}_{Fe}}-3X_{Fe}^{2})+ \\ & X_{Fe}^{3}{{]}^{2}}{{L}_{Fe,Al}}+{{X}_{Zn}}{{({{X}_{Fe}}+{{X}_{Zn}})}^{0}}{{L}_{Al,Zn}}- \\ & {{X}_{Zn}}{{X}_{Fe}}^{0}{{L}_{Fe,Zn}}\_+2{{X}_{Zn}}{{X}_{Fe}}{{({{X}_{Zn}}-{{X}_{Fe}})}^{1}}{{L}_{Fe,Zn}}+ \\ & {{X}_{Fe}}{{X}_{Zn}}{{(-3X_{Fe}^{2}+6{{X}_{Fe}}{{X}_{Zn}}-3X_{Zn}^{2})}^{2}}{{L}_{Fe,Zn}} \\ \end{align}$ | (12) |
| $\begin{align} & {{\mu }_{Zn}}{{=}^{0}}{{G}_{Zn}}+RT\ln {{X}_{Zn}}+{{X}_{Fe}}{{({{X}_{Zn}}+{{X}_{Al}})}^{0}}{{L}_{Fe,Zn}}+ \\ & {{[2{{X}_{Zn}}{{X}_{Fe}}({{X}_{Zn}}+{{X}_{Al}})-X_{Zn}^{2}]}^{1}}{{L}_{Fe,Zn}}+ \\ & [{{X}_{Zn}}{{X}_{Fe}}(3{{X}_{Fe}}-3X_{Fe}^{2}+6{{X}_{Fe}}{{X}_{Zn}}-4{{X}_{Zn}}-3X_{Zn}^{2})+ \\ & X_{Zn}^{3}{{]}^{2}}{{L}_{Fe,Zn}}+{{X}_{Al}}{{({{X}_{Al}}+{{X}_{Fe}})}^{0}}{{L}_{Al,Zn}}-{{X}_{Al}}{{X}_{Zn}}^{0}{{L}_{Fe,Zn}}+ \\ & 2{{X}_{Al}}{{X}_{Fe}}{{({{X}_{Fe}}-{{X}_{Al}})}^{1}}{{L}_{Al,Fe}}+{{X}_{Al}}{{X}_{Fe}}(-3X_{Al}^{2}+ \\ & 6{{X}_{Al}}{{X}_{Fe}}-3X_{Fe}^{2}{{)}^{2}}{{L}_{Al,Fe}} \\ \end{align}$ | (13) |
在Fe-Al-Zn三元混合系统中,形成Fe2Al5Zn0.4的方程式为
| $2Fe+5Al+0.4Zn=Fe{{l}_{2}}A{{l}_{5}}Z{{N}_{0.4}}$ | (14) |
根据式(11)可分别确定式(9)中的各项系数,则XFe=10/37、XAl=25/37、 XZn=2/37、x=2、y=5、z=0.4。将各值代入式(14),化简整理得
| $\begin{align} & \Delta G={{G}_{m}}-2{{G}_{Fe}}-5{{G}_{Al}}-0.4{{G}_{Zn}}= \\ & -{{1.7297}^{0}}{{G}_{Fe}}-{{4.3243}^{0}}{{G}_{Al}}-{{0.3459}^{0}}{{G}_{Zn}}- \\ & 5.1043RT-{{0.0117}^{0}}{{L}_{Fe,Zn}}+{{0.0930}^{1}}{{L}_{Fe,Zn}}- \\ & {{0.0132}^{2}}{{L}_{Fe,Zn}}-{{1.2418}^{0}}{{L}_{Fe,Al}}-{{0.6418}^{1}}{{L}_{Fe,Al}}- \\ & {{0.1921}^{2}}{{L}_{Fe,Al}}-{{0.2337}^{0}}{{L}_{Al,Zn}} \\ \end{align}$ | (15) |
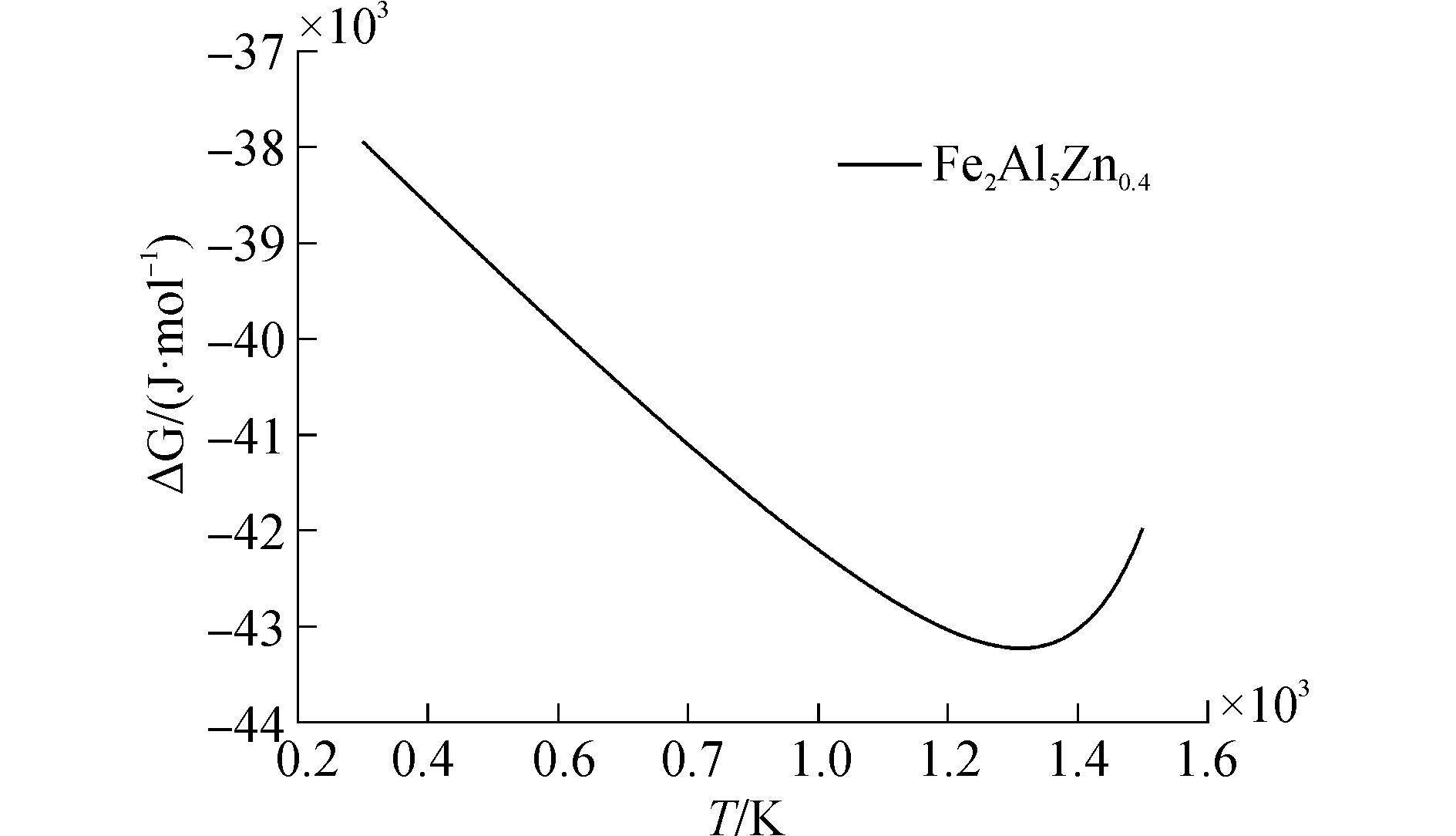
根据表 1列出的与Fe-Al-Zn反应有关的热力学数据,按照计算模型,应用Matlab编制求解程序计算了Fe2Al5Zn0.4相在300~1500K的生成自由能,计算结果如图 2所示。从计算结果可以看出,形成Fe2Al5Zn0.4相的摩尔吉布斯自由能在电弧熔钎焊温度范围内小于零。因此,该化合物相在铝/镀锌钢板焊接接头界面处可能存在。
| 符号 | 表达式或值 |
| 0LFe,Al | -91976.5+22.131 4T |
| 1LFe,Al | -5 672.58+4.872 8T |
| 2LFe,Al | +121.9 |
| 0LAl,Zn | 10 465.5-3.392 59T |
| R | 8.314 |
| 0LFe,Zn | 58 088-23.665T |
| 1LFe,Zn | 92 219-55.584T |
| 2LFe,Zn | 13 570 |
| Tc | 1043 K |
| β | 2.22 |
|
| 图2 Fe2Al5Zn0.4相形成的吉布斯自由能变化 Figure 2 The Gibbs free-energy change of form Fe2Al5Zn0. 4 |
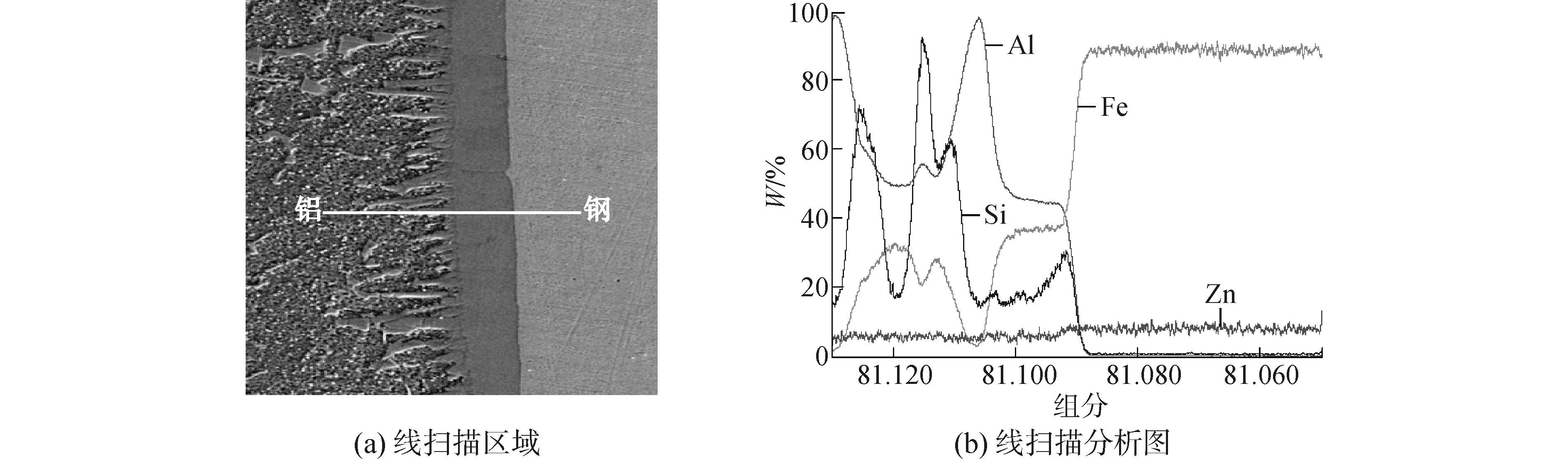
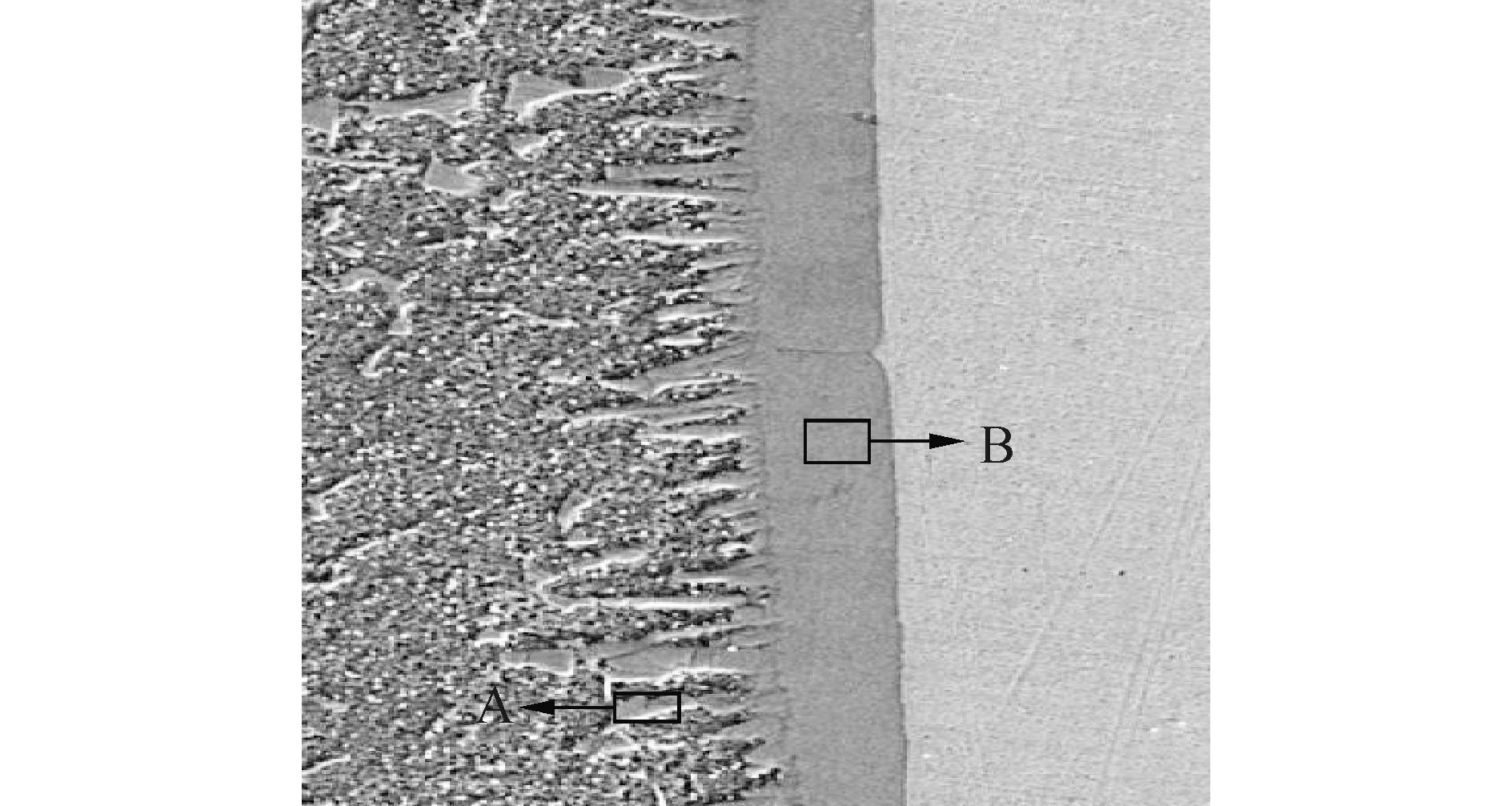
为进一步验证所建立的铝/钢界面Fe-Al-Zn三元金属间化合物形成吉布斯自由能计算模型的合理性,采用旁路脉冲耦合电弧熔钎焊对铝与镀锌钢板进行焊接。焊接所使用的材料为镀锌层为100g/m2的镀锌钢板填充材料为直径1.2mm的ER5356铝合金焊丝,保护气体为Ar。采用电子探针仪进行线扫描分析焊接接头界面中心的金属间化合物层的化学成分,由图 3可知,在金属间化合物层中,Al和Fe的含量分布在焊接接头界面中心比较平齐,且出现平台。对界面进行EDS分析,如图 4所示,获得界面中心不同区域元素成分,如表 2所示。这表明在焊接接头界面中心可能形成FexAly 金属间化合物。
|
| 图3 铝/镀锌钢焊接接头线扫描分析 Figure 3 Linear scanning analyses of welded joint |
|
| 图4 焊接接头界面中心不同区域的EDS分析 Figure 4 EDS analysis on different interface centre areas |
| Area | Wt / % | At / % | ||
| Fe | Al | Fe | Al | |
| A | 41.70 | 55.74 | 25.84 | 71.48 |
| B | 37.31 | 62.69 | 21.63 | 75.38 |
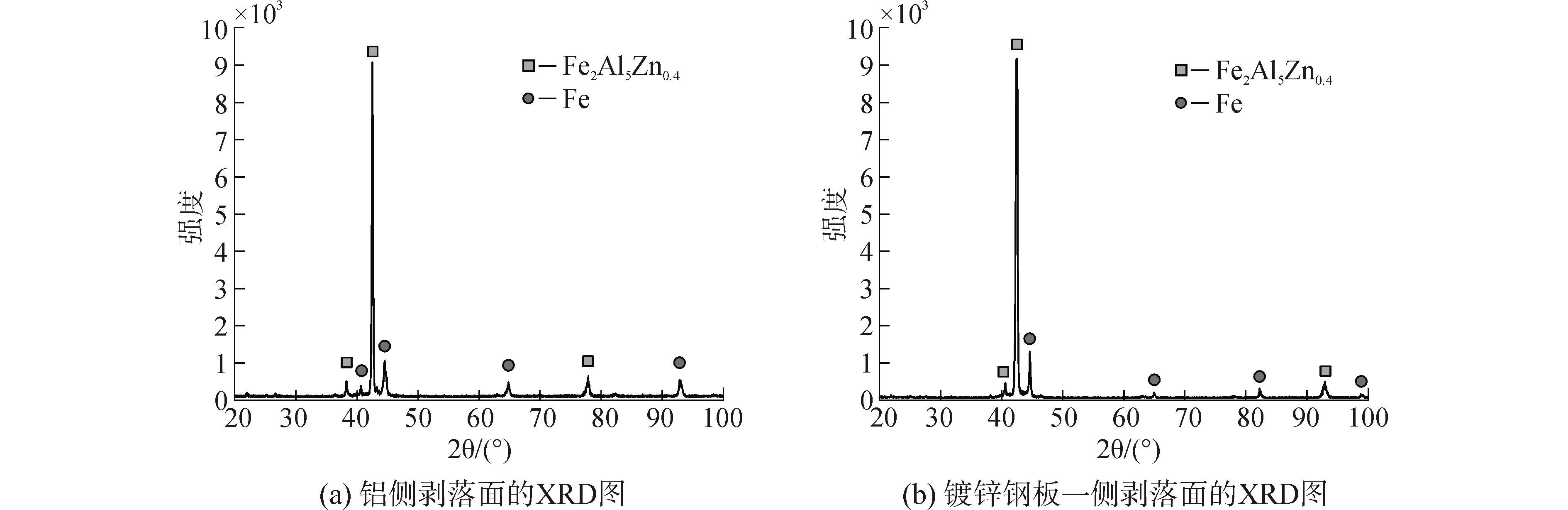
将焊后的铝/钢接头试样从界面处撕裂拉断,分离后的试样如图 5所示。分别对铝侧和镀锌钢板一侧试样的剥落面进行X射线衍射分析,其结果如图 6所示。

|
| 图5 剥落的试样 Figure 5 The spalling samples |
|
| 图6 试样剥落面的XRD分析图谱 Figure 6 XRD analysis on the specimen spalling surface |
从图 6中可以看出,中间界面区金属间化合物还存在有Fe2Al5Zn0.4,这表明在铝钢界面这与计算结果相吻合。由计算及试验结果可知,在铝/镀锌钢板接头界面存在Fe2Al5Zn0.4相化合物组织。
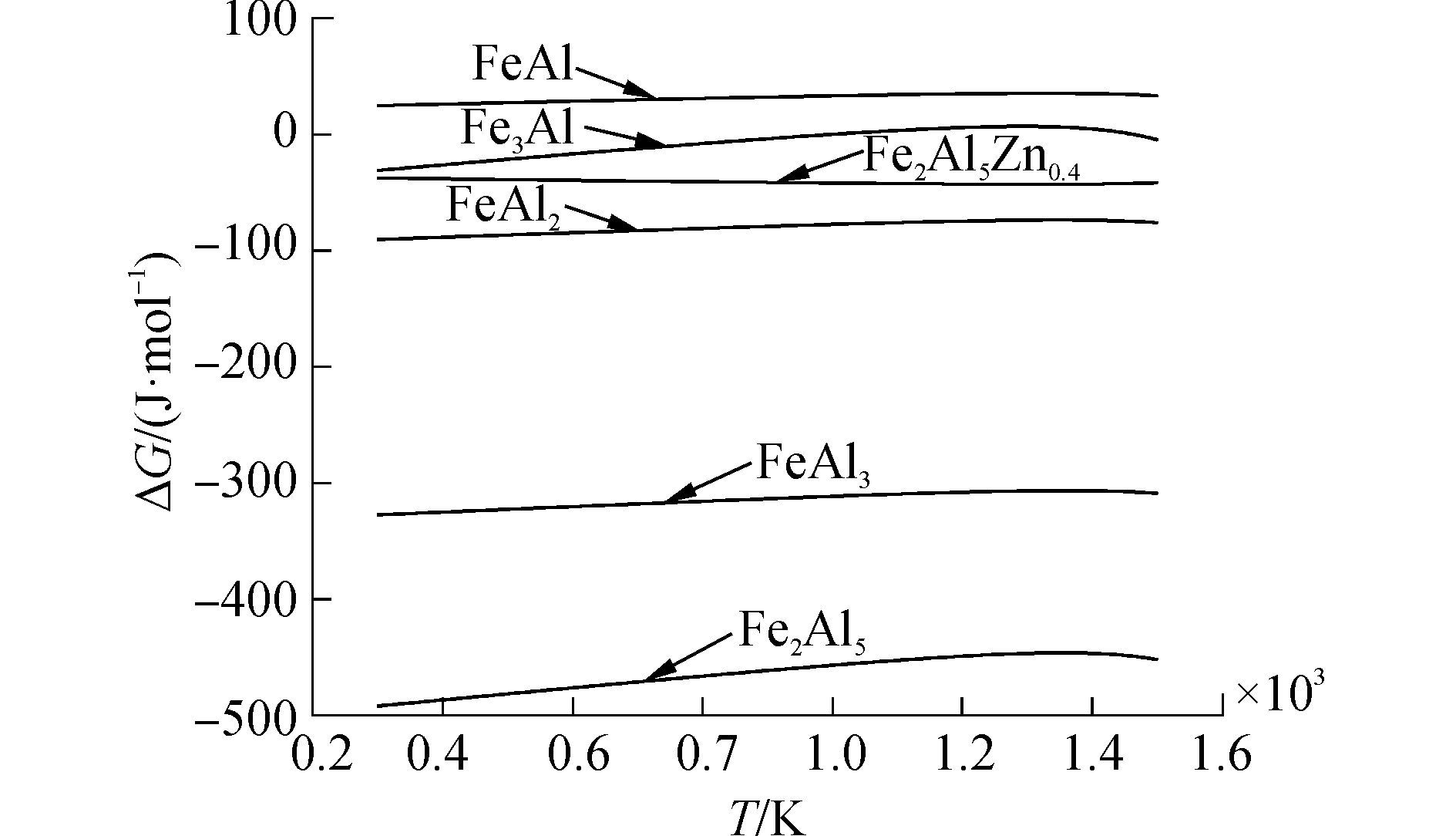
3 铝/镀锌钢界面过程分析将相同温度范围内的各种Fe-Al金属间化合物相和Fe2Al5Zn0.4相的摩尔吉布斯自由能进行比较,Fe-Al化合物自由能计算依据文献[8-10]。结果如图 7所示。
|
| 图7 金属间化合物的吉布斯自由能变化 Figure 7 The gibbs free energy change of intermetallic compounds |
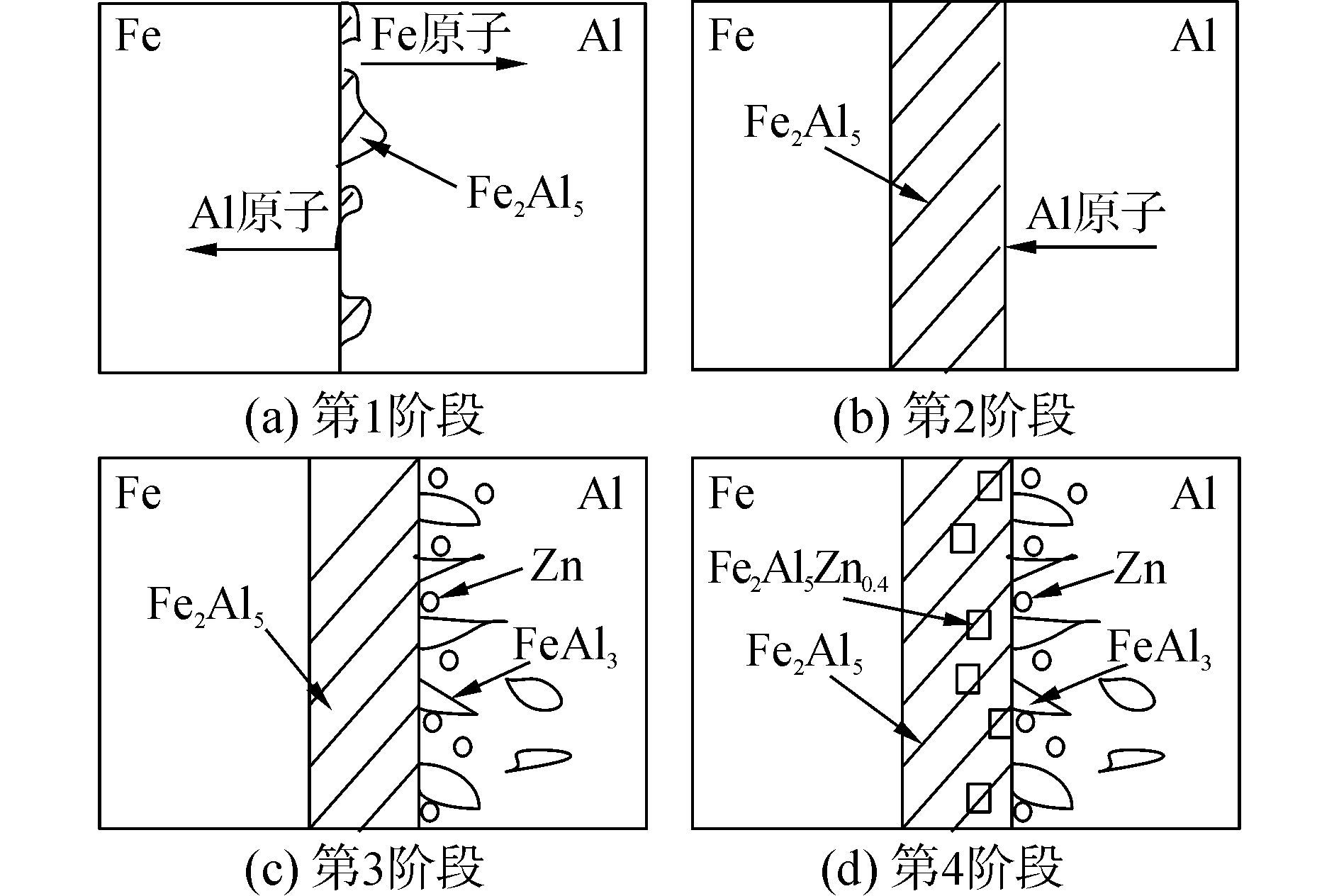
由图 7可以看出,生成Fe2Al5Zn0.4相的摩尔吉布斯自由能远远大于生成Fe2Al5和FeAl3相的摩尔吉布斯自由能,表明Fe2Al5Zn0.4相是在Fe2Al5和FeAl3相形成后才形成的,由此可以推断在铝/镀锌钢板焊接界面处金属间化合物的形成过程如图 8所示。
|
| 图8 Fe2Al5Zn0.4金属间化合物形成过程的示意图 Figure 8 Illustration for formation process of Fe2Al5Zn0.4 |
根据以上对铝/钢界面金属间化合物的吉布斯自由能变化的计算,提出以下化合物扩散生长模型,并将其形成生长过程分为四个阶段。由于形成Fe2Al5相的Gibbs自由能最低,当液态Al与固态Fe界面处的Fe原子达到热处理温度下的极限溶解度时,便在铝/钢界面处形成了Fe2Al5晶核,如图 8(a)所示;随着Al原子继续向Fe基体中扩散,Fe2Al5晶核先沿界面横向生长,逐渐连成整体,形成连续的Fe2Al5相层,如图 8(b)所示;电弧加热完成以后,随着温度的降低,Fe原子在液态铝中的溶解度降低,液态Al逐渐开始凝固,游离Al原子与Fe2Al5相结合形成离散的、针片状的FeAl3相,如图 8(c)所示;当Fe2Al5和FeAl3形成后,由于Fe2Al5的斜方晶系结构,晶体内存在大量空位,于是在Fe2Al5与镀锌层的界面处,Zn缓慢扩散进入Fe2Al5,Fe2Al5相与Zn原子结合反应生成的了Fe2Al5Zn0.4金属间化合物,如图 8d所示。
4 结论1) 通过对Fe2Al5Zn0.4金属间化合物相的热力学计算,结果表明在铝/镀锌钢接头界面处可以形成Fe2Al5Zn0.4金属间化合物,与试验结果相吻合。
2) Fe2Al5Zn0.4的吉布斯自由能高于Fe2Al5 和FeAl3,则Fe2Al5Zn0.4是在Fe2Al5 和FeAl3形成后,Zn扩散进入Fe2Al5的晶体内的空位,Fe2Al5相与Zn原子结合反应生成的。
| [1] | MURAKAMI T, NAKATA K, TONG Hongjun, et al. Dissimilar metal joining of aluminum to steel by MIG arc brazing using flux cored wire[J]. ISIJ international, 2003, 43(10): 1596–1602. |
| [2] | RATHOD M, KUTSUNA M. Laser roll bonding of A5052 aluminium alloy and SPCC steel[J]. Quarterly journal of the Japan welding society, 2003, 21(2): 282–294. |
| [3] | MATHIEU A, SHABADI R, DESCHAMPS A, et al. Dissimilar material joining using laser (aluminum to steel using zinc-based filler wire)[J]. Optics & laser technology, 2007, 39(3): 652–661. |
| [4] | NISHIMOTO K, HARANO T, OKUMOTO Y, et al. Mechanical properties of laser-pressure-welded joint between dissimilar galvannealed steel and pure aluminium[J]. Welding international, 2009, 23(11): 817–823. |
| [5] | ZHANG H T, FENG J C, HE P. Interfacial phenomena of cold metal aatransfer (CMT) welding of zinc-coated steel and wrought aluminium[J]. Materials science and technology, 2008, 24(11): 1346–1349. |
| [6] |
石玗, 温俊霞, 黄健康, 等. 基于旁路耦合电弧的铝钢MIG熔钎焊研究[J].
机械工程学报, 2011, 47(16): 25–29.
SHI Yu, WEN Junxia, HUANG Jiankang, et al. Study on DE-GMAW MIG-brazing method for bonding steel with aluminum[J]. Journal of mechanical engineering, 2011, 47(16): 25–29. |
| [7] | LUKAS H, FRIES S G, SUNDMAN B. Computational themodynamics[M]. Cambridge, England: Cambridge University Press,2007 . |
| [8] | KANG Yilin. The dissolution of iron from automotive steel sheets in a molten zinc bath and the kinetics of the nucleation and growth of dross particles[D]. Cleveland, Ohio:Case Western Reserve University, 2011. |
| [9] | SUNDMAN B, OHNUMA I, DUPIN N, et al. An assessment of the entire Al-Fe system including D03 ordering[J]. Acta materialia, 2009, 57(10): 2896–2908. |
| [10] |
石玗, 何翠翠, 黄健康, 等. 铝钢焊接界面金属间化合物形成的热力学分析[J].
兰州理工大学学报, 2013, 39(4): 5–7.
SHI Yu, HE Cuicui, HUANG Jiankang, et al. Thermodynamic analysis of the forming intermetallic compounds on aluminum-steel welding interface[J]. Journal of Lanzhou university of technology, 2013, 39(4): 5–7. |



